Similar presentations:
Строение атома. Планетарная модель Резерфорда
1.
Строение атома1.
2.
3.
4.
5.
Квантово-механическая модель строения атома.
Квантовые числа.
Атомные орбитали.
Энергетические уровни и подуровни.
Строение электронных оболочек атомов элементов.
Многоэлектронный атом.
2.
Планетарная модельРезерфорда
1911 г.
1. В центре атома - положительно
заряженное ядро.
2. Весь положительный заряд и почти
вся масса атома сосредоточены в его
ядре.
3. Вокруг ядра вращаются электроны.
Их число равно положительному
заряду ядра.
3.
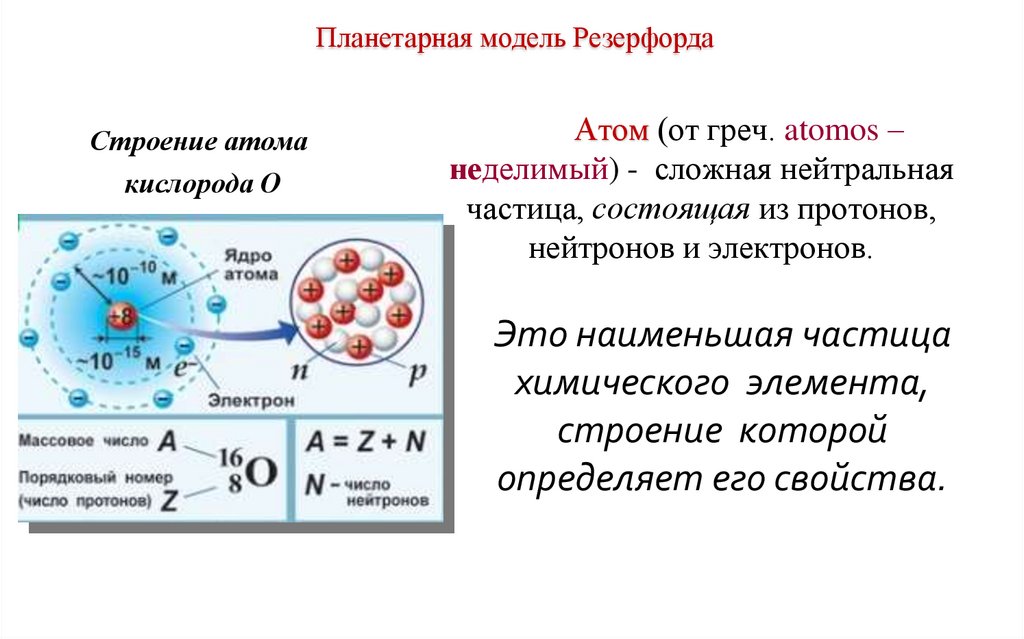
Планетарная модель РезерфордаСтроение атома
кислорода О
Атом (от греч. atomos –
неделимый) - сложная нейтральная
частица, состоящая из протонов,
нейтронов и электронов.
Это наименьшая частица
химического элемента,
строение которой
определяет его свойства.
4.
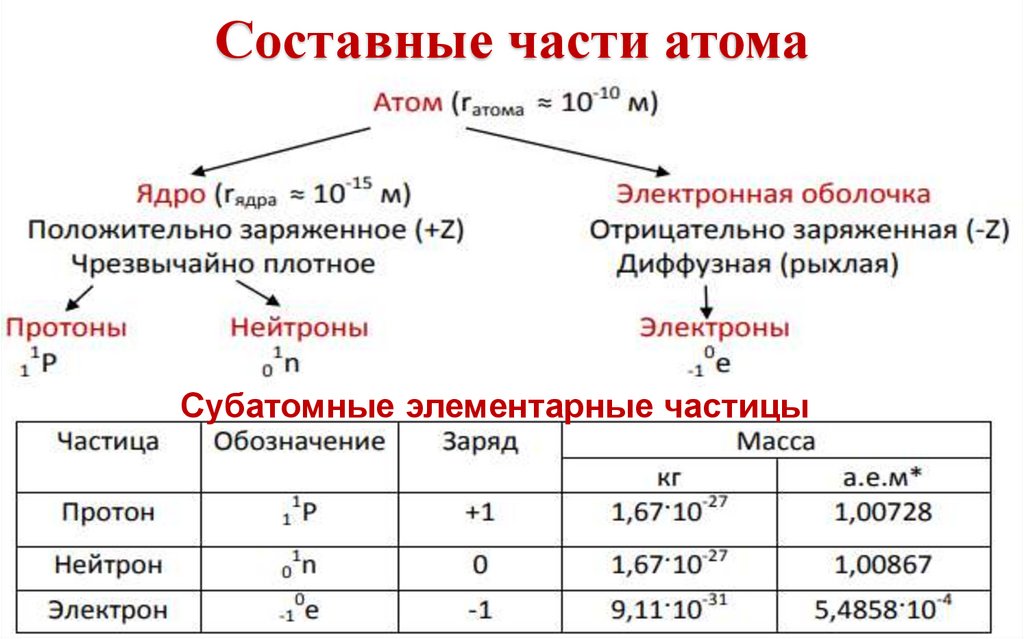
Составные части атомаСубатомные элементарные частицы
5.
Понятие о химическом элементеmатома = mядра + mэлектронов ≈ mядра
mатома ≈ mядра ≈ Z·mp + N·mn ≈ (Z + N)·1 [а.е.м.]
A = (Z + N)
mатома ≈ A [а.е.м.],где A — массовое число; N — число нейтронов
Z —число протонов; заряд ядра; порядковый номер элемента в
Периодической Системе.
Химический элемент — это совокупность атомов с
.
одинаковыми зарядами ядер: Z = const.
Атомы одного химического элемента, различающиеся
массовыми числами называют изотопами:
Z = const; N — переменная.
6.
Изотопы- это разновидность атомов химического элемента,
имеющие одинаковое число протонов, но разное число
нейтронов (греч. «изос» -одинаковый, «топос» - место).
Изотопы имеют одинаковое строение электронных оболочек и
одинаковые химические
свойства, различаются они
массовым числом.
изотопы лития
7.
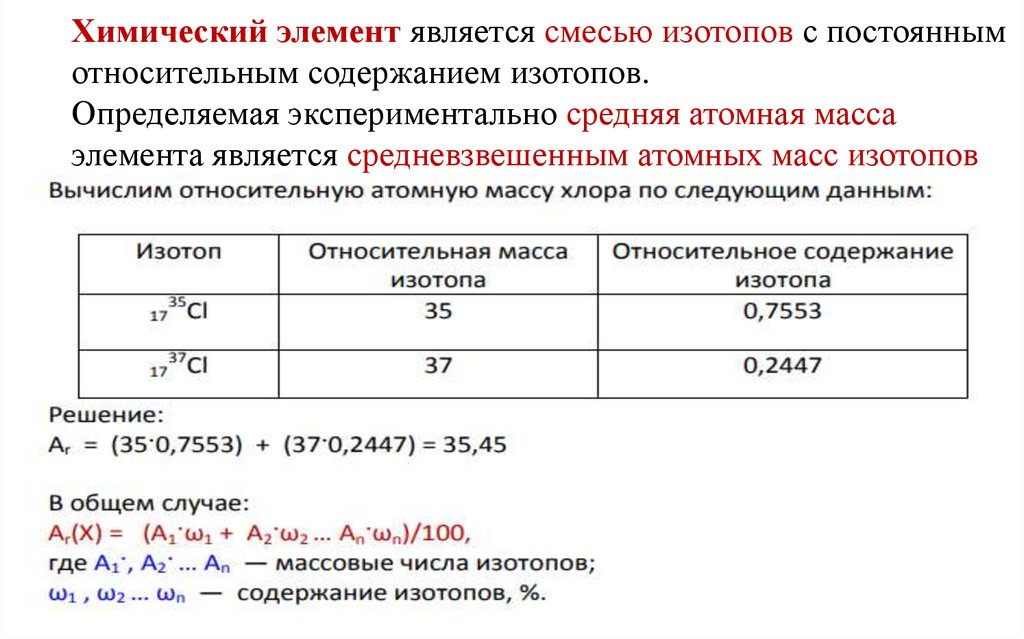
Химический элемент является смесью изотопов с постояннымотносительным содержанием изотопов.
Определяемая экспериментально средняя атомная масса
элемента является средневзвешенным атомных масс изотопов
элемента
8.
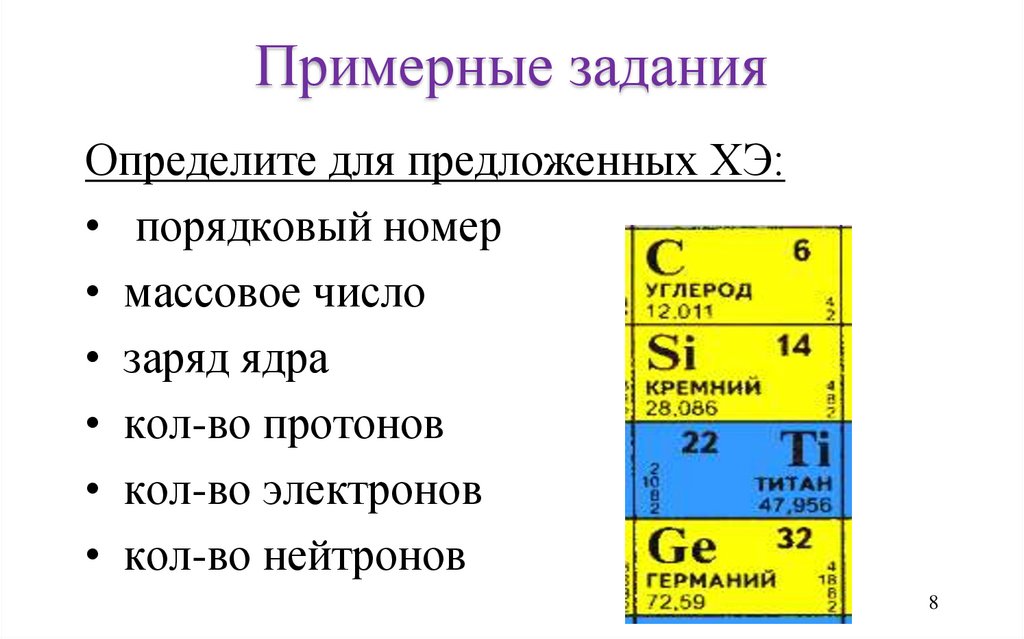
Примерные заданияОпределите для предложенных ХЭ:
• порядковый номер
• массовое число
• заряд ядра
• кол-во протонов
• кол-во электронов
• кол-во нейтронов
8
9.
Квантово-механическая модельстроения атома
• Учение о строении вещества является основным
в системе знаний современной химии. С его
позиций рассматривают физико-химические
свойства веществ, химических элементов,
процессы химических превращений.
• Современные представления о строении атома
базируются на квантово-механической модели.
10.
Современный этап атомистикиназывается
квантово-механическим.
Квантовая механика – это раздел
физики, изучающий движение
элементарных частиц.
11.
Основные положенияквантово-механической теории атома
1. Электрон имеет двойственную
(корпускулярно-волновую) природу. Он может
вести себя и как частица, и как волна.
2. Принцип неопределенности Гейзенберга:
в атоме невозможно точно определить
местоположения электрона.
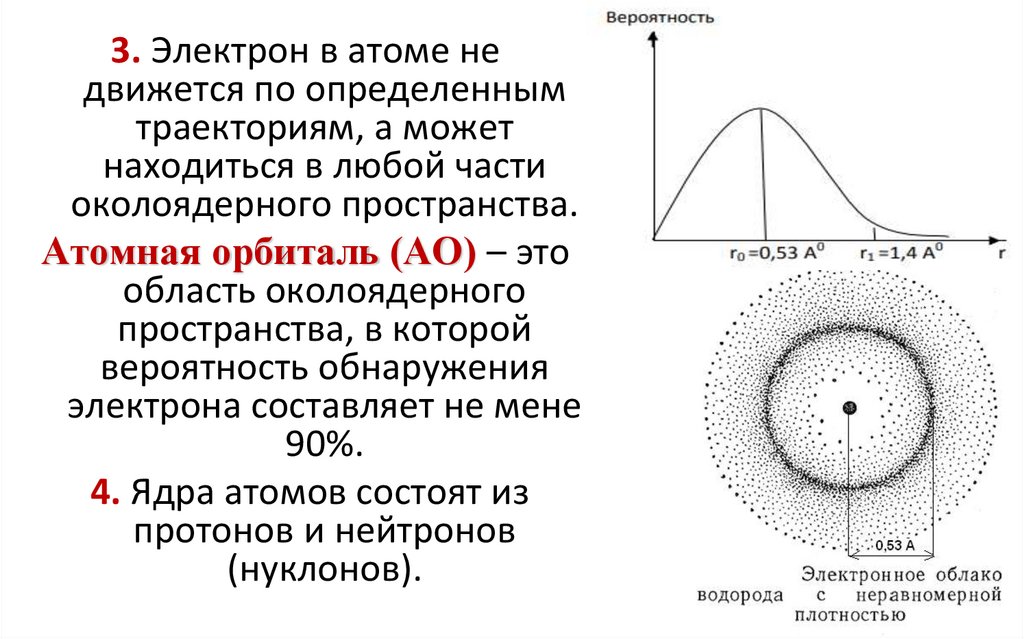
12.
3. Электрон в атоме недвижется по определенным
траекториям, а может
находиться в любой части
околоядерного пространства.
Атомная орбиталь (АО) – это
область околоядерного
пространства, в которой
вероятность обнаружения
электрона составляет не мене
90%.
4. Ядра атомов состоят из
протонов и нейтронов
(нуклонов).
13.
КВАНТОВЫЕ ЧИСЛА- энергетические параметры, определяющие
состояние электрона и тип атомной орбитали,
на которой он находится.
Состояние каждого электрона в атоме обычно
описывают с помощью четырех квантовых чисел:
главного (n),
орбитального (l),
магнитного (m)
спинового (s).
13
14.
Главное квантовое число (n)характеризует энергию электрона в атоме и
размер атомной орбитали (электронного облака):
чем больше n тем большей энергией обладает электрон,
и больше размеры электронного облака.
Атомные орбитали с одинаковым значением
главного квантового числа n образуют один
энергетический уровень (электронный слой).
n=1÷∞
Для реальных атомов: n =1, 2, 3, 4, 5, 6, 7
–
15.
1ядро
Е1 < E2 < E3
2
3
Наименьшей энергией электрон обладает при n = 1,
с увеличением n энергия электрона возрастает.
В реально существующих атомах электронами могут
быть заполнены 6 уровней, 7-ой заполнен частично.
Определяет размер электронного облака (чем больше n,
тем больше размер облака).
15
16.
Орбитальное квантовое число (l)Каждый уровень (кроме n = 1) имеет несколько
подуровней, которые обозначаются орбитальным
квантовым числом l
l = 0 ÷ (n-1)
Состояние электрона, которое характеризуется
определенным значением l , называется
энергетическим подуровнем.
Энергетический подуровень – это совокупность
электронных состояний, характеризующихся
определенным набором двух квантовых чисел n и l
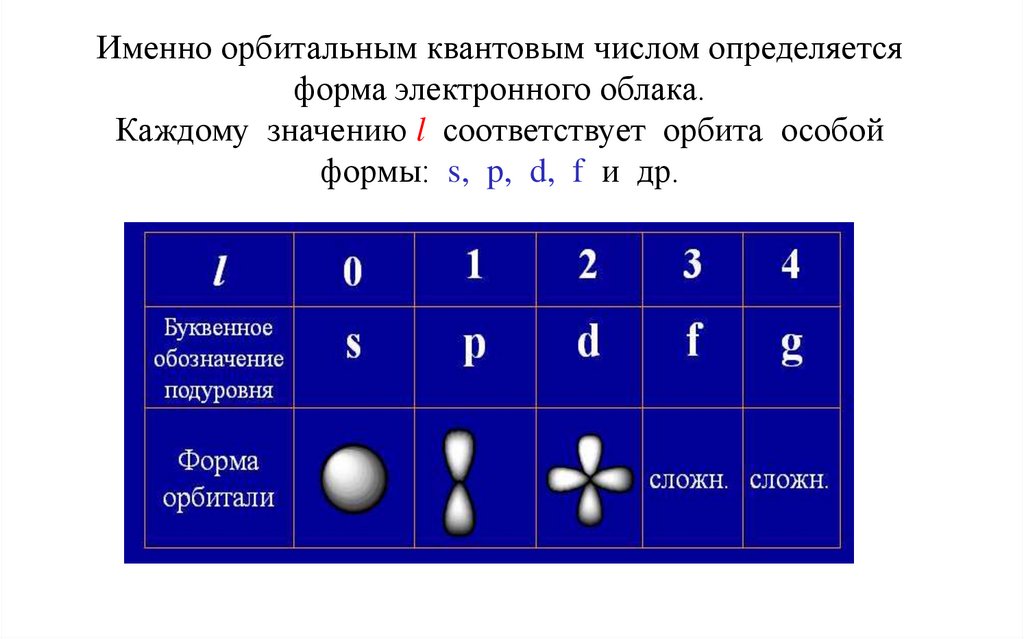
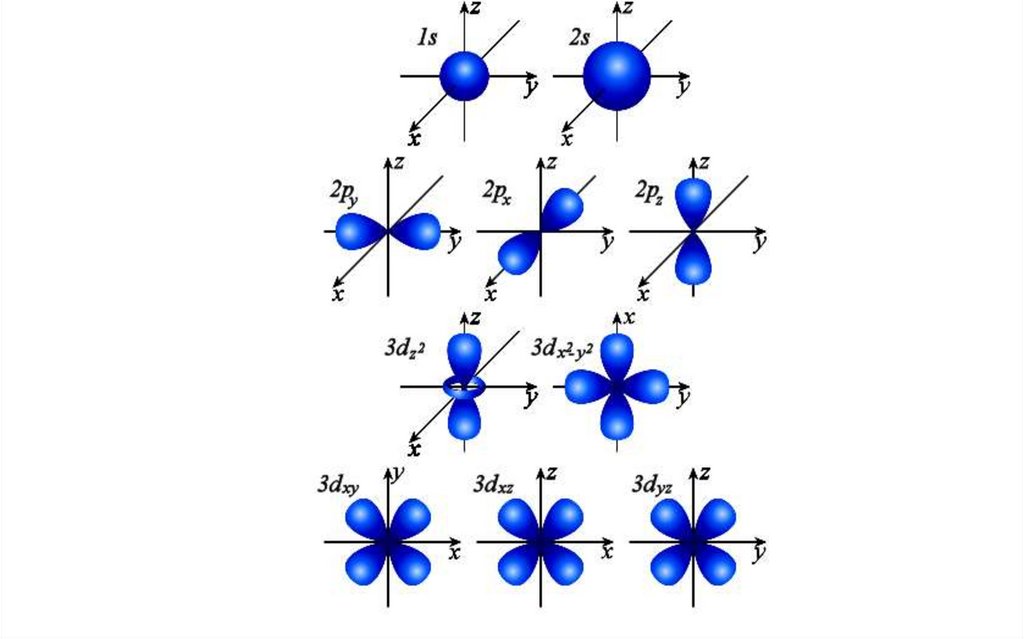
17.
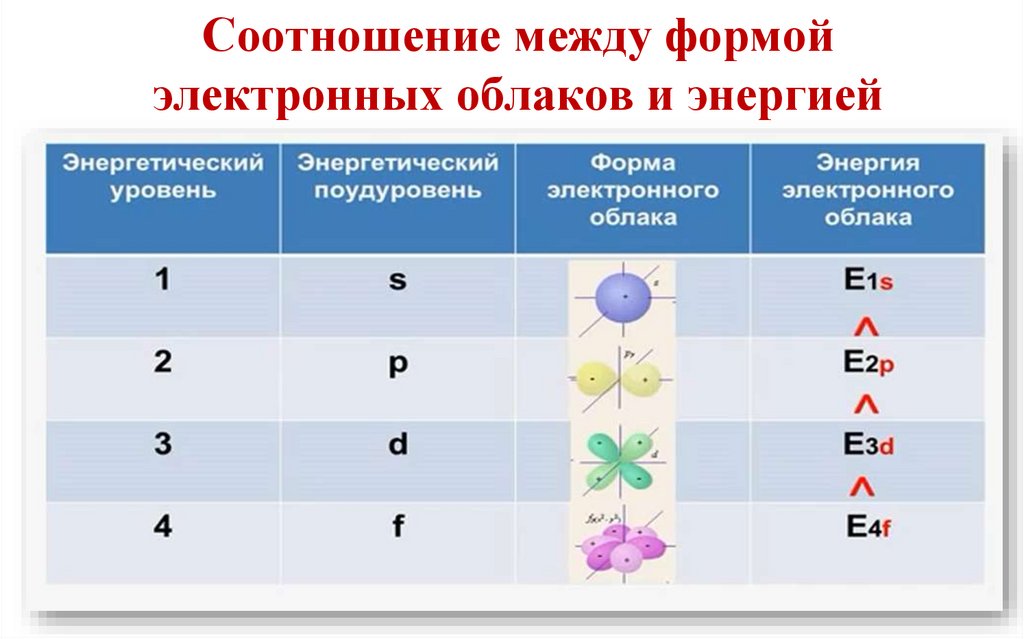
Именно орбитальным квантовым числом определяетсяформа электронного облака.
Каждому значению l соответствует орбита особой
формы: s, p, d, f и др.
18.
19.
Соотношение между формойэлектронных облаков и энергией
20.
Между l и n существует простая связь:• при n = 1, l может быть равно только 0 и в этом
случае электронное облако имеет форму шара;
• при n = 2, l = 0 и 1;
• при n = 3, l = 0,1 и 2;
• при n = 4, l = 0, 1, 2 и 3 и т. д.
Следовательно, два квантовых числа (n и l)
характеризуют положение данного электрона в
электронной конфигурации атома.
Например, если n = 3, l = 2, то это значит, что электрон
принадлежит к 3(M)-оболочке и входит в состав ее dподуровня; такой электрон обозначается символом 3d.
21.
Магнитное квантовое число (m)Подуровни также делятся на атомные орбитали
АО, обозначаемые магнитным квантовым числом m.
Его значение определяет возможные способы
расположения электронных облаков в пространстве.
Принимает целочисленные значения:
m = - l÷(0)÷ +l
По физическому смыслу m определяет направление, в
котором вытянуто электронное облако.
22.
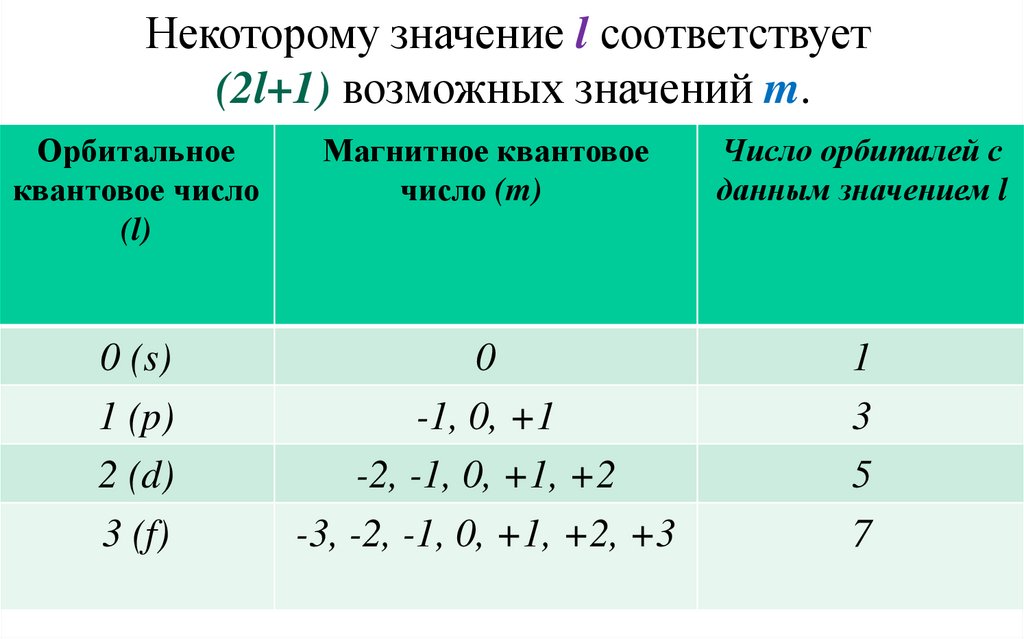
Некоторому значение l соответствует(2l+1) возможных значений m.
Орбитальное
квантовое число
(l)
Магнитное квантовое
число (m)
Число орбиталей с
данным значением l
0 (s)
1 (p)
2 (d)
3 (f)
0
-1, 0, +1
-2, -1, 0, +1, +2
-3, -2, -1, 0, +1, +2, +3
1
3
5
7
23.
Подуровни АО имеют одинаковую энергию,т. к. все направления равноценны.
Состояние электрона с определенными
значениями квантовых чисел n, l и m
(определенными размерами, формой и
ориентацией облака в пространстве),
называется
атомной электронной орбиталью.
24.
Спиновое квантовое число (s или ms )Характеризует вращательное движение электрона вокруг
своей оси. Если вращение электрона ориентировано по
часовой стрелке (по направлению поля), то значение
спинового квантового числа ms = +1/2. Если против – то ms =
-1/2. Два возможных и противоположных друг другу
направления собственного магнитного момента электрона,
называемого спином.
Принимает значения:
Для обозначения электронов с различными спинами используются символы:
↑и↓.
1 1
s ;
2 2
25.
26.
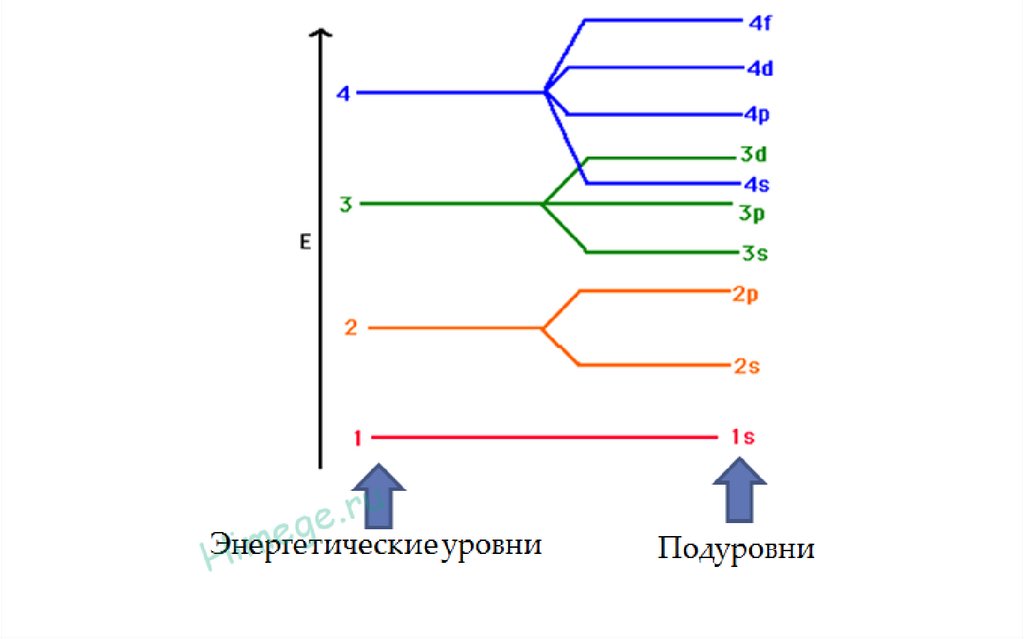
Максимальное число электронов на атомных энергетических уровнях и подуровнях27.
Строение электронных оболочек атомовэлементов. Многоэлектронные атомы.
Число электронов, вращающихся вокруг ядра,
соответствует «+» заряду ядра.
Подобно любой системе, атомы стремятся к минимуму
энергии, что достигается распределением электронов по
уровням, подуровням и атомным орбиталям.
28.
Электронную структуру атома принято записыватьдвумя квантовыми числами в виде nl.
Число электронов на подуровне обозначается цифрой
справа вверху. Например, электронная конфигурация
22s22р63s1 .
атома Na:
Na
1s
11
Энергия незанятых электронами уровней увеличивается
с ростом n, а в пределах уровня - с увеличением l:
ns < nр < nd < nf.
До аргона 18Аr электронные подуровни будут
заполняться в порядке возрастания энергии, а далее
за счет роста числа электронов усиливается
межэлектронное отталкивание, подуровни смещаются.
29.
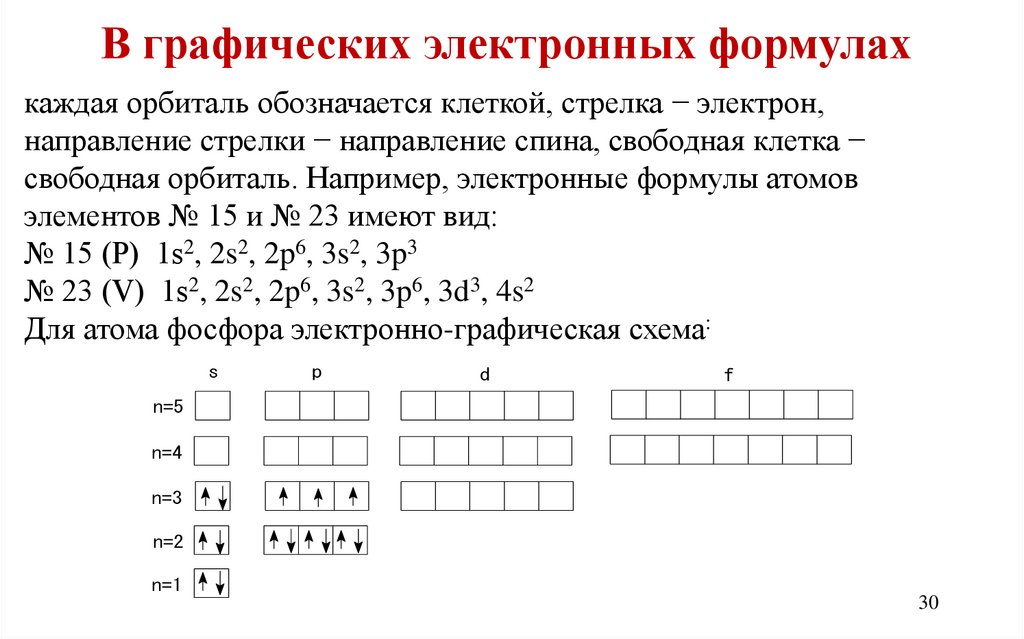
В графических электронных формулахкаждая орбиталь обозначается клеткой, стрелка − электрон,
направление стрелки − направление спина, свободная клетка −
свободная орбиталь. Например, электронные формулы атомов
элементов № 15 и № 23 имеют вид:
№ 15 (Р) 1s2, 2s2, 2p6, 3s2, 3p3
№ 23 (V) 1s2, 2s2, 2p6, 3s2, 3p6, 3d3, 4s2
Для атома фосфора электронно-графическая схема:
s
p
d
f
n=5
n=4
n=3
n=2
n=1
30
30.
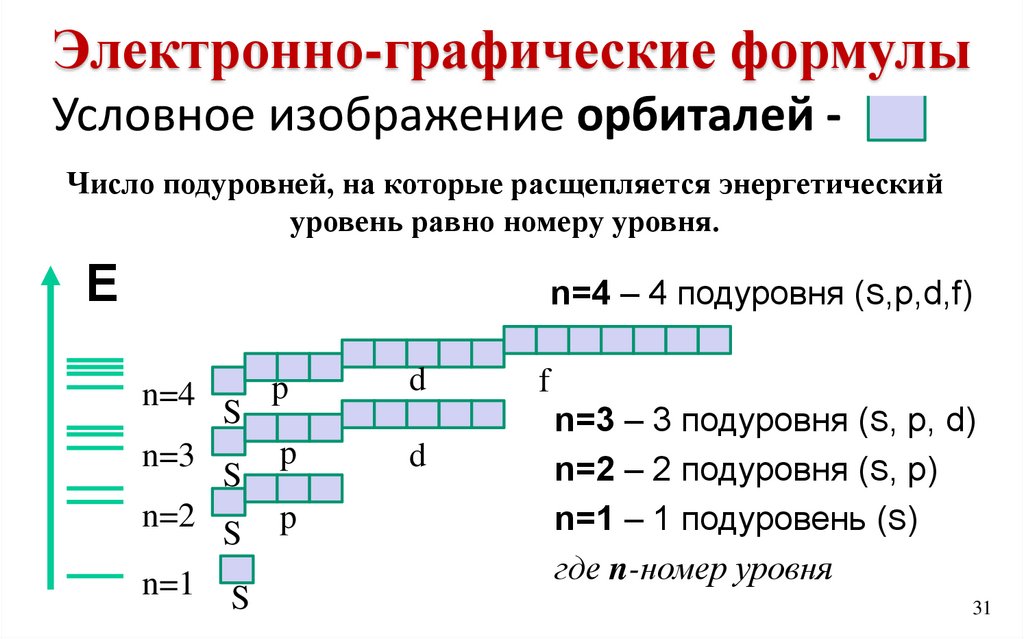
Электронно-графические формулыформулы
Электронно-графические
Условное изображение орбиталей Число подуровней, на которые расщепляется энергетический
уровень равно номеру уровня.
Е
n=4 – 4 подуровня (S,р,d,f)
n=4
n=3
n=2
n=1
S
S
S
S
p
d
p
d
p
f
n=3 – 3 подуровня (S, р, d)
n=2 – 2 подуровня (S, р)
n=1 – 1 подуровень (S)
где n-номер уровня
31
31.
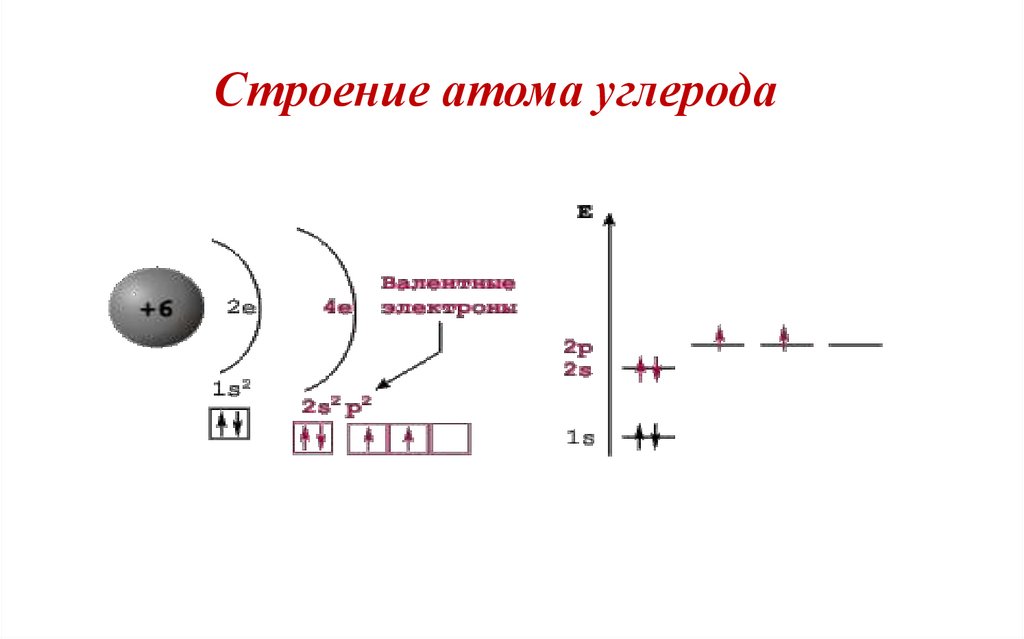
Строение атома углерода32.
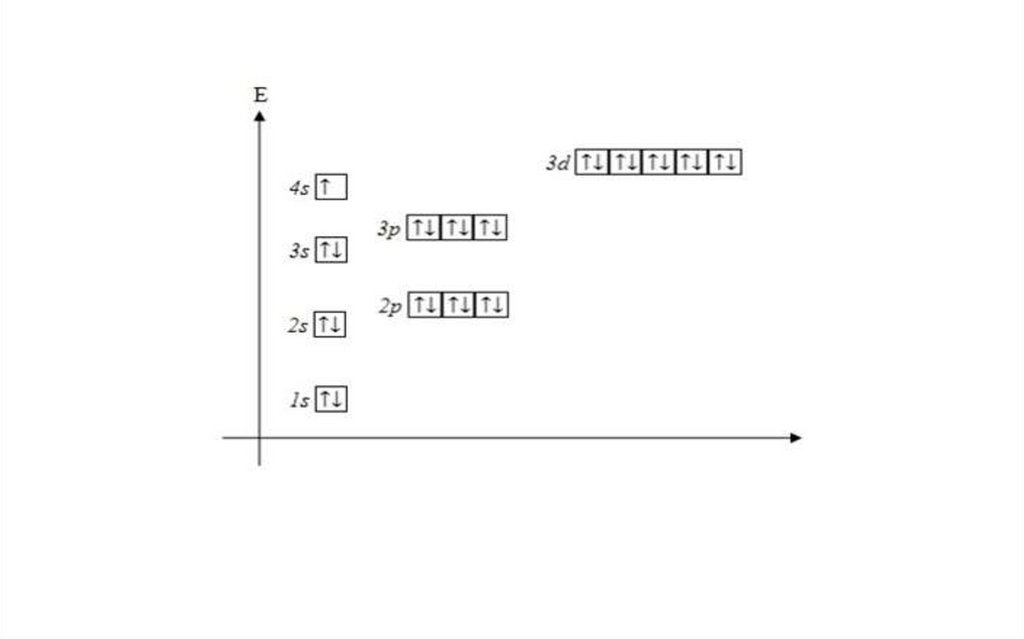
Состояние электронов в многоэлектронных атомахОсобенности:
1. Заряд ядра увеличивается, электронные оболочки сильнее
притягиваются к ядру, уплотняются.
2. Электроны в многоэлектронном атоме движутся не
только в поле ядра большего заряда, но и в поле других
электронов, между которыми возникает отталкивание.
Энергия подуровней одного уровня в многоэлектронном
атоме различна и определяется двумя квантовыми числами:
n и l.
33.
При составлении электронныхконфигураций многоэлектронных атомов
учитывают
• Принцип наименьшей энергии
• Принцип Паули
• Правила Гунда и Клечковского
34.
Принцип наименьшей энергииЭлектроны в основном состоянии заполняют орбитали в
порядке повышения уровня их энергии.
Первыми заполняются орбитали с минимальными
уровнями энергии- сначала
заполняются те подуровни,
для которых сумма значений
квантовых чисел m и l
является наименьшей.
35.
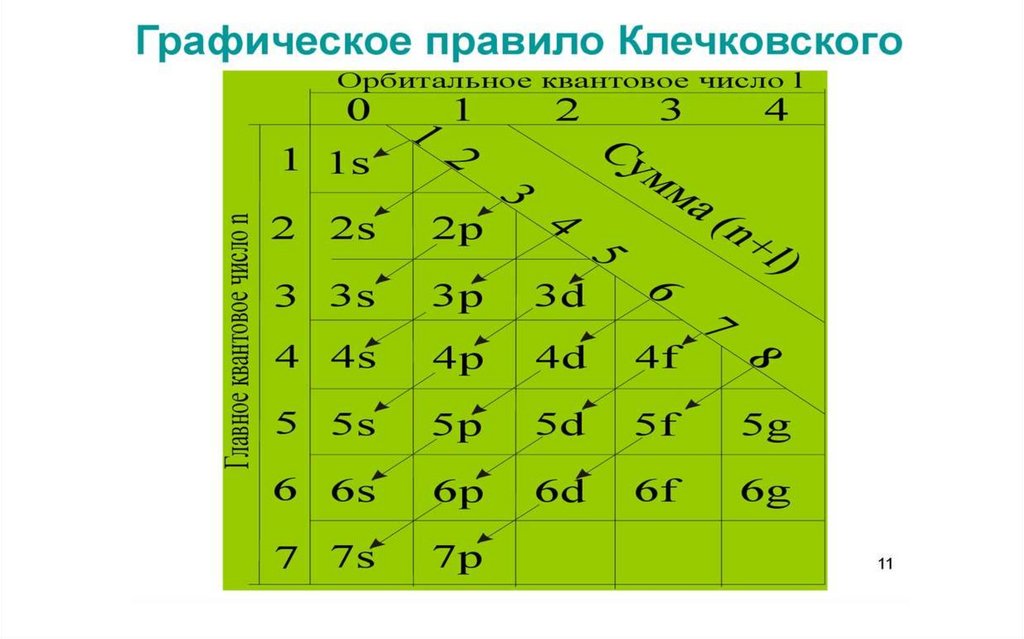
Правила КлечковскогоВначале электронами заполняется
тот подуровень, для которого
минимальна сумма (n+l),
2. При одинаковых значениях этой суммы
предпочтительней подуровень с
меньшим значением n.
1.
Всеволод
Маврикиевич
Клечковский
(1900–1972)
36.
Заполнение электронами энергетических уровней иподуровней идет в следующем порядке:
Например:…3s
(n+ l)
Сумма (n+ l)
3p
(3+0) (3+1)
3
3d
4s
4p…
(3+2) (4+0)
(4+1)
4
5
4
Применяем второе правило Клечковского.
Получаем следующую последовательность заполнения
электронами атомных орбиталей:
…3s
4p…
3p
4s
Увеличение Е
3d
5
37.
38.
В соответствии с правилом Клечковскогоформируется реальный ряд распределения
электронов:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
5s2 4d10 5p6 6s2 4f14 5d10 6p6
7s2 5f14 6d10 7p6 6f14 7d10 7f14
39.
40.
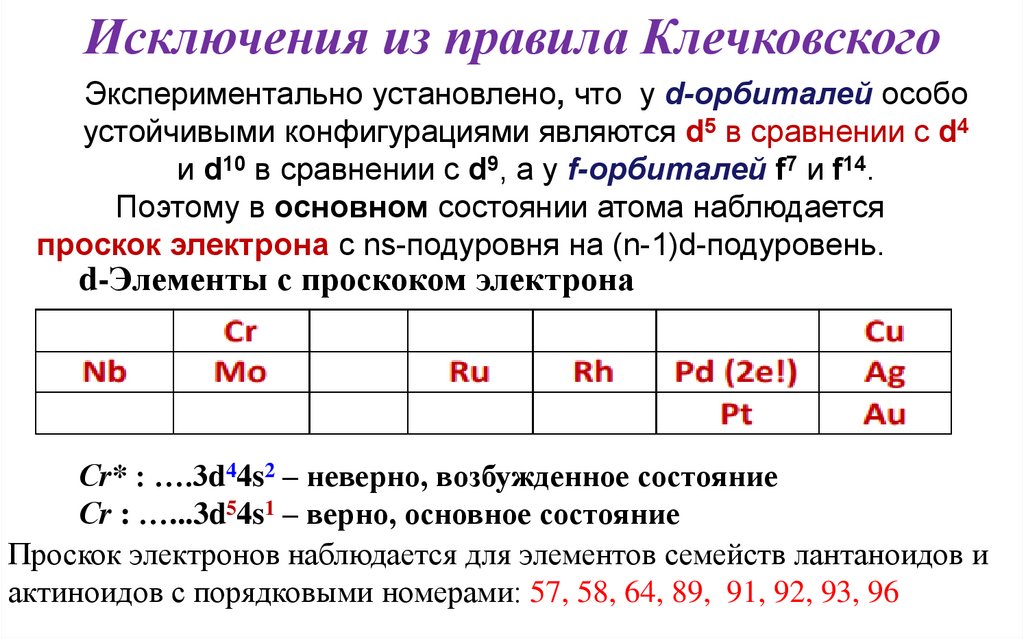
Исключения из правила КлечковскогоЭкспериментально установлено, что у d-орбиталей особо
устойчивыми конфигурациями являются d5 в сравнении с d4
и d10 в сравнении с d9, а у f-орбиталей f7 и f14.
Поэтому в основном состоянии атома наблюдается
проскок электрона с ns-подуровня на (n-1)d-подуровень.
d-Элементы с проскоком электрона
Сr* : ….3d44s2 – неверно, возбужденное состояние
Сr : …...3d54s1 – верно, основное состояние
Проскок электронов наблюдается для элементов семейств лантаноидов и
актиноидов с порядковыми номерами: 57, 58, 64, 89, 91, 92, 93, 96
41.
Принцип Паулидля каждого электрона
характерен свой набор
квантовых чисел,
т.е. в атоме не может быть
2 электронов,
характеризующихся
одинаковыми значениями
всех квантовых чисел.
Вольфганг ПАУЛИ
(1900 г – 1958г)
42.
Следствия из принципа Паули1) на одной орбитали могут находиться не более двух электронов,
отличающихся друг от друга значениями спиновых квантовых чисел.
2) на одной орбитали могут находиться не более двух электронов с
разными спинами
3) максимальное число электронов на энергетическом подуровне:
2(2l+1)
s2, p6, d10, f14
4) максимальное число электронов на энергетическом уровне: N = 2n2
5) вакантная (пустая) орбиталь
6) частично заполненная орбиталь (с неспаренным электроном)
7) насыщенная орбиталь (с неподеленной парой электронов)
43
43.
Правило Хундаатом в основном состоянии
должен иметь максимально
возможное число неспаренных
электронов в пределах
определенного подуровня
или по атомным орбиталям
электроны распределяются
таким образом, чтобы
обеспечить максимальное
значение суммарного спинового
числа
Фридрих ХУНД
(1891 - 1974)
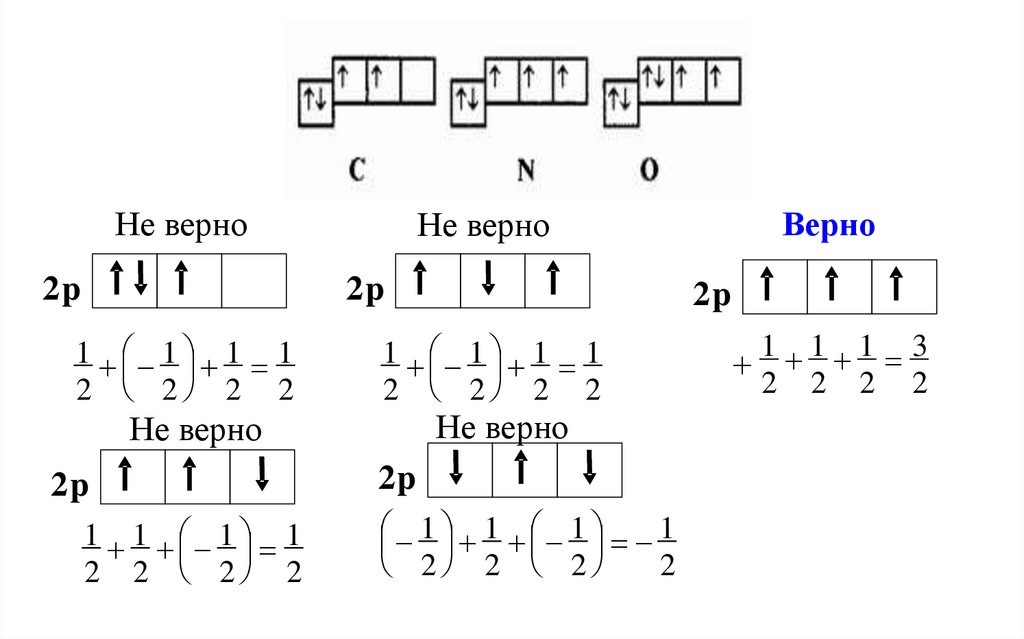
44.
Не верно2p
2p
2p
1 1 1 1
2 2 2 2
1 1 1 1
2 2 2 2
Не верно
Не верно
2p
1 1 1 1
2 2 2 2
Верно
Не верно
2p
1 1 1 1
2
2
2
2
1 1 1 3
2
2
2
2
45.
Электронная конфигурация атома- распределение электронов по атомным орбиталям
1. Полная электронная формула:
2 2
6 2
6 2
10
4
34Se 1s 2s 2p 3s 3p 4s 3d 4p
2. Краткая электронная формула составляется, учитывая, что
конфигурация внутренних электронов совпадает с конфигурацией
благородного газа, завершающего предыдущий период
2 2
6 2
6
18Ar [1s 2s 2p 3s 3p ]
2 2
6 2
6
2
10
4
34Se [1s 2s 2p 3s 3p ]4s 3d 4p
2
10
4 или Se [Ar] 3d104s24p4
34Se [Ar]4s 3d 4p
34
3. Электронно-графическая
формула
46.
Валентные электроны — электроны внешнего уровня итого предвнешнего подуровня, который заполняется у
данного атома. 10 2 4
2
4
34Se [Ar] 3d
4s 4p
1 5
24Cr[Ar]4s 3d
валентные электроны 34Se …4s 4p
1 5
валентные электроны 24Cr….4s 3d
Валентные атомные орбитали — орбитали внешнего
уровня, как занятые так и свободные, и орбитали
предвнешнего подуровня, который заполняется у данного
атома, как занятые так и свободные.
47.
Типы элементовs-элементы:
Элементы 1 и 2 групп (главные подгруппы I-II групп), имеющие в качестве
валентных электронов только s – электроны
например: Li (литий) – 2s1, Ca (кальций) – 4s2,
p – элементы:
Элементы 13-18 групп (главные подгруппы III-VIII групп), имеющие в
качестве валентных электронов только s и p электроны
например: N (азот) – 2s22p3; S (сера) – 3s23p4 .
d-элементы:
Элементы 3-12 групп (побочные подгруппы), имеющие в качестве валентных
электронов s и d электроны
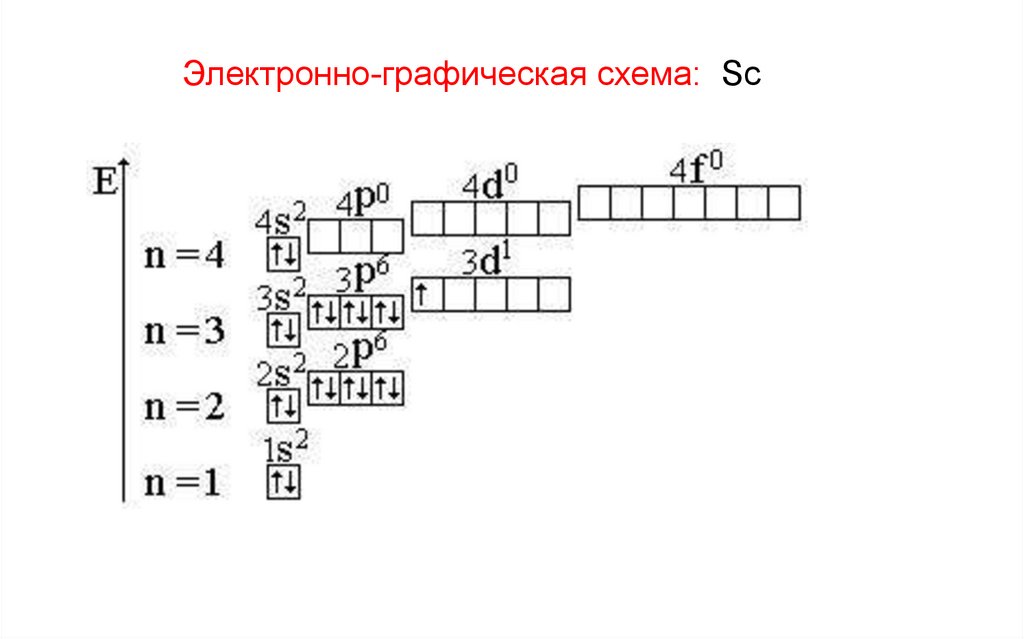
например: Sc (скандий) – 4s23d1.
f-элементы:
Элементы –лантаноиды и актиноиды, имеющие в качестве валентных
электронов s, d и f электроны
например: U (уран) - 5f37s26d1; Pu (плутоний) – 5f67s2
48.
Алгоритм составления электроннойконфигурации атома
При составлении электронных формул атомов элементов следует иметь в виду:
· порядковый номер элемента равен общему числу электронов в атоме (сумме
верхних индексов в электронной формуле), т.е. у каждого последующего
элемента на один электрон больше, чем у предыдущего;
· номер периода соответствует энергетических уровней;
· номер группы показывает число валентных электронов;
· распределение электронов по подуровням происходит в порядке возрастания их
энергии.
У атомов некоторых элементов, наблюдается явление «проскока» электрона с
внешнего энергетического уровня на предпоследний. Проскок электрона
происходит у атомов меди, хрома, палладия и некоторых других элементов.
2 2
6 2
6
10 1
Например:
29Cu 1s 2s 2p 3s 3p 3d 4s
49.
50.
Строение атома• Составьте электронную формулу
химического элемента № 17
51.
Строение атома1. Элемент № 17 называется хлор и имеет химический символ Cl.
2. Элемент хлор находится в третьем периоде.
3. Внешним энергетическим уровнем в атоме хлора является уровень под
номером 3.
4. Элемент хлор находится в группе номер VII.
5. Хлор входит в подгруппу А.
6. На внешнем электронном уровне атома хлора имеется 7 электронов.
7. Заряд ядра атома элемента хлора равен +17.
8. На трёх энергетических уровнях атома хлора располагаются 17
электронов.
9. На первом энергетическом уровне атома хлора располагаются 2 электрона.
10. Первый электронный уровень любого атома периодической системы,
кроме атома водорода, можно представить так: 1s2.
52.
Строение атома• 11. На втором энергетическом уровне атома хлора находится 8 электронов.
17 - (2 + 7) = 8
• 12. На втором энергетическом уровне имеются два подуровня s и р.
• 13. Число электронов в атоме хлора на втором s - подуровне равняется 2.
• 14. Число электронов в атоме хлора на втором р - подуровне равняется 6.
8-2=6
• 15. Число электронов находящихся на одной р -орбитали не может быть
больше чем 2.
• 16. На втором энергетическом уровне в атоме хлора имеется три
р - орбитали, расположенных перпендикулярно друг-другу.
53.
Строение атома• 17. Расположение электронов на втором энергетическом уровне
можно записать так: 2s22p6. Если прибавить эту запись к ранее
сделанной записи первого энергетического уровня, то получится:
1s22s22p6
• 18. На третьем энергетическом уровне в атоме хлора имеется три
подуровня s, р, d. Из них заполняется семью электронами только
два s и р, d - подуровень остаётся пустым.
• 19. Расположение электронов на третьем энергетическом уровне
можно записать так: 3s23p5. Если добавить эту запись к ранее
сделанной записи первого и второго энергетического уровней, то
получится электронная формула атома хлора:
1s22s22p63s23p5
Ответ: электронная формула атома хлора 1s22s22p63s23p5.
54.
Электронно-графическая схема: Sc55.
Способы изображения электронных структурЭлектронная формула
32Ge
1s22s22p63s23p64s23d104p2 – полная
32Ge [Ar]4s2 3d104p2
32Ge …
– краткая
4s24p2 – валентных электронов
Электронографическая структура
32Ge
4p
4s
-1
0
0
+1
n = 4,
ℓ = 1, mℓ = 0,
ms = +½
56.
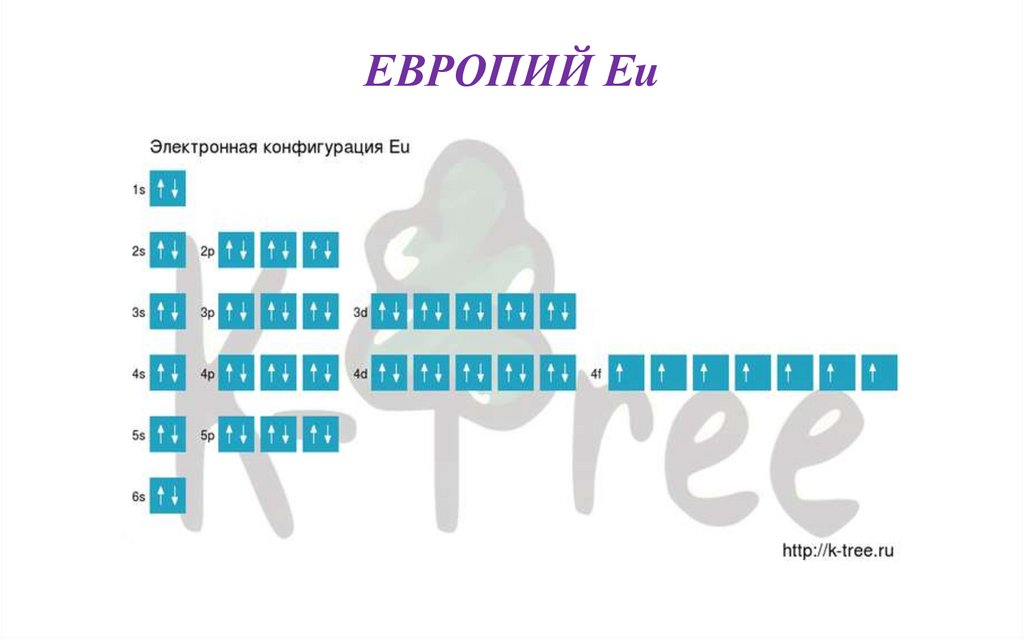
ЕВРОПИЙ Eu• В таблице Менделеева занимает 63 место, в 6 периоде.
• Порядок заполнения оболочек атома европия (Eu) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
→ 4f → 5d → 6p → 7s → 5f → 6d → 7p.
• ЭЛЕКТРОННАЯ СХЕМА
• Eu: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f7
Короткая запись:
Eu: [Xe]6s2 4f7
• Квантовые числа определяются последним электроном
в конфигурации, для атома Eu эти числа имеют
значение
n = 4, l = 3, m = 3, s = -½
57.
ЕВРОПИЙ Eu58.
Задания:Записать электронные формулы атомов ниобия, титана,
кобальта и хрома. Указать валентные электроны.
Ответ.
41Nb - элемент 5 периода, V группы, побочной подгруппы
1s22s22p63s23p63d104s24p64d35s2
2 2
6 2
6
3 2
23Ti 1s 2s 2p 3s 3p 3d 4s
2 2
6 2
6
7 2
27Co 1s 2s 2p 3s 3p 3d 4s
2 2
6 2
6
5 1
24Cr 1s 2s 2p 3s 3p 3d 4s
59.
2. Атомы элементов имеют следующие электронныеформулы: 1s22s22p4 и 1s22s22p63s 23p63d54s1. Определить
порядковый номер элемента, а также семейство и
группу, к которым они относятся.
Ответ. Суммарное число электронов на всех
подуровнях равно порядковому номеру элемента.
В первом случае число электронов равно 8,
следовательно, это кислород, он находится в VI группе,
главной подгруппе и относится к семейству p-элементов.
Во втором случае сумма электронов равна 24, значит это
хром, он находится в в VI группе, побочной подгруппе и
относится к семейству d-элементов.
60.
Строение атома технеция• Напишите электронную формулу атома
технеция. Сколько электронов находится на dподуровне предпоследнего электронного слоя?
К какому электронному семейству относится
элемент?
61.
Строение атома технеция• Атом Tc в таблице Менделеева имеет порядковый номер 43.
Следовательно, в его оболочке содержится 43 электрона.
В электронной формуле распределяем их
по подуровням согласно порядку заполнения (в соответствии
с правилами Клечковского) и учитывая емкость подуровней:
Tc: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d5
Короткая запись:
Tc: [Kr]5s2 4d5
62.
Строение атома• Атом какого элемента имеет
электронную конфигурацию
1s22s22p63s23p63d104s24p64d105s25p1?
• Укажите квантовые числа порядкового
электрона.
63.
Строение атома• Решение.
• Количество электронов в оболочке
нейтрального атома составляет 49.
Поэтому его заряд ядра и, следовательно,
порядковый номер, также равны 49.
В периодической системе
Д.И.Менделеева находим, что этот
элемент – индий.
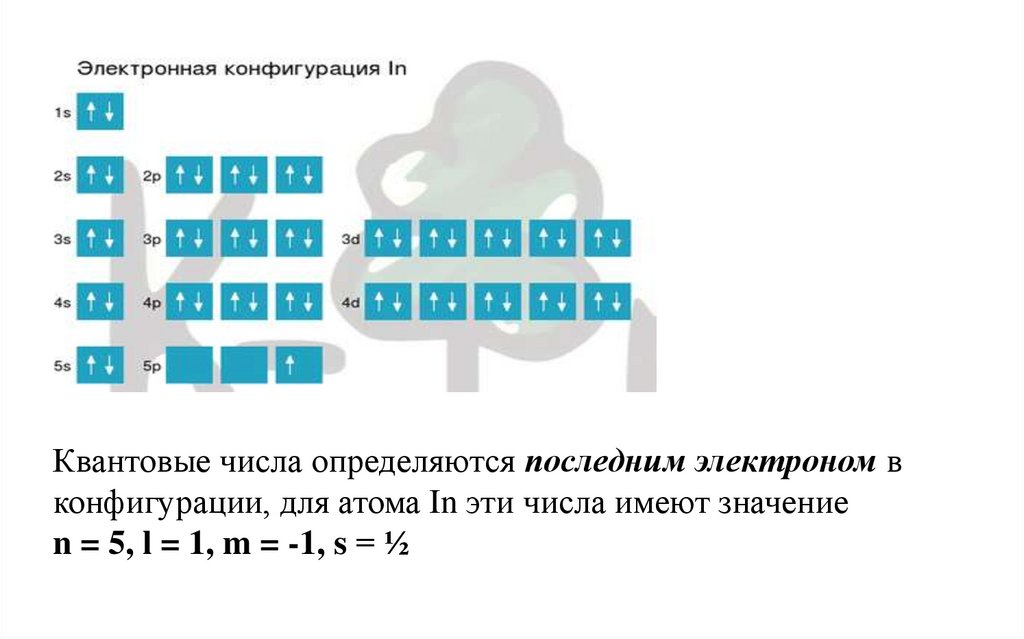
• Ответ: In.
64.
Квантовые числа определяются последним электроном вконфигурации, для атома In эти числа имеют значение
n = 5, l = 1, m = -1, s = ½
65.
Строение атома• Атом металла имеет электронную
конфигурацию 1s2 2s2 2p6 3s2, формула
оксида, гидроксида и сульфата этого
элемента
1) ЭО; Э(ОН)2; ЭSO4
3) ЭО; ЭОН; ЭSO4
2) Э2О; ЭОН; Э2SO4
4) Э 2 О 2; Э(ОН)2; Э 2 SO4
66.
Строение атома• 1s2 2s2 2p6 3s2
• Э+2
• 1)Э+2О-2; Э+2 (ОН)-2;Э+2SO4-2
67.
Найдите соответствияэлементов и их признаков:
ЭЛЕМЕНТ
ПРИЗНАК
А. Литий
Б. Фтор
В. Азот
Д. Берилий.
1) s-элемент
2) Неметалл
3) число протонов 9
4) f-элемент
5) число электронов 4
6) d-элемент
7) Металл
8) Наивысшая ЭО по сравнению
с остальными вариантами
атомов
68
68.
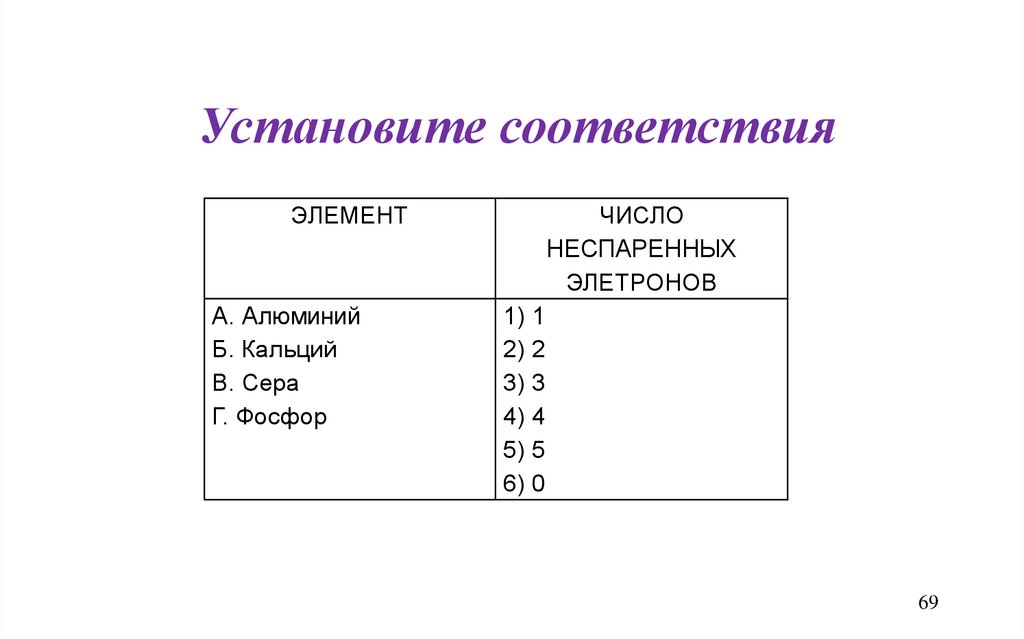
Установите соответствияЭЛЕМЕНТ
А. Алюминий
Б. Кальций
В. Сера
Г. Фосфор
ЧИСЛО
НЕСПАРЕННЫХ
ЭЛЕТРОНОВ
1) 1
2) 2
3) 3
4) 4
5) 5
6) 0
69
69.
Электронные конфигурации ионовПоложительно заряженные ионы (катионы) образуются при
отрыве электронов от атома
А – ne → An+
Легче всего отрываются электроны внешнего подуровня внешнего
уровня (правила Клечковского не соблюдаются)
2
10
4
5 2
5 1
34Se [Ar]4s 3d 4p
25Mn [Ar]3d 4s
24Cr [Ar] 3d 4s
4+
2
10
0
2+
5 0
34Se [Ar]4s 3d 4p
25Mn [Ar]3d 4s
6+
10 0
0
3+
3 0
34Se [Ar]3d 4s 4p
24Cr [Ar] 3d 4s
Отрицательно заряженные ионы (анионы) образуются в результате
присоединения электронов к атому (по правилам Клечковского)
А + ne → An210 2
6
34Se [Ar]3d 4s 4p
Изоэлектронные частицы имеют одинаковое число электронов и
совпадающие (по формуле) электронные конфигурации.
2 2
6 2
6
18Ar 1s 2s 2p 3s 3p
17Cl
- 1s22s22p63s23p6
+
2 2
6 2
6
19K 1s 2s 2p 3s 3p
70.
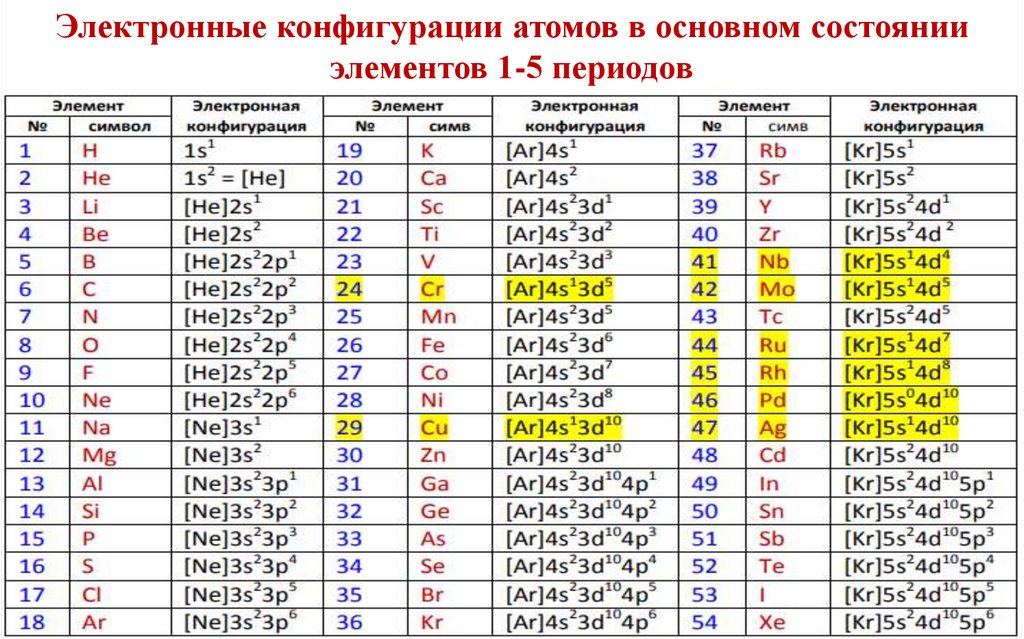
Электронные конфигурации атомов в основном состоянииэлементов 1-5 периодов
71.
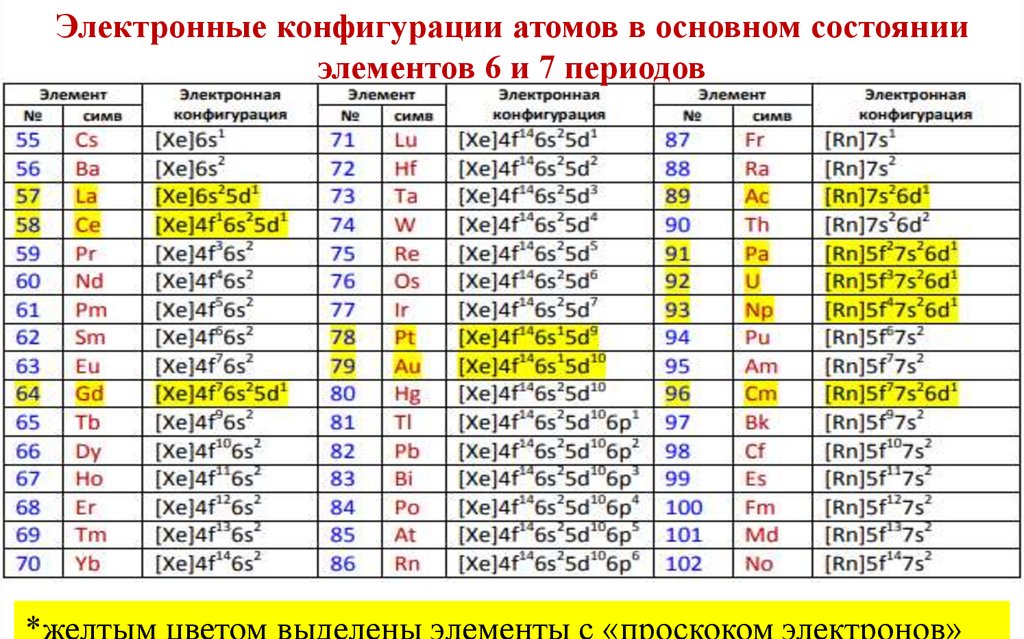
Электронные конфигурации атомов в основном состоянииэлементов 6 и 7 периодов
*желтым цветом выделены элементы с «проскоком электронов»
72.
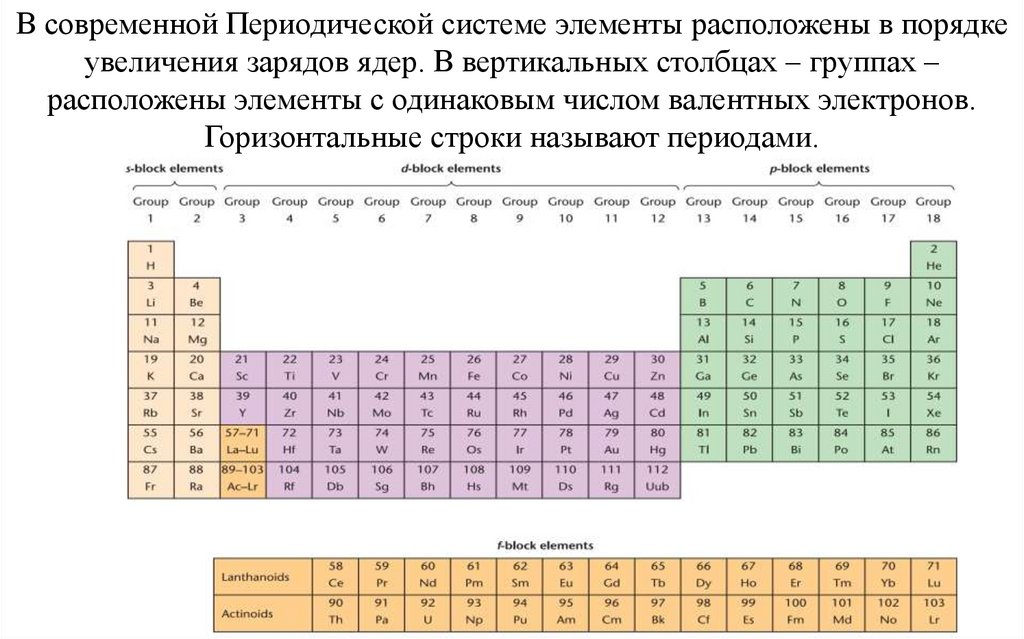
В современной Периодической системе элементы расположены в порядкеувеличения зарядов ядер. В вертикальных столбцах – группах –
расположены элементы с одинаковым числом валентных электронов.
Горизонтальные строки называют периодами.
73.
Практические задания1.
2.
3.
4.
Указать, какие из приведенных ниже электронных конфигураций не могут
существовать, и по какой причине: а)1p3
б)3p6
в)3s2
г) 2s2
д) 2d5
е) 5s2
ж) 2p4
з)3p7
Напишите электронные формулы атомов элементов гольмия и плутония.
Укажите квантовые числа порядковых электронов
В чем заключается принцип наименьшей энергии? Как распределяются
электроны на атомных орбиталях у атомов калифорния и иттербия?
Укажите квантовые числа порядковых электронов.
Электронная структура внешних энергетических уровней элементов
описываются формулами …6d1 7s2 и …4f 75d1 6s2. Составьте полные
электронные формулы атомов этих элементов. Назовите их. Укажите
квантовые числа порядковых электронов.
74.
Спасибо за внимание !75

















































 chemistry
chemistry