Similar presentations:
Теория электролитической диссоциации (9 класс)
1.
ГБОУ СОШ № 1352 с углубленнымизучением английского языка г. Москвы.
Теория
электролитической
диссоциации
Уроки 20-22, 9 класс, программа
Оржековского П.А
Политова С.В, учитель химии высшей
квалификационной категории.
2.
План работы1. Определение.
2. Электролиты, неэлектролиты.
3. Теория диссоциации.
4. Механизм диссоциации.
5. Диссоциация кислот, оснований, солей.
3.
ДиссоциацияЭлектролитами называются вещества, растворы или
расплавы которых проводят электрический ток.
Электролиты:
соли;
кислоты;
основания.
Тип связи: ионные или ковалентные
полярные.
4.
ДиссоциацияНеэлектролитами называются вещества, растворы
или расплавы которых не проводят электрический ток.
Неэлектролиты:
кислород;
водород;
многие органические вещества (сахар,
эфир, бензол).
Тип связи: ковалентные неполярные или
малополярные.
5.
Степень диссоциацияЧисло, показывающее, какая часть молекул
распалась на ионы, называется степенью
электролитической диссоциации.
Степень диссоциации равна отношению числа
молекул, которые распались на ионы, к общему числу
молекул в растворе.
ά=
n
N
* 100%
n - число молекул, распавшихся на ионы; N - общее
число растворенных молекул.
6.
Сильные электролитыСильные электролиты –это такие электролиты,
которые в водных растворах полностью диссоциируют
на ионы, степень диссоциации равна 1 (100 %).
Соли.
NaCl, KNO3, AlCl3
Сильные
кислоты.
HClO4, HClO3, HNO3, H2SO4, HCl,
HI, HBr
Щелочи.
NaOH, KOH, CsOH, RbOH,
Sr(OH)2, LiOH, Ba(OH)2, Ca(OH)2.
7.
Слабые электролитыСлабые электролиты –это такие электролиты, которые в
водных растворах не полностью диссоциируют на ионы,
степень диссоциации меньше 1 (100 %).
Слабые кислоты:
HClO2, HClO, HNO2, H2SO3,H2CO3, H2SiO3,
H3PO4, H3PO3, H3BO3, CH3COOH, H2S, HCN, HF
Слабые нерастворимые в воде основания:
Fe(OH)2, Cu(OH)2, Pb(OH)2
Гидроксид аммония:
NH4OH.
8.
Механизм диссоциацииCl-
Na+
-
+
Na+
Cl-
+
-
Cl-
Na+
-
+
Схема диссоциации.
9.
++
-
-
+
-
-
+
-
+
+
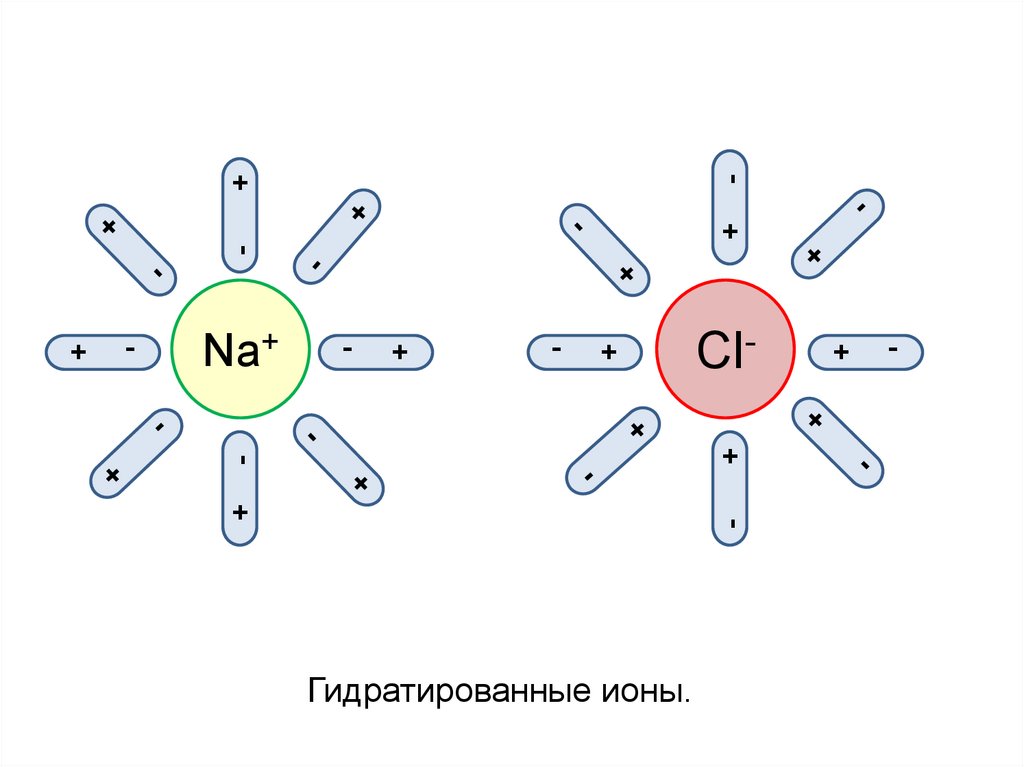
Гидратированные ионы.
+
Cl-
-
Na+
-
+
10.
Диссоциация щелочейNaOH = Na+ + OHKOH = …+ + …-
Ca(OH)2 = …2+ + 2…Вывод: щелочь диссоциирует на катионы металла и
гидроксид-анионы.
11.
Диссоциация солейNaСl = Na+ + ClKNO3 = …+ + …-
CaCl2 = …2+ + 2…Вывод: соли диссоциирует на катионы металла и
анионы кислотного остатка.
12.
КислотыТрехосновная кислота
Пример:
Одноосновная
кислота
Кислоты-электролиты, при диссоциации
которых образуются катионы водорода.
HCl
H++Cl-
H3PO4
H++H2PO4- (1 ступень)
H2PO4-
H++HPO42- (2 ступень)
HPO42-
H++PO43- (3 ступень)
13.
Проверь себяHClO4 = H+ + ClO4HNO3 = H+ + …NaCl =…+ + ClH2SO4 =...H+ + SO4…
LiOH =…+ + OH-
14.
Реакции ионного обменаМолекулярное уравнение
Fe Cl3+ 3 Na OH =Fe(OH)3 + 3 Na Cl
Полное ионное уравнение
Fe3++3Cl-+3Na++3OH-=Fe(OH)3 +3Na++3ClСокращенное ионное уравнение
Fe3++3Cl-+3Na++3OH-=Fe(OH)3 +3Na++3ClFe3++3OH-=Fe(OH)3













 chemistry
chemistry








