Similar presentations:
Окислительно-восстановительные реакции в органической химии
1.
Окислительно-восстановительныереакции в органической химии
Подготовила Аргудаева И.В
Учитель химии МБОУ ЦО № 10
2.
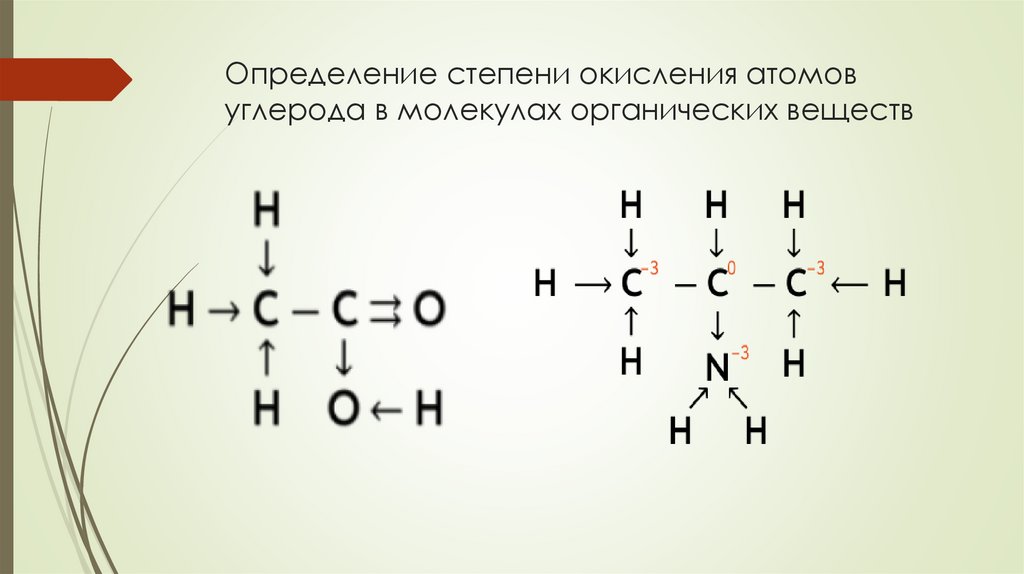
Определение степени окисления атомовуглерода в молекулах органических веществ
3.
Окисление алкановНеполное окисление — взаимодействие алканов с окислителями в
мягких условиях. Не образуется углекислый газ.
1.Окисление бутана
Получение уксусной кислоты. Промышленный способ :
2. Каталитическое окисление метана кислородом
Возможно получение метанола, формальдегида или муравьиной
кислоты. Все реакции проходят в присутствии катализатора и высокой
температуры :
4.
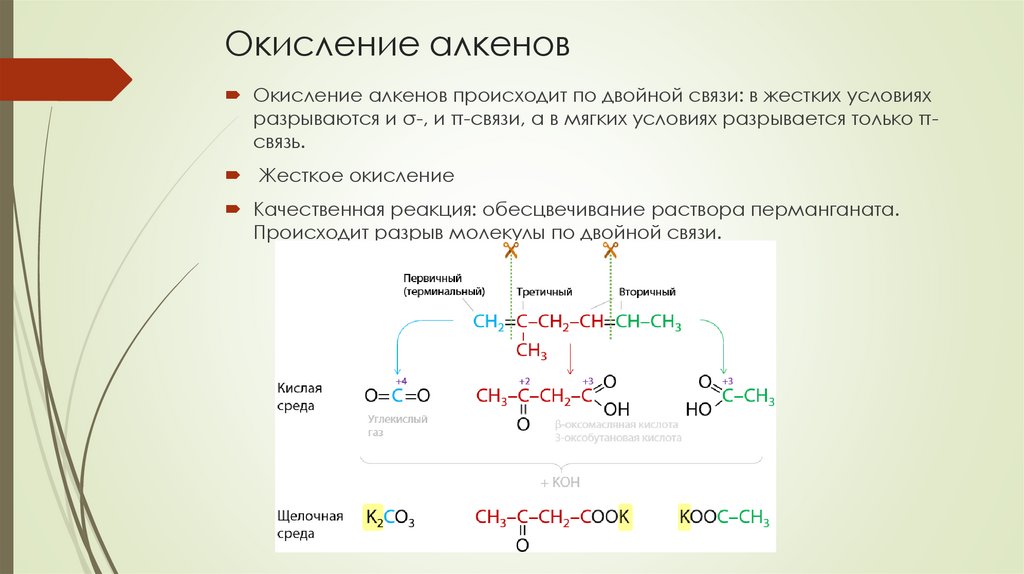
Окисление алкеновОкисление алкенов происходит по двойной связи: в жестких условиях
разрываются и σ-, и π-связи, а в мягких условиях разрывается только πсвязь.
Жесткое окисление
Качественная реакция: обесцвечивание раствора перманганата.
Происходит разрыв молекулы по двойной связи.
5.
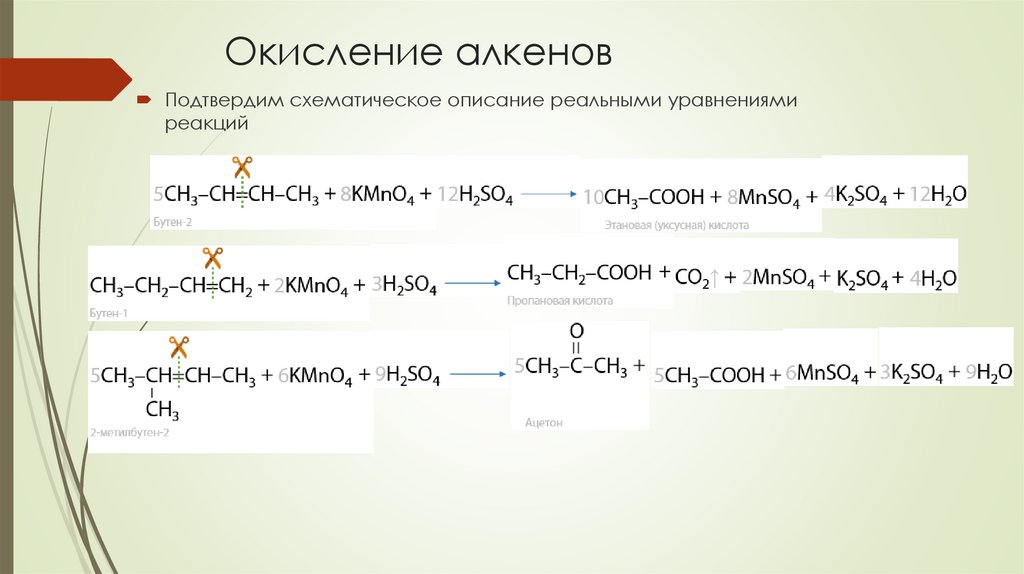
Окисление алкеновПодтвердим схематическое описание реальными уравнениями
реакций
6.
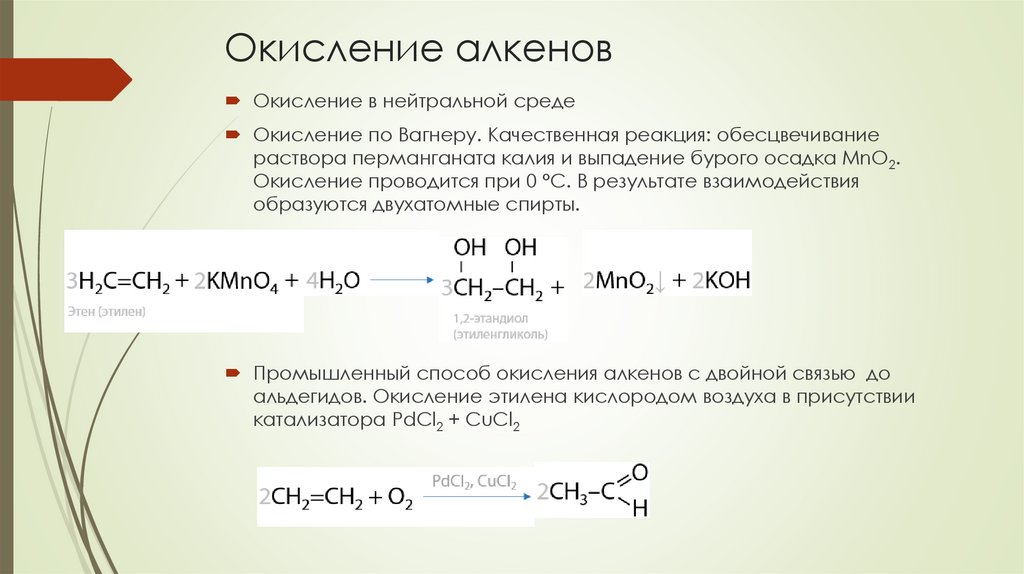
Окисление алкеновОкисление в нейтральной среде
Окисление по Вагнеру. Качественная реакция: обесцвечивание
раствора перманганата калия и выпадение бурого осадка MnO2.
Окисление проводится при 0 °C. В результате взаимодействия
образуются двухатомные спирты.
Промышленный способ окисления алкенов с двойной связью до
альдегидов. Окисление этилена кислородом воздуха в присутствии
катализатора PdCl2 + CuCl2
7.
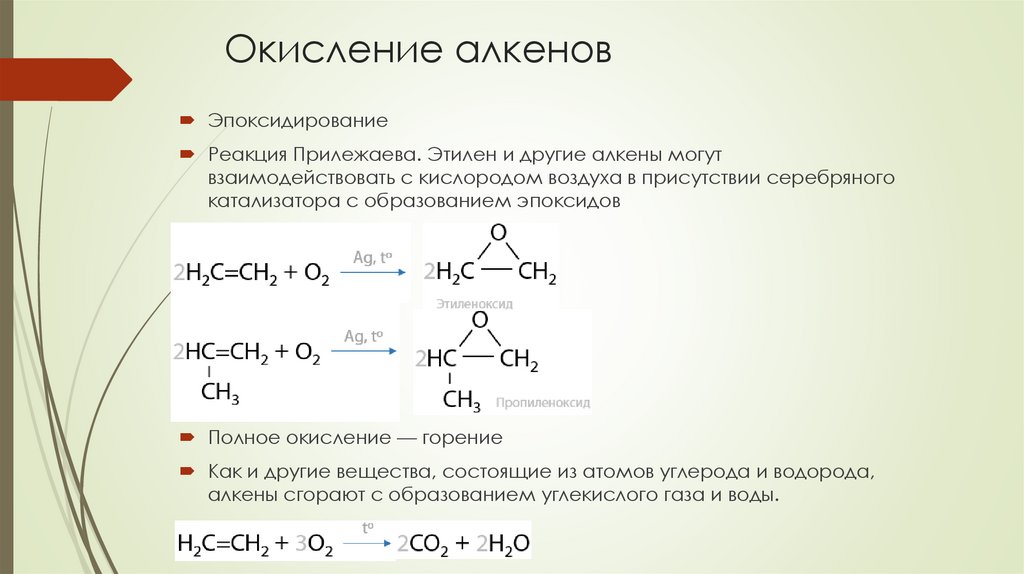
Окисление алкеновЭпоксидирование
Реакция Прилежаева. Этилен и другие алкены могут
взаимодействовать с кислородом воздуха в присутствии серебряного
катализатора с образованием эпоксидов
Полное окисление — горение
Как и другие вещества, состоящие из атомов углерода и водорода,
алкены сгорают с образованием углекислого газа и воды.
8.
Окисление алкиновМягкое окисление
В процессе взаимодействия алкинов с окислителями первоначально
происходит «разрыв» π-связей. Мягкое окисление нейтральным
(слабощелочным) раствором перманганата калия KMnO4
Жесткое окисление
Раствором KMnO4 в кислой среде. Способ определения положения
кратной связи в алкине по продуктам окисления.
Определение положения кратной связи: если в процессе окисления
выделился газ (углекислый CО2), то тройная связь находилась при
крайнем атоме углерода.
9.
Окисление алкадиеновАлкадиены подвергаются окислению по кратным (двойным) связей.
Неполное окисление перманганатом калия
a) в жестких условиях (кислая среда и нагревание) происходит полный
разрыв двойных связей с образованием дикарбоновых кислот
b) в мягких условиях (нейтральная среда и охлаждение) диены
превращаются в многоатомные спирты — реакция Вагнера
10.
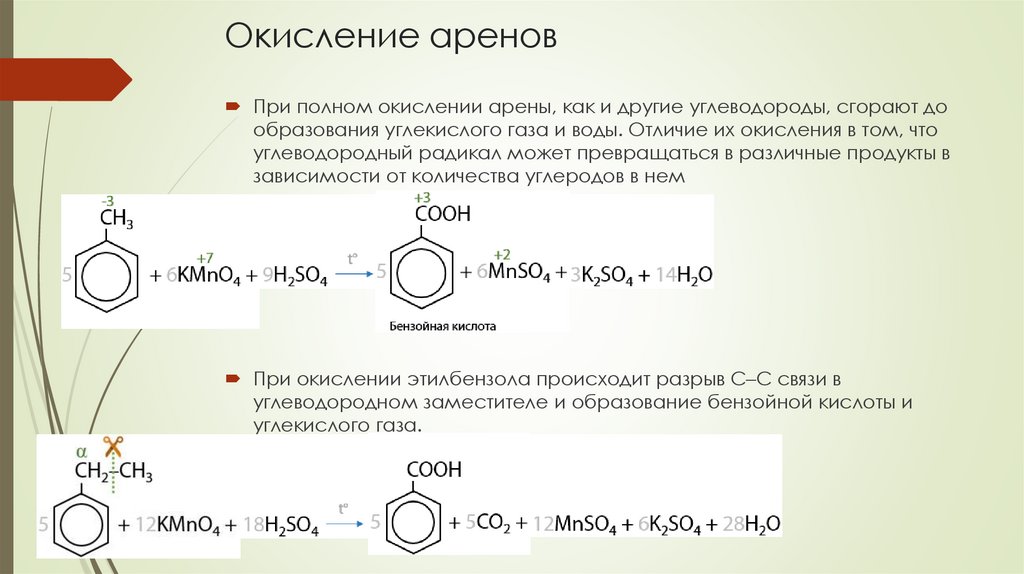
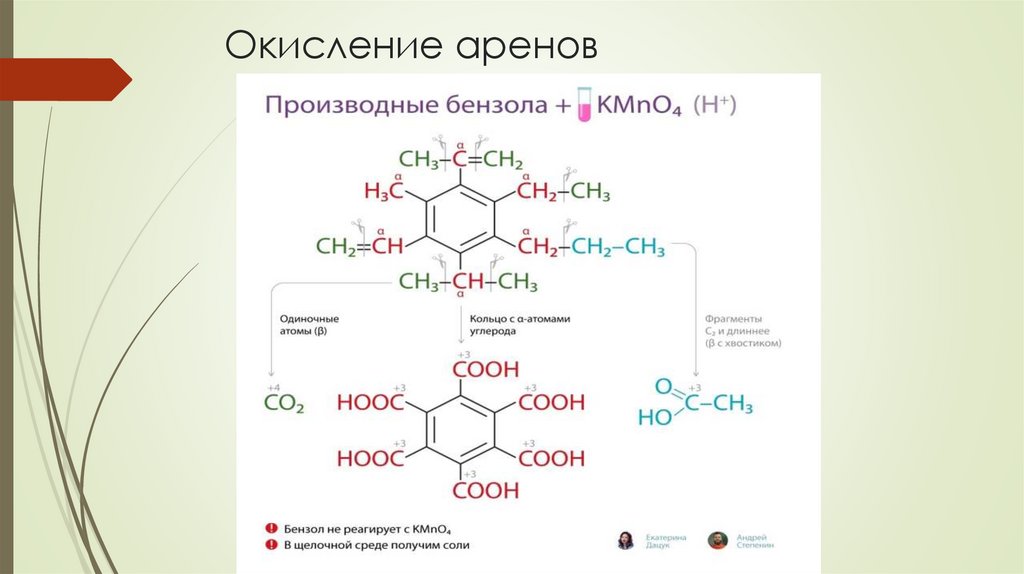
Окисление ареновПри полном окислении арены, как и другие углеводороды, сгорают до
образования углекислого газа и воды. Отличие их окисления в том, что
углеводородный радикал может превращаться в различные продукты в
зависимости от количества углеродов в нем
При окислении этилбензола происходит разрыв С–С связи в
углеводородном заместителе и образование бензойной кислоты и
углекислого газа.
11.
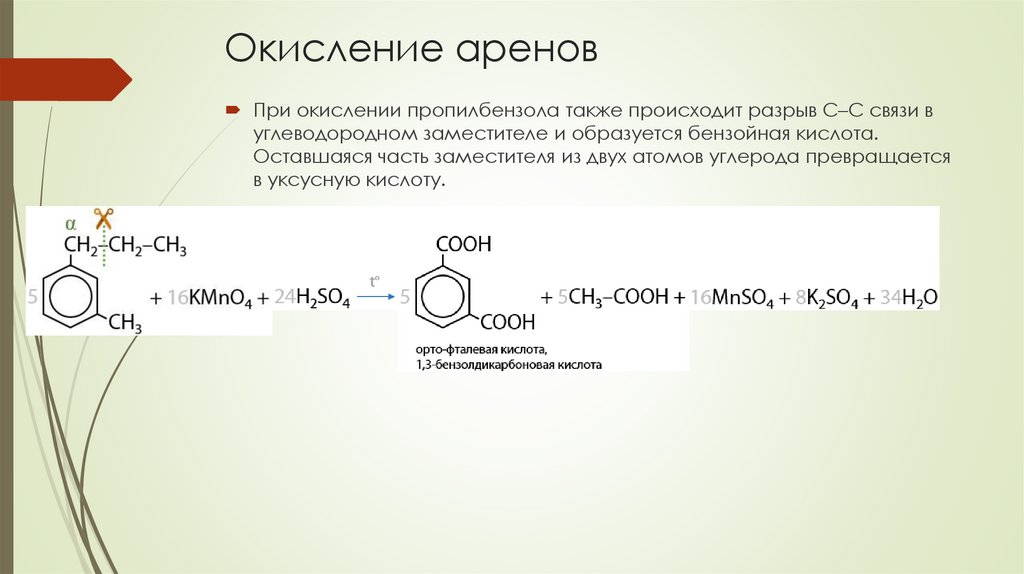
Окисление ареновПри окислении пропилбензола также происходит разрыв С–С связи в
углеводородном заместителе и образуется бензойная кислота.
Оставшаяся часть заместителя из двух атомов углерода превращается
в уксусную кислоту.
12.
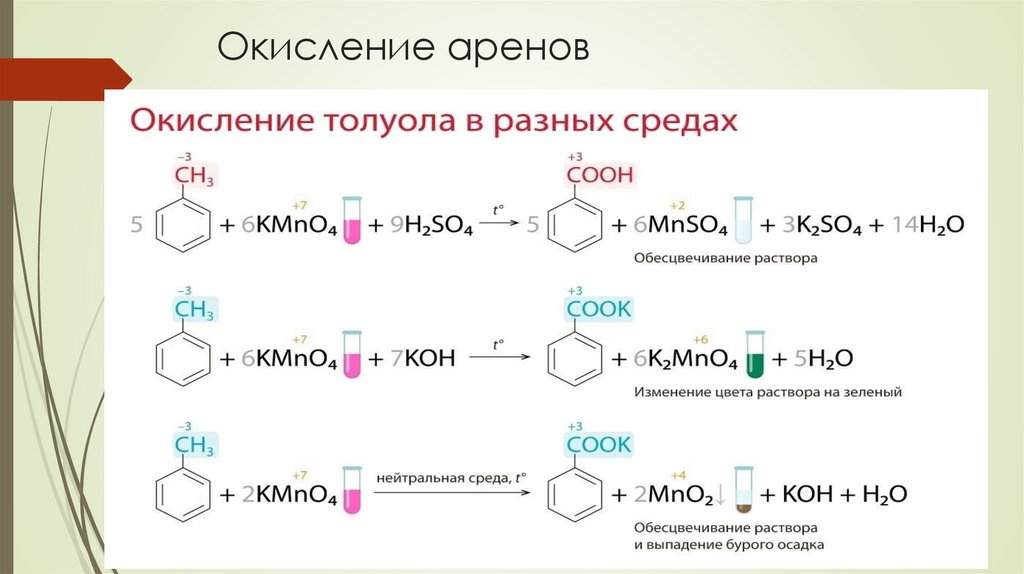
Окисление аренов13.
Окисление аренов14.
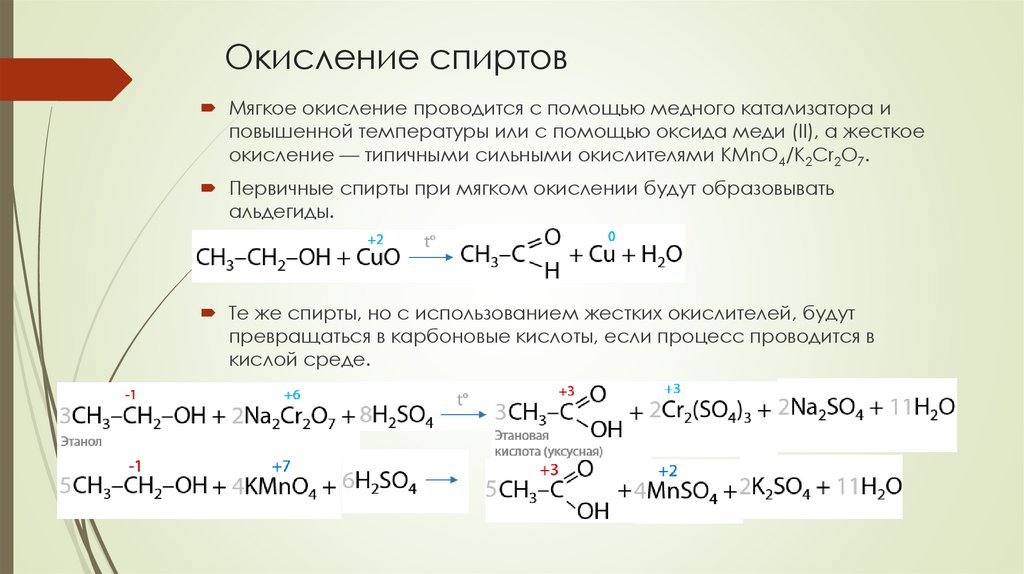
Окисление спиртовМягкое окисление проводится с помощью медного катализатора и
повышенной температуры или с помощью оксида меди (II), а жесткое
окисление — типичными сильными окислителями KMnO4/K2Cr2O7.
Первичные спирты при мягком окислении будут образовывать
альдегиды.
Те же спирты, но с использованием жестких окислителей, будут
превращаться в карбоновые кислоты, если процесс проводится в
кислой среде.
15.
Окисление спиртовПри проведении окисления в щелочной среде образуются соли
соответствующих карбоновых кислот
Вторичные спирты при использовании любого вида окисления будут
образовывать кетоны
Для окисления циклогексанола (реакция из ЕГЭ) часто применяют
концентрированную азотную кислоту HNO3, иногда для ускорения
процесса применяют катализатор — сульфат марганца MnSO4:
16.
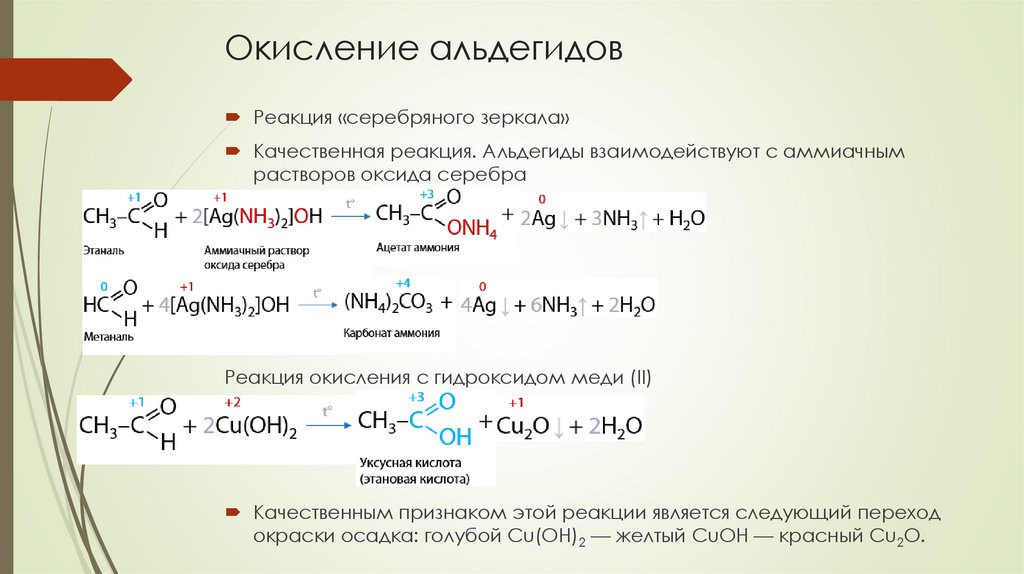
Окисление альдегидовРеакция «серебряного зеркала»
Качественная реакция. Альдегиды взаимодействуют с аммиачным
растворов оксида серебра
Реакция окисления с гидроксидом меди (II)
Качественным признаком этой реакции является следующий переход
окраски осадка: голубой Cu(OH)2 — желтый CuOH — красный Cu2O.
17.
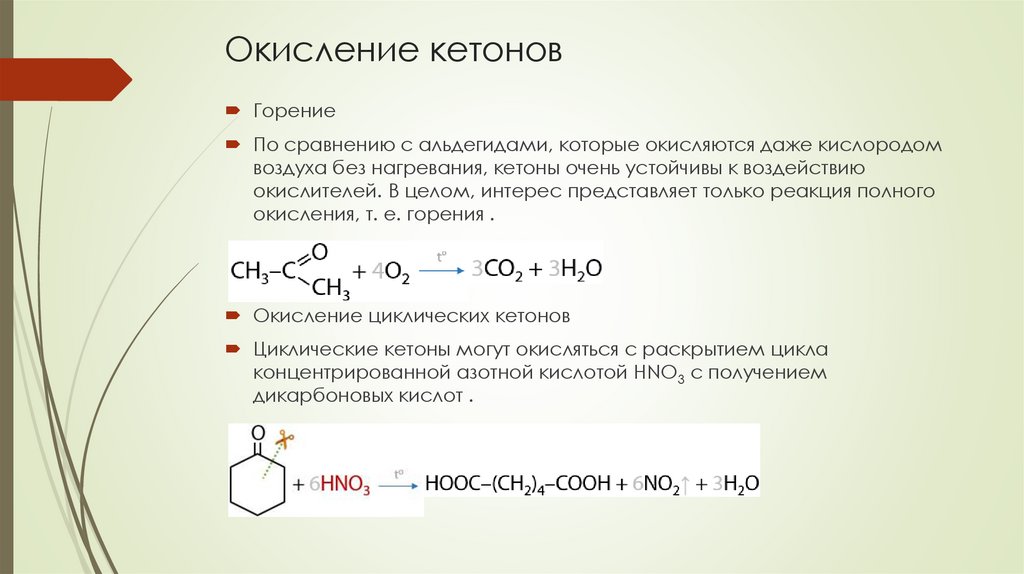
Окисление кетоновГорение
По сравнению с альдегидами, которые окисляются даже кислородом
воздуха без нагревания, кетоны очень устойчивы к воздействию
окислителей. В целом, интерес представляет только реакция полного
окисления, т. е. горения .
Окисление циклических кетонов
Циклические кетоны могут окисляться с раскрытием цикла
концентрированной азотной кислотой HNO3 с получением
дикарбоновых кислот .
18.
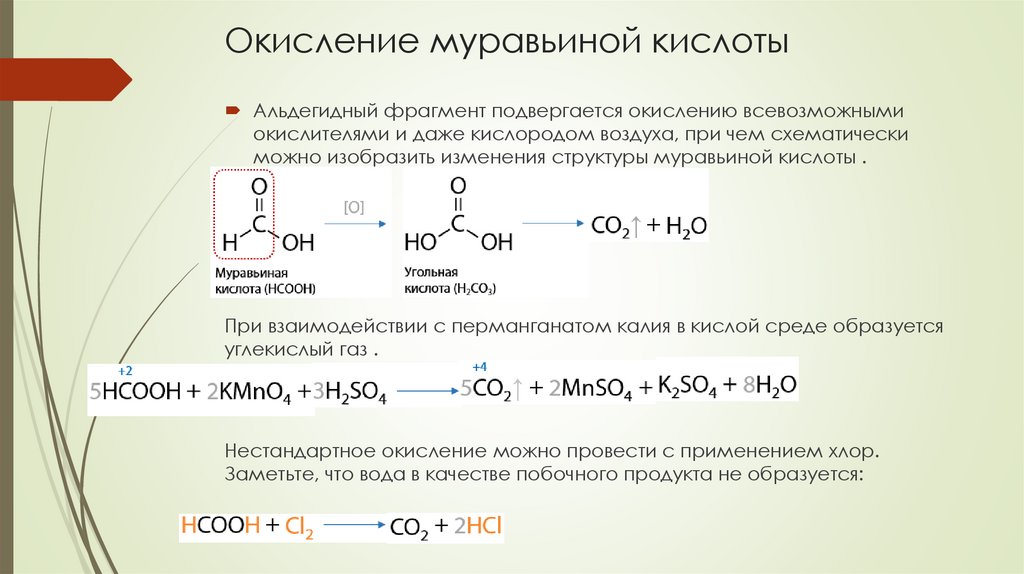
Окисление муравьиной кислотыАльдегидный фрагмент подвергается окислению всевозможными
окислителями и даже кислородом воздуха, при чем схематически
можно изобразить изменения структуры муравьиной кислоты .
При взаимодействии с перманганатом калия в кислой среде образуется
углекислый газ .
Нестандартное окисление можно провести с применением хлор.
Заметьте, что вода в качестве побочного продукта не образуется:
19.
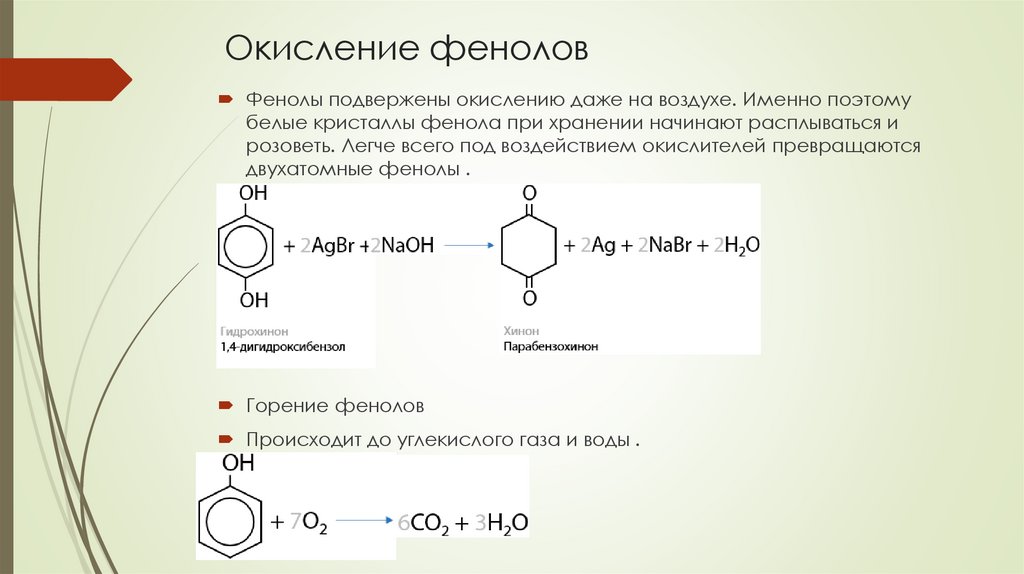
Окисление феноловФенолы подвержены окислению даже на воздухе. Именно поэтому
белые кристаллы фенола при хранении начинают расплываться и
розоветь. Легче всего под воздействием окислителей превращаются
двухатомные фенолы .
Горение фенолов
Происходит до углекислого газа и воды .
20.
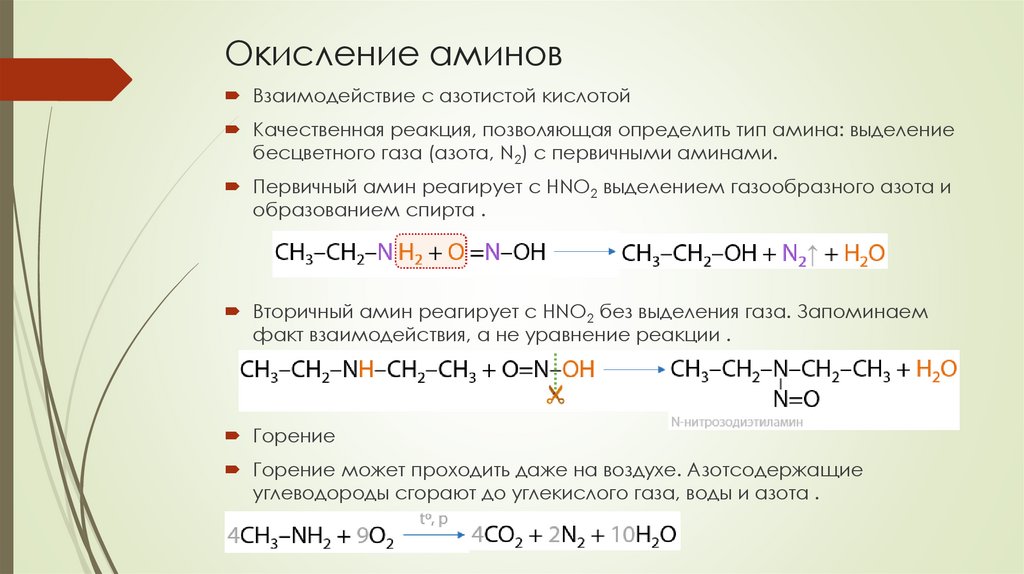
Окисление аминовВзаимодействие с азотистой кислотой
Качественная реакция, позволяющая определить тип амина: выделение
бесцветного газа (азота, N2) с первичными аминами.
Первичный амин реагирует с HNO2 выделением газообразного азота и
образованием спирта .
Вторичный амин реагирует с HNO2 без выделения газа. Запоминаем
факт взаимодействия, а не уравнение реакции .
Горение
Горение может проходить даже на воздухе. Азотсодержащие
углеводороды сгорают до углекислого газа, воды и азота .






 chemistry
chemistry








