Similar presentations:
Окислительно-восстановительные реакции в органической химии
1.
Окислительновосстановительныереакции в органической
химии
2.
Содержание• Окислительно-восстановительные
реакции в органике
• Степень окисления в органической химии
• Метод электронного баланса
3.
Степень окисления в органическойхимии
• В неорганической химии степень
окисления – одно из основных понятий,
в органической химии – нет.
4.
Степень окисления в органической химииДля органической химии важна не
степень окисления атома, а смещение
электронной плотности, в результате
которого на атомах появляются частичные
заряды, никак не согласующиеся со
значениями степеней окисления.
С→ - смещение электронной плотности от
углерода на более электроотрицательный атом
→ С - смещение электронной плотности на
углерод
5.
Определение степени окисления в органическихсоединениях алгебраическим методом
1.Алгебраический способ (в молекуле один
углерод)
-4 +
Метан
СН4,
-2+
-2 +
метиловый спирт СНзОН,
0 + -2
формальдегид СН2О,
+ +2 -2 -2 +
муравьиная кислота НСООН
6.
Определение степени окисления в органическихсоединениях графическим методом
2. Графический метод:
1) изображается полная структурная формула
вещества;
2) по каждой связи стрелкой показывается смещение
электронов к наиболее электроотрицательному
элементу;
3) все связи С – С считаются неполярными;
4) далее ведется подсчет: сколько стрелок
направлено к атому, столько «–» , сколько от атома
– столько «+». Сумма «–» и «+» определяет
степень окисления атома. Рассмотрим несколько
примеров:
7.
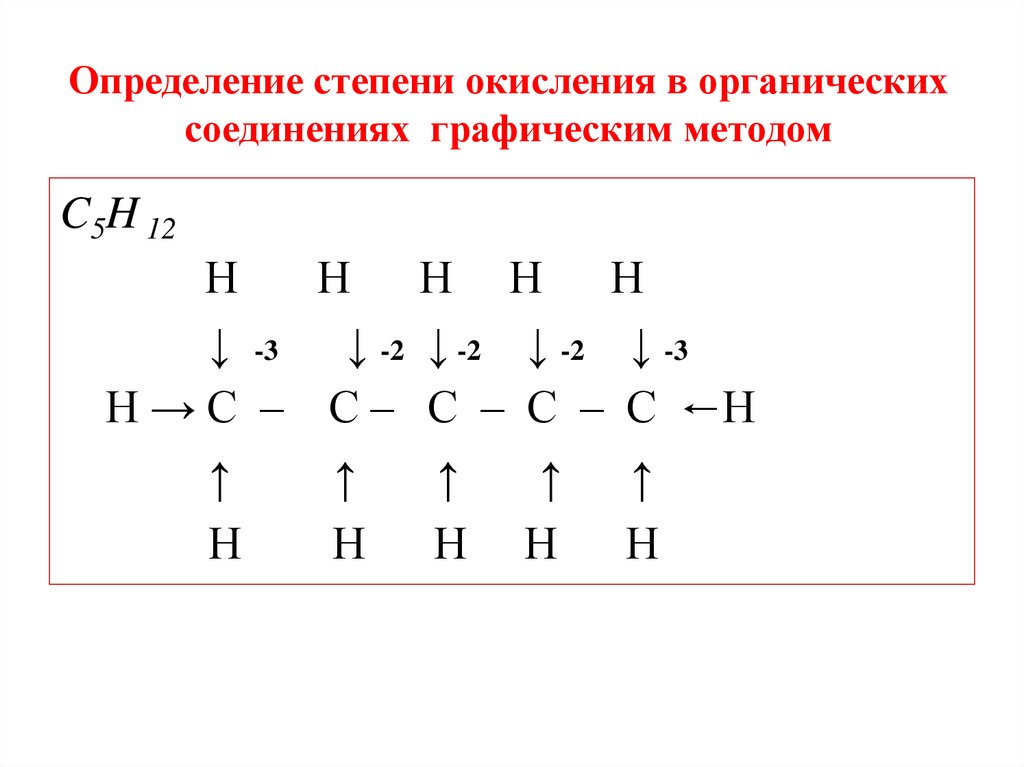
Определение степени окисления в органическихсоединениях графическим методом
C5H 12
Н
Н Н Н Н
↓ -3 ↓ -2 ↓ -2 ↓ -2 ↓ -3
Н → С – С – С – С – С ←Н
↑
Н
↑
Н
↑
Н
↑
Н
↑
Н
8.
Определение степени окисления в органическихсоединениях графическим методом
СН3 СОН
Н
↓ -3 +1
Н → С – С => О
↑
↑
Н
Н
9.
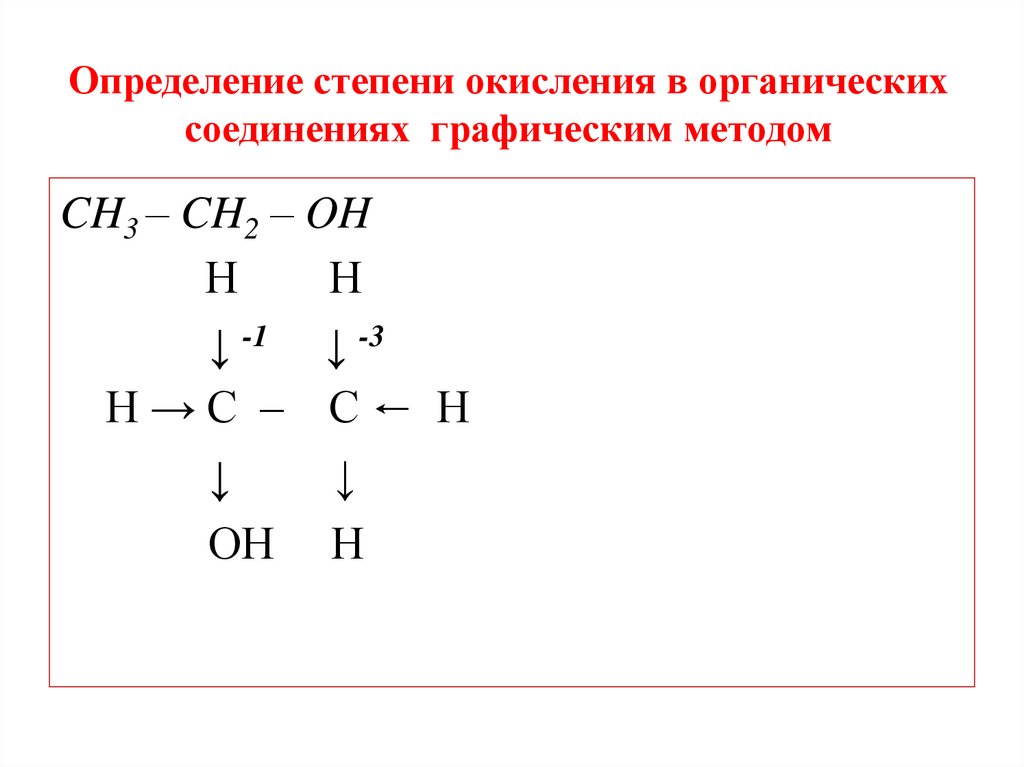
Определение степени окисления в органическихсоединениях графическим методом
CH3 – CH2 – OH
Н
Н
↓ -1 ↓ -3
Н→С – С← Н
↓
ОН
↓
Н
10.
Определение степени окисления в органическихсоединениях графическим методом
СН3 СООН
Н
↓-3 +3
Н → С – С => О
↑
↓
Н ОН
11.
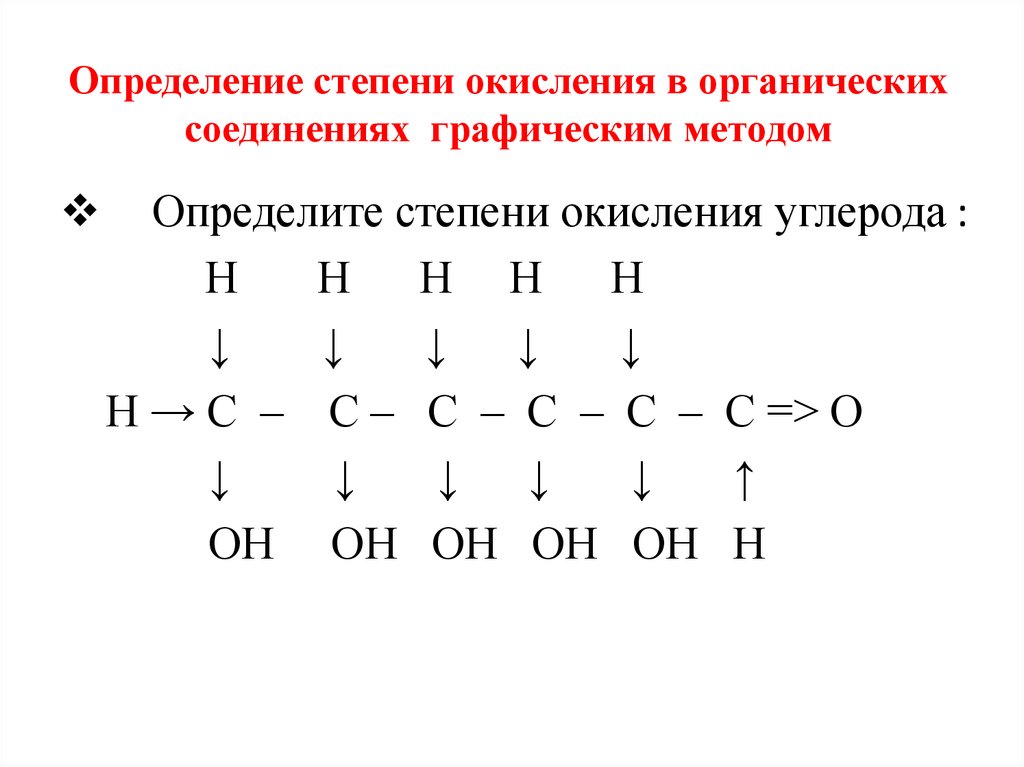
Определение степени окисления в органическихсоединениях графическим методом
Определите степени окисления углерода :
Н
Н Н Н Н
↓
↓
↓ ↓
↓
Н → С – С – С – С – С – С => О
↓
↓
↓ ↓
↓
↑
ОН ОН ОН ОН ОН Н
12.
Окислительно-восстановительные реакции сучастием органических веществ, их
разновидности, определение продуктов
1. Полное окисление и горение. В качестве окислителей
используются кислород, концентрированные азотная и
серная кислота, можно использовать твердые соли, при
нагревании которых выделяется кислород (хлораты,
нитраты, перманганаты и т.п.), другие окислители
(например, оксид меди (II)).
В этих реакциях наблюдается разрушение всех химических
связей в органическом веществе. Продуктами окисления
органического вещества являются углекислый газ и вода.
13.
2.Мягкое окислениеВ этом случае не происходит разрыва углеродной цепи. К
мягкому окислению относится окисление спиртов до
альдегидов и кетонов, окисление альдегидов до
карбоновых кислот, окисление алкенов до двухатомных
спиртов (Реакция Вагнера), окисление ацетилена до
оксалата калия, толуола – до бензойной кислоты и т.д. В
качестве окислителей в этих случаях используются
разбавленные растворы перманганата калия, дихромата
калия, азотной кислоты, аммиачный раствор оксида
серебра, оксид меди (II), гидроксид меди (II).
14.
3.Деструктивное окисление(жесткое)
Происходит в более жестких условиях, чем мягкое
окисление, сопровождается разрывом некоторых
углерод-углеродных связей. В качестве
окислителей используются более
концентрированные растворы перманганата
калия, дихромата калия при нагревании. Среда
этих реакций может быть кислой, нейтральной и
щелочной. От этого будут зависеть продукты
реакций.
15.
Подбор коэффициэнтов в уравнениях ОВРметодом электронного баланса
• При составлении уравнений ОВР, протекающих с
участием органических веществ, в простейших
случаях можно применить степень окисления.
16.
Горение бутана0
+4 -2
+ -2
2
окисление
26
восстановление
14
26
12
52
4
4
17.
Окисление фенилацетилена водным растворомперманганата калия при нагревании.
С6Н5-С0≡С-1Н + KMn+7O4 С6Н5-С+3ООК +
Mn+4O2 + К2С+4О3 + КНС+4О3 + H2O
С 0 – 3е С+3 8 3
Окисление
восстановитель С -1– 5е С+4
Mn+7 + 3е Mn+4 3 8
Восстановление
3С6Н5-С0≡С-1Н + 8KMn+7O4 3С6Н5-С+3ООК
+ 8Mn+4O2 + 2К2С+4О3 + КНС+4О3 + H2O
окислитель
18.
Окисление бутена-1 водным растворомперманганата калия при нагревании.
C-3H3-C-2H2-C-1H=C-2H2 + KMn+7O4
С2Н5-С+3ООК + Mn+4O2 + KOH+ К2С+4О3 + H2O
С -1 – 4е С+3
Восстановитель С -2 – 6е С+4 10 3
Окисление
окислитель Mn+7 + 3е Mn+4 3 10
Восстановление
3C-3H3-C-2H2-C-1H=C-2H2 + 10KMn+7O4
3С2Н5-С+3ООК + 10Mn+4O2 + KOH+ 3К2С+4О3 +H2O
19.
Реакция окисления этилена растворомперманганата калия в нейтральной среде на холоду
(реакция Вагнера).
2
20.
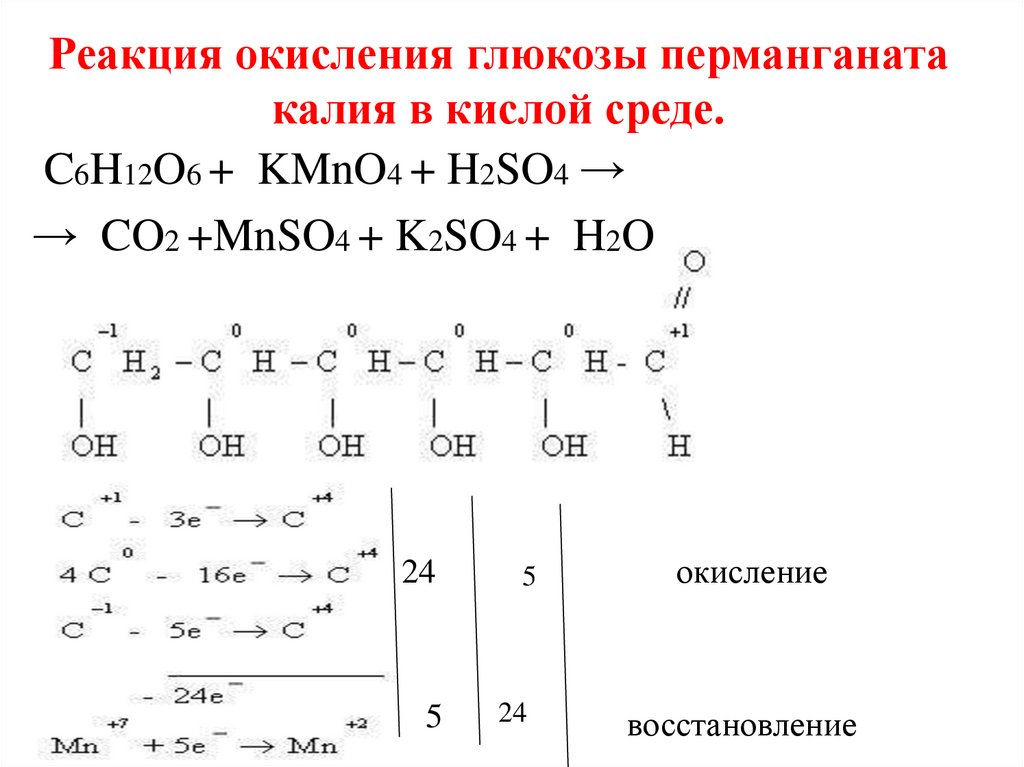
Реакция окисления глюкозы перманганатакалия в кислой среде.
C6H12O6 + KMnO4 + H2SO4 →
→ CO2 +MnSO4 + K2SO4 + H2O
24
5
окисление
5
24
восстановление
21.
Упражнения.Расставьте коэффициенты методом электронного
баланса в уравнениях реакций:
б) С3Н8 + О2 → СО2+ Н2О
в) СН3СН2ОН + KMnO4
→ СН3СООН + MnO2 + КОН
+ Н2О
г) С6Н5СН3+ KMnO4+ H2SO 4 → С6Н5СООН + MnSO4+
K2SO4+ H2O.

















 chemistry
chemistry








