Similar presentations:
Комплемент. Межклеточные пространства, заполненные тканевой жидкостью
1.
КомплементЛекция 6
2.
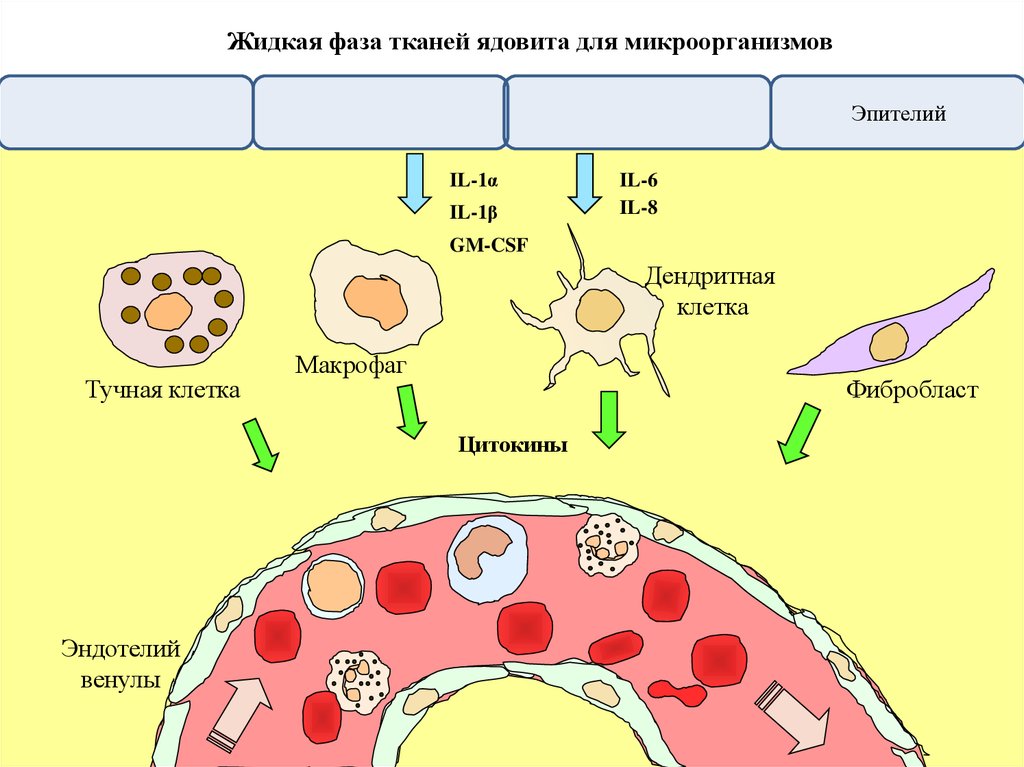
Жидкая фаза тканей ядовита для микроорганизмовЭпителий
IL-1α
IL-1β
IL-6
IL-8
GM-CSF
Дендритная
клетка
Тучная клетка
Макрофаг
Фибробласт
Цитокины
Эндотелий
венулы
3.
КЛЕТКИ ТКАНИ ОМЫВАЮТСЯ ЖИДКОЙ СРЕДОЙ,ЧЕРЕЗ КОТОРУЮ ПРОИСХОДИТ ОБМЕН ВЕЩЕСТВ
артериола
венула
Клетки, населяющие
ткань
вена
артерия
капилляр
Тканевая жидкость показана желтым цветом
4. Межклеточные пространства, заполненные тканевой жидкостью
аб
Ядро
Миофибрилла
Скелетная мышца: продольный (а) и поперечный (б) срезы
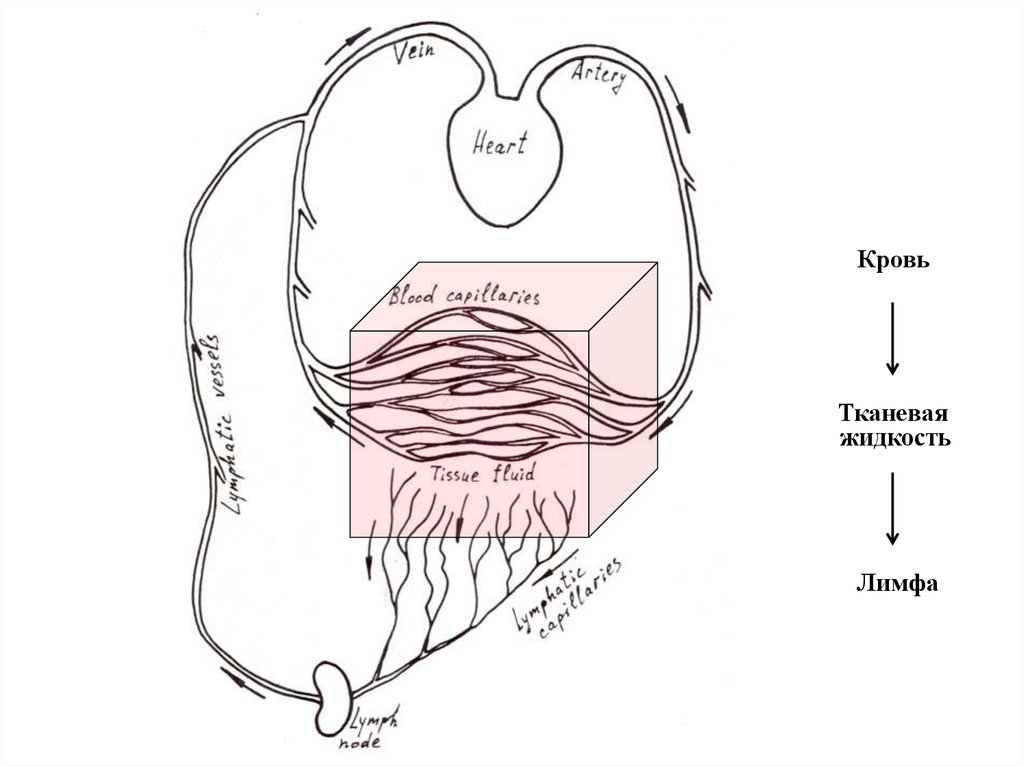
5.
КровьTalin
Тканевая
жидкость
Лимфа
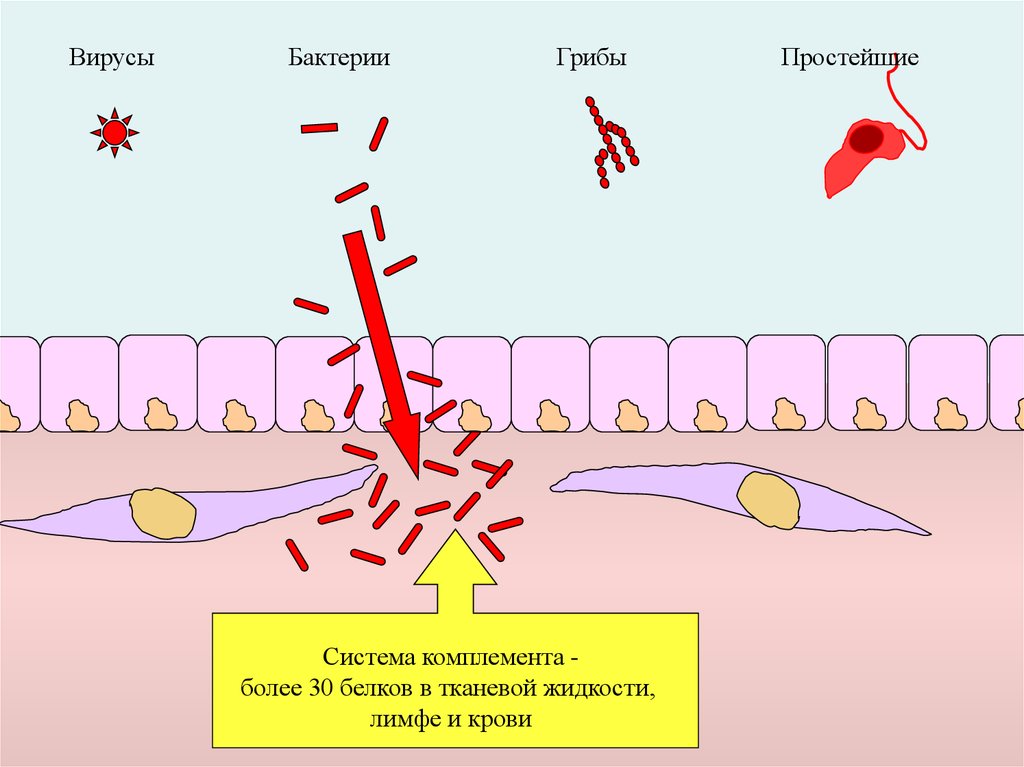
6.
ВирусыБактерии
Грибы
Система комплемента более 30 белков в тканевой жидкости,
лимфе и крови
Простейшие
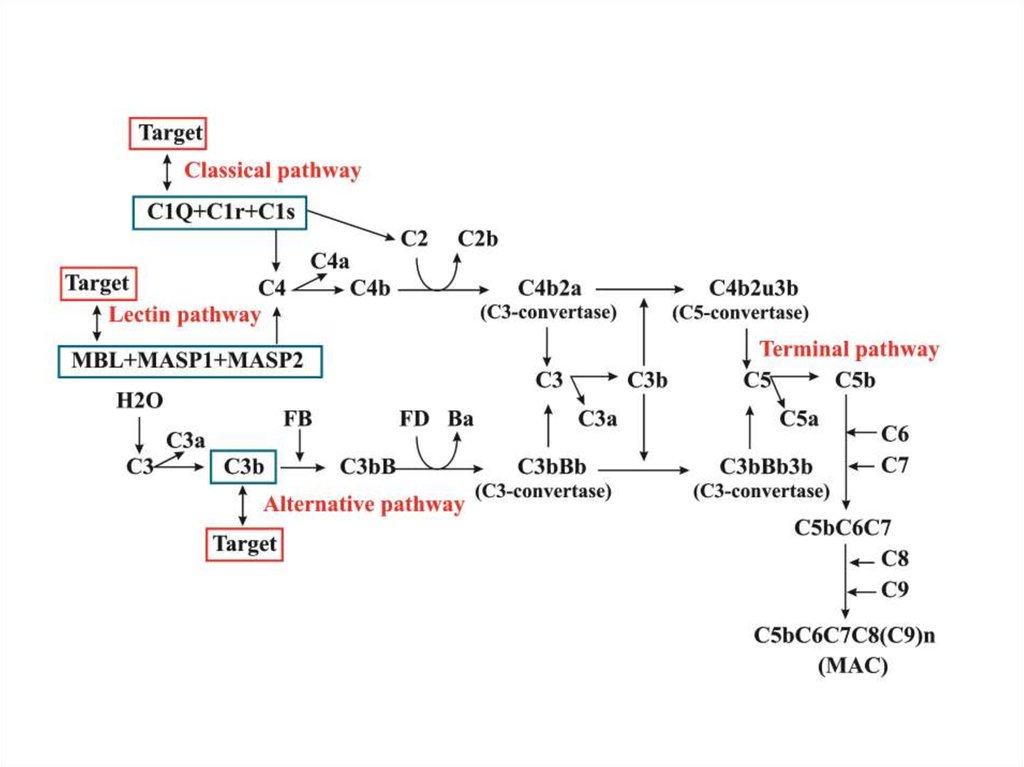
7.
Типичное представление системы комплемента8.
9.
10.
11.
Неклассическое представление о системе комплемента:Динамическая структура молекул
Функциональные блоки
Развертывание во времени (Кинетика)
Развертывание в пространстве
12.
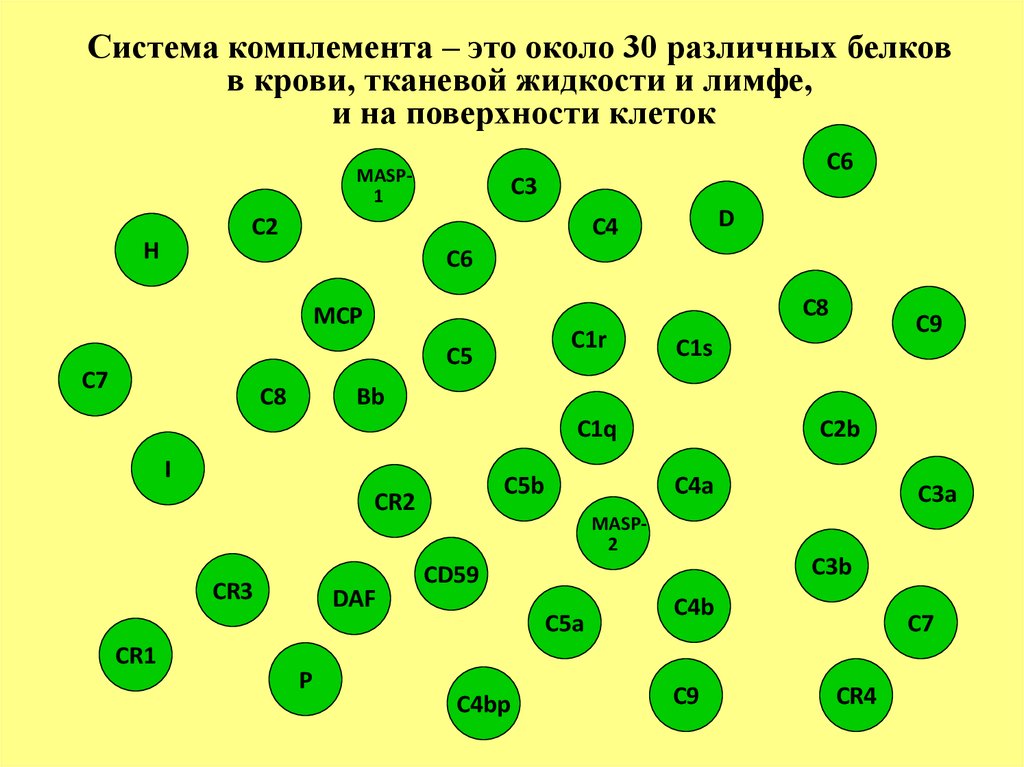
Система комплемента – это около 30 различных белковв крови, тканевой жидкости и лимфе,
и на поверхности клеток
MASP1
С6
С3
С2
H
D
С4
С6
С8
MCP
С1r
С5
С7
С8
С1s
Bb
С1q
I
С5b
CR2
CR3
CR1
С9
DAF
P
С2b
С4a
MASP2
С3b
СD59
С5a
С4bp
С3a
С4b
С9
С7
CR4
13.
Где производятся факторы комплемента:Гепатоциты
Лейкоциты
Фибробласты
Жировые клетки
Эпителиальные клетки
14.
15.
16.
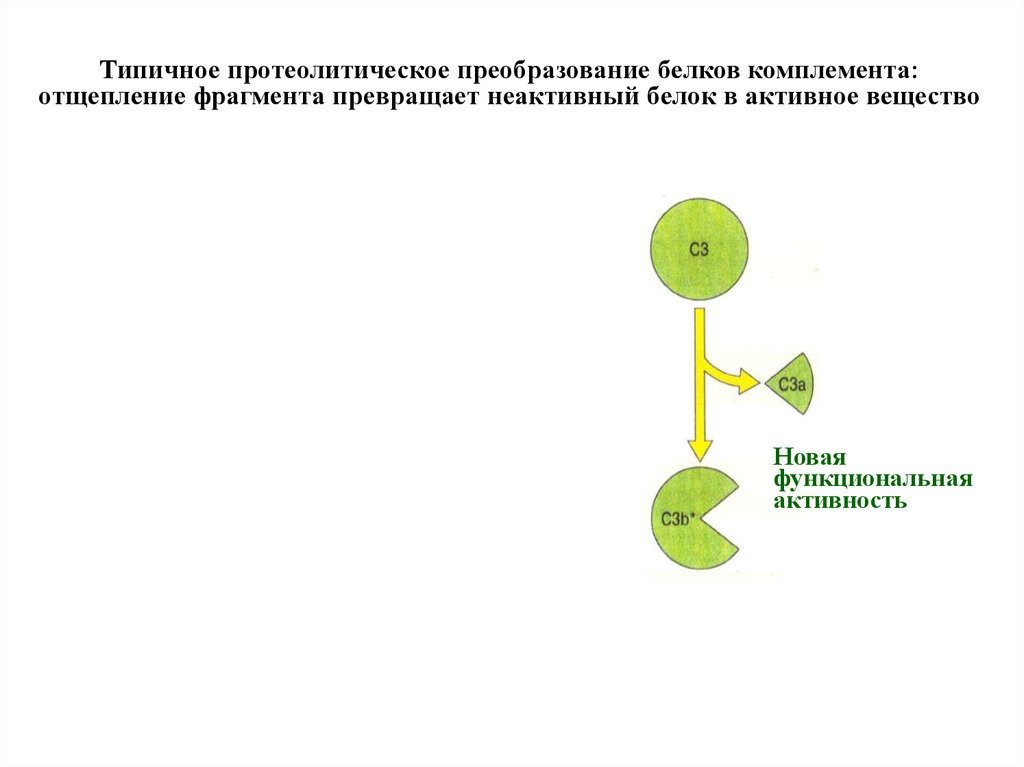
Типичное протеолитическое преобразование белков комплемента:отщепление фрагмента превращает неактивный белок в активное вещество
Новая
функциональная
активность
Откалывая фрагменты от обыкновенного булыжника,
древние люди превращали его в нож, скребок или
другой полезный инструмент
17.
Типы превращений белков комплемента:Протеолитическое отщепление пептида, приводящее к активации белка.
Протеолитическое отщепление небольшого пептида → оба фрагмента активны.
Конформационное изменение белка с последующим протеолитическим
отщеплением пептида и изменением активности белка.
Протеолитическое отщепление пептида и последующее конформационное
изменение белка → появление новой активности
Стыковка (docking) двух белковых молекул с последующим
протеолитическим отщеплением пептида от одного из белков → появление
новой активности у тандема.
Отщепление пептида от одного из белков с последующей стыковкой
(docking) двух белковых молекул → появление новой активности у тандема.
18.
Белок С3 – ключевой фактор системы комплемента.Его особенность состоит в нестабильности.
Тиоэфирная группа склонна к спонтанному гидролизу
С3
С3
С3
С3 – глобулярный белок, состоит из двух цепей α и β,
Всего – более 1600 a.a., организованных в 13 доменов
19.
При спонтанном гидролизе тиоэфирной группыдомены TED и CUB отодвигаются от остальной части молекулы C3.
Открывается место для посадки фактора В. Протеаза D отщепляет один из доменов фактора B.
Образуется активный фермент C3u+Bb, он способен разрушать новые молекулы С3
C3
vWA
SP
С3-конвертаза
Ba
C3u
(C3H20)
(C3u+Bb)
фактор
B
протеаза D
vWA
SP
Тиоэфирная группа не может пришиваться к поверхности, C3uBb остается в жидкой фазе,
называется «жидкофазовая конвертаза С3»
20.
«Холостая» активация С321.
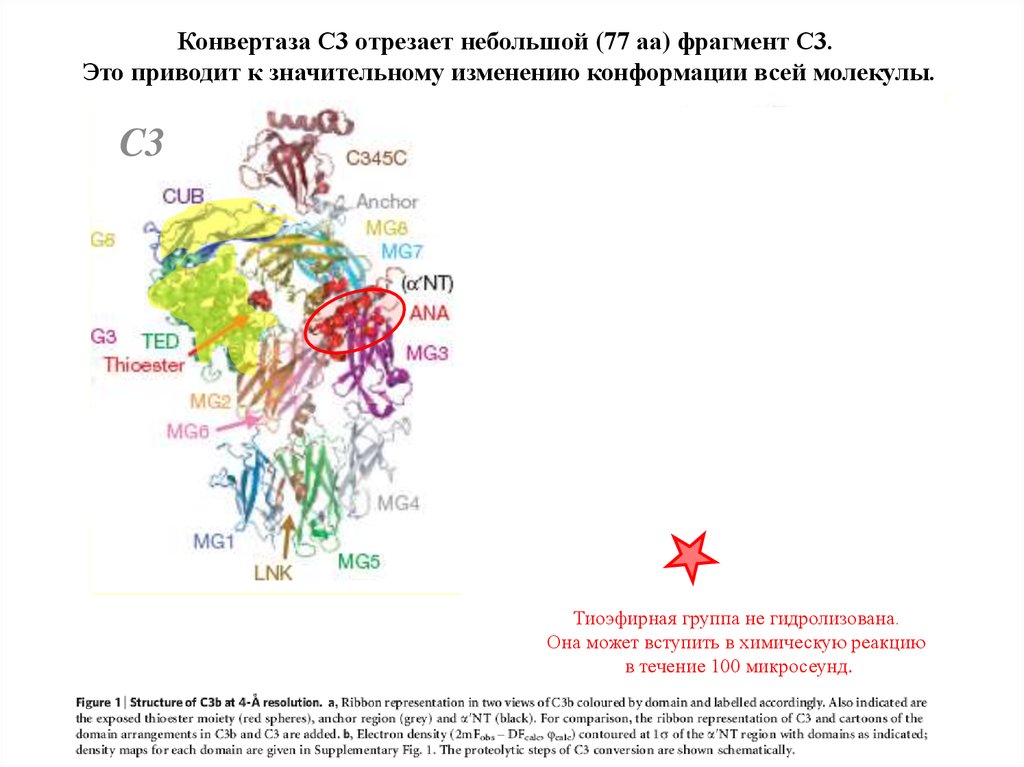
Конвертаза С3 отрезает небольшой (77 аа) фрагмент С3.Это приводит к значительному изменению конформации всей молекулы.
C3
C3b
Тиоэфирная группа не гидролизована.
Она может вступить в химическую реакцию
в течение 100 микросеунд.
22.
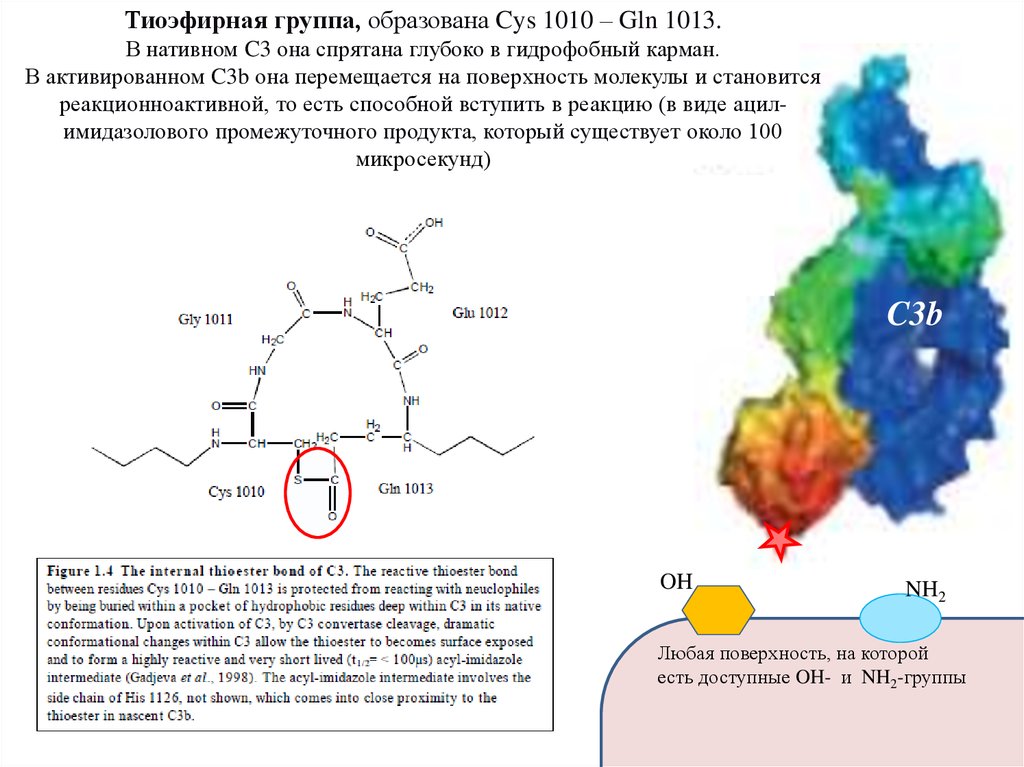
Тиоэфирная группа, образована Cys 1010 – Gln 1013.В нативном C3 она спрятана глубоко в гидрофобный карман.
В активированном C3b она перемещается на поверхность молекулы и становится
реакционноактивной, то есть способной вступить в реакцию (в виде ацилимидазолового промежуточного продукта, который существует около 100
микросекунд)
C3b
OH
NH2
Любая поверхность, на которой
есть доступные OH- и NH2-группы
23.
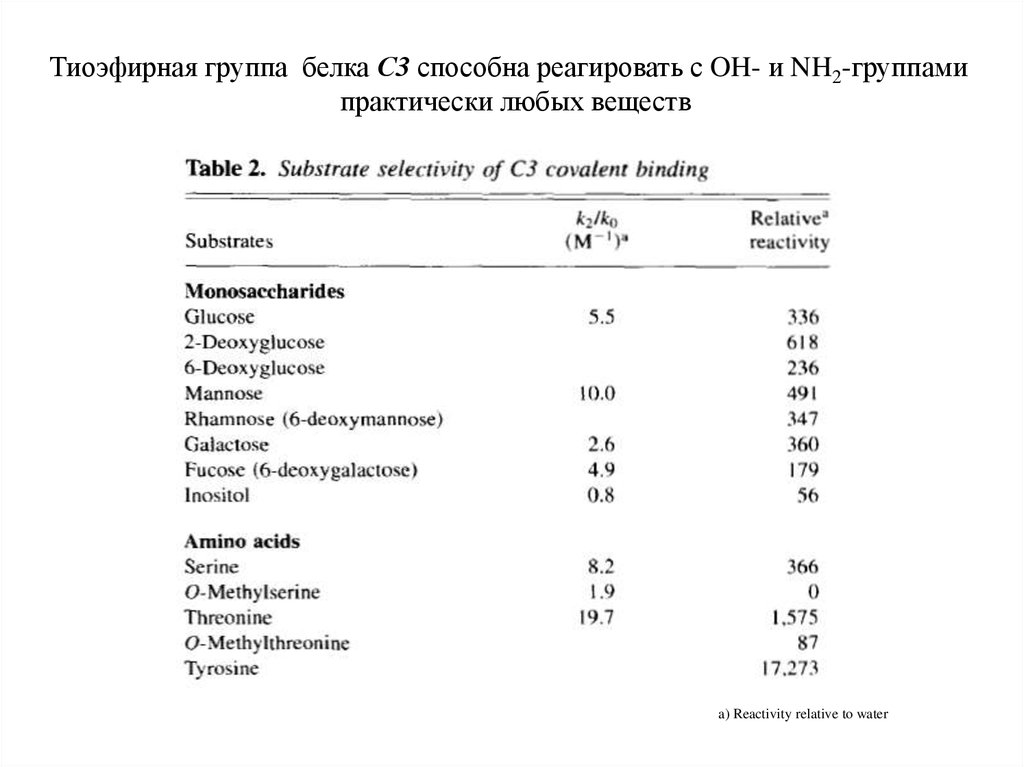
Тиоэфирная группа белка С3 способна реагировать с OH- и NH2-группамипрактически любых веществ
a) Reactivity relative to water
24.
Образование твердофазовой С3-конвертазы (C3b+Bb)Образовалась конвертаза C3
Протеаза
D
VWA
SP
C3b
Ba
Ковалентная связь
с поверхностью
25.
Комплекс C3b + Bb нестабилен.Его стабилизирует пропердин.
Пропердин
Фактор
B
Фактор
Фактор C3b
Bb
Фактор
C3b
26.
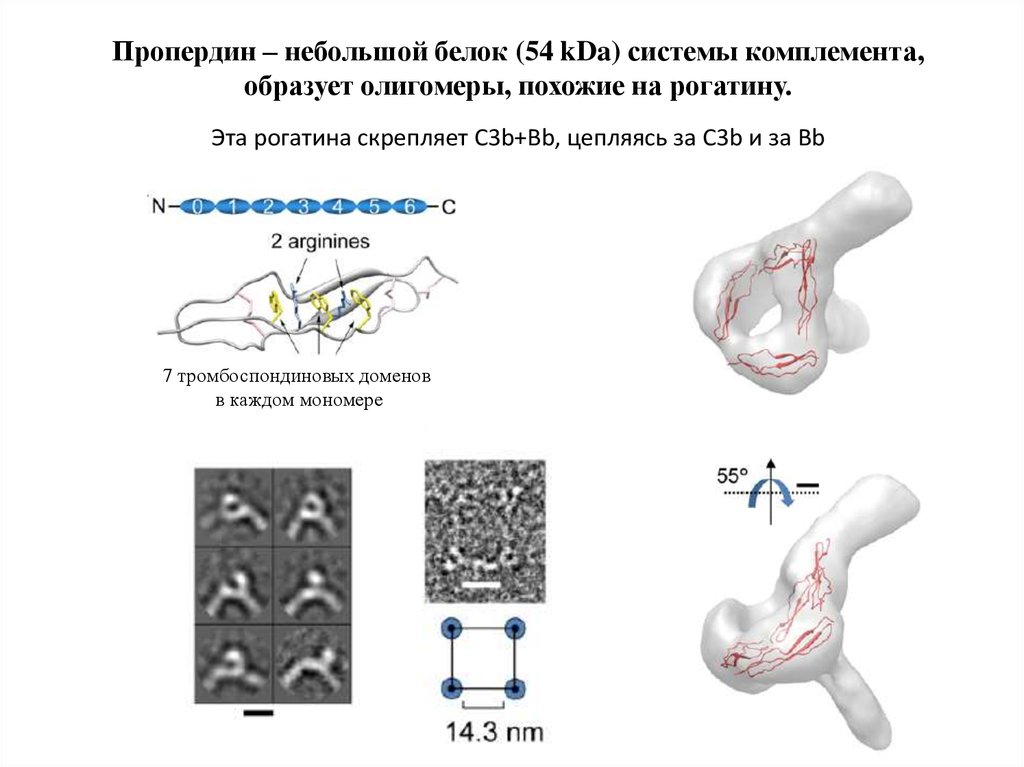
Пропердин – небольшой белок (54 kDa) системы комплемента,образует олигомеры, похожие на рогатину.
Эта рогатина скрепляет C3b+Bb, цепляясь за C3b и за Bb
7 тромбоспондиновых доменов
в каждом мономере
27.
Пропердин стабилизирует С3-конвертазу(C3b+Bb+Properdin)
Пропердин
Пропердин
Фактор Bb
Фактор C3b
Фактор C3b
Фактор Bb
28.
Спонтанный гидролиз тиоэфирной группы – событие случайное и нечастое,но при большом количестве молекул C3 в крови оно происходит регулярно.
Система комплемента то и дело «вспыхивает», образуя потенциально
активный белок C3u и вслед за ним – конвертазу C3u+Bb.
Эта конвертаза называется жидкофазовой, она неустойчива, разрушается в
течение микросекунд.
Если образуется C3b, а затем конвертаза C3bBb, то возникает возможность
стабилизации реакции путем присоединения тиоэфирной группы к какойлибо поверхности
Пропердин
TED
Фактор Bb
Тиоэфирная
группа
Фактор C3u
Ковалентная
связь
Фактор C3b
Поверхность
29.
Конвертаза С3 отрезает небольшой (77 аа) фрагмент С3.Это приводит к значительному изменению конформации всей молекулы.
C3
C3b
Тиоэфирная группа не гидролизована.
Она может вступить в химическую реакцию
в течение 100 микросеунд.
30.
Размножение С3bреализуется на доступной поверхности
С3
С3b
B
C3a
C3a
C3a
C3b C3a
C3
C3b
C3
C3b C3a
C3
C3b
С3b-B
C3
C3a
C3b
C3
C3a
D
C3b
C3
С3b-Bb
C3a
C3b
C3
C3b
Конвертаза С3 − это фермент,
C3
разрушающий С3
с образованием C3a и C3b
31.
Три важных следствия возникновения твердофазовой С3-конвертазы:1. Поверхность модифицируется химически (ковалентно пришитыми молекулами C3b)
2. От этой поверхности исходит поток небольших фрагментов C3a
(создается градиентное поле химического вещества)
3. Каждая новая молекула продукта (C3b) может стать ферментом (C3bBb),
производящим этот же самый продукт (C3b). Процесс имеет свойства цепной реакции,
что приводит к химическому взрыву!
32.
Химическая ковалентная пришивка C3b к поверхностиC3a
C3
C3b
C3b
33.
Модификация поверхности микробной клетки множеством молекул C3bимеет фатальные последствия для микроорганизма –
гибель вследствие фагоцитоза или гибель вследствие лизиса
C3b
34.
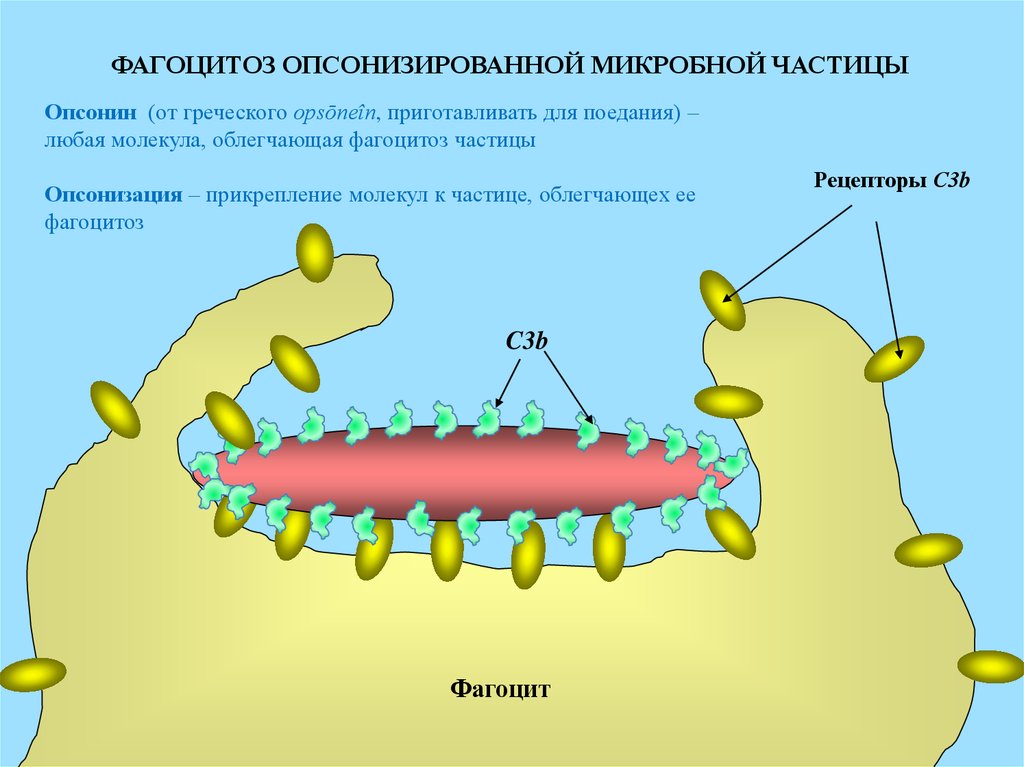
ФАГОЦИТОЗ ОПСОНИЗИРОВАННОЙ МИКРОБНОЙ ЧАСТИЦЫОпсонин (от греческого opsōneîn, приготавливать для поедания) –
любая молекула, облегчающая фагоцитоз частицы
Опсонизация – прикрепление молекул к частице, облегчающех ее
фагоцитоз
C3b
Фагоцит
Рецепторы С3b
35.
Complement Receptors36.
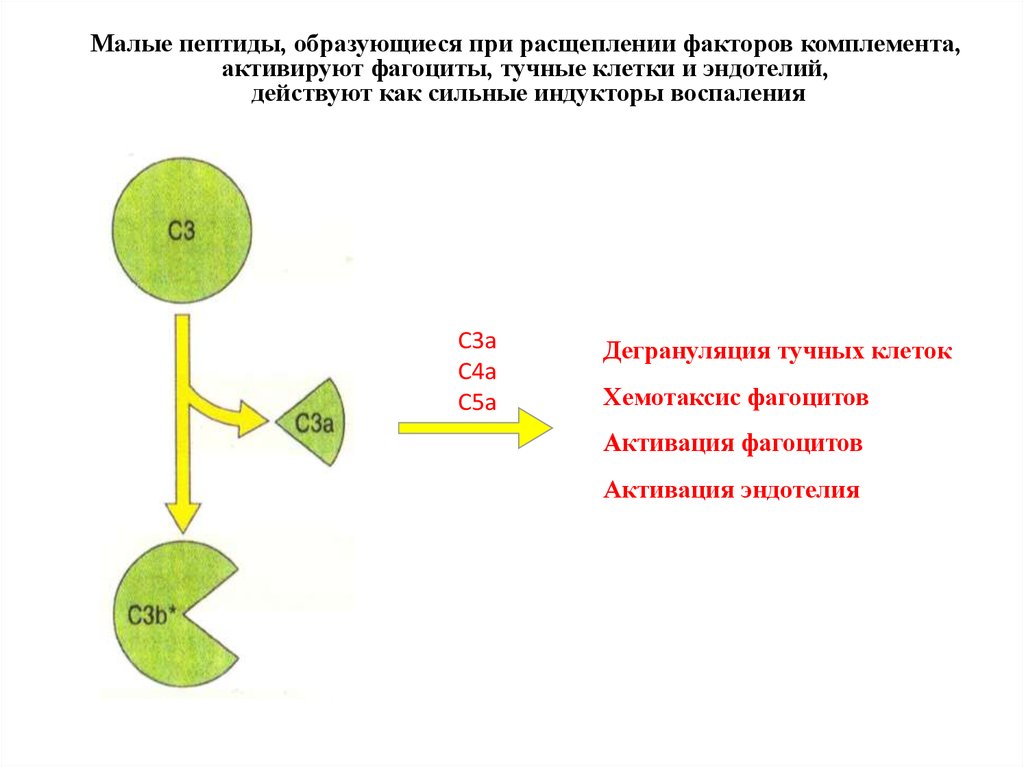
Малые пептиды, образующиеся при расщеплении факторов комплемента,активируют фагоциты, тучные клетки и эндотелий,
действуют как сильные индукторы воспаления
C3a
C4a
C5a
Дегрануляция тучных клеток
Хемотаксис фагоцитов
Активация фагоцитов
Активация эндотелия
37.
Лавинообразный процесс образования C3b и C3a.Стабилизированные на поверхности молекулы C3b превращаются в новые
ферменты конвертазы C3bBb, которые производят еще больше C3b,
которые…...
Не стабилизированные молекулы C3b (в жидкой фазе) быстро разрушаются
протеазами.
Молекулы C3a образуют диффузионный градиент с эпицентром на
реакционной поверхности.
C3a
C3
C3b
C3
C3a
C3
C3b
C3
C3
C3b
C3a
C3a
C3a C3
C3b C3
C3a
C3a
C3b
C3a
C3b C3
C3b
C3a
C3a
C3b
C3
C3a
C3a
C3b
C3a
C3a
C3C3a
C3
C3a C3b C3C3b
C3b
C3b
C3C3
C3b
C3
C3a
C3b
C3
C3a
C3b
C3a
C3a
C3b
C3a
C3
C3
C3
C3b
C3b
C3b
C3b
C3
C3b
C3a C3
C3bC3
38.
Небольшие пептиды С3a (C4a, C5a)являются мощными факторами хемотаксиса
и активаторами лейкоцитов
С4а
Лейкоцит
С5а
С3а
Активация комплемента
на поверхности
микробной клетки
Рецептор
хемокина
Вектор движения клетки
39.
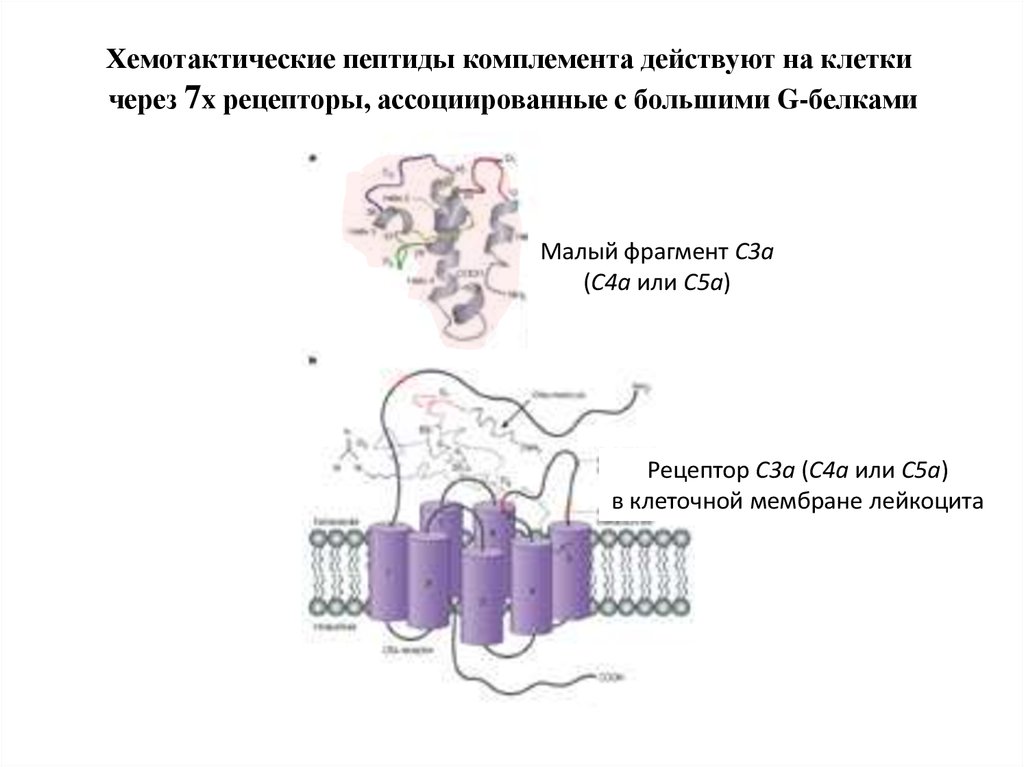
Хемотактические пептиды комплемента действуют на клеткичерез 7x рецепторы, ассоциированные с большими G-белками
Малый фрагмент C3a
(С4а или С5а)
Рецептор C3a (С4а или С5а)
в клеточной мембране лейкоцита
40.
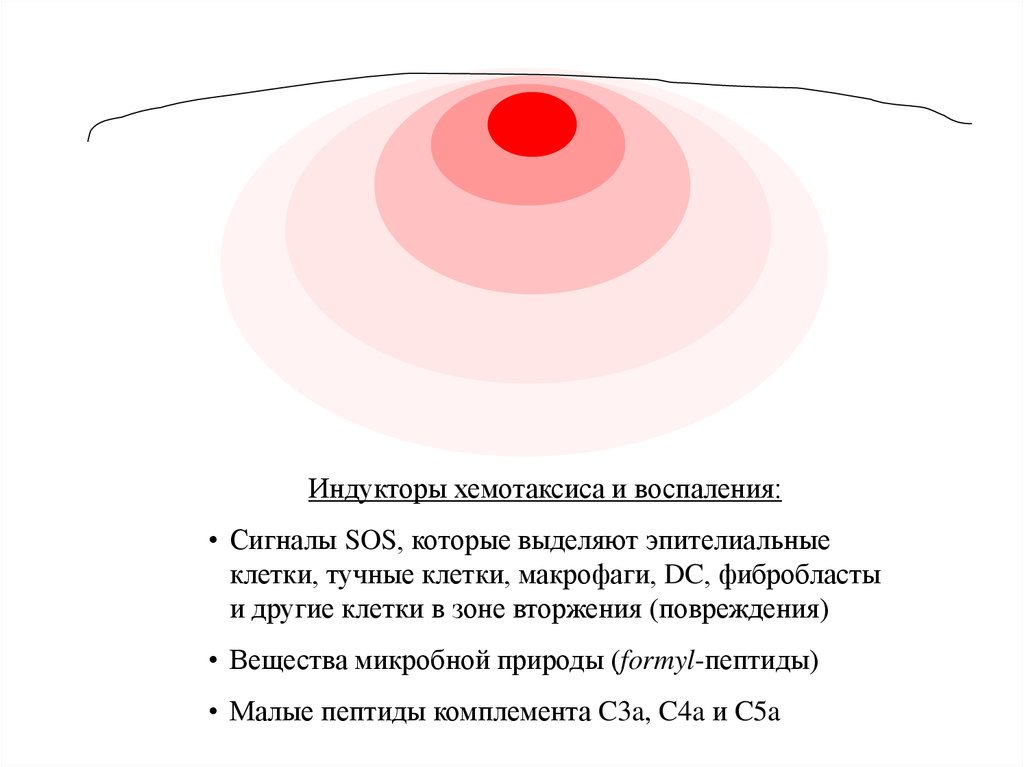
Индукторы хемотаксиса и воспаления:• Сигналы SOS, которые выделяют эпителиальные
клетки, тучные клетки, макрофаги, DC, фибробласты
и другие клетки в зоне вторжения (повреждения)
• Вещества микробной природы (formyl-пептиды)
• Малые пептиды комплемента C3a, C4a и C5a
41.
Цитокины из очага воспаления попадают в кровь.Достигнув печени, они включают синтез дополнительных защитных
веществ – маннан-связывающий лектин, С-реактивный белок,
сывороточный амилоид.
Маннан-связывающий
лектин
ИЛ-6
С-реактивный
белок
42.
Маннан-связывающий лектин(mannan-binding lectin, MBL)
Концевая
манноза
43.
Структура олигосахаридов, которые связывает MBL44. Маннан-связывающий лектин
Биологической активностью обладаюттетрамеры, пентамеры или гексамеры,
то есть «чудовища» с 4, 5 или 6 головами
Каждая субъединица (голова-шея) складывается
из трех небольших мономеров ~10kDa
45.
Маннан-связывающий лектинассоциирован с сериновыми протеазами
MASP-1 и MASP-2
MASP
46.
Движение коллагеноподобных стержнеймолекулы маннан-связывающего лектина
перемещает субъединицы MASP, что приводит
к их суперпозиции и активации
Figure 6 Structural Basis of Complement Activation in the Lectin Pathway (A) Superimposition of the structures of the MBL/MASP-1 complex
with the human CUB1-EGF-CUB2 (PDB: <ce:inter-ref href="pdb:3DEM" type="simple"> 3DEM</ce:inter-ref> ) and extension of...
Alexandre R. Gingras , Umakhanth Venkatraman Girija , Anthony H. Keeble , Roshni Panchal , Daniel A. Mitchell , Pet...
Structure Volume 19, Issue 11 2011 1635 - 1643
Structural Basis of Mannan-Binding Lectin Recognition by Its Associated Serine Protease MASP-1: Implications for Complement Activation
http://dx.doi.org/10.1016/j.str.2011.08.014
47.
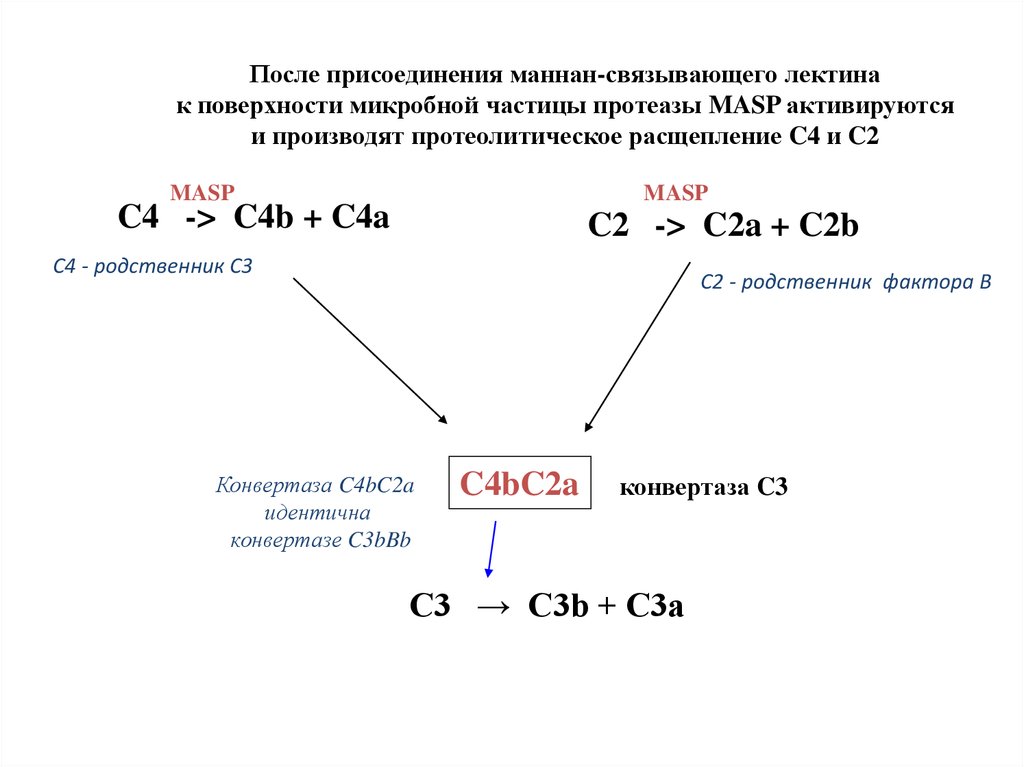
После присоединения маннан-связывающего лектинак поверхности микробной частицы протеазы MASP активируются
и производят протеолитическое расщепление C4 и C2
MASP
MASP
C4 -> C4b + C4a
C2 -> C2a + C2b
C4 - родственник C3
C2 - родственник фактора В
Конвертаза C4bC2a
идентична
конвертазе C3bBb
C4bC2a
конвертаза C3
C3 → C3b + C3a
48.
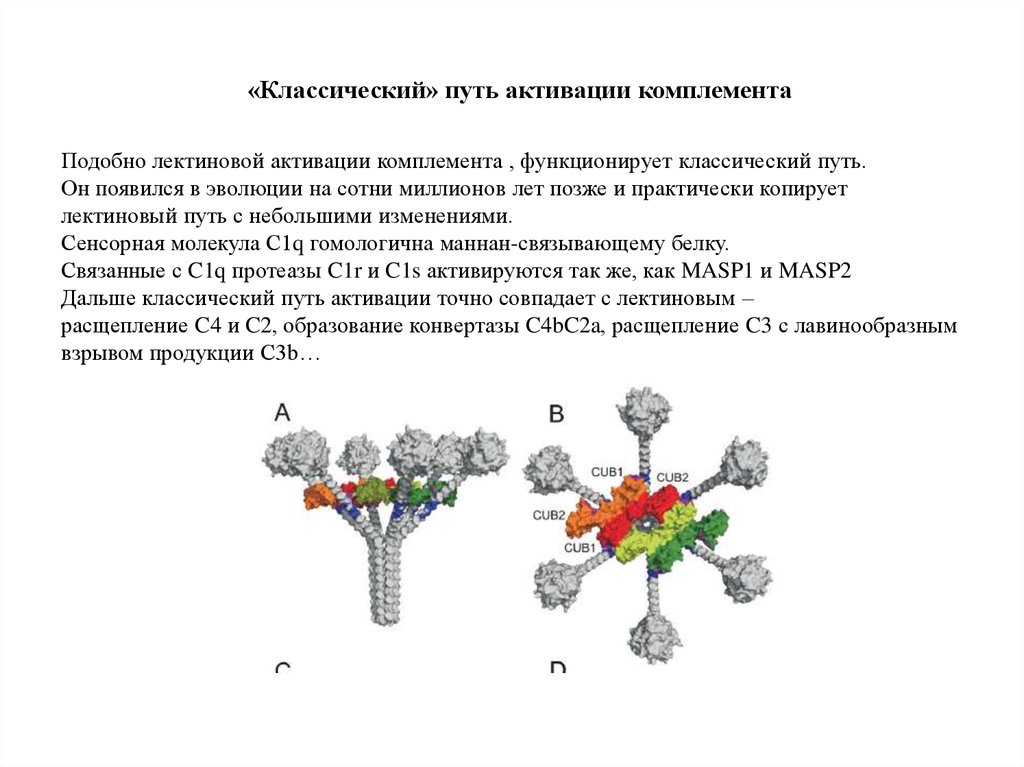
«Классический» путь активации комплементаПодобно лектиновой активации комплемента , функционирует классический путь.
Он появился в эволюции на сотни миллионов лет позже и практически копирует
лектиновый путь с небольшими изменениями.
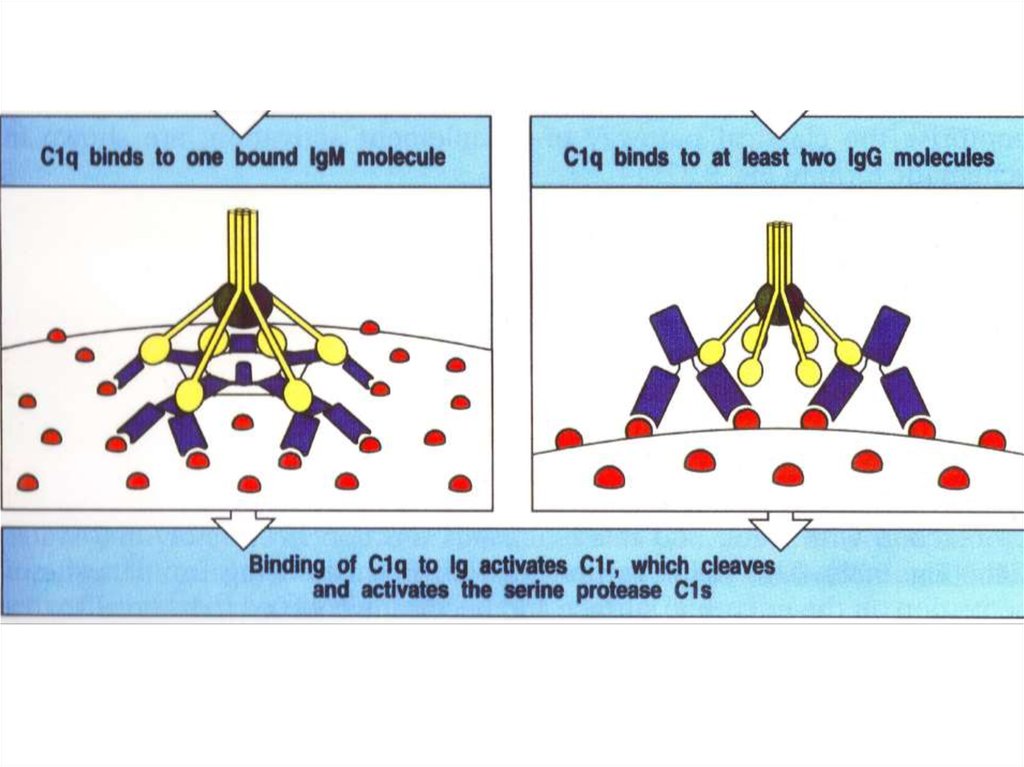
Сенсорная молекула С1q гомологична маннан-связывающему белку.
Связанные с C1q протеазы C1r и C1s активируются так же, как MASP1 и MASP2
Дальше классический путь активации точно совпадает с лектиновым –
расщепление C4 и C2, образование конвертазы C4bC2a, расщепление C3 с лавинообразным
взрывом продукции C3b…
49.
Активация протеаз C1r происходит в результатеконформационных движений коллагеноподобных
тяжей C1q (стебли тюльпанов)
50.
Маннан-связывающий лектинC1q
Концевая
манноза
51.
52.
VH-domainCH1-domain
C1q-site
CH2-domain
CH3-domain
53.
Модель взаимодействия C1q c Fc-фрагментом антитела (IgG)54.
55.
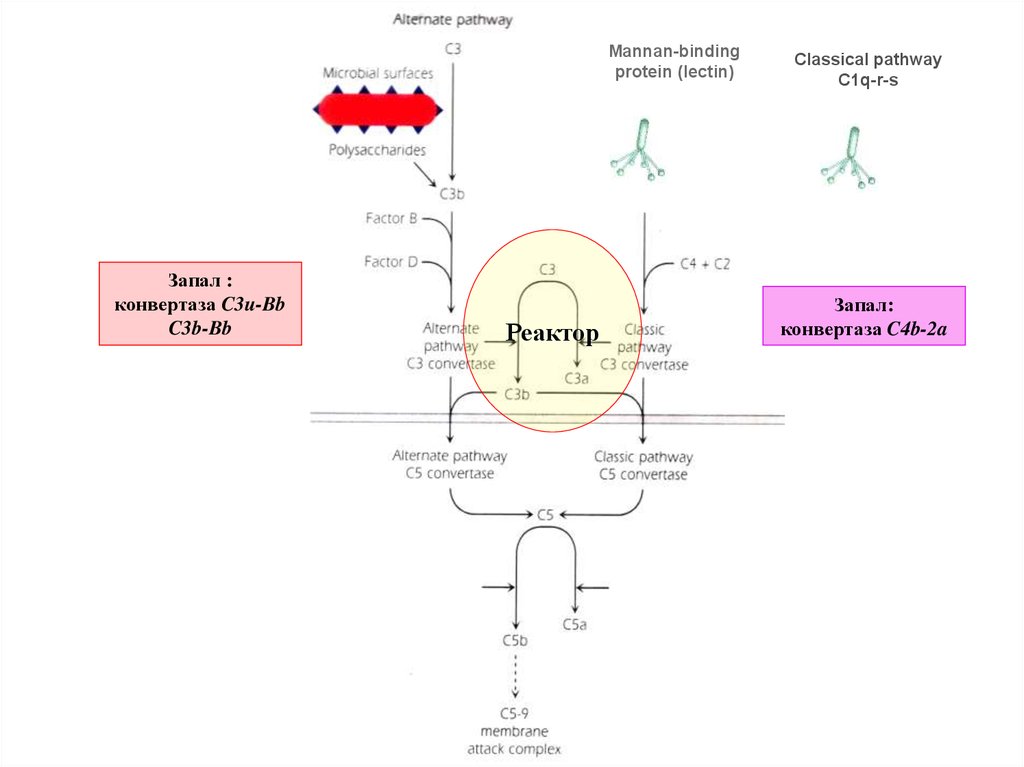
Mannan-bindingprotein (lectin)
Запал :
конвертаза C3u-Bb
C3b-Bb
Реактор
Classical pathway
C1q-r-s
Запал:
конвертаза C4b-2a
56.
Еще одно важное следствие работы твердофазовой конвертазы C3:В результате нарастания концентрации C3b происходит образование
новых конвертаз C3b-Bb-C3b и C4b-2a-C3b.
Это – ферменты, расщепляющие C5 (конвертазы С5).
C5a
C5a
C5
C5bC3a
C3
C3b-Bb
C3b
-C3b
-C3b
C5
C5b
C3a
C3
C3b
C4b-C2a
57.
MBLКонвертазы C3bBbС3b
и С4bC2aС3b
расщепляют С5,
что приводит к лизису
микробной клетки
C1q-r-s
58.
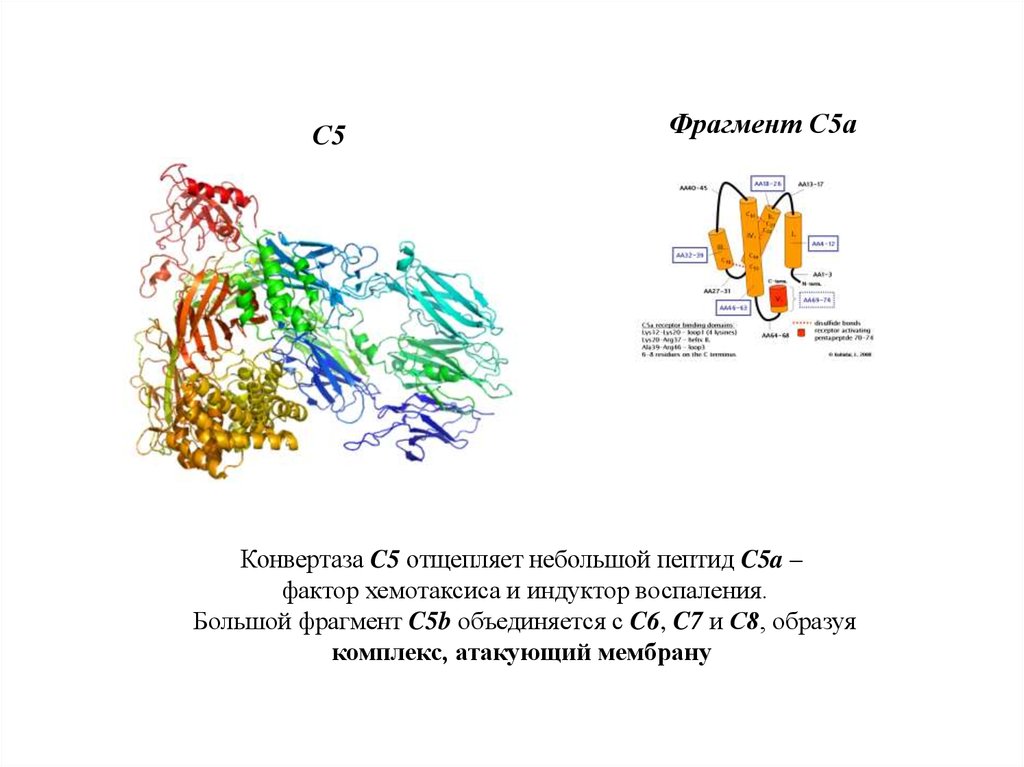
С5Фрагмент С5а
Конвертаза C5 отщепляет небольшой пептид C5a –
фактор хемотаксиса и индуктор воспаления.
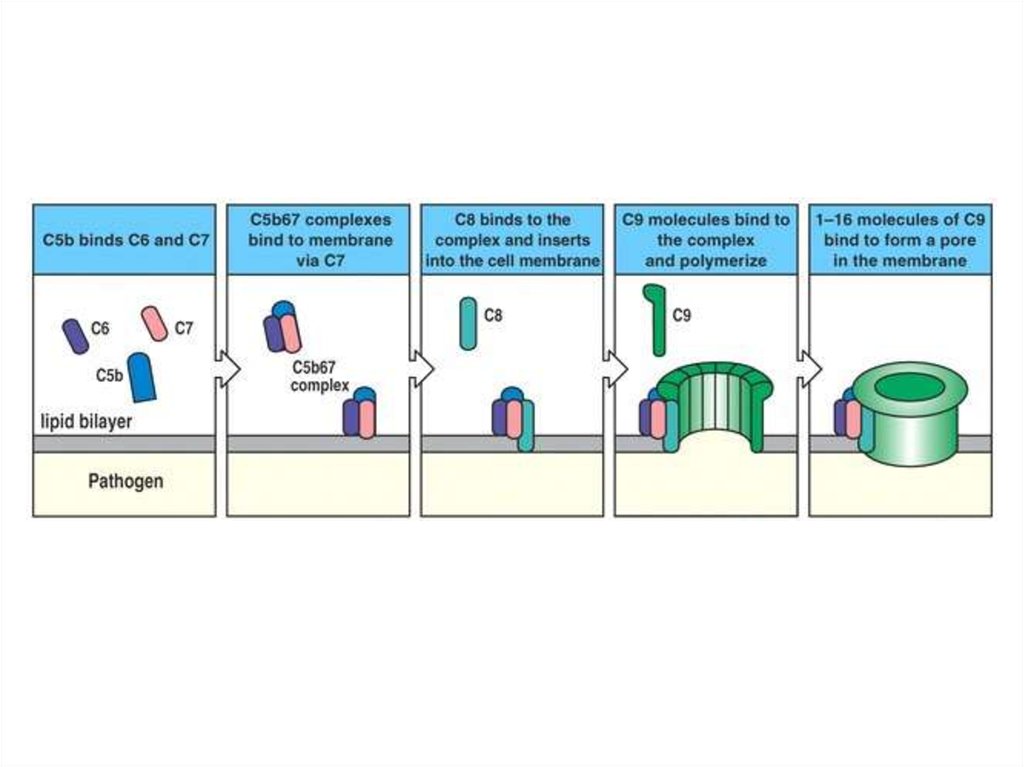
Большой фрагмент C5b объединяется с C6, C7 и С8, образуя
комплекс, атакующий мембрану
59.
60.
61.
62.
C5b объединяется с C6 и C7, комплекс сразу погружается в мембрану.К нему присоединяются C8α и C8β.
С6
С7
63.
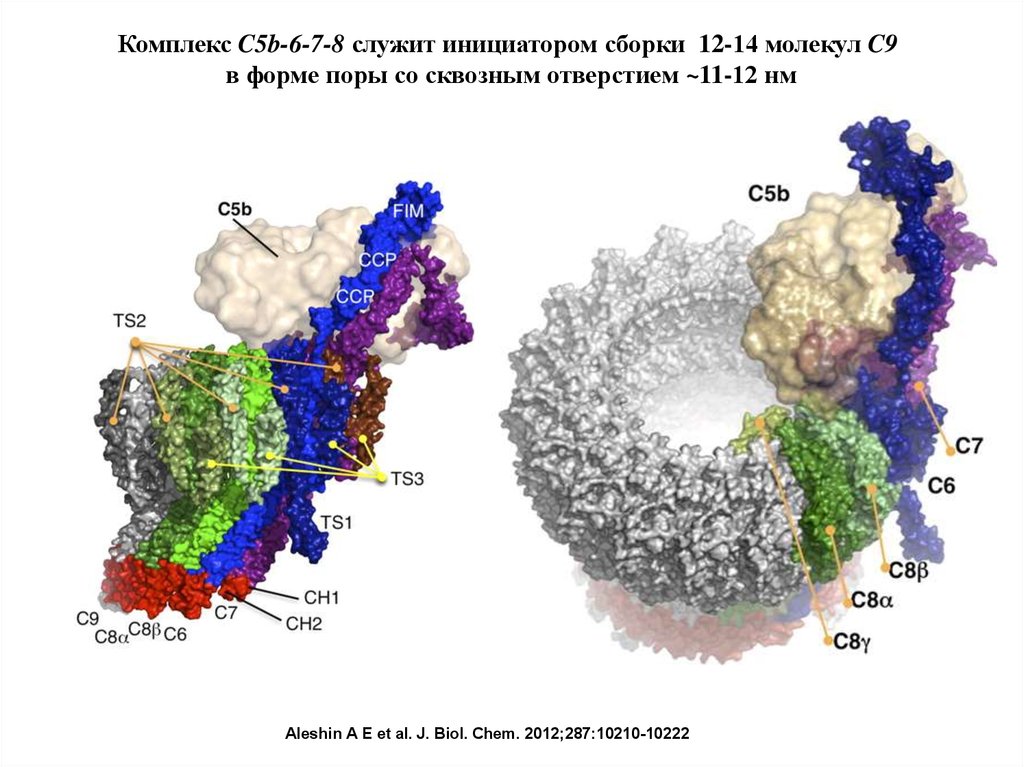
Комплекс C5b-6-7-8 служит инициатором сборки 12-14 молекул C9в форме поры со сквозным отверстием ~11-12 нм
Aleshin A E et al. J. Biol. Chem. 2012;287:10210-10222
64.
Основные эффекторные функции комплемента1. Опсонизация частиц (облегчение фагоцитоза).
2. Привлечение фагоцитов (хемотаксис).
3. Цитолиз незащищенных клеток («чужие» и измененные «свои»).
4. Индукция воспаления.
65.
Немного кинетики66.
Кинетика сборки комплекса, атакующего мембрану:C5b-C6
C5b-C6-C7-C8
C5b-C6-C7
C5b-C6-C7-C8-C9
67.
Кинетика пусковых процессовC1q per cell
C4 and C2 per cell
C1q
seconds
minutes
68.
Математическая модель комплемента показывает, что распространениелавинообразной активации (цепная реакция) останавливается
не в результате истощения каких-либо факторов комплемента, например,
С3 или B.
Главной причиной остановки взрыва является истощение поверхности,
на которой зародилась и распространяется цепная реакция.
Следовательно, реакция остановится только тогда, когда комплемент
«выжжет» всю доступную незащищенную поверхность.
Начавшись в одной точке поверхности (например, бактерия или вирус),
комплемент химически модифицирует всю поверхность, без остатка
(стратегия «выжженной земли»).
69.
Клетки нашего организма надежно защищеныот агрессивного действия комплемента
70.
Белки, которыми защищены наши клеткиот агрессивного действия комплемента
71.
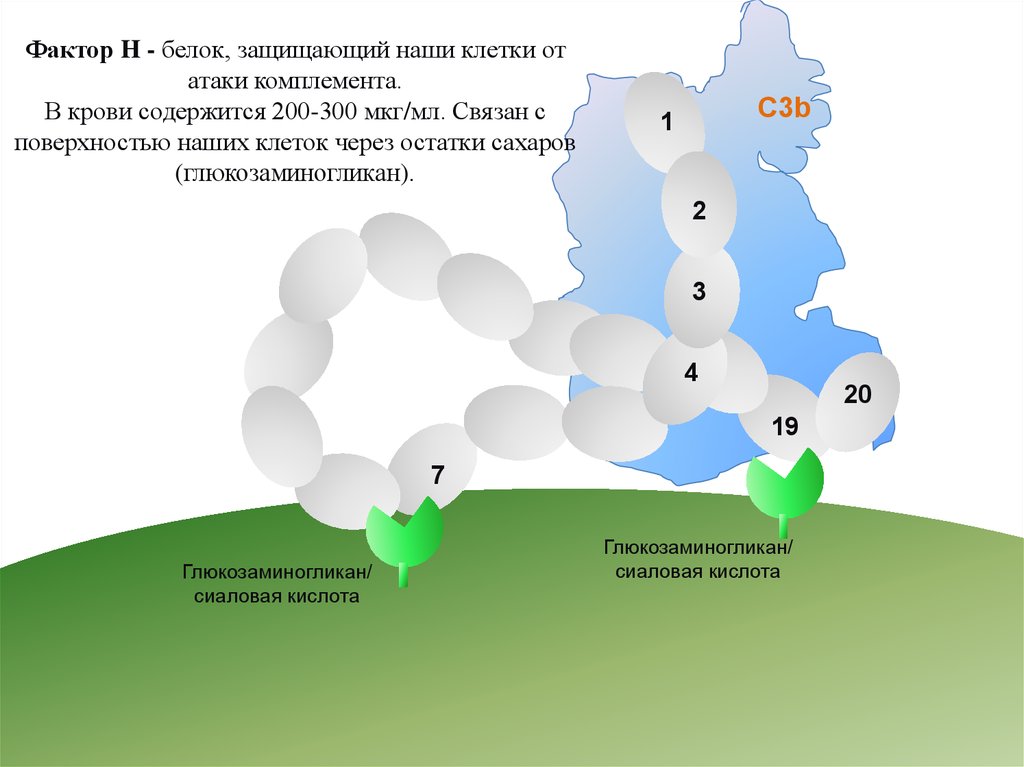
Фактор H - белок, защищающий наши клетки отатаки комплемента.
В крови содержится 200-300 мкг/мл. Связан с
поверхностью наших клеток через остатки сахаров
(глюкозаминогликан).
C3b
1
2
3
4
20
19
7
Глюкозаминогликан/
сиаловая кислота
Глюкозаминогликан/
сиаловая кислота
72.
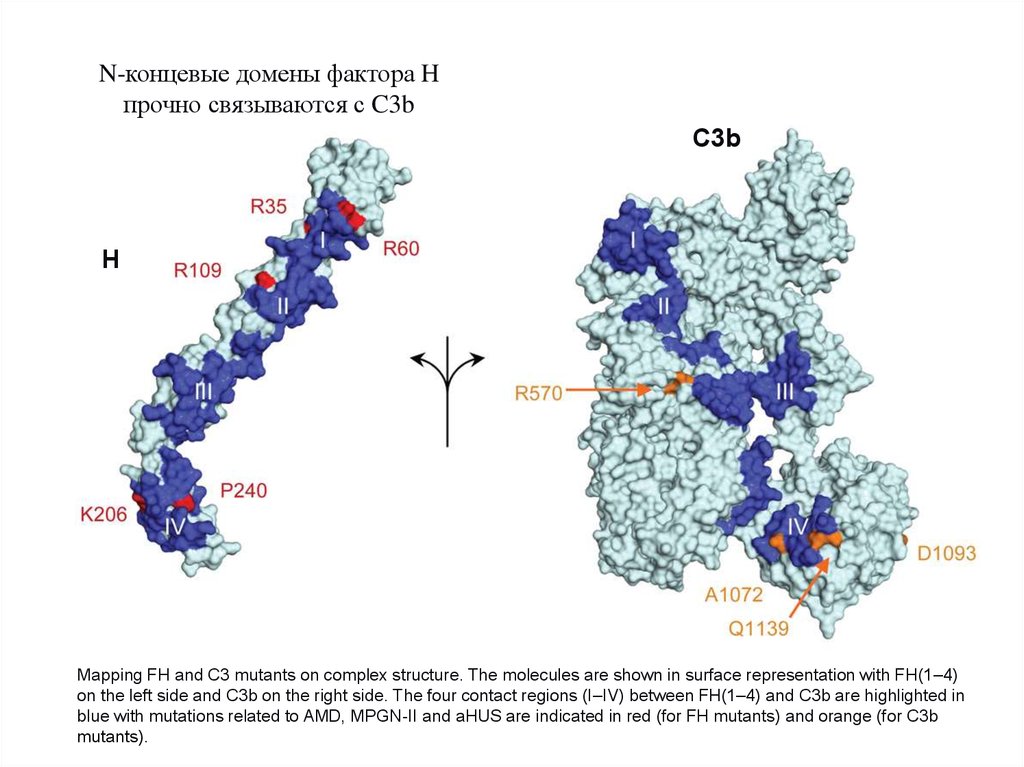
N-концевые домены фактора Hпрочно связываются с C3b
C3b
H
Mapping FH and C3 mutants on complex structure. The molecules are shown in surface representation with FH(1–4)
on the left side and C3b on the right side. The four contact regions (I–IV) between FH(1–4) and C3b are highlighted in
blue with mutations related to AMD, MPGN-II and aHUS are indicated in red (for FH mutants) and orange (for C3b
mutants).
73.
Фактор Н вытесняет фактор Ви открывает «щель» для атаки
протеазы I
Протеаза I
1
2
3
C3b
4
Фактор Н
20
19
7
Поверхность наших клеток
74.
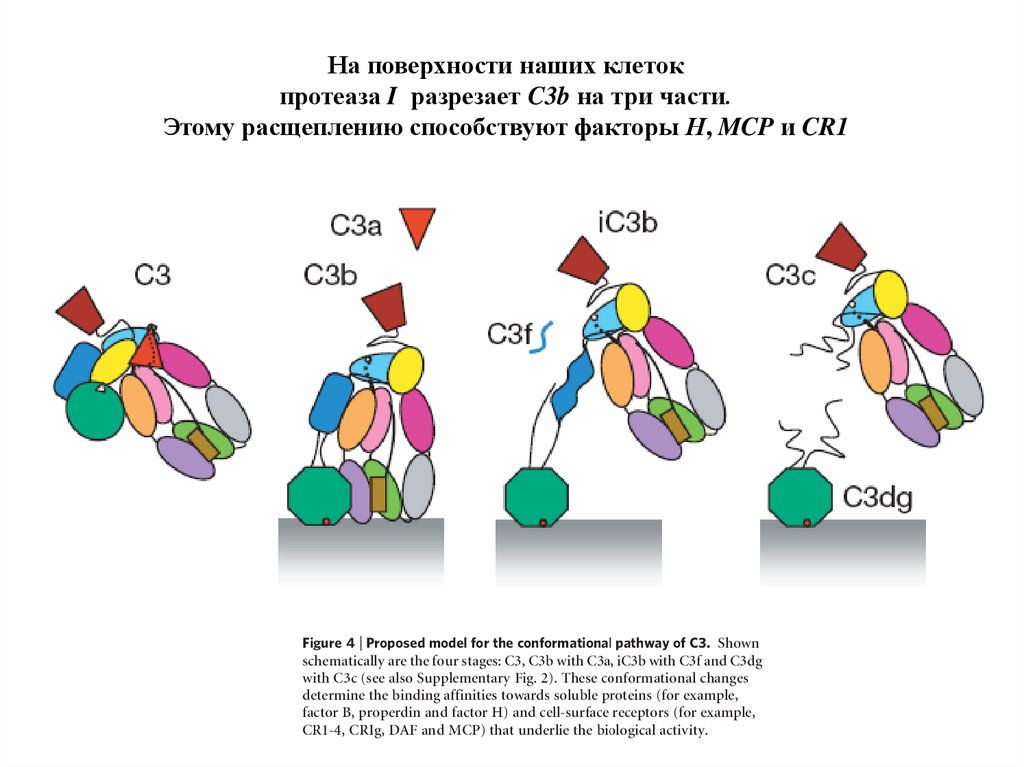
На поверхности наших клетокпротеаза I разрезает C3b на три части.
Этому расщеплению способствуют факторы Н, MCP и CR1
75.
DAF – очень похож на N-концевой фрагмент фактора H.DAF держится в липидной мембране с помощью GPI-якоря
(glucosylphosphatidylinositol).
76.
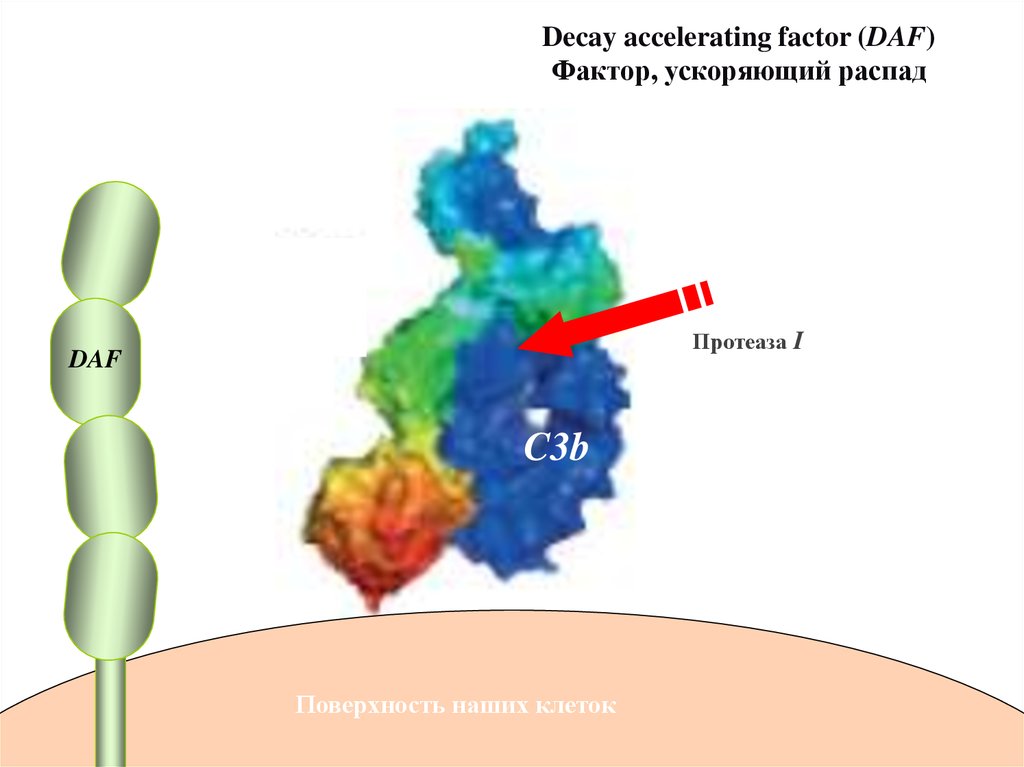
Decay accelerating factor (DAF)Фактор, ускоряющий распад
Протеаза I
DAF
C3b
Поверхность наших клеток
77.
CR1 ускоряет разрушение C3b и C4b протеазой IC3b
78.
CD59 crystal structureGPI-anchore
79.
Комплекс C5b-6-7-8 служит инициатором сборки 12-14 молекул C9в форме поры со сквозным отверстием ~11-12 нм
Aleshin A E et al. J. Biol. Chem. 2012;287:10210-10222
80.
Агрессивная среда нашего организма опасна только для «чужаков»81.
Cobra venom factor (CVF)структурный и функциональный аналог
С3 кобры и млекопитающих, соединяется с В,
образует конвертазу CVF-Bb,
которая не инактивируется факторами H и I
C3b
Поверхность наших клеток
82.
Функциональные блоки системы комплементаЭкзогенные факторы X
(запал 1)
MASPMBP 1
MASP2
Запал 2
С1s
С3u
CR2 CR1
С5a С4a
P
С3a
Центральное звено
«ядерное устройство»
H
I
СD59
DAF MCP С4bp
CR1
Функция 4
Самозащита
С2a
С4b
Bb
С3b
C3b CR3
CR4
С4
Запал 3
D
С3
Функция 1
Опсонизация
С1q С1r
С2
С2b
Функция 2
Хемотаксис
С5
С6
С5b
С7
С8
С9
Функция 3
Цитолиз
83.
Может ли активация комплемента распространятьсяза пределы атакованной поверхности?
84.
Клетки искусственно атаковали комплементом (розовые)и без промедления перемешали с интактными клетками (красные).
85.
Перенос агрессивных факторов комплемента с одних клеток – на другиеЭритроциты, опсонизированные антителами + комплементом
Эритроциты , обработанные антителами к DAF и CD59
Эритроциты интактные
86.
Повреждающие факторы комплемента могут диффундироватьс поверхности атакованной клетки на соседние интактные клетки.
В этих экспериментах мы убрали все защитные
факторы (H, I и др.) из жидкой фазы
87.
Атака комплемента ограничена размерами незащищенной поверхности.Границы незначительно «размыты», но не шире нескольких клеточных размеров.
Распространение цепной реакции активированного комплемента в масштабах
организма невозможно. Спасают два фактора – защитные вещества и короткое
время жизни активных белков комплемента в жидкой фазе.
10 мкм
88.
Система комплемента:• Точность (+10 мкм)
• Быстрота (10-30 секунд)
• Агрессивность (стратегия «выжженной земли»)
• Удовлетворительная безопасность для организма (живем
пока)
• Вездесущность (нет ни малейшего уголочка в организме,
куда она не проникнет)
• Локализация атаки в пространстве и во времени.
89.
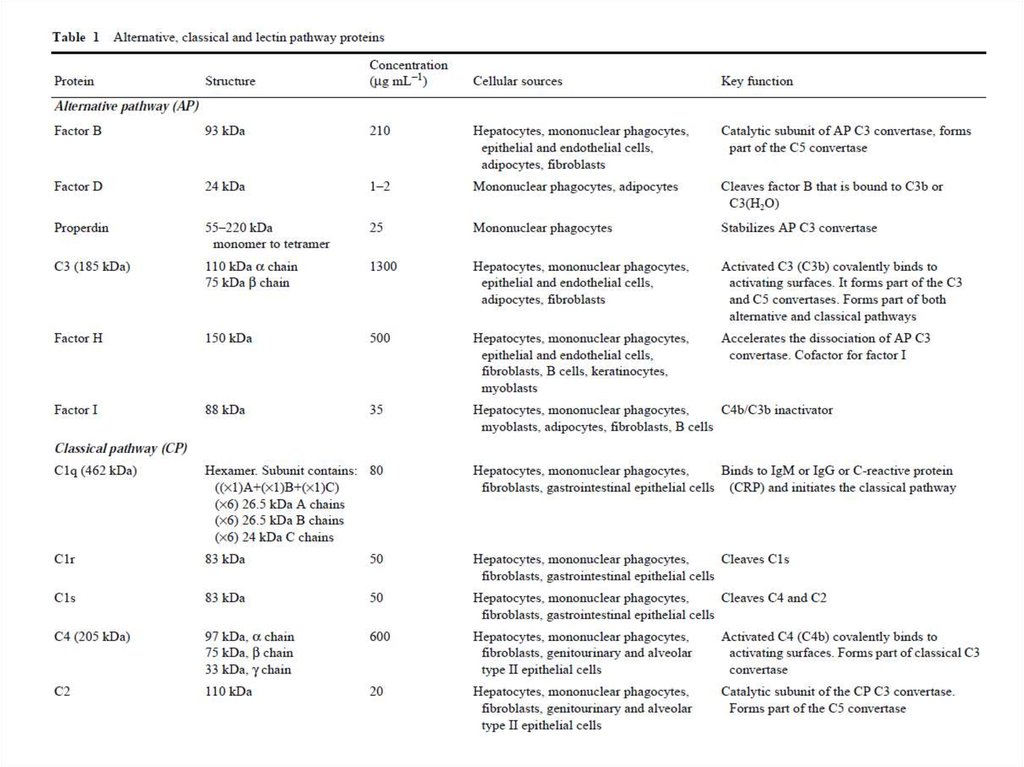
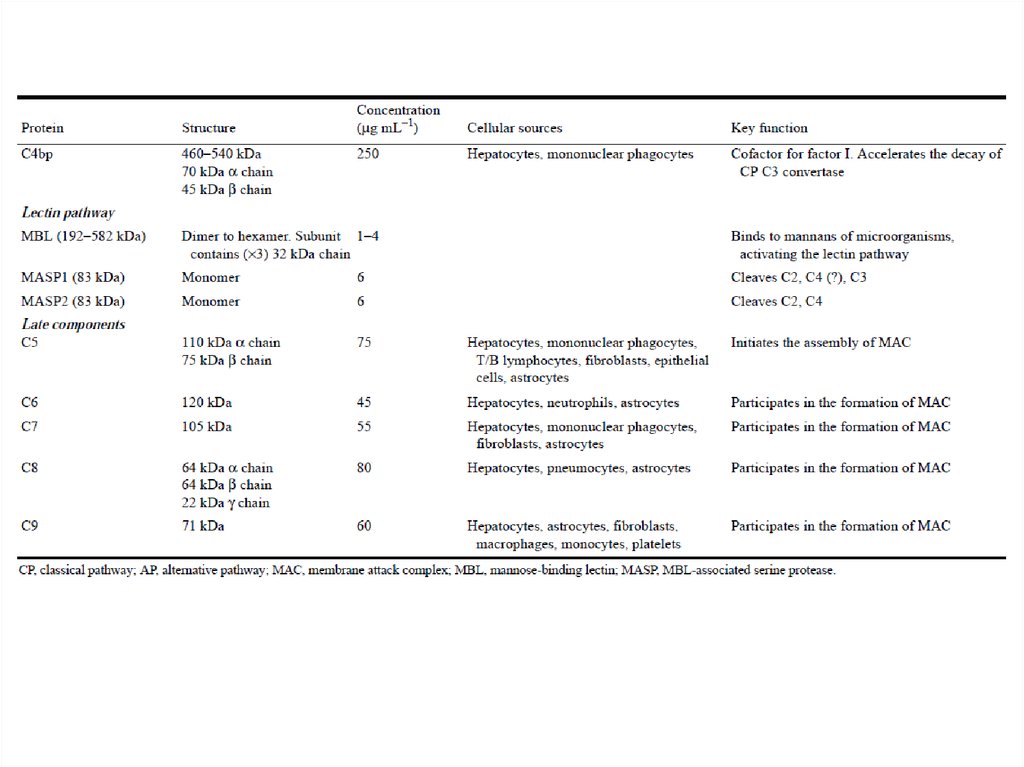
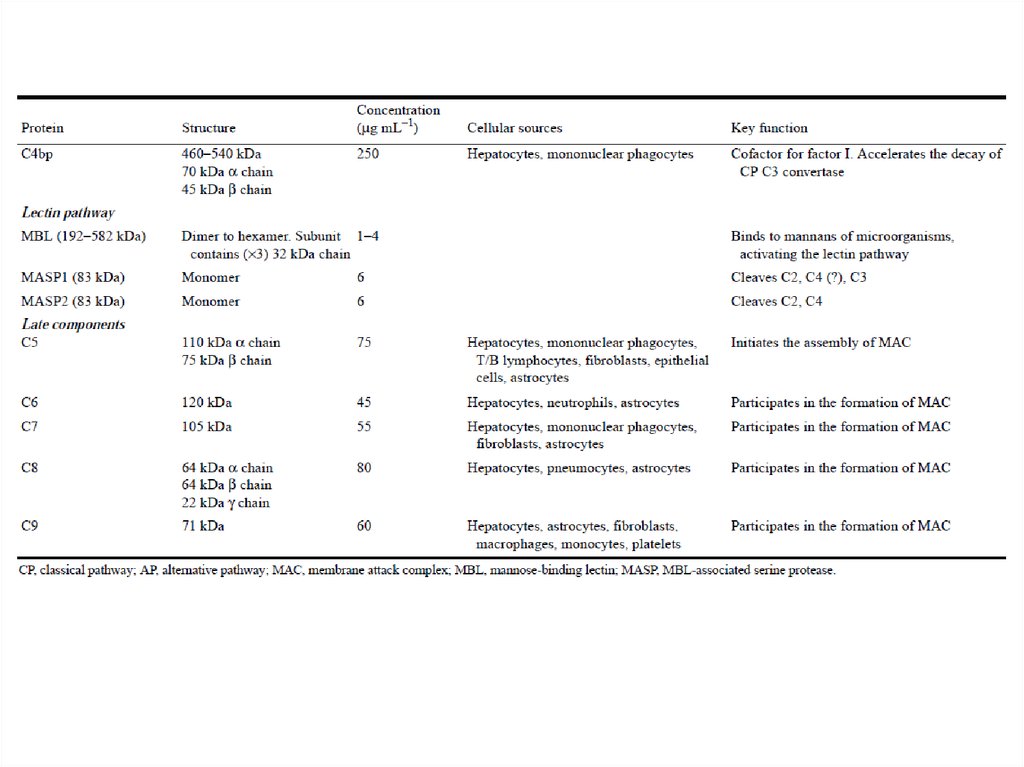
Большинство белков комплемента крупнее альбумина(см. следующую таблицу), следовательно, через стенку
обычных кровеносных сосудов они не выходят.
При изменении проницаемости кровеносных сосудов
вблизи очага инфекции или повреждения именно здесь
выходят белки комплемента и мгновенно запускают
смертельную для микробов атаку
90.
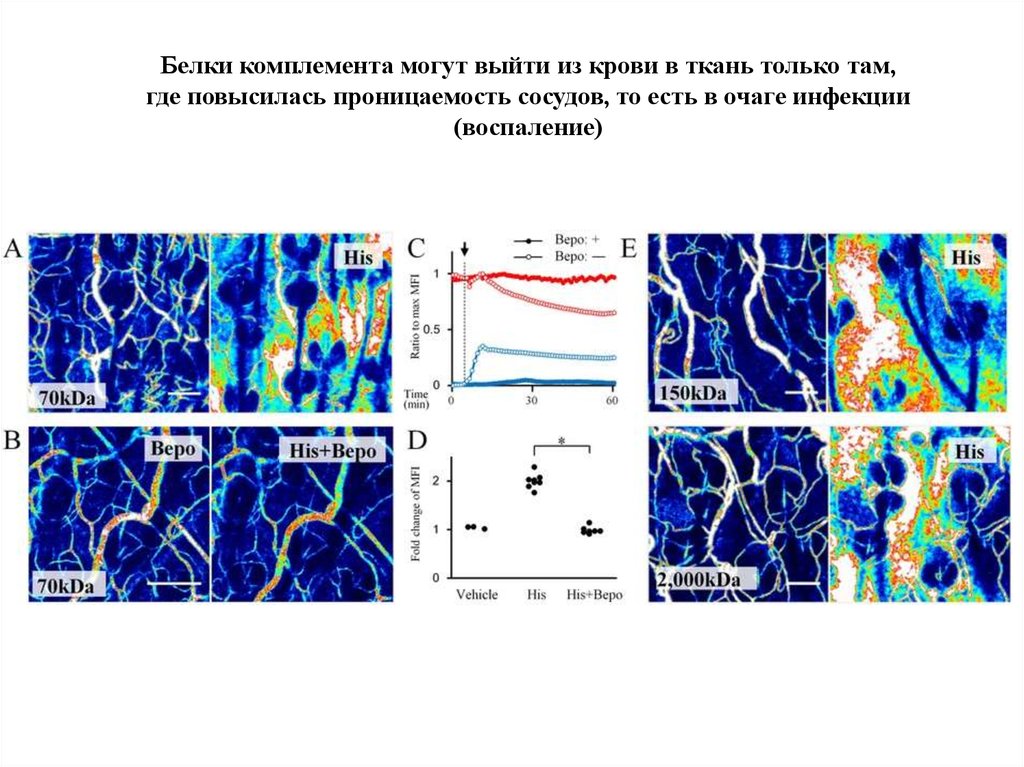
91.
92.
Белки комплемента могут выйти из крови в ткань только там,где повысилась проницаемость сосудов, то есть в очаге инфекции
(воспаление)
93.
Комплемент – защита, точно локализованная в пространстве и временивирусов и
































































 medicine
medicine








