Similar presentations:
Врождённый иммунитет
1. ВРОЖДЁННЫЙ (=естественный) ИММУНИТЕТ
2. Иммунитет (лат. immunitas – освобождение от чего-либо, избавление) –
совокупность защитных иприспособительных реакций
организма, направленных на:
-
поддержание антигенного гомеостаза
-
защиту от инфекций и
генетических чужеродных агентов
3. Иммунитет – реакция:
древняя (возникла вместе с инфекцией)уникальная (только у живых организмов)
универсальная (у всех особей без исключения)
многокомпонентная
многообразная в проявлениях
4.
Иммунитетпо возникновению
Врождённый
Приобретённый
5. Врождённый иммунитет –
- форма видовой невосприимчивости- осуществляется совокупностью
биологических особенностей организма
- не связана с развитием специфического ИО
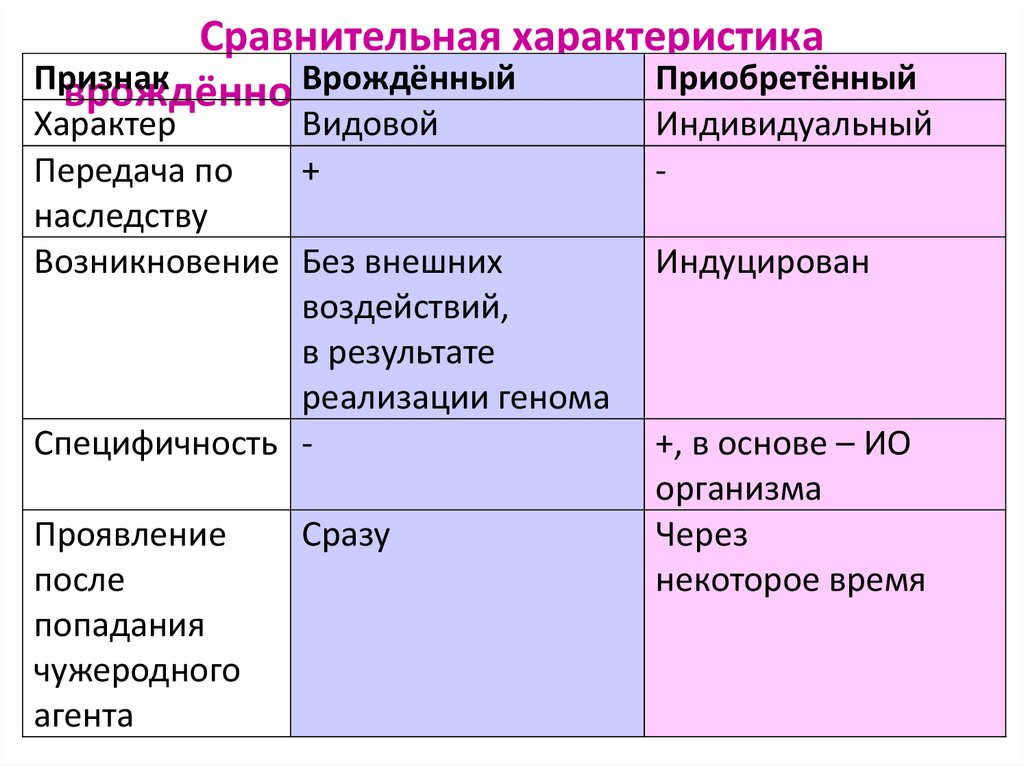
6. Сравнительная характеристика врождённого и приобретённого иммунитета
Сравнительная характеристикаПризнак
Врождённый
Приобретённый
врождённого
и приобретённого
иммунитета
Характер
Видовой
Передача по
+
наследству
Возникновение Без внешних
воздействий,
в результате
реализации генома
Специфичность Проявление
после
попадания
чужеродного
агента
Сразу
Индивидуальный
Индуцирован
+, в основе – ИО
организма
Через
некоторое время
7.
Факторыврождённого
иммунитета
Неиммунные –
не связаны с ИС
Иммунные –
неспецифические
факторы ИС
8.
Неиммунные факторыврождённого иммунитета
Механические
Физико-химические
Физиологические
Биологические
9. Механические неиммунные факторы
Барьерные свойства кожи и слизистыхГистогематические барьеры
(мозг, глаза, внутреннее ухо, тимус, половые железы, плод)
Реснитчатый эпителий дыхательных путей
Механические выделительные реакции
(кашель, чихание, рвота, диарея)
10. Физико-химические неиммунные факторы
Бактерицидные секретыпотовых и сальных желёз
(антимикробные свойства кожи)
HCl желудочного сока
Рибонуклеаза – иммунитет к вирусам
11. Физиологические неиммунные факторы
Ареактивность клеток и тканей(отсутствие мишеней для микроорганизма в тканях)
Клеточная гетерохрония
(неодновременность развития клеток в составе ткани)
Мутации
(серповидно-клеточная анемия – иммунитет к малярии)
Температурная реакция
Изменение обмена веществ
Состояние НС и ЭС
Воспалительная реакция
Состав пищи
12. Биологические неиммунные факторы
Конкурентная роль нормальной микрофлоры(микробный антагонизм):
- бифидумбактерии препятствуют
развитию патогенных МИО в толстом кишечнике
- пробиотики используются для коррекции дисбиозов
- патогенная флора влагалища уничтожается палочками Дедерлейна (МКБ)
13.
Иммунные факторыврождённого иммунитета
Гуморальные
Клеточные
14.
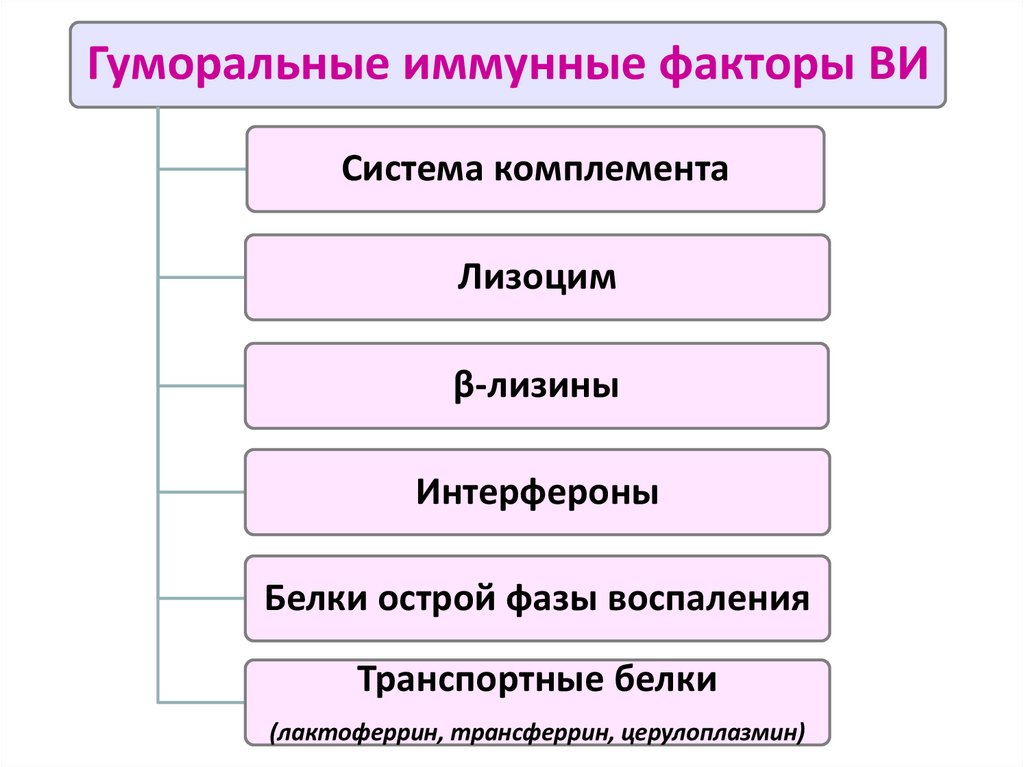
Гуморальные иммунные факторы ВИСистема комплемента
Лизоцим
β-лизины
Интерфероны
Белки острой фазы воспаления
Транспортные белки
(лактоферрин, трансферрин, церулоплазмин)
15. Система комплемента (лат. сотрlеmеntum – дополнение)
- система белков сыворотки крови и тканевой жидкости(постоянно присутствуют, 10% всех белков сыворотки)
- синтезируются гепатоцитами, Мф, нейтрофилами
- циркулируют в неактивном состоянии
(неактивные проферменты)
- неспецифически распознают активаторы
(МИО, иммунные комплексы АГ-АТ)
- каскадно активируются путём протеолиза
16. Состав системы комплемента (> 30 белков и белковых комплексов):
Состав системы комплемента(> 30 белков и белковых комплексов):
Компоненты – набор протеаз (всего 11 белков),
обозначаются С и номером:
С1 (3 субъединицы: q, r, s), С2, С3, С4, С5, С6, С7, С8, С9
Продукты протеолиза обозначаются
дополнительно строчными буквами – a, b.
Центральную роль в работе системы комплемента играет С3
(его концентрация в сыворотке крови 1 г/л)
Факторы B, D, H, P
Регуляторные белки: С1-ингибитор, С3в-инактиватор и др.
Рецепторы белков комплемента на клетках: CR1-CR4
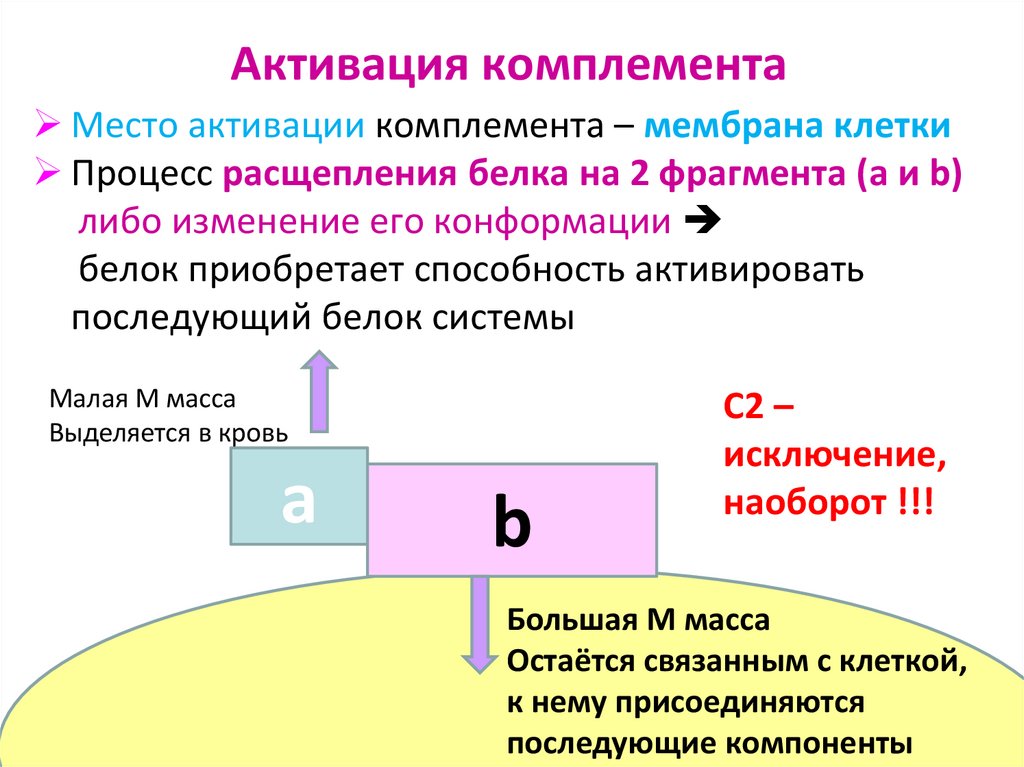
17. Активация комплемента
Место активации комплемента – мембрана клеткиПроцесс расщепления белка на 2 фрагмента (a и b)
либо изменение его конформации
белок приобретает способность активировать
последующий белок системы
Малая М масса
Выделяется в кровь
a
b
С2 –
исключение,
наоборот !!!
Большая М масса
Остаётся связанным с клеткой,
к нему присоединяются
последующие компоненты
18. Активация комплемента
Протекает каскадно, каждый активированныйфермент действует как усилитель: расщепляет много
молекул следующего профермента и приводит к
образованию множества литических комплексов
• Большинство компонентов активны только в составе комплекса,
при этом их активные формы существуют очень короткое время
• Если в течение этого времени они не встретятся со следующим
компонентом комплекса, то активные формы теряют связь с
комплексом и становятся неактивными
В результате активации образуются регуляторные и
эффекторные биомолекулы
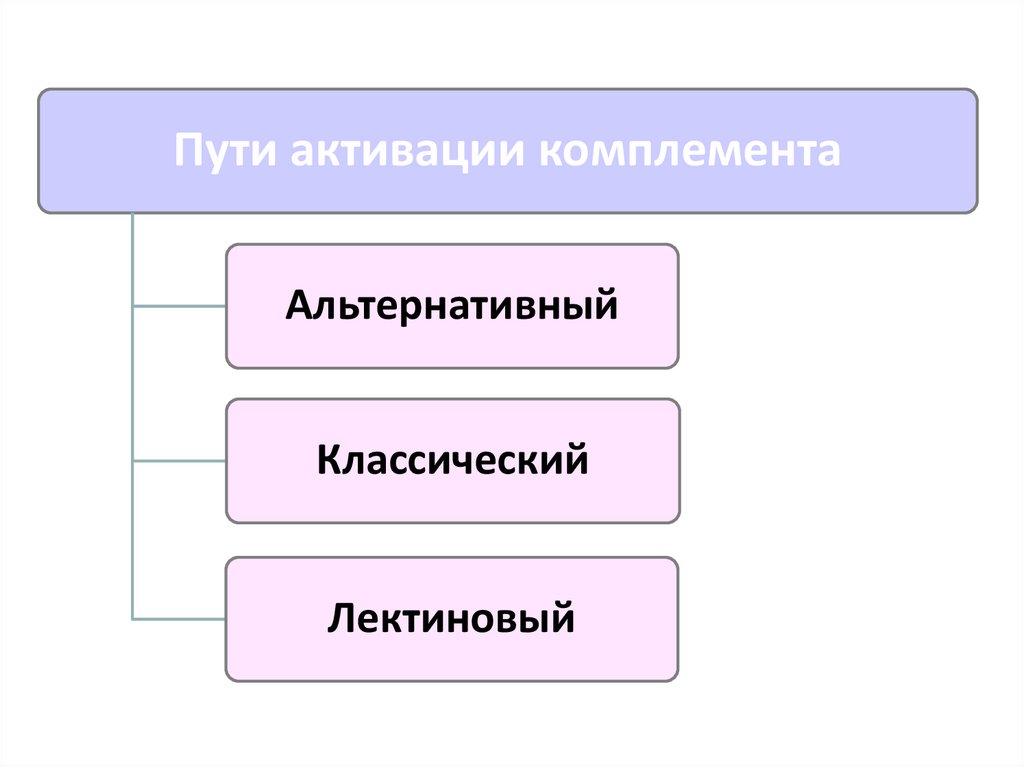
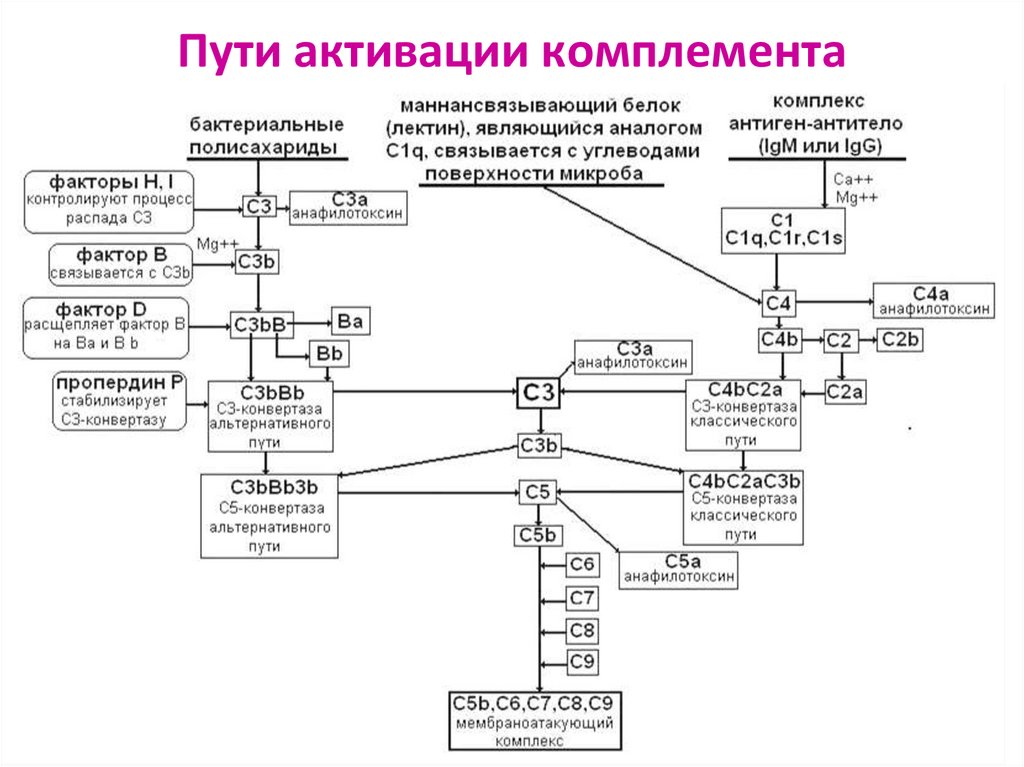
19.
Пути активации комплементаАльтернативный
Классический
Лектиновый
20. Альтернативный путь (АП)
Ранний: протекает в неиммунном организме(без участия комплекса АГ-АТ)
Активатор – ЛПС МИО;
АП развивается при связывании С3b с поверхностью МИО
Не участвуют ранние белки (С1, С4, С2)
Участвуют:
- ионы Са++, Мg++
- факторы B, D, P (пропердин)
- поздние белки (С3, С5-С9)
Малая скорость реакций
21. Ранние этапы альтернативного пути (АП)
1. В сыворотке циркулирует небольшое количество С3bПри взаимодействии с С3b,
фактор D катализирует расщепление фактора В на Ва и Вb
С3b вместе с Вb образует комплекс С3bВb - С3 конвертазу АП
2. Связывание с пропердином Р стабилизирует С3 конвертазу АП
3. Стабилизированный комплекс
катализирует продолжение протеолиза С3
амплификация (усиление)
за счёт вновь образующихся активированных фрагментов C3b
4. Комплекс C3bBb связывает новые фрагменты C3b
образуется (С3b)nBb – C5 конвертаза АП
22.
23.
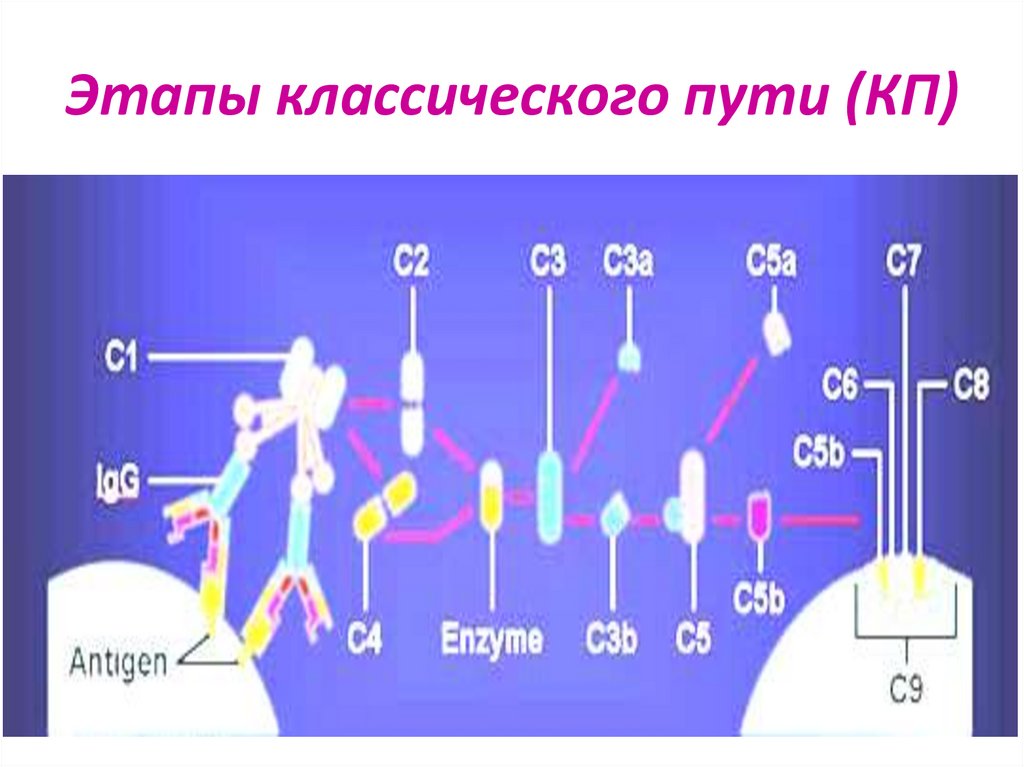
24. Классический путь (КП)
Был открыт первым, но эволюционно является новымПоздний:
протекает в иммунном организме
Активатор – иммунный комплекс (АГ-АТ), IgM и IgG
обладают высоким сродством к субкомпоненту С1q
Участвуют все 9 компонентов с С1 по С9
Высокая скорость реакций
25. Ранние этапы классического пути (КП)
1.Связывание С1q конформационные изменения в С1,активация субкомпонентов С1r и С1s
протеолиз С4 с образованием фрагментов С4а и С4b
2.Более крупный фрагмент С4b связывается с С2,
который затем под действием С1s распадается на С2а и С2b
Фрагмент С2а остаётся связанным с С4b,
образуя С4bС2а – С3-конвертазу КП
3. С3-конвертаза КП катализирует протеолиз С3
с образованием С3а и активного фрагмента С3b, который
участвует в формировании С4bС2аС3b – С5-конвертазы КП
26. Этапы классического пути (КП)
27.
28. Лектиновый путь (ЛП)
Активатор – полисахариды поверхности МИОИграет важную роль
в системе врождённого иммунитета
у пациентов с дефицитом С1
Роль С1q выполняет маннозо-связывающий лектин
Роль С1r и C1s выполняет ассоциированная
протеиназа, активирующая компоненты С4 и С2
29. ЗАКЛЮЧИТЕЛЬНЫЕ СТАДИИ ЛИЗИСА
Конвертазы (С3b)nBb и С4bС2аС3b –конечные продукты КП, АП и ЛП активации комплемента
С3b – участок связывания белка С5,
который в результате протеолиза распадается на С5а и С5b
Фрагмент С5b начинает формирование МАК,
связывает белки С6 и С7, образуется комплекс С5bС6С7
С комплексом С5bС6С7 связываются С8 и С9, образуя
С5bС6С7С8С9 =литический мембраноатакующий комплекс (МАК),
где С9 – белок-перфорин, образует пору в мембране клетки;
клетка подвергается осмотическому лизису
30. Пути активации комплемента
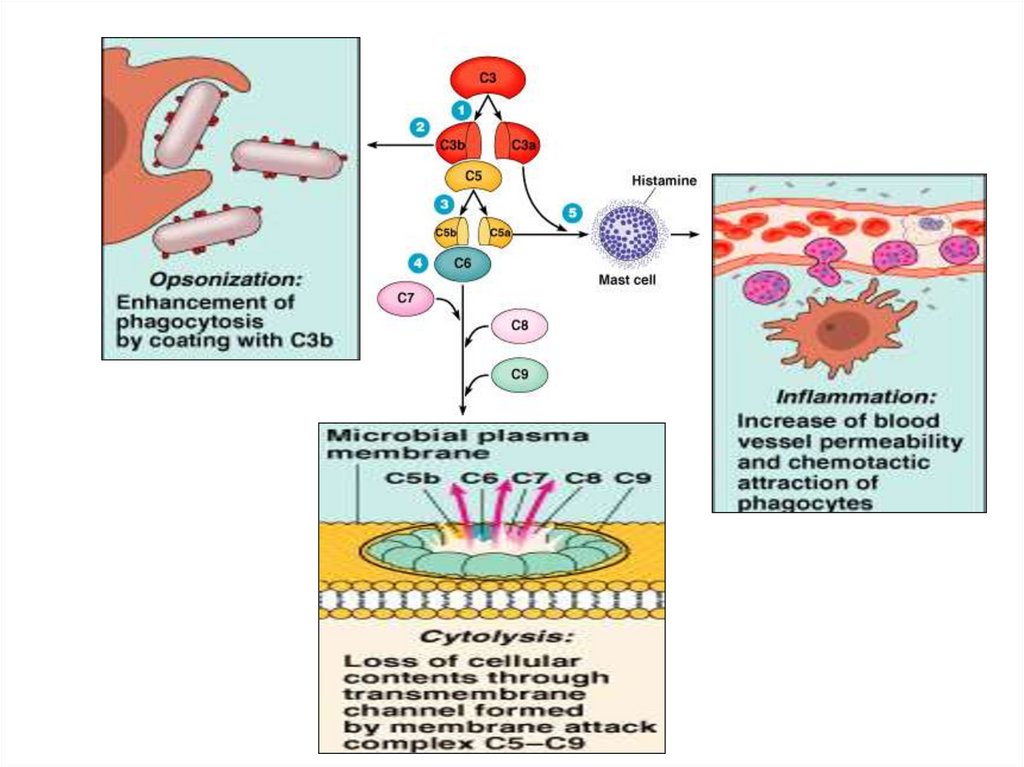
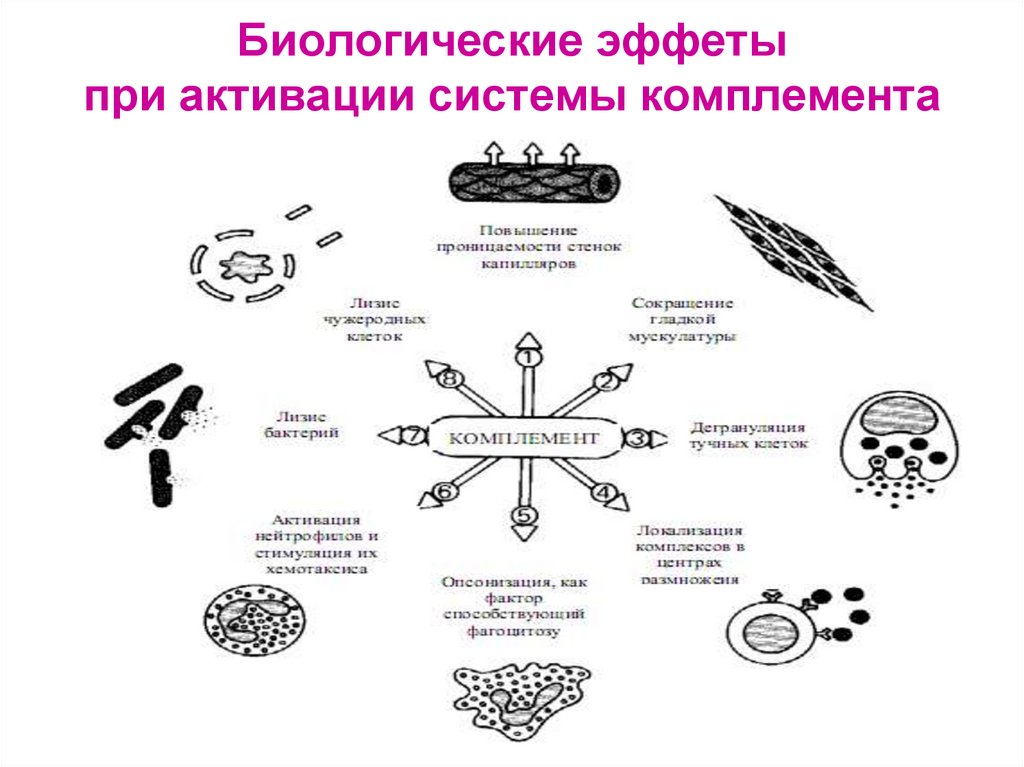
31. Функции системы комплемента
1. Усиление фагоцитоза:- хемотаксины С5а, С3а, С6, С7 – способствуют
накоплению фагоцитов в очаге воспаления
- опсонины С3b, C4b, C5b –
активируют иммунный фагоцитоз, обеспечиваемый Мф
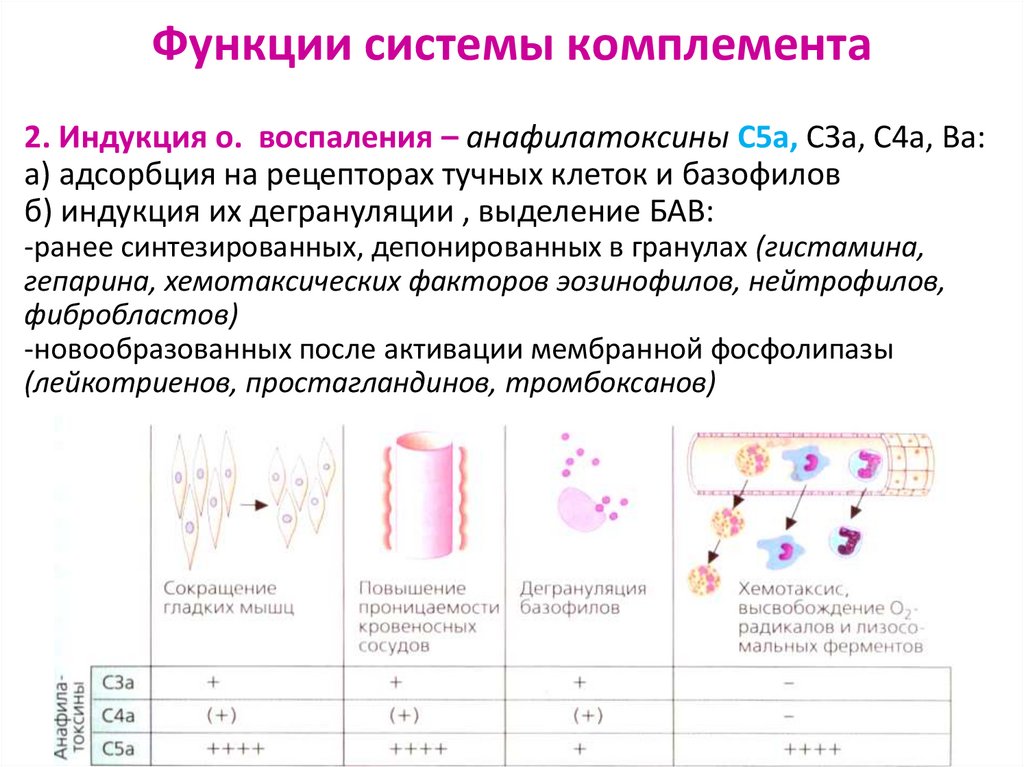
32. Функции системы комплемента
2. Индукция о. воспаления – анафилатоксины С5а, СЗа, С4а, Ва:а) адсорбция на рецепторах тучных клеток и базофилов
б) индукция их дегрануляции , выделение БАВ:
-ранее синтезированных, депонированных в гранулах (гистамина,
гепарина, хемотаксических факторов эозинофилов, нейтрофилов,
фибробластов)
-новообразованных после активации мембранной фосфолипазы
(лейкотриенов, простагландинов, тромбоксанов)
33. БАВ – индукторы острого воспаления
- расширение сосудов – rubor (покраснение)- местное температуры – сalor (жар)
- проницаемости сосудов белки и фагоциты
проникают в ткани – tumor (припухлость)
- давления в тканях, раздражающее действие на
чувствительные нервные окончания – dolor (боль)
- functio laeza (нарушение функции)
34. Функции системы комплемента
3. Участие в аллергических реакциях: воздействие БАВ- сокращение гладких мышц и проницаемости сосудов
- хемотаксис и активация фагоцитов,
выброс лизосомальных ферментов
4. Цитолитическое действие за счёт С9 (перфорина):
- лизис мембран бактерий (бактериолиз)
- цитолиз (лизис соматических клеток)
цитотоксические и аутоиммунные реакции
5. Удаление из организма иммунных комплексов
6. Регуляция иммунного ответа:
- С3а – супрессия ИО (ингибиция взаимодействия Лф с рецепторами)
- С5а – стимуляция ИО (активация взаимодействия Лф с рецепторами)
35. Биологические эффеты при активации системы комплемента
36. Регуляция системы комплемента
Все пути активации включают этапы, связанные сферментативным воздействием длительное сохранение
активности формирующихся при активации ферментов
нежелательно для организма
Система комплемента может быть очень опасной для тканей
хозяина её активация должна хорошо регулироваться
Контролируется каждый из ферментативных этапов активации,
для этого:
- в плазме крови (даже в большей концентрации, чем сами белки
системы комплемента) присутствуют специальные белки
- на мембранах клеток организма есть белки, предохраняющие
клетки их от атаки со стороны белков системы комплемента
37.
Регуляторные механизмысистемы комплемента
А. Ферменты плазмы крови – расщепляют и
инактивируют компоненты комплемента:
фактор I, инактиватор анафилатоксинов
Б. Белки плазмы крови – связывают и
активность компонентов комплемента:
С1-ингибитор, фактор H, C4bр, S-белок (=витронектин)
В. Регуляторные белки клеточных мембран –
препятствуют активации комплемента на поверхности
собственных клеток организма:
DAF, MCP, С8-связывающий белок
38. Регуляция начальных этапов активации
С1-ингибитор (α-глобулин плазмы):а) контролирует КП: связывает и инактивирует C1r и C1s субъединицы,
не допуская образования избыточных количеств активированного С1
б) выключает ЛП, удаляя ферменты MASP из MBP-комплекса
в) ингибирует плазмин, калликреин, активированный фактор Хагемана
C4bр (С4-связывающий белок):
а) препятствует образованию избыточных количеств С3-конвертазы КП:
- конкурирует с С1 за присоединение С4
- вытесняет С2а из комплексов C4bC2a
б) кофактор для фактора I –
связывается с С4b и делает его доступным атаке фактора I
39. Регуляция начальных этапов активации
Фактор I (сериновая протеаза):а) инативатор С3-конвертаз:
расщепляет С4b (только в присутствии C4bp и фактора Н)
б) инактиватор С5-конвертаз:
расщепляет С3b (в растворе и на поверхности клетки)
расщеплённый С3b не может функционировать в составе С5-конвертаз;
образуются биоактивные продукты расщепления: С3с и С3е
Фактор H (кофактор фактора I) – ингибирует активность C3bBb:
связывает и инактивирует С3b образуется неактивный iC3b
Инактиватор анафилатоксинов (сывороточная карбоксипептидаза N):
разрушает С3а, С5а, С4а
40. Начальные механизмы защиты клеточных мембран
DAF (= фактор, ускоряющий диссоциацию, CD55) –препятствует образованию С3-конвертаз КП и АП:
- ускоряет диссоциацию С4bС2a (препятствует связыванию С2 с C4b,
вытесняет С2а из комплексов C4bC2a)
- ускоряет диссоциацию C3bBb
MCP (= мембранный кофакторный белок, CD46) – способствует
инактивации С3b и C4b фактором I
CR1 – рецептор комплемента первого типа (= CD35) –
расположен на поверхности эритороцитов:
- препятствует образованию С3-конвертаз КП и АП (аналогично DAF)
- способствует инактивации С3b и C4b фактором I (аналогично MCP)
41. Механизмы защиты клеточных мембран от уже начавших формироваться МАК
СЫВОРОТОЧНЫЕ РЕГУЛЯТОРЫ: S-белок (витронектин) –его присоединение связывает неустойчивый комплекс С5b67
и защищает клетки-мишени от лизиса
МЕМБРАННЫЕ РЕГУЛЯТОРЫ ЯДРОСОДЕРЖАЩИХ КЛЕТОК:
- эндоцитоз или экзоцитоз участков мембраны,
на поверхности которых формируются комплексы C5bС6C7С8
МЕМБРАННЫЕ РЕГУЛЯТОРЫ ЭРИТРОЦИТОВ:
а) молекула CD59 присоединяется к белку С8 в составе формирующегося МАК и
ингибирует полимеризацию С9, не давая сформироваться МАК
б) HRF (=фактор гомологичной рестрикции (ограничения), С8-связывающий белок):
-препятствует ассоциации С8 с комплексом С5b67
-ограничивает внедрение в мембрану С9 (< эффективен, чем CD59)
42. Дефекты (болезни)системы комплемента
1. ДЕФЕКТЫ КОМПОНЕНТОВ:С1, С4, С2 нарушение элиминации ИК,
аутоиммунные заболевания
С3 рецидивирующие гнойные инфекции
С5,6,7 тяжёлое течение и генерализация бактериальных
инфекций, вызванных Neisseria (гонорея и менингит)
2. ДЕФЕКТЫ ИНГИБИТОРОВ КОМПОНЕНТОВ:
Дефицит DAF пароксизмальная ночная гемоглобинурия –
чувствительности эритроцитов
к комплемент-опосредованному лизису
Дефект С1-ингибитора врождённый
ангионевротический отёк
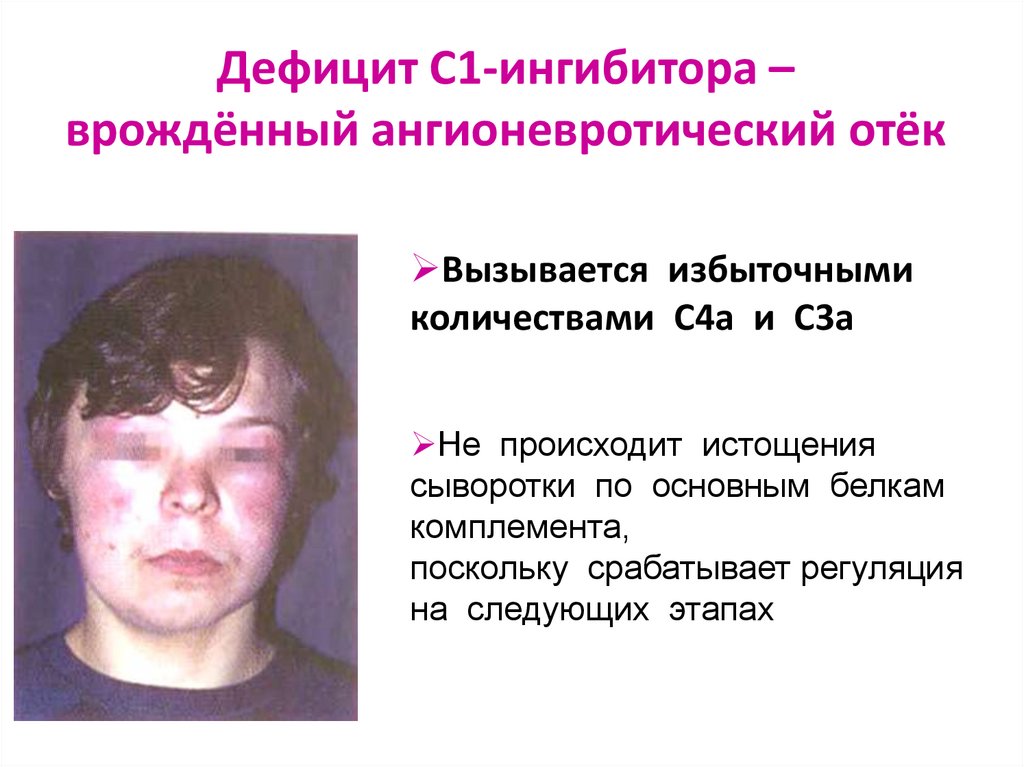
43.
Дефицит С1-ингибитора –врождённый ангионевротический отёк
Вызывается избыточными
количествами С4а и С3а
Не происходит истощения
сыворотки по основным белкам
комплемента,
поскольку срабатывает регуляция
на следующих этапах
44. Лизоцим (=фермент муромидаза)
расщепляет пептидогликан (муреин)клеточных стенок Г+ бактерий
содержится:
- в секретах слизистых
- в лизосомах фагоцитов
- в сыворотке (<)
45. Интерфероны
Низкомолекулярные белкиСинтезируются эукариотическими клетками
(лейкоцитами, фибробластами)
в ответ на внедрение биологических агентов
Явление интерференции – противовирусный иммунитет:
при инфицировании одним вирусом вырабатывается интерферон,
он не обладает вирусспецифическим действием
и защищает клетки от инфицирования другими вирусами
Видоспецифическое действие «+»
Вирусспецифическое действие «-»
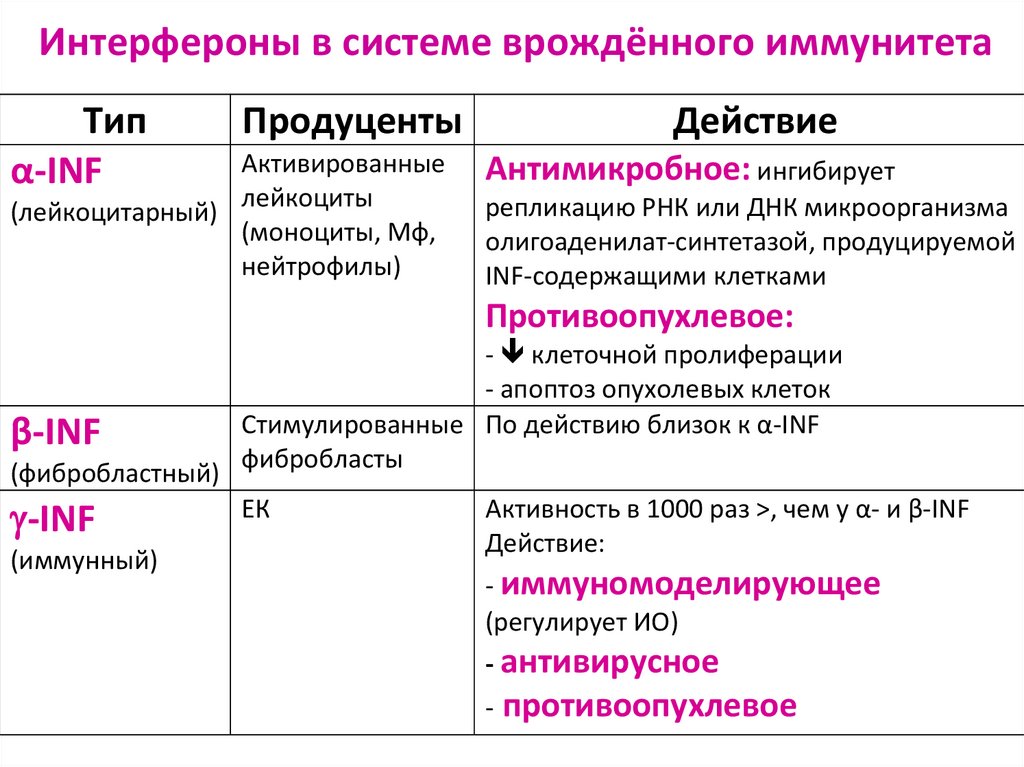
46. Интерфероны в системе врождённого иммунитета
Типα-INF
Продуценты
Активированные
лейкоциты
(лейкоцитарный)
(моноциты, Мф,
нейтрофилы)
Действие
Антимикробное: ингибирует
репликацию РНК или ДНК микроорганизма
олигоаденилат-синтетазой, продуцируемой
INF-содержащими клетками
Противоопухлевое:
β-INF
(фибробластный)
-INF
(иммунный)
- клеточной пролиферации
- апоптоз опухолевых клеток
Стимулированные По действию близок к α-INF
фибробласты
ЕК
Активность в 1000 раз >, чем у α- и β-INF
Действие:
- иммуномоделирующее
(регулирует ИО)
- антивирусное
- противоопухлевое
47.
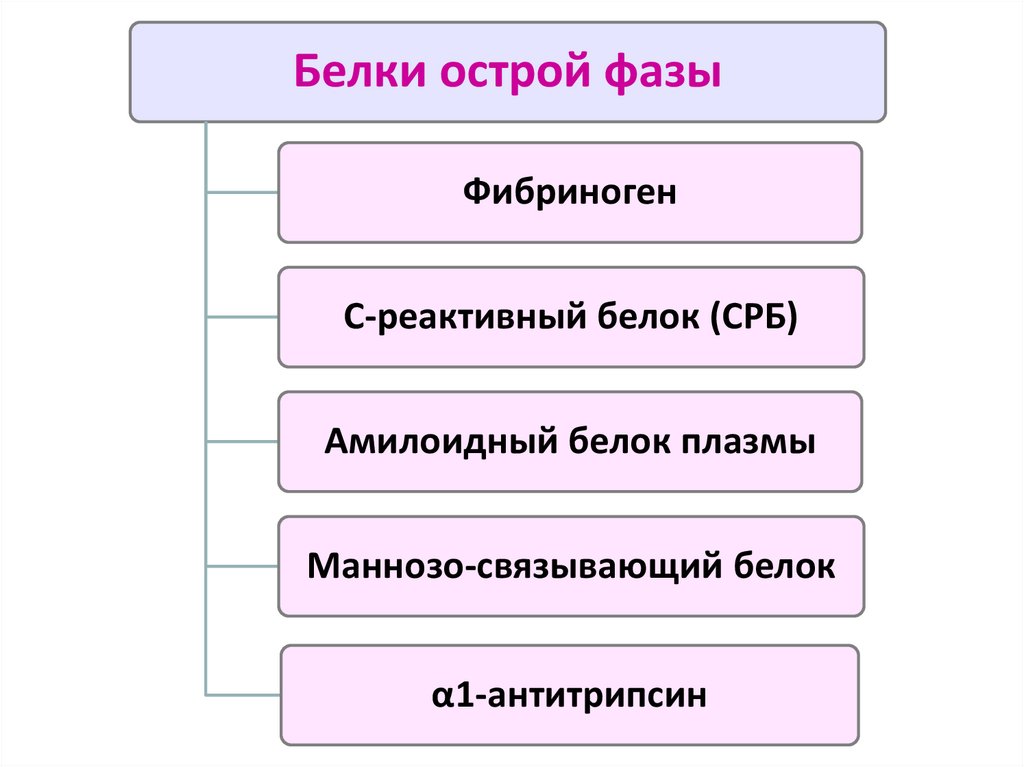
Белки острой фазыФибриноген
С-реактивный белок (СРБ)
Амилоидный белок плазмы
Маннозо-связывающий белок
α1-антитрипсин
48. Белки острой фазы
Синтезируются клетками РЭС и гепатоцитамиПостоянно присутствуют в норме в плазме крови
Их синтез на несколько порядков:
- при системном воспалении
- под воздействием ИЛ6, ИЛ1, ФНОα
Определение некоторых белков острой фазы (СРБ)
применяется в клинике для оценки интенсивности воспаления
49. С-реактивный белок (СРБ) Амилоидный белок плазмы
Относятся к семейству пентраксинов (состоят из 5 субъединиц)По химическому строению и свойствам - лектины С-типа
(связываются с углеводными молекулами на поверхности МИО)
При связывании активируют комплемент
Связанный СРБ - хемоаттрактант и опсонин для нейтрофилов
При деградации пентраксинов высвобождаются фрагменты,
активирующие Мф
и стимулирующие синтез провоспалительных цитокинов
50. Маннозо-связывающий белок (МСБ)
Относится к семейству коллектинов (по структуре напоминает С1q);каждая цепь содержит коллагеноподобный участок
и С-лектиновый участок, специфичный к сахарам МИО
(маннозе, фукозе, глюкозамину)
При связывании сахаров на фрагментах клеточной стенки МИО
МСБ изменяет конформацию
и превращается в сериновую протеазу, которая:
- активирует протеазы, ассоциированные с МСБ запуск ЛП активации
комплемента
- расщепляет факторы С2 и С4 запуск КП активации комплемента
51. Транспортные белки (лактоферрин, трансферрин, церулоплазмин)
Конкурируют с МИО за Fe и Cu –факторы роста для МИО
Обладают бактериостатическим действием
52.
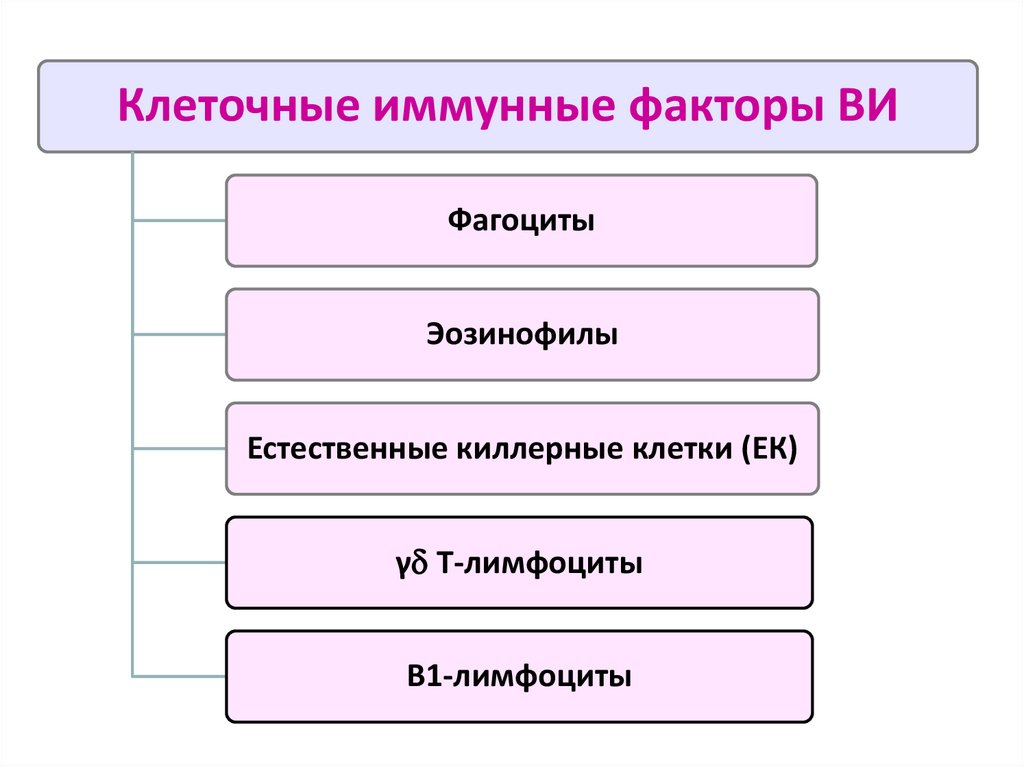
Клеточные иммунные факторы ВИФагоциты
Эозинофилы
Естественные киллерные клетки (ЕК)
γ Т-лимфоциты
В1-лимфоциты
53. Происхождение клеток системы врождённого иммунитета
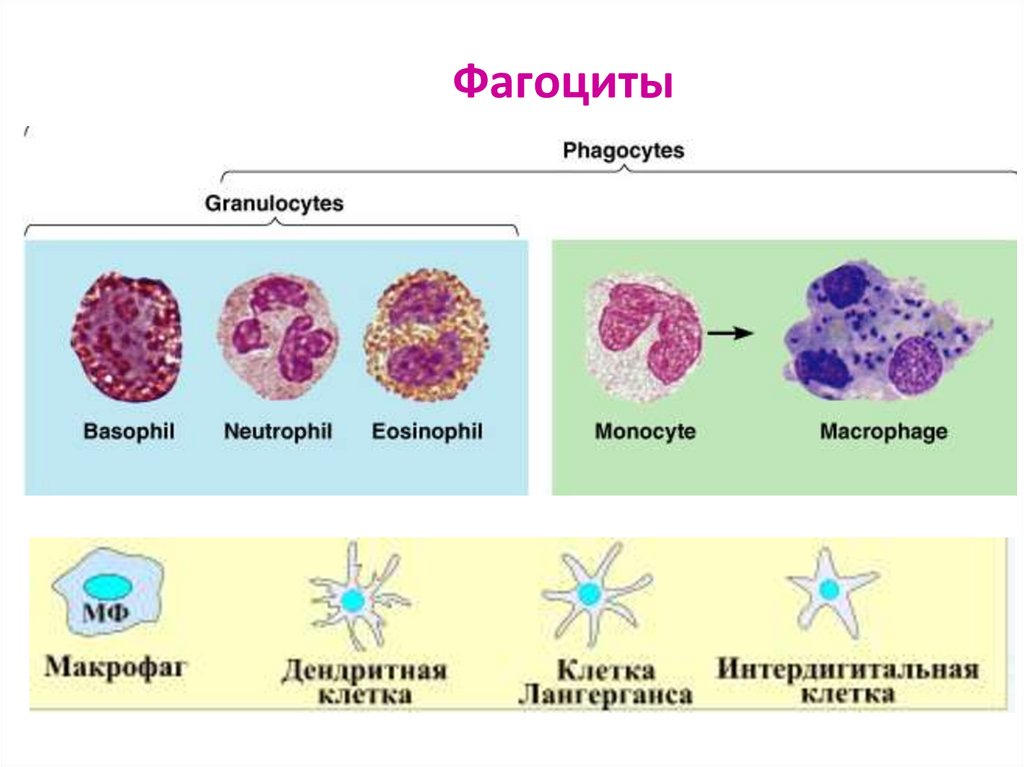
1. Миелоидной природы – фагоциты:- ПЯЛ (гранулоциты) – нейтрофилы, эозинофилы, базофилы
- тучные клетки – тканевые базофилы
- мононуклеарные лейкоциты:
- моноциты крови
- тканевые Мф (купферовские клетки печени, перитонеальные Мф, плевральные Мф,
альвеолярные Мф, глиальные Мф, мезангиальные клетки почек, остеокласты,
дендритные клетки)
2. Лимфоидной природы:
- естественные киллеры (ЕК)
- Лф с двойственной функцией (γδ Tл , Bл 1 типа)
54. Фагоциты
55. Фагоцитоз (греч. phagen – есть) –
процессузнавания,
поглощения
и биодеградации чужеродных частиц
(в т. ч. МИО) и макромолекул
специализированными клетками ИС –
фагоцитами
56. Электронограмма лейкоцита и фагоцитируемой им бактерии, полученная при сканирующей электронной микроскопии
57.
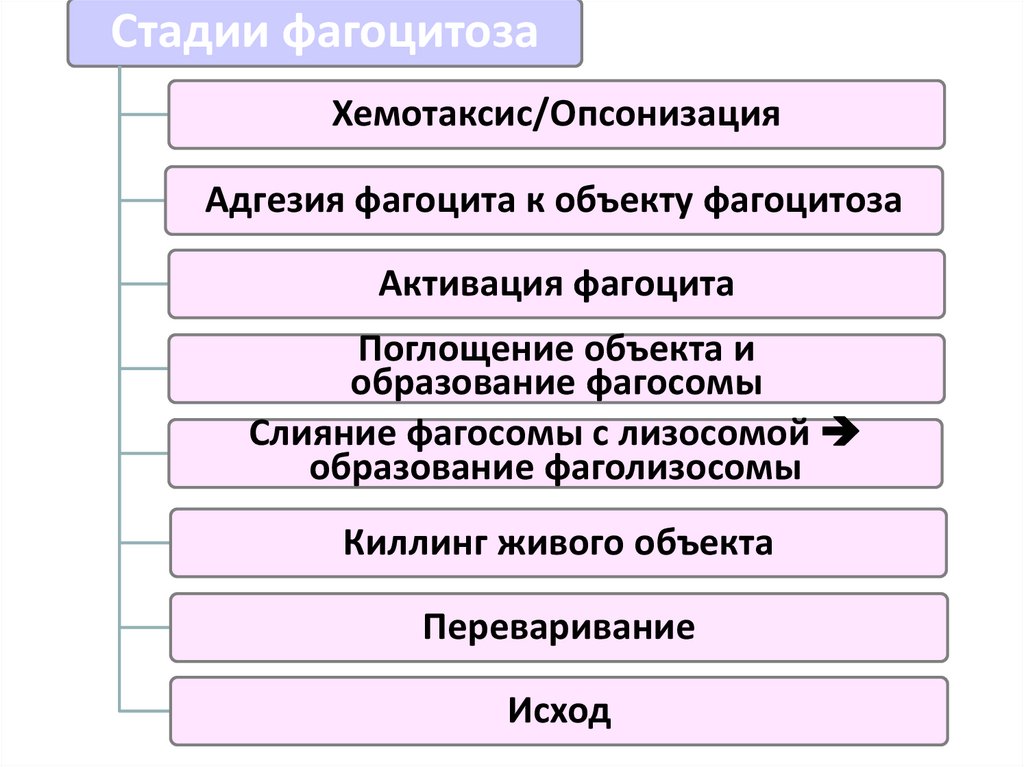
Стадии фагоцитозаХемотаксис/Опсонизация
Адгезия фагоцита к объекту фагоцитоза
Активация фагоцита
Поглощение объекта и
образование фагосомы
Слияние фагосомы с лизосомой
образование фаголизосомы
Киллинг живого объекта
Переваривание
Исход
58. Хемотаксис
Направленное движение фагоцитовпо градиенту хемоаттрактантов:
- продуктов деградации бактерий (пептидов, липопротеидов)
- цитокинов (ИЛ8)
- продуктов активации комплемента (С3а, С5а)
- протеолитических фрагментов факторов свёртывания крови
- фибринолизина
Хемоаттрактанты обеспечивают
поступление Мф в очаг воспаления
Задерживают Мф в очаге воспаления
ингибиторы хемотаксиса (интерферон, гиалуроновая кислота)
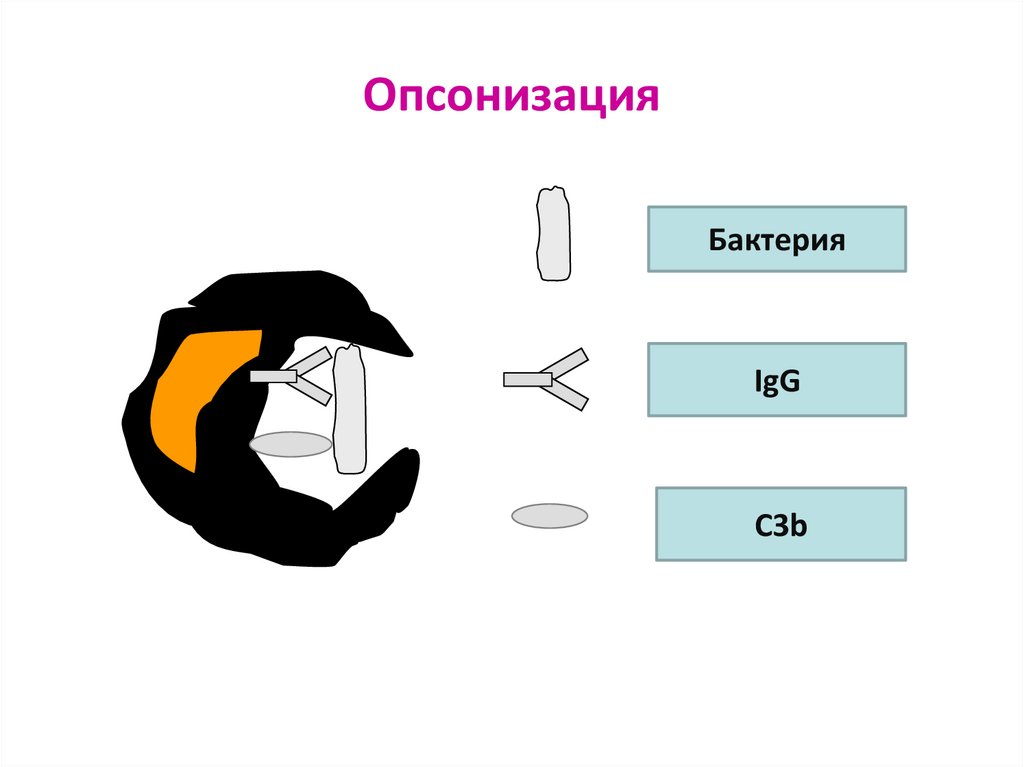
59. Опсонизация (opsonin – усиливающий) – фагоцитоза за счёт связывания опсонинов с поверхностью объекта и взаимодействия с
Опсонизация (opsonin – усиливающий) – фагоцитозаза счёт связывания опсонинов с поверхностью объекта
и взаимодействия с рецепторами фагоцитов
Опсонины:
- активированный С3b (связывается с рецептором к С3b на фагоците)
- IgG (связывается с рецептором к Fc-фрагменту IgG на фагоците)
- фибронектин – гликопротеин, который связывается с МИО
(затем связывается с рецептором к фибронектину на фагоците)
60. Опсонизация
БактерияIgG
C3b
61.
62. Активаторы фагоцитов
Все лиганды ТПР (ЛПС)Цитокины ( -INF)
Адгезины (интегрины, хемокины)
Активированные факторы комплемента
Стимуляторы перечисленных факторов
63. Проявления активации фагоцитов
Усиление фагоцитоза, кислородный взрывэкспрессии адгезинов, молекул костимуляции и ГКГС
Синтез цитокинов
цитотоксичности
Отмена апоптоза
64.
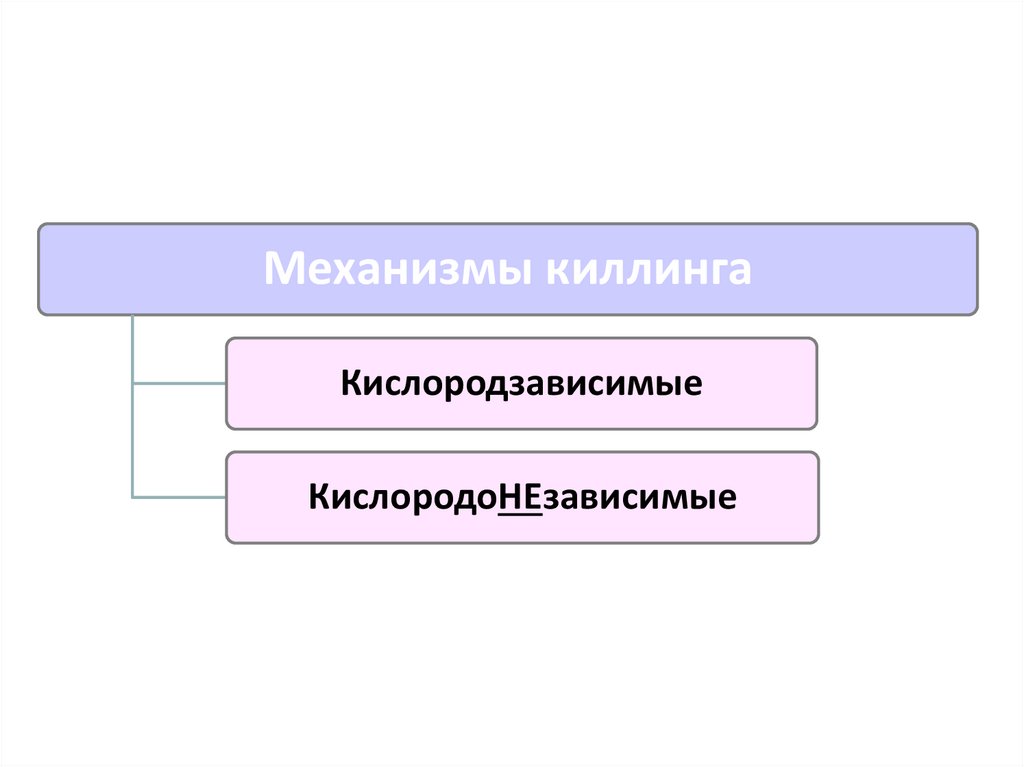
Механизмы киллингаКислородзависимые
КислородоНЕзависимые
65.
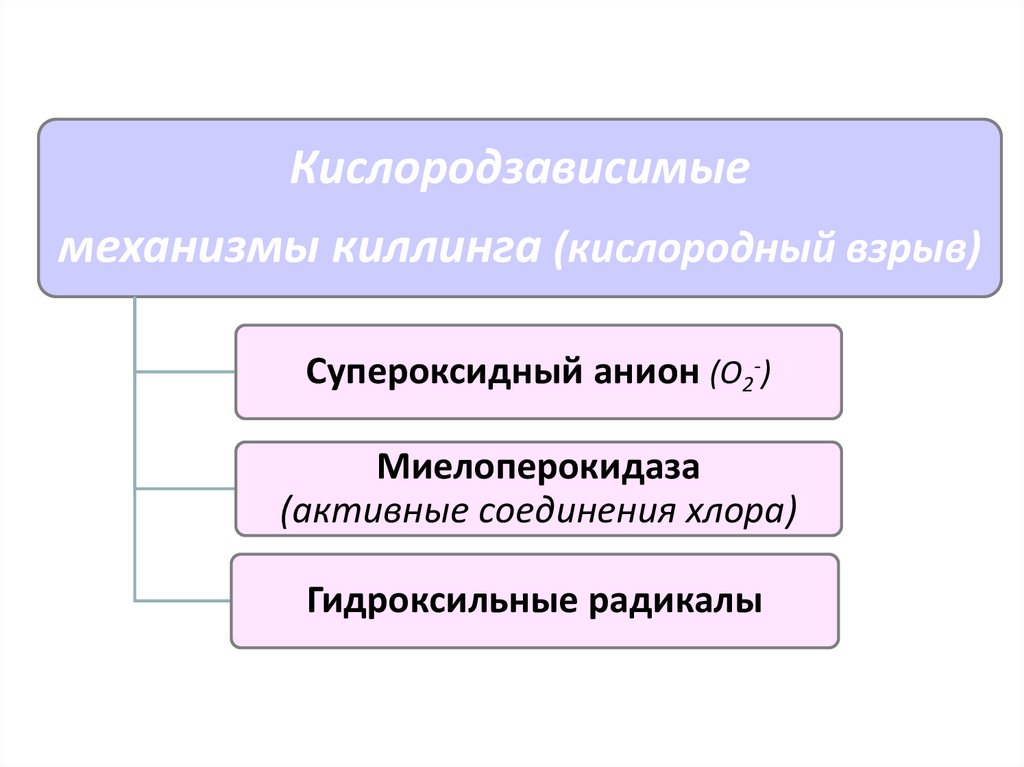
Кислородзависимыемеханизмы киллинга (кислородный взрыв)
Супероксидный анион (О2-)
Миелоперокидаза
(активные соединения хлора)
Гидроксильные радикалы
66. Кислородный взрыв
Активация пентозо-фосфатного шунта, накопление НАДФОбразование активного супероксид-аниона кислорода
с участием НАДФ и цитохрома b245 (НАДФ-оксидаза)
Спонтанные реакции с водой и протонами
образование перекисных соединений и синглетного кислорода
При участии миелопероксидазы
образуются активные соединения хлора и синглетный хлор
67. Кислородозависимые механизмы внутриклеточной бактерицидности
68. Оксид азота (NO)
Образуется из аргинина с помощьюNO-синтетазы, НАДФ и лейкотриена В4
NO-синтетаза:
- конститутивная
- индуцибельная (в 1000 раз активнее)
активируется -INF, ФНОα, ИЛ1
угнетается ИЛ-10, 4, 13
Механизмы действия NO:
- нерепарируемые повреждения
- инактивация ферментов
- быстрое связывание железа
69.
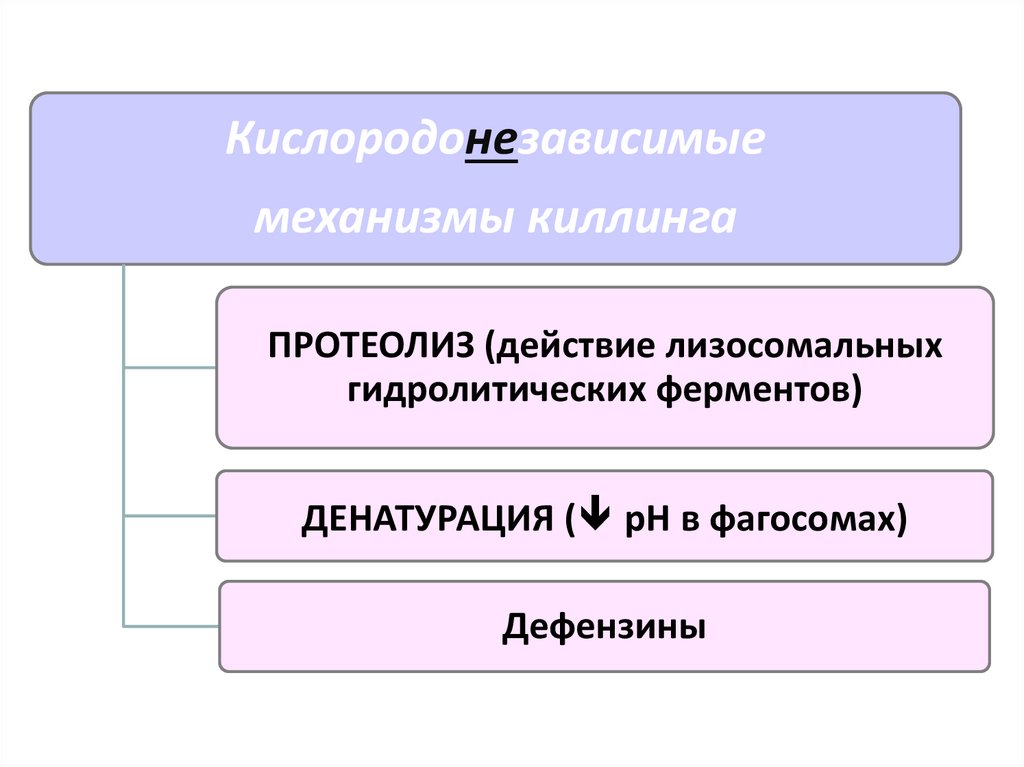
Кислородонезависимыемеханизмы киллинга
ПРОТЕОЛИЗ (действие лизосомальных
гидролитических ферментов)
ДЕНАТУРАЦИЯ ( рН в фагосомах)
Дефензины
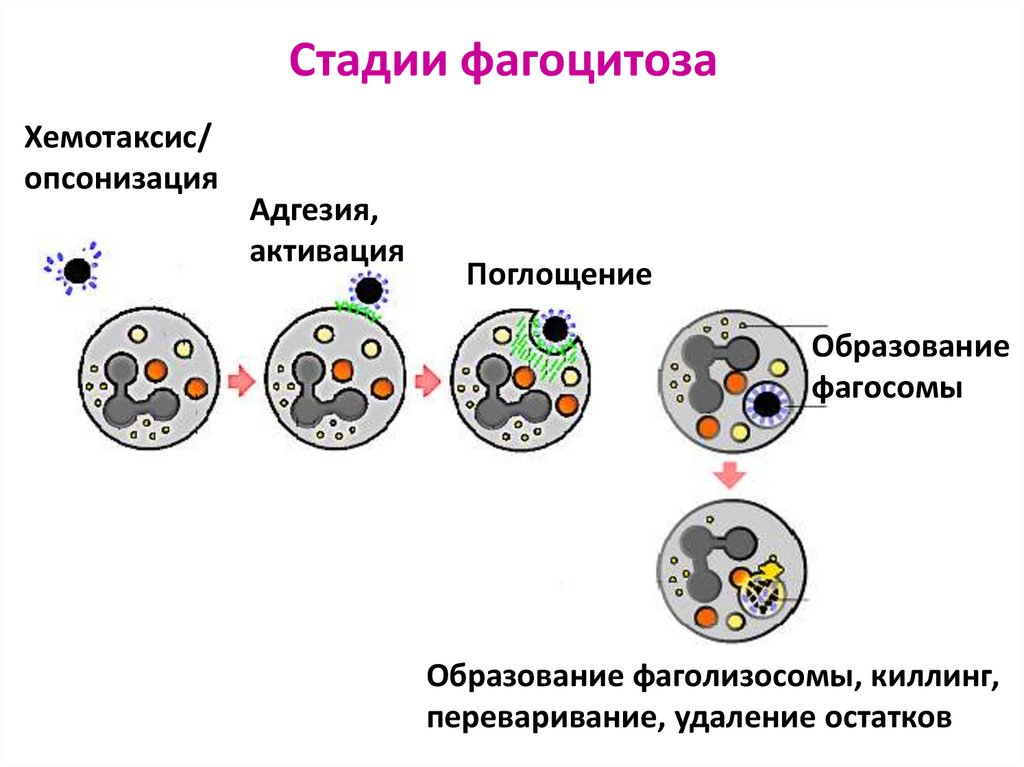
70. Стадии фагоцитоза
Хемотаксис/опсонизация
Адгезия,
активация
Поглощение
Образование
фагосомы
Образование фаголизосомы, киллинг,
переваривание, удаление остатков
71. Исходы фагоцитоза
ЗавершённыйНезавершённый:
- гибель фагоцита
- персистенция МИО в фагоците
72.
73. Механизмы персистенции МИО в фагоцитах
Блокада слияния фагосомы и лизосомыРезистентность
к действию лизосомальных ферментов
Способность патогенных МИО
покидать фагосому до слияния её с лизосомой
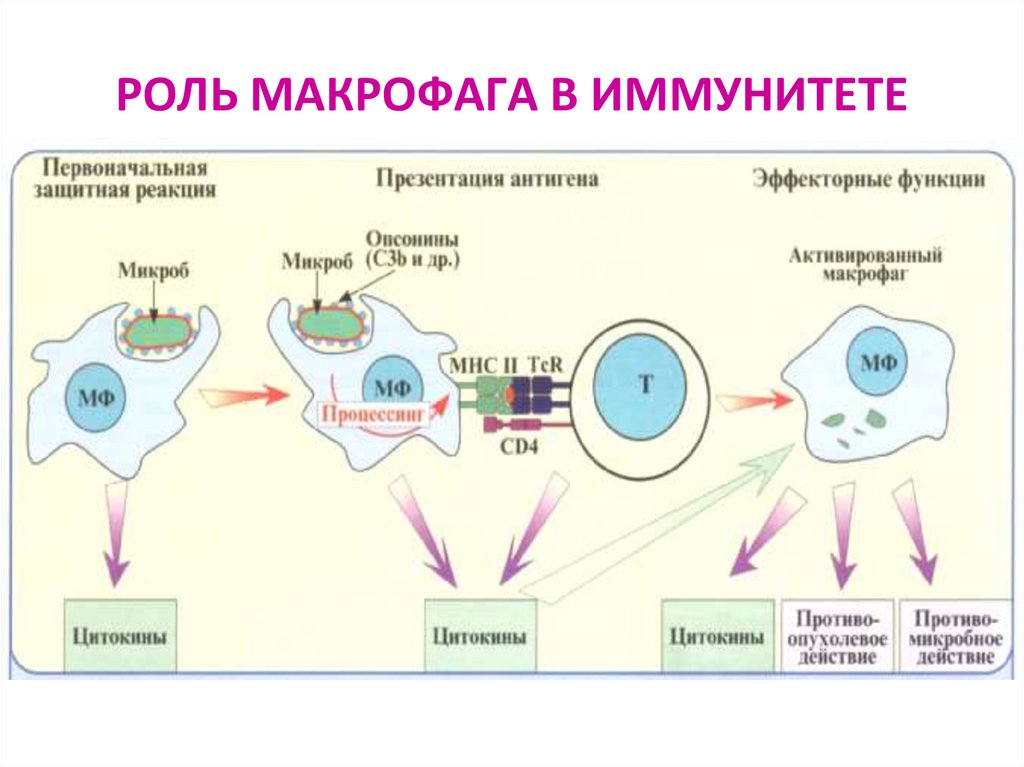
74. РОЛЬ МАКРОФАГА В ИММУНИТЕТЕ
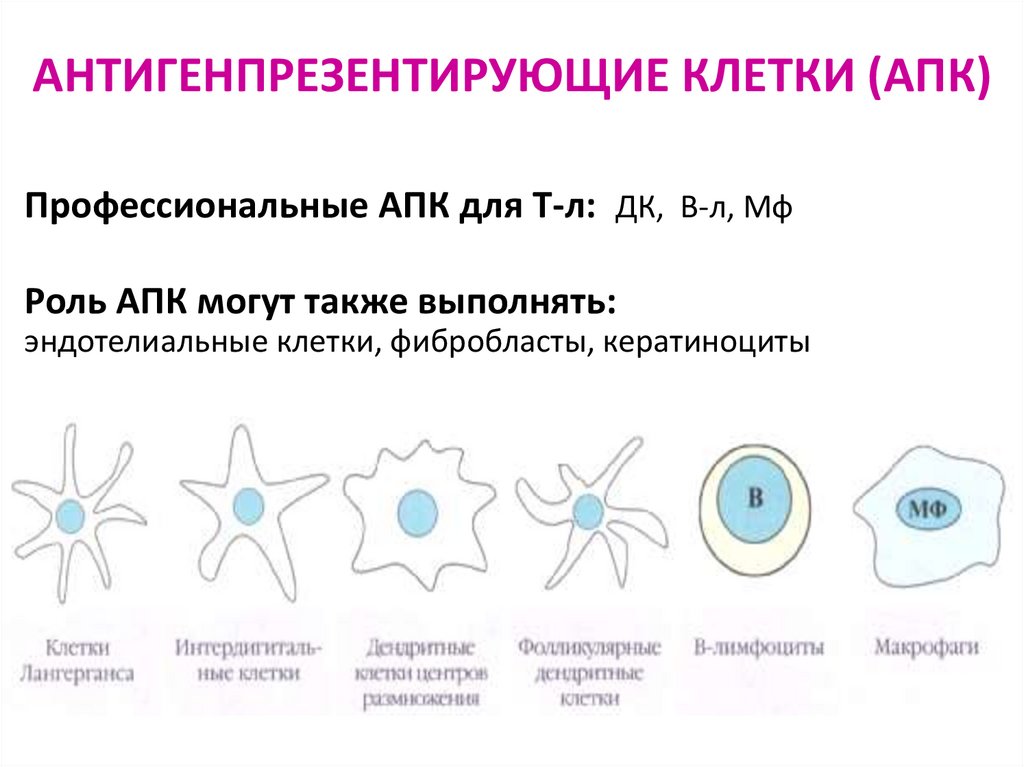
75. АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ (АПК)
Профессиональные АПК для Т-л: ДК, В-л, МфРоль АПК могут также выполнять:
эндотелиальные клетки, фибробласты, кератиноциты
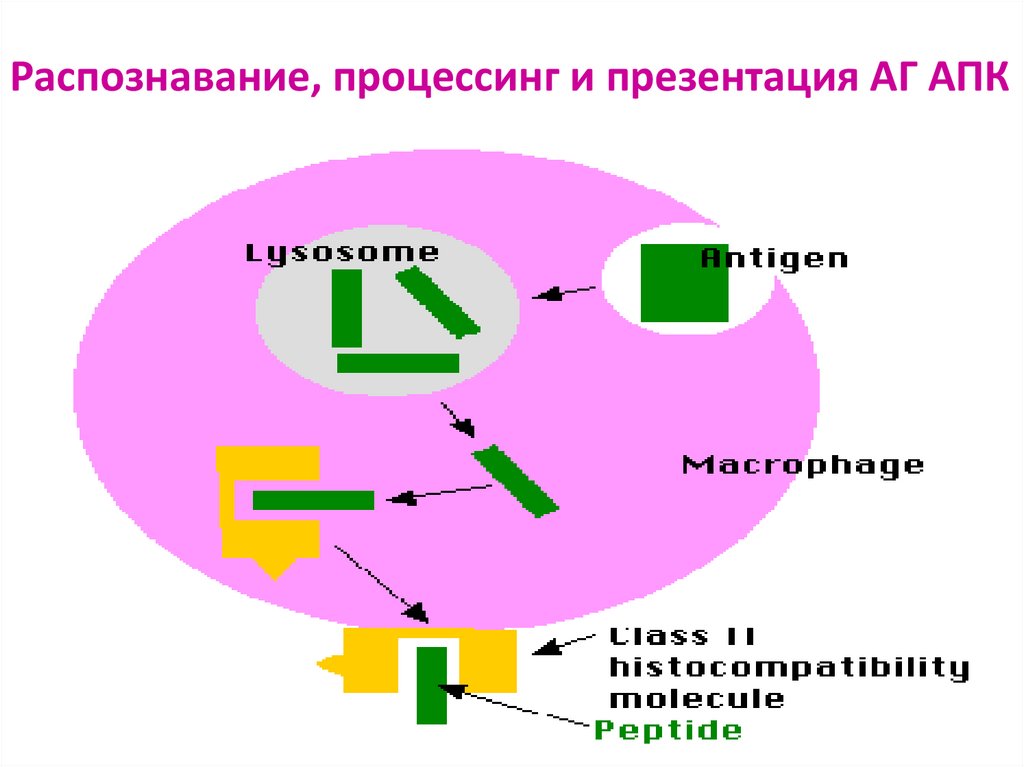
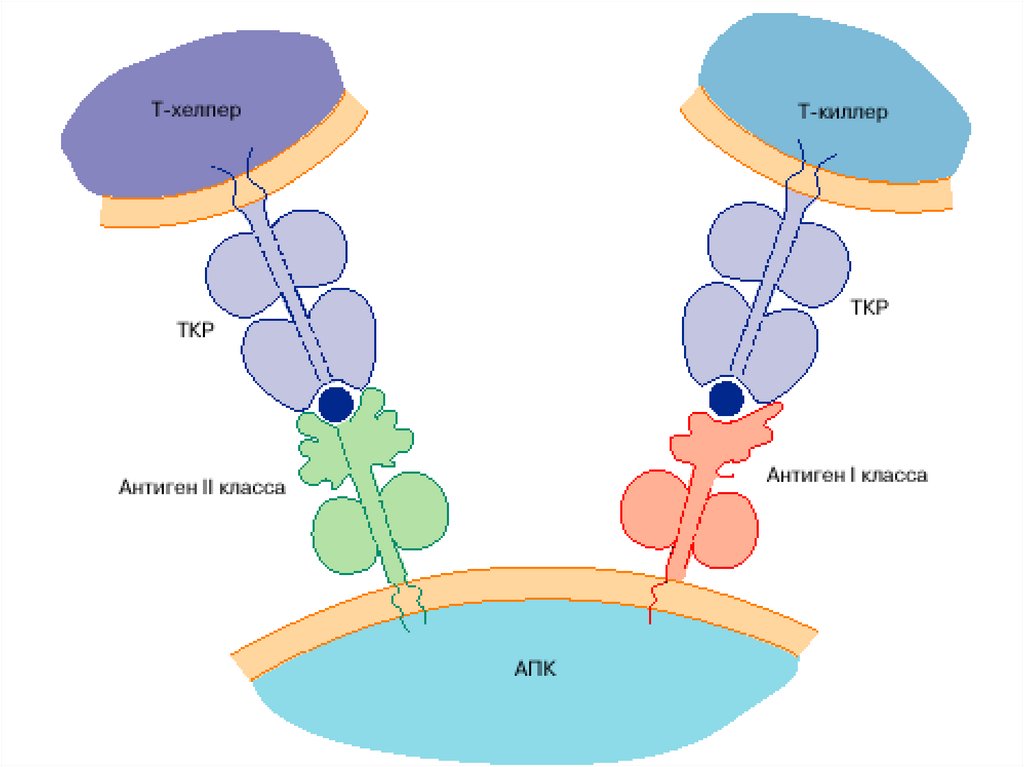
76. Распознавание АГ лимфоцитами возможно только после предварительного процессинга и представления АГ АГ-презентирующей клеткой
Презентация антигена – представление процессированного АГв комплексе с молекулами ГКГС
антигенспецифическим клонам
регуляторных и эффекторных Т-лимфоцитов
Этапы АГ- презентации:
поглощение АГ антиген-презентирующей клеткой
расщепление АГ в цитоплазме АПК ферментами (процессинг АГ)
связывание образующихся антигенных пептидов с молекулами ГКГС I или II класса
транспортировка и выход образовавшегося комплекса на поверхность мембраны
клетки, где АГ (пептид) распознается рецепторами лимфоцитов
77. Распознавание, процессинг и презентация АГ АПК
78.
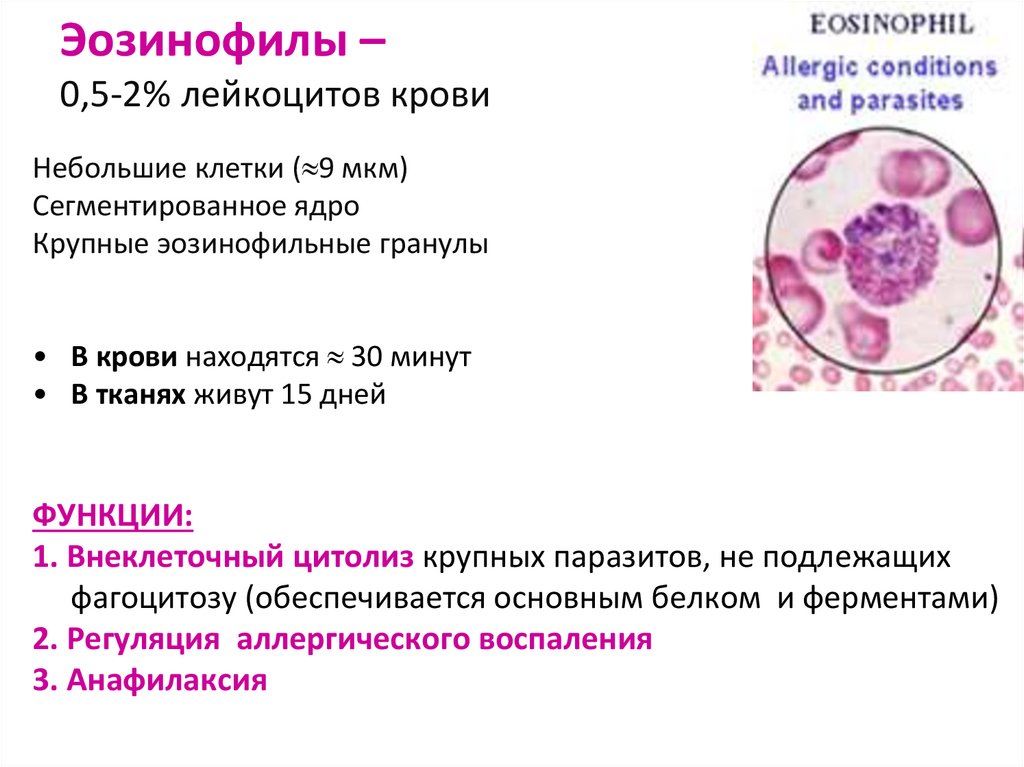
79. Эозинофилы – 0,5-2% лейкоцитов крови
Небольшие клетки ( 9 мкм)Сегментированное ядро
Крупные эозинофильные гранулы
• В крови находятся 30 минут
• В тканях живут 15 дней
ФУНКЦИИ:
1. Внеклеточный цитолиз крупных паразитов, не подлежащих
фагоцитозу (обеспечивается основным белком и ферментами)
2. Регуляция аллергического воспаления
3. Анафилаксия
80. Естественные (нормальные) киллеры (=ЕК,НК,NK)
5-20% Лф периферической крови из пула нулевых ЛфКрупные (12-15 мкм)
Гранулярные (содержат азурофильные гранулы)
Накапливаются в тканях:
- печень – до 50% всех Лф
- лёгкие – 30%
- селезёнка – 10%
CD16+, CD56+
Не имеют маркеров Т- и В-клеток, АГ-распознающих рецепторов
Не требуют предварительной сенсибилизации,
т.е. быстро лизируют чужеродные клетки-мишени
без предварительного контакта с АГ
81. Прямая цитотоксичность ЕК осуществляется за 1-2 часа
распознают лектины на мембранах чужеродных клеток-мишеней↓
выделяют белок перфорин
↓
перфорин связывается с мембраной клетки,
формирует в ней трансмембранный канал
↓
ч/з трансмембранный канал в клетку впрыскиваются гранзимы
↓
гранзимы активируют каспазы (сериновые протеазы) в клетке
↓
каспазы активируют эндонуклеазы
↓
- фрагментация ДНК (апоптоз клетки-мишени)
- лизис клетки-мишени
82. Функции ЕК обусловлены внеклеточным киллингом клеток, несущих чужеродные антигены
1.Противоопухолевый иммунитет(один ЕК может уничтожить
до 40 опухолевых клеток)
2. Противовирусный иммунитет
3. Противогрибковый иммунитет
4. Регуляция ИО
83. γ Т-лимфоциты – клетки врождённого иммунитета
γ Т-лимфоциты –клетки врождённого иммунитета
минорная (1–3%) субпопуляция
преобладающее место локализации – барьерные ткани:
- слизистая оболочка кишечника (20–30% от общего числа Т-л)
- слизистая оболочка респираторного тракта
- эпидермис кожи
в периферической крови – около 5% от числа лимфоцитов
способность к рециркуляции очень ограничена,
однако способны к перемещениям в лимфоидной ткани,
могут мигрировать во вторичные лимфоидные органы
подобно ЕК, распознают стрессорные молекулы с помощью NKG2D и
NKG2/CD94
вариабельность γδTКР невелика
ограничен спектр АГ, распознаваемых с его помощью
большинство γδТ-клеток лишено CD4 и CD8 они распознают АГ без
участия корецепторов, т.е. без ограничения по ГКГС
в их активации не участвуют костимулирующие молекулы
84. Функции γδТ-лимфоцитов
Участвуют в формировании 1-й линии иммунной защиты, играяроль цитотоксических клеток
Мигрируя в л/у, играют роль АПК
В барьерных тканях
активно взаимодействуют с эпителиальными клетками,
поддерживая их выживаемость и функциональную активность,
способствуя регенерации эпителия при его повреждениях
Ограничивают чрезмерно интенсивный иммунный ответ и
аутоагрессию, выступая в качестве регуляторных Т-клеток
85. В1-лимфоциты – клетки врождённого иммунитета
Маркёр – CD5Малое разнообразие В1-л
по специфичности их АГ-распознающих рецепторов (ВКР)
Синтезируют естественные (нормальные АТ) – IgМ и IgA:
- АТ к ПС УП бактерий
- изогемагглютинины групп крови (АВО)
После выхода из серозных полостей в кровоток
во время миграции по организму оседают преимущественно
в миндалинах, брюшной и плевральной полостях, сальнике;
в л/у их не 35 % от всех В-л
86.
Распознаваниев системе
врождённого иммунитета
(СВИ)
87. Образы патогенности, или патоген-ассоциированные молекулярные паттерны (Pathogen-associated molecular patterns — PAMP)
Образы патогенности, или патогенассоциированные молекулярные паттерны(Pathogen-associated molecular patterns — PAMP)
Группы молекул, отсутствующие в организме-хозяине
Характерны для патогенов (вирусов, бактерий, грибов,
простейших, паразитов)
Высоко консервативны, однозначно связаны с
патогенностью являются универсальным сигналом
о проникновении в организм не просто чужеродного,
а биологически агрессивного агента
Их узнавание — основа распознавания
в системе врождённого иммунитета
88. Рецепторы для PAMP у человека (паттернраспознающие рецепторы или молекулы)
Результат эволюцииРаспознают чужеродные,
а не собственные молекулы организма
Широкая специфичность: распознают практически все патогены,
т.к. обладают пространственным сродством к наиболее общим и
связанным с патогенностью молекулярным маркёрам
чужеродных агентов (компонентам КС бактерий, эндотоксинам, НК)
Каждый рецептор распознает не индивидуальную молекулу,
а целую группу молекул образов патогенности
Кодируются небольшим числом генов, что не составляет
чрезмерной «обузы» для многоклеточного организма
89. Экспрессия рецепторов для PAMP (паттернраспознающих рецепторов или молекул)
На поверхности клеток-эффекторов иммунитета –11 типов Toll- подобных рецепторов
(TLR, ТР, нем. toll – замечательный) –
связывают определённые структуры МИО
В распознавании структур ТР помогает молекула CD14
В гранулах, в которые попадают чужеродные агенты
при фагоцитозе
В жидких средах организма
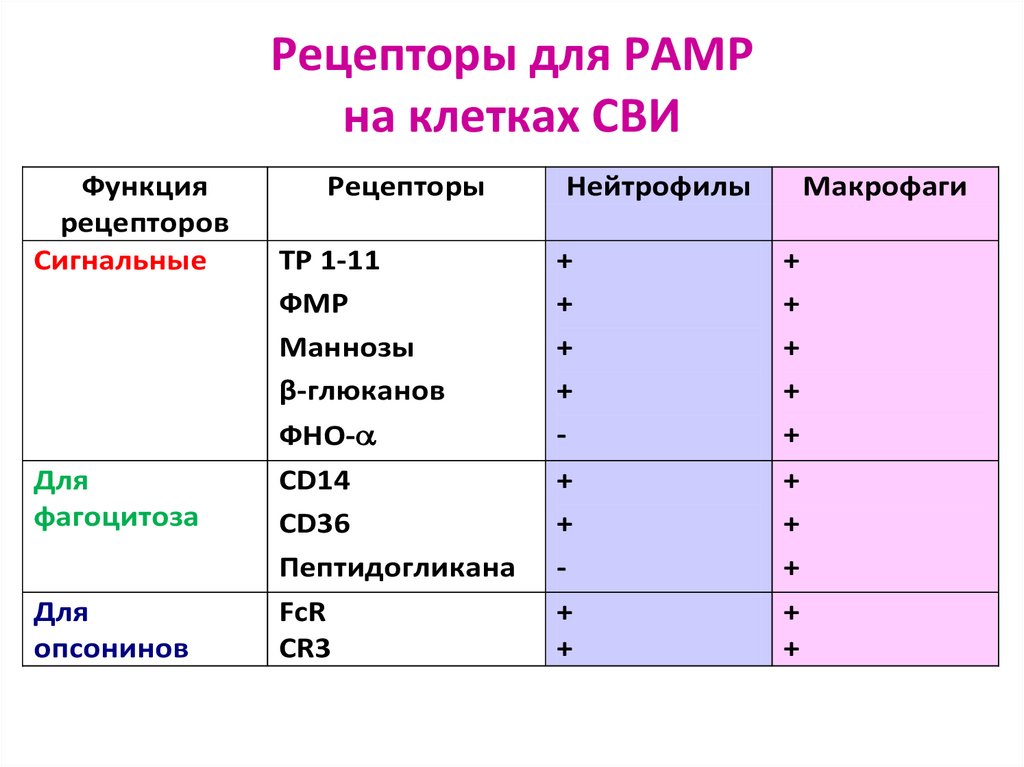
90. Рецепторы для PAMP на клетках СВИ
Функциярецепторов
Сигнальные
Рецепторы
ТР 1-11
ФМР
Маннозы
β-глюканов
Нейтрофилы
Макрофаги
ФНО-
+
+
+
+
-
+
+
+
+
+
Для
фагоцитоза
CD14
CD36
Пептидогликана
+
+
-
+
+
+
Для
опсонинов
FcR
CR3
+
+
+
+
91.
Активацияпаттернраспознающих рецепторов
Быстрый эффекторный ответ:
- уничтожение, лизис, фагоцитоз
- индукция воспаления
- организация специфического ИО
92. Распознавание АГ клетками СВИ АГ распознается в исходной, необработанной форме
Молекулы патогеновДНК бактерий и вирусов
ЛПС Грам- бактерий
Липопротеиды
ПГ Грам+ бактерий
Маннаны бактерий и грибов
Клеточные рецепторы
ТР-9
Рецепторы-мусорщики,
CD14, ТР-4
ТР-2
ТР-2, CD14
Манназный рецептор
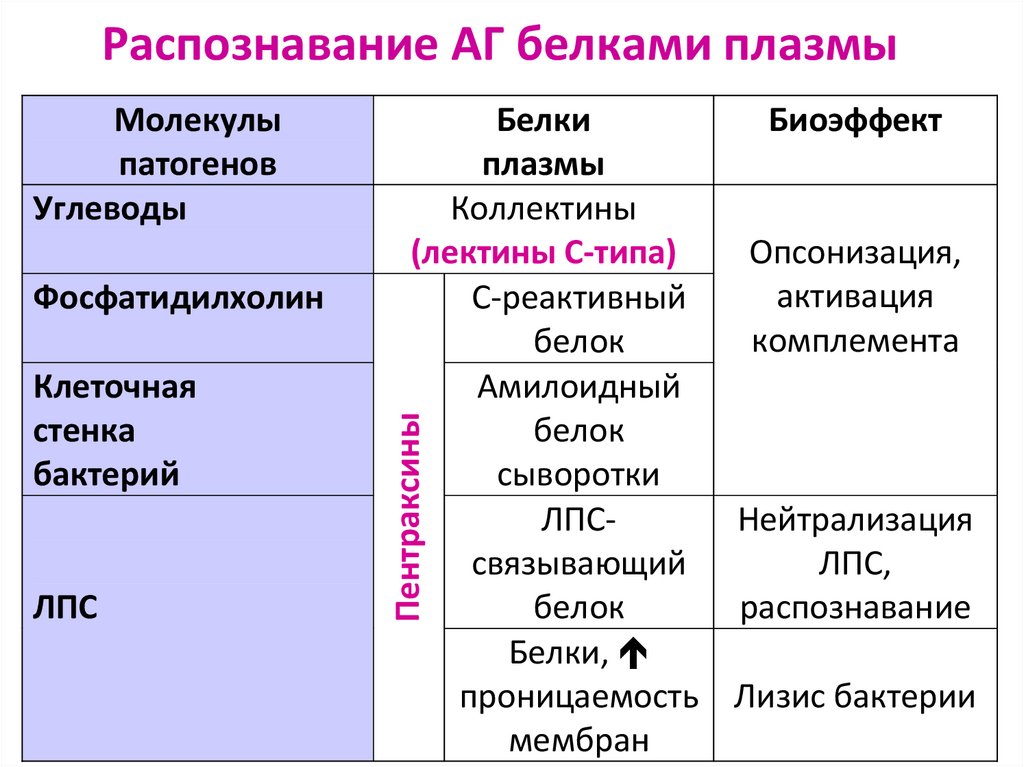
93. Распознавание АГ белками плазмы
ФосфатидилхолинКлеточная
стенка
бактерий
ЛПС
Белки
Биоэффект
плазмы
Коллектины
(лектины С-типа)
Опсонизация,
активация
С-реактивный
комплемента
белок
Амилоидный
белок
сыворотки
ЛПСНейтрализация
cвязывающий
ЛПС,
белок
распознавание
Белки,
проницаемость Лизис бактерии
мембран
Пентраксины
Молекулы
патогенов
Углеводы
94.
Первая линияиммунной защиты
95. Активация Мф, приводящая к секреции цитокинов, – первая реакция СВИ на проникновение патогенов во внутреннюю среду организма
Проникновение патогена во внутреннюю среду организмамобилизация ИС; ключевое событие – контакт патогена с клетками ИС,
присутствующими почти во всех тканях (прежде всего в барьерных)
эти клетки формируют первую линию защиты;
наиболее важную роль в запуске иммунных процессов играют Мф,
на поверхности и в ЦП гранулах которых есть рецепторы,
распознающие PAMP
активированные Мф начинают выделять провоспалительные цитокины
дальнейшая активация клеток врождённого иммунитета
96. Функции цитокинов
1) вовлечение в защитную реакцию других клеток(эпителиальных, эндотелиальных, дендритных)
без обязательного их контакта с патогеном
2) «организация» миграции лейкоцитов из кровотока
в очаг воспаления важна т.к., как правило,
содержание Мф и др. эффекторных клеток
в месте проникновения патогена невелико
и достаточно только для запуска реакции
приток лейкоцитов из крови
реализация полноценной местной защитной реакции
с участием факторов врождённого иммунитета
97. Формирование воспалительного очага
1) В очаг воспаления поступают наиболее мобильные лейкоциты —нейтрофилы, их защитный потенциал реализуется в виде
фагоцитоза
2) Затем мигрируют моноциты, дифференцирующиеся в Мф;
они кроме фагоцитоза, выполняют регуляторные функции,
стимулируют пролиферацию клеток, способствуют репарации
3) Одновременно вовлекаются гуморальные факторы: активируется
система комплемента по АП, синтезируются белки острой фазы,
выделяются бактерицидные вещества
При вирусной инфекции патоген распознают в основном
плазмоцитоидные ДК и ЕК (при этом происходит их активация)
4) Активируются В1-л, они продуцируют полиспецифические АТ с
низким сродством к АГ.
Взаимодействуя с патогеном, эти АТ активируют комплемент по КП.
5) Посредством комплемента
АТ вовлекают фагоциты в иммунные реакции
98. Врождённый иммунитет
Древний компонент ИС, его возраст – 1,5 млрд летЕго главные составляющие:
1)распознавание чужеродных агентов во внутренней среде
организма с помощью рецепторов, специализированных на
узнавании «образов» патогенности
2) элиминация опознанных чужеродных агентов из организма
путём фагоцитоза
Фагоциты практически не нуждаются в межклеточных контактах
и коммуникациях нет необходимости их локализации в
специализированных органах ИС:
миелоидные клетки широко распределены по организму;
особенно богаты ими барьерные ткани
99. Врождённый иммунитет
В его рамках сформировался дополнительный механизм ответана эндогенные сигналы опасности, который служит основой
защиты от трансформированных (опухолевых) клеток
Иммунологическая память не формируется; каждый раз
реакции на внедрение чужеродных молекул развиваются как
впервые
Его активация необходима для запуска адаптивного
иммунитета, основанного на индивидуальном распознавании АГ
– макромолекул, обычно чужеродных, но не обязательно
связанных с патогенами

































































 medicine
medicine








