Similar presentations:
Определение фазового равновесия. Правило фаз Гиббса. Уравнение Клапейрона-Клаузиуса. Диаграммы состояния воды и серы
1.
Определение фазового равновесия. Правило фазГиббса. Уравнение Клапейрона-Клаузиуса.
Диаграммы состояния воды и серы
1
2.
Фазовые равновесия: основные понятияФаза (Ф) – это совокупность гомогенных частей системы имеющих
одинаковые
химические,
физические
и
термодинамические
характеристики во всех своих точках. Фазы отделены друг от друга
поверхностями раздела.
Системы, у которых отдельные компоненты находятся в одной фазе и
отсутствуют поверхности раздела, называются гомогенными.
Системы, состоящие из нескольких фаз, имеют поверхность раздела и
называются гетерогенными.
Фазовым переходом (или фазовым превращением) называется переход
вещества из одного агрегатного состояния в другое, а также изменение
полиморфной или аллотропной модификации.
2
3.
Число составляющих веществ – это число тех веществ, которые можновыделить из системы в индивидуальном виде. Например, в водном растворе
поваренной соли можно насчитать много видов частиц (вода, молекулы NaCl,
гидратированные ионы Na+ и Cl-, ионы Н+ и ОН -). В действительности же в
системе только два составляющих вещества: вода и NaCl, так как ни один из
перечисленных ионов не может быть извлечен из данной системы в
отдельности.
Независимыми компонентами (К) называются независимые составные части
системы. Если между веществами, составляющими систему, невозможны
никакие химические реакции, то число компонентов равно числу
составляющих веществ.
Число степеней свободы (С) или вариантность – показывает сколько
параметров (давление, температуру, концентрации) можно одновременно и
произвольно менять (т. е. независимо друг от друга), не изменяя числа или
вида фаз равновесной системы.
3
4.
Правило фаз ГиббсаК — число компонентов в системе
К Ф – число параметров системы, характеризующих концентрации компонентов
(К – 1) – концентрация
(К – 1) Ф – число концентраций
(К - 1) Ф + 2 – общее число параметров системы
µi°= µi° + RTlg[xi]
µ11 = µ12 = µ13 =. . .= µ1f,
µ21 = µ22 = µ23 =. . .= µ2f,
...........................................
µк1 = µк2 = µк3= ... = µкf,
к — номер компонента в системе.
(Ф–1) К — число уравнений, связывающих концентрации компонентов в системе
С = (К–1) Ф + 2 – (Ф–1) К = К – Ф + 2
4
5.
Условия фазового равновесияЕсли имеется двухфазная система, включающая К компонентов.
Считается, что система находится в состоянии фазового равновесия
относительно i – компонента, если не происходит результирующего
перемещения данного компонента из одной фазы в другую. Равновесие
может быть динамическим, т. е. отдельные молекулы вещества
могут переходить из одной фазы в другую, но количество таких
переходов в единицу времени строго одинаково.
Виды равновесий:
1. термическое (равенство температур)
2. механическое (равенство давлений)
3. химическое (равенство химических потенциалов)
4. электрическое
5. магнитное
5
6.
ВЫВОД И АНАЛИЗ УРАВНЕНИЯ КЛАПЕЙРОНА – КЛАУЗИУСА6
7.
Однокомпонентные системыПри kн = 1 уравнение правила фаз примет вид:
С = 3 - Ф,
Если в равновесии 1 фаза, то С = 2, говорят, что система бивариантна;
2 фазы С = 1, система моновариантна;
3 фазы С = 0, система инвариантна.
Диаграмма, выражающая зависимость состояния системы от внешних
условий или от состава системы, называется фазовой диаграммой.
Каждая точка (ее называют фигуративной точкой) на такой диаграмме
изображает некоторое равновесное состояние.
7
8.
Принципы построения и анализа диаграммПринцип непрерывности. При непрерывном изменении параметров,
определяющих состояние системы, свойства отдельных фаз и всей
системы в целом изменяются непрерывно, если в системе не
появляются или не исчезают фазы. При появлении новых или
исчезновении существовавших фаз свойства системы как целого
изменяются скачком.
Принцип соответствия. Каждому сочетанию фаз в равновесной
системе
на
геометрический
диаграмме
состояния
отвечает
определенный
образ:
поверхность,
линия,
точка.
Путем
геометрического исследования фазовых диаграмм определяют число,
химическую природу и границы существования фаз в равновесных
системах, образованных одним, двумя или несколькими компонентами.
8
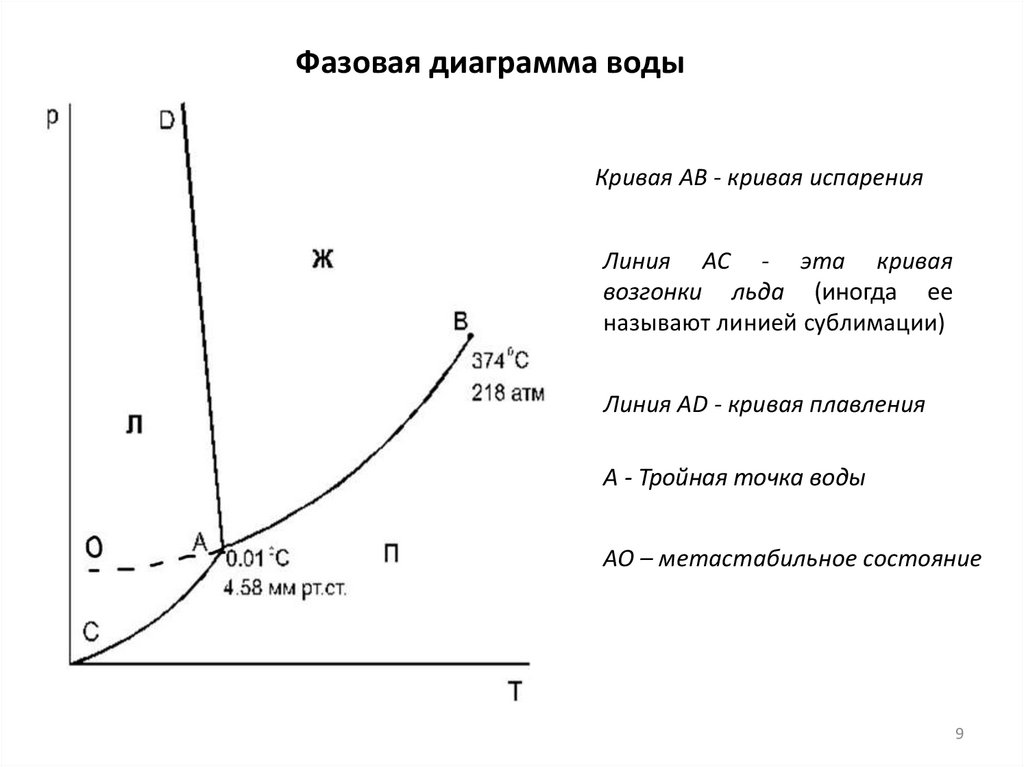
9.
Фазовая диаграмма водыКривая АВ - кривая испарения
Линия АС - эта кривая
возгонки льда (иногда ее
называют линией сублимации)
Линия АD - кривая плавления
А - Тройная точка воды
АО – метастабильное состояние
9
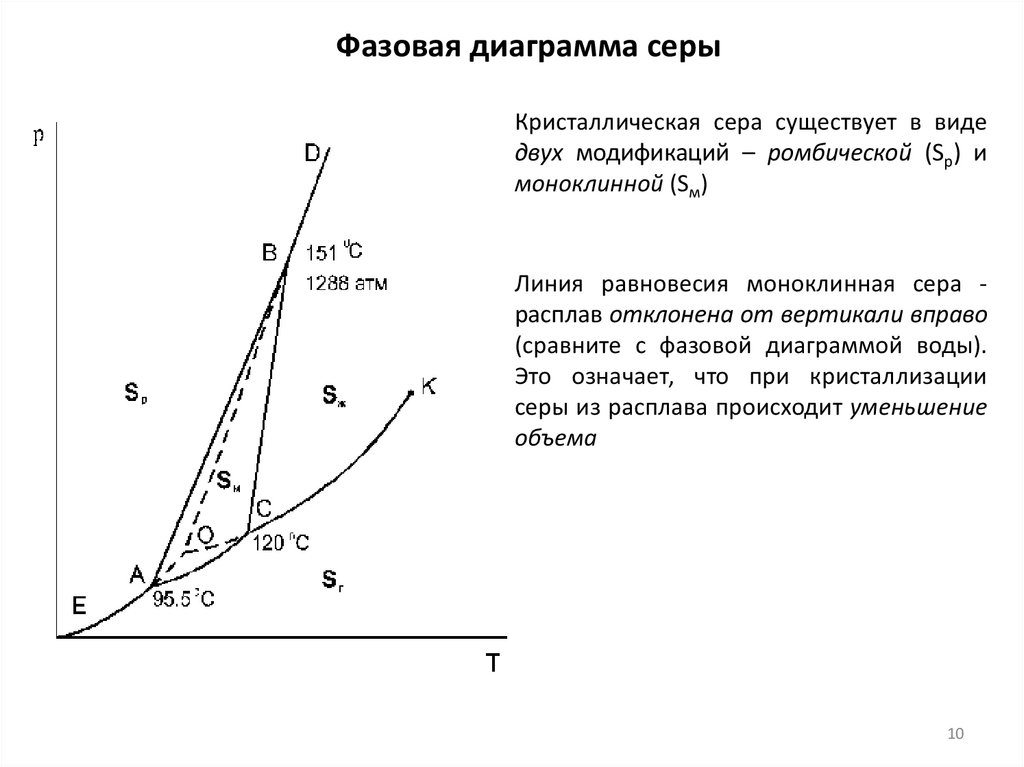
10.
Фазовая диаграмма серыКристаллическая сера существует в виде
двух модификаций – ромбической (Sр) и
моноклинной (Sм)
Линия равновесия моноклинная сера расплав отклонена от вертикали вправо
(сравните с фазовой диаграммой воды).
Это означает, что при кристаллизации
серы из расплава происходит уменьшение
объема
10








 chemistry
chemistry








