Similar presentations:
Физико- химические свойства белков
1.
Физико-химическиесвойства белков
преподаватель ПРЦ
Бейшебаева Ч.Р.
2.
Физико-химические свойства• Форма молекул
• Молекулярная масса
• Суммарный заряд молекулы
• Растворимость
• Осаждение (обратимое и
необратимое)
• Конформационная
лабильность (подвижность)
3.
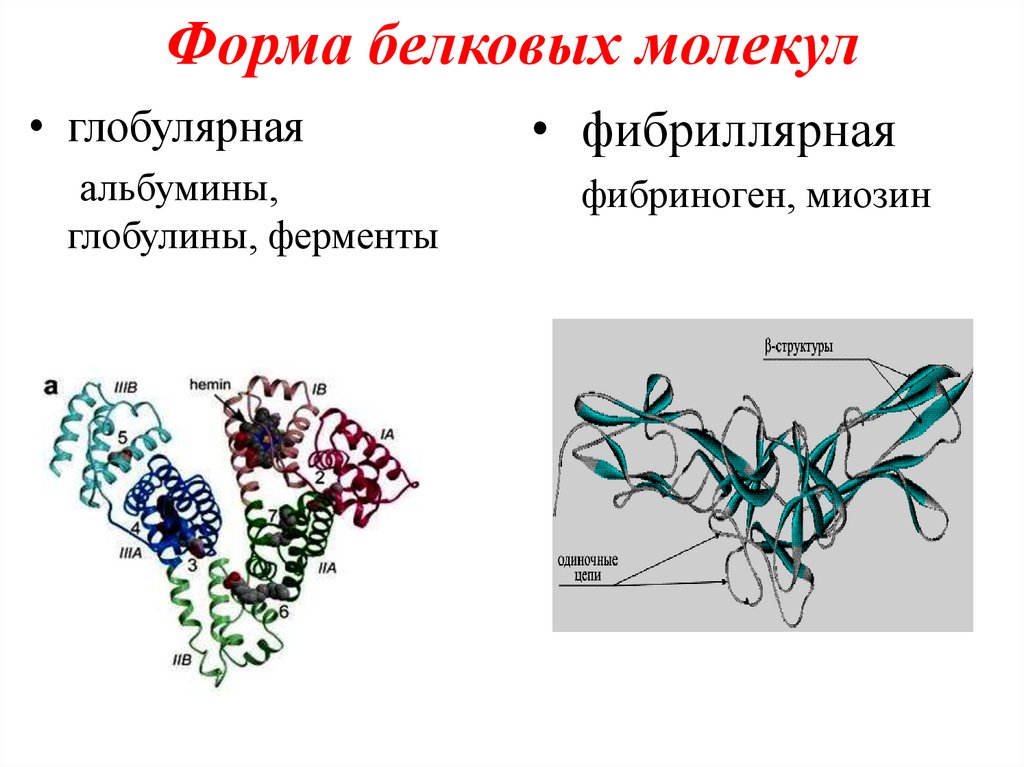
Форма белковых молекул• глобулярная
альбумины,
глобулины, ферменты
• фибриллярная
фибриноген, миозин
4.
Молекулярная массазависит от количества аминокислот и от
количества протомеров
Белки
Молекулярный вес
Миоглобин
Гемоглобин
Альбумины
Креатинкиназа MB
Лактатдегидрогеназа
Иммуноглобулин G
17 кДа
64 кДа
15-70 (65) кДа
87 кДа
144 кДа
150 кДа
5.
Суммарный заряд молекулызависит от:
• Соотношения положительно и
отрицательно заряженных групп
на поверхности белковой
молекулы
• pH среды
6.
По электрохимическим признакамбелки делятся на
кислые
основные
нейтральные
карбоксильных аминогрупп
групп больше,
больше, чем
чем аминогрупп карбоксильных
количество
аминогрупп равно
количеству
карбоксильных
Альбумины
Иммуноглобулины
pI = 4,7
Гистоны
pI = 9,5-12,0
pI = 7,0-7,3
7.
Растворимость зависит от:• Формы молекул
• Молекулярного веса
• Соотношения полярных и неполярных
групп на поверхности молекулы
• Заряда молекулы
• pH среды
• Температуры
8.
Гидратная оболочка9.
Свойства белковых растворовСходство с истинными
растворами
• Устойчивость
• Самопроизволь
ная хорошая
растворимость
Сходство с коллоидными
растворами
• Высокая вязкость
• Высокое онкотическое
давление
• Эффект
светорассеивания и
светопреломления
• Не способность к
диализу
10.
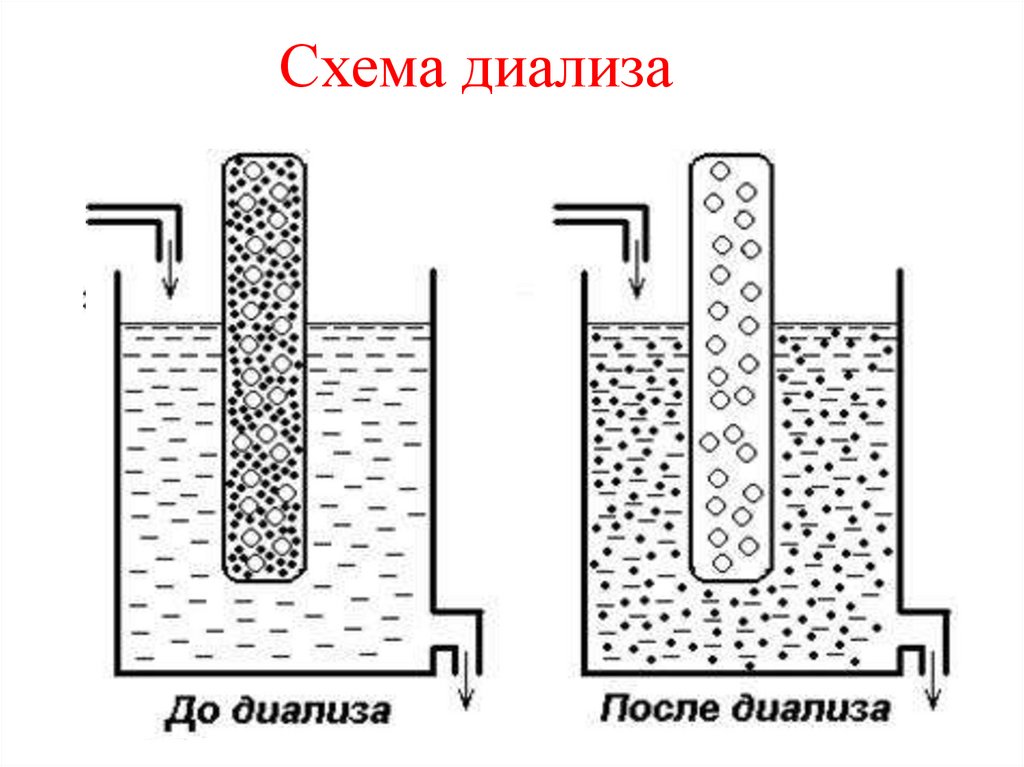
Диализ –удаление из растворов
высокомолекулярных
соединений примесей
низкомолекулярных веществ с
помощью полупроницаемых
мембран
11.
Схема диализа12.
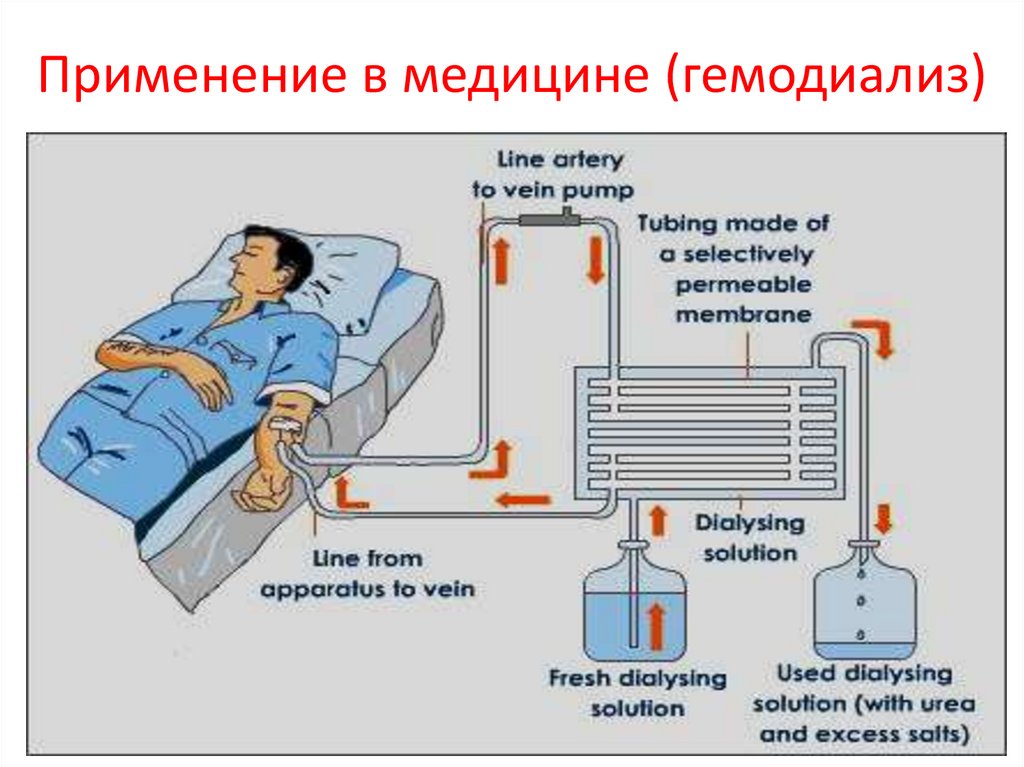
Применение в медицине (гемодиализ)13.
14.
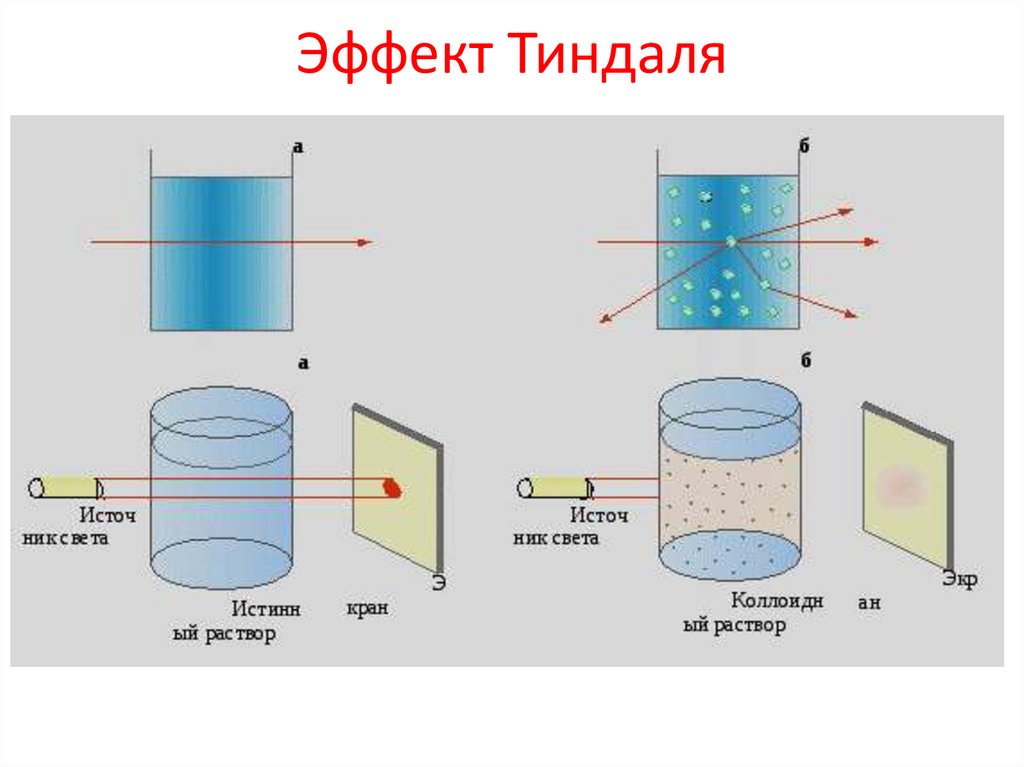
Эффект Тиндаля15.
16.
Использование эффекта Тиндаля• Нефелометрия — метод количественного
анализа, основанный на измерении
интенсивности света, рассеянного частицами
мутной среды. Мутные среды образуют
суспензии, эмульсии, коллоидные растворы.
Турбодиметрия - метод анализа, основанный
на измерении ослабления интенсивности
светового потока при прохождении его через
мутную среду.
17.
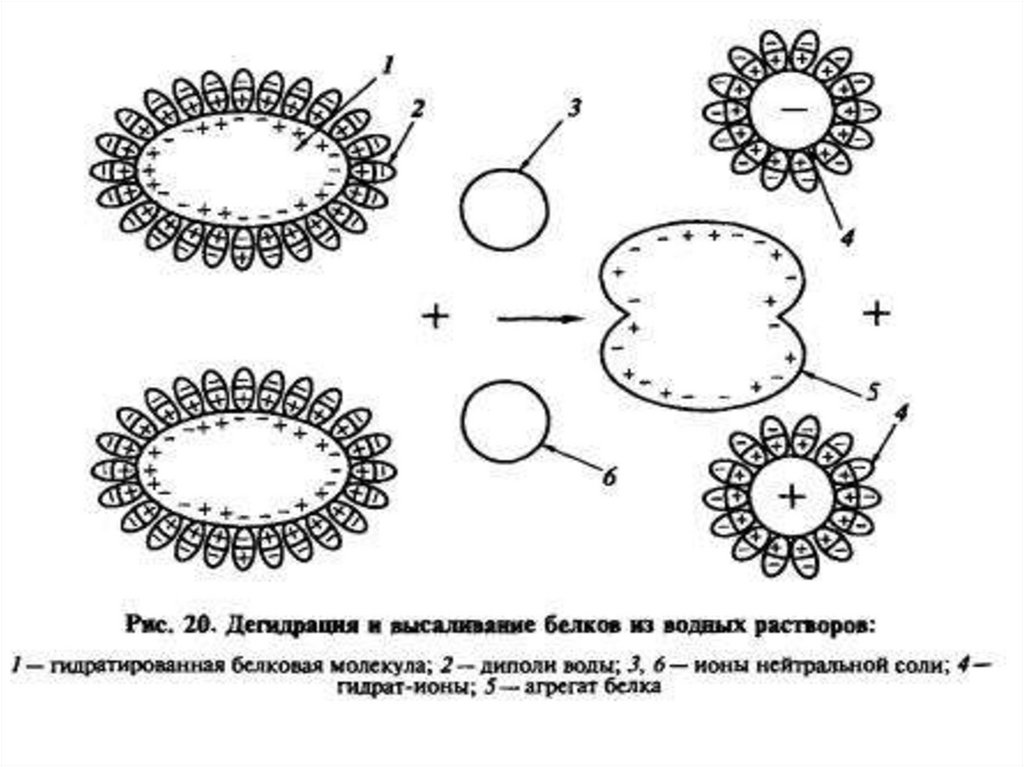
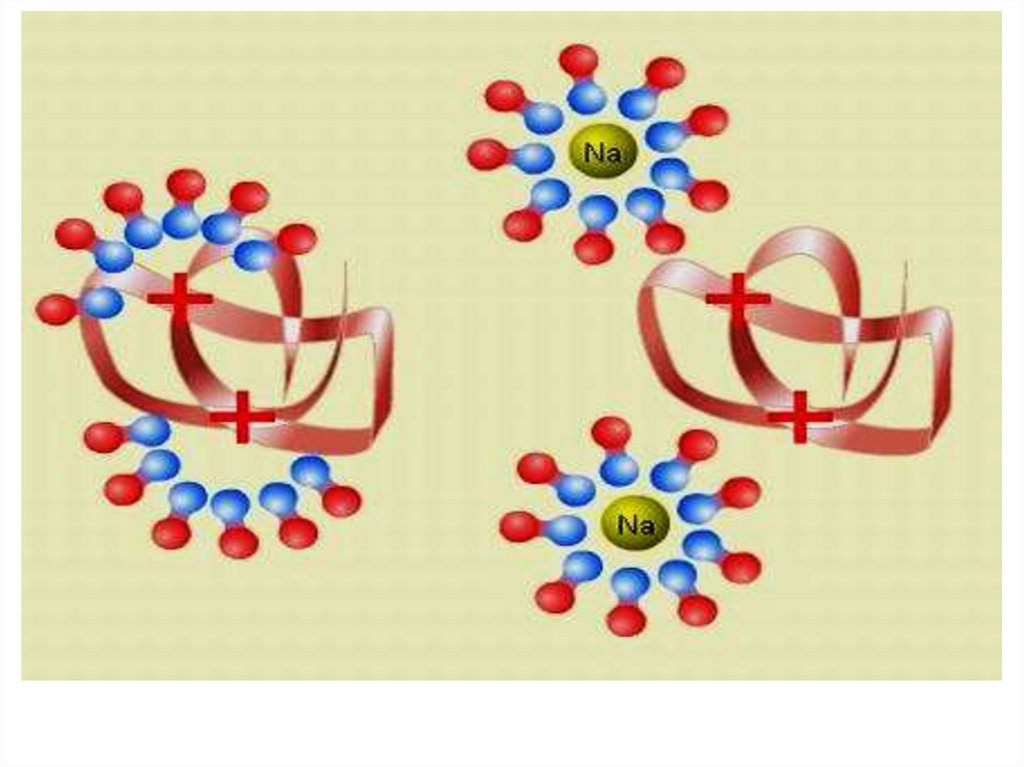
Высаливание –это процесс обратимого
осаждения белков под
действием
водоотнимающих факторов
18.
19.
20.
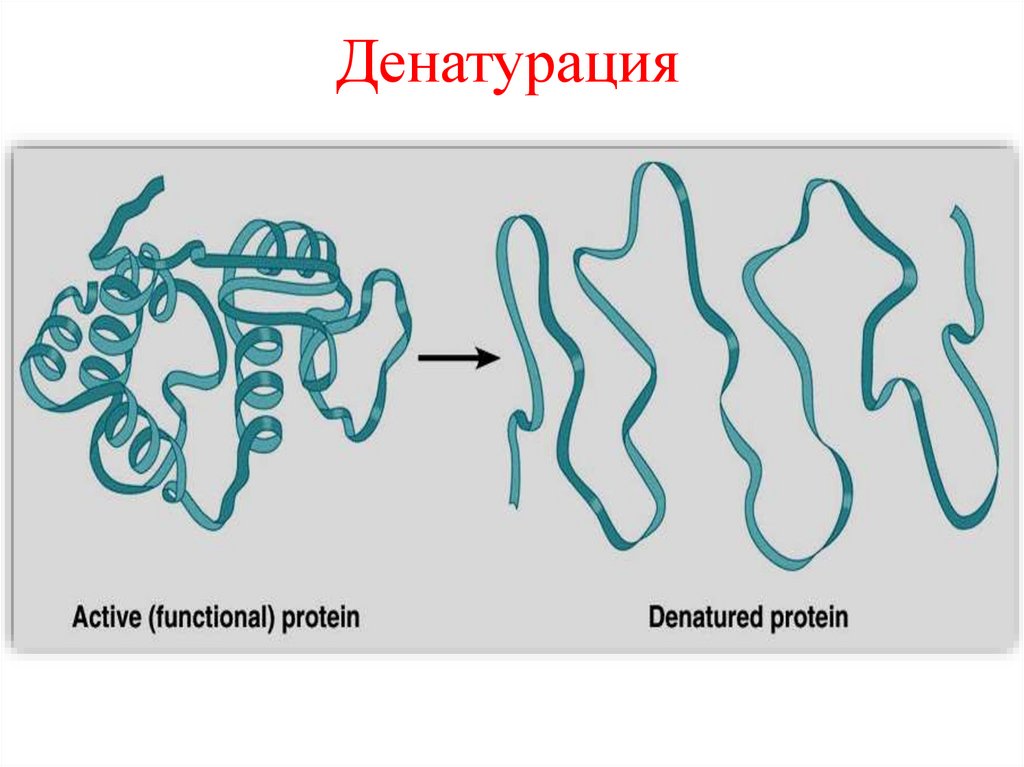
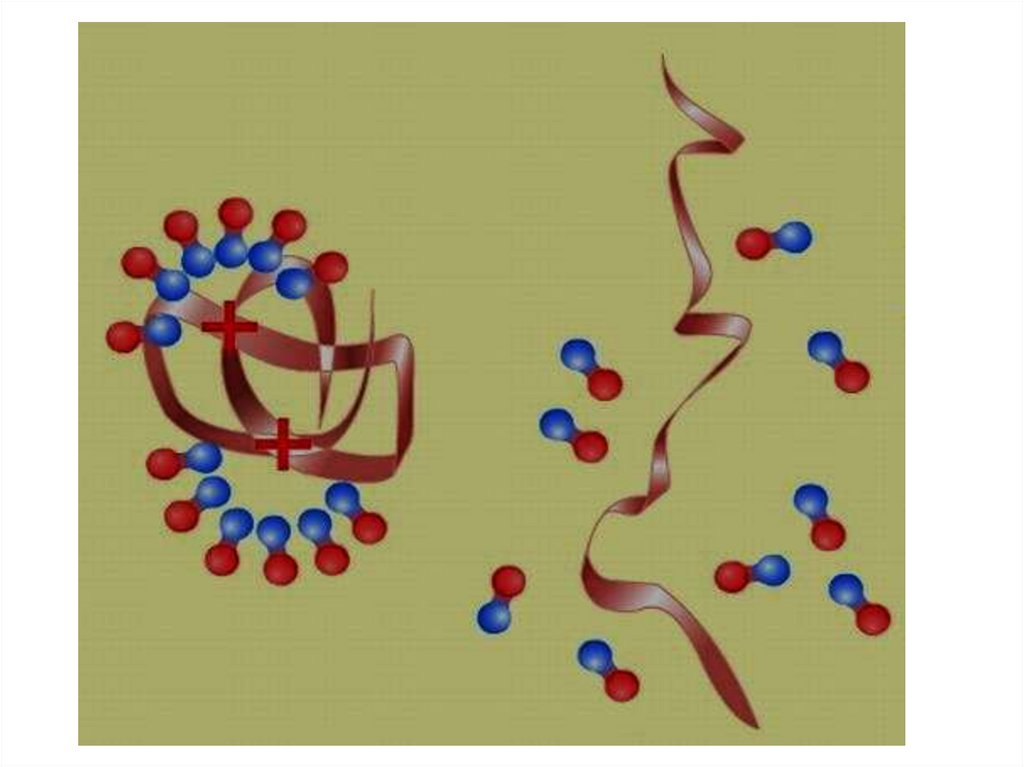
Денатурация это процесс разрушениянативной структуры белка
(четвертичной, третичной,
вторичной)
21.
Денатурация22.
23.
Факторы высаливания1. Cоли щелочных и
щелочноземельных металлов
2. Соли аммония
3. Ацетон
4. Спирт 70%
24.
Физические факторы денатурации1.Температура
2. Давление
3. Механические воздействия
(вибрация)
4.Ультразвуковые излучения
5.Ионизирующие излучения
25.
Химические факторы денатурации1. Кислоты и щелочи
2. Органические растворители
(фенол, крезол)
3. Детергенты
4. Соли тяжелых металлов
5. Окислители
26.
Применение в медициневысаливание
денатурация
1.Приготовление
1. Асептика и антисептика
кристаллических
2. Пастеризация
белковых препаратов, 3. Стерилизация
хранение плазмы в
4. Лечение доброкачественных
сухом виде
опухолей
2.Разделение белковых 5. Удаление белков из
фракций
биологических жидкостей
для определения
низкомолекулярных
соединений
27.
Методы разделения белков1. Фракционное высаливание
2. Ультрацентрифугирование
3. Хроматография
4. Гель-фильтрация
5. Электрофорез
6. Изоэлектрофокусирование
28.
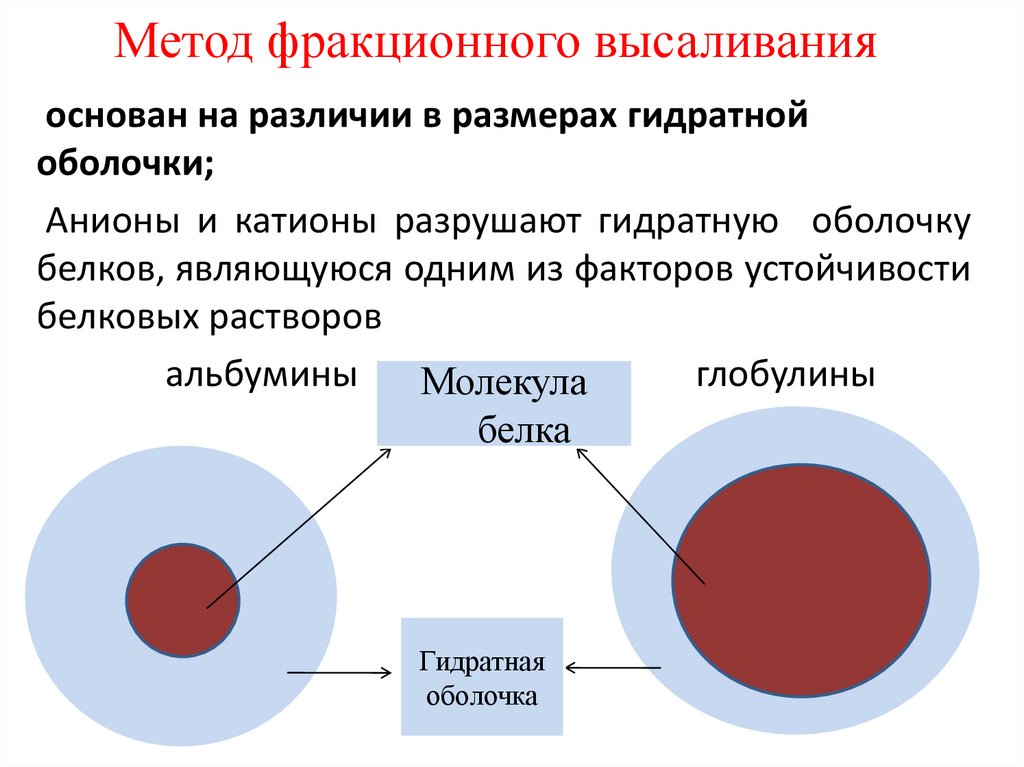
Метод фракционного высаливанияоснован на различии в размерах гидратной
оболочки;
Анионы и катионы разрушают гидратную оболочку
белков, являющуюся одним из факторов устойчивости
белковых растворов
альбумины
глобулины
Молекула
белка
Гидратная
оболочка
29.
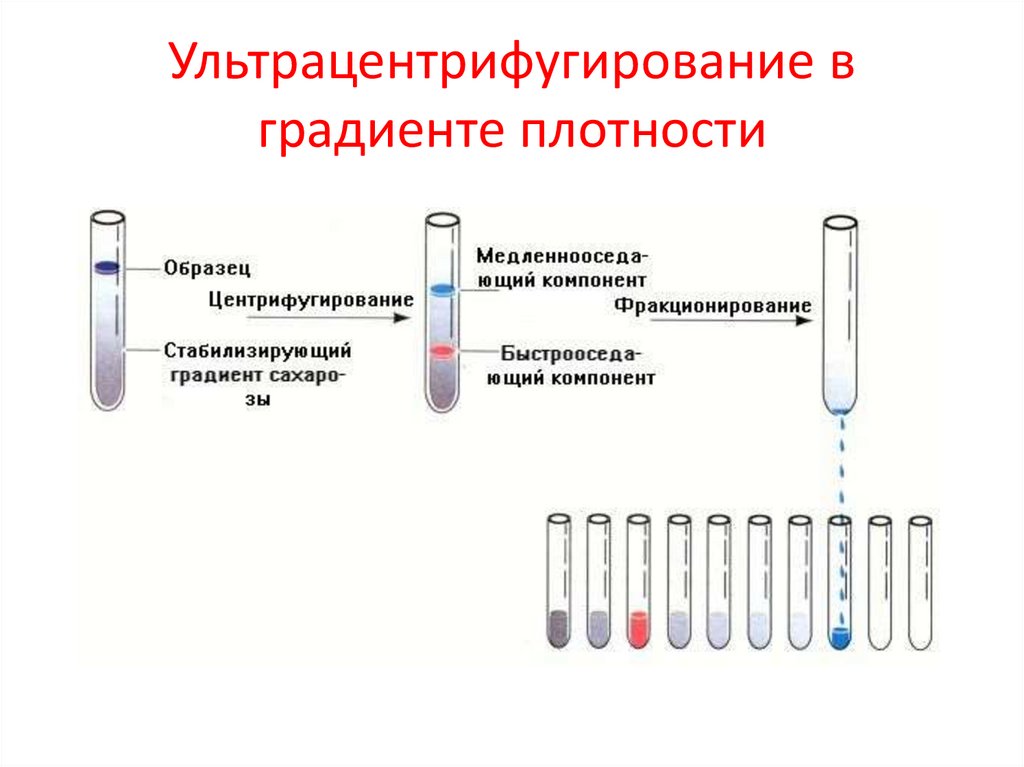
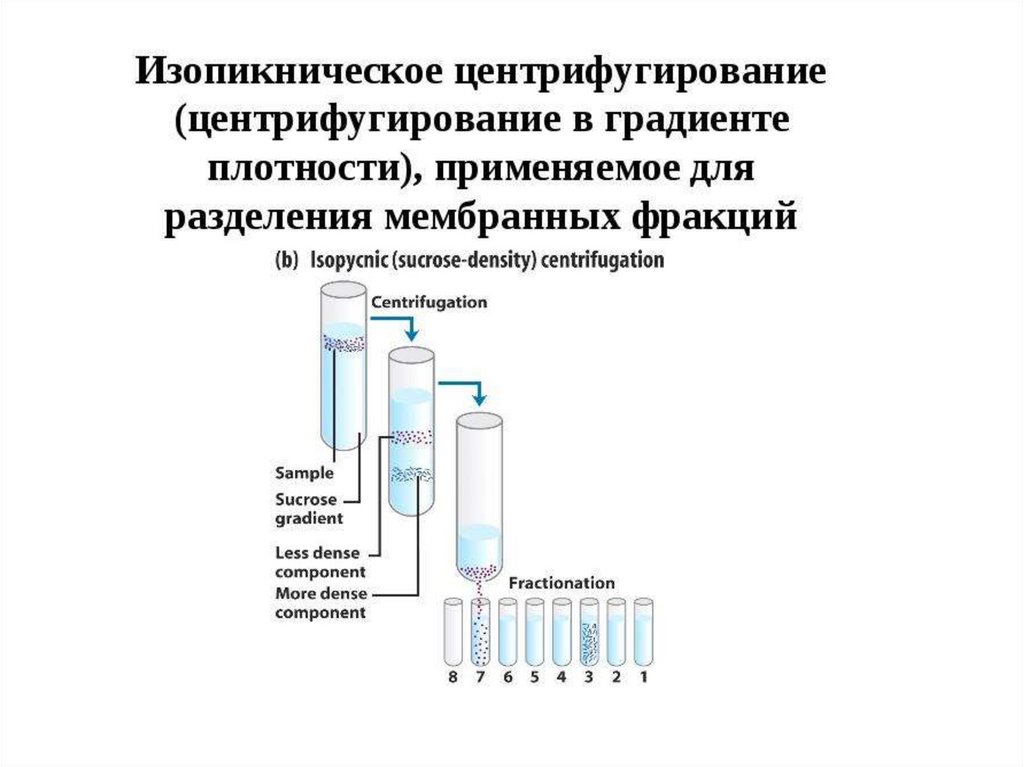
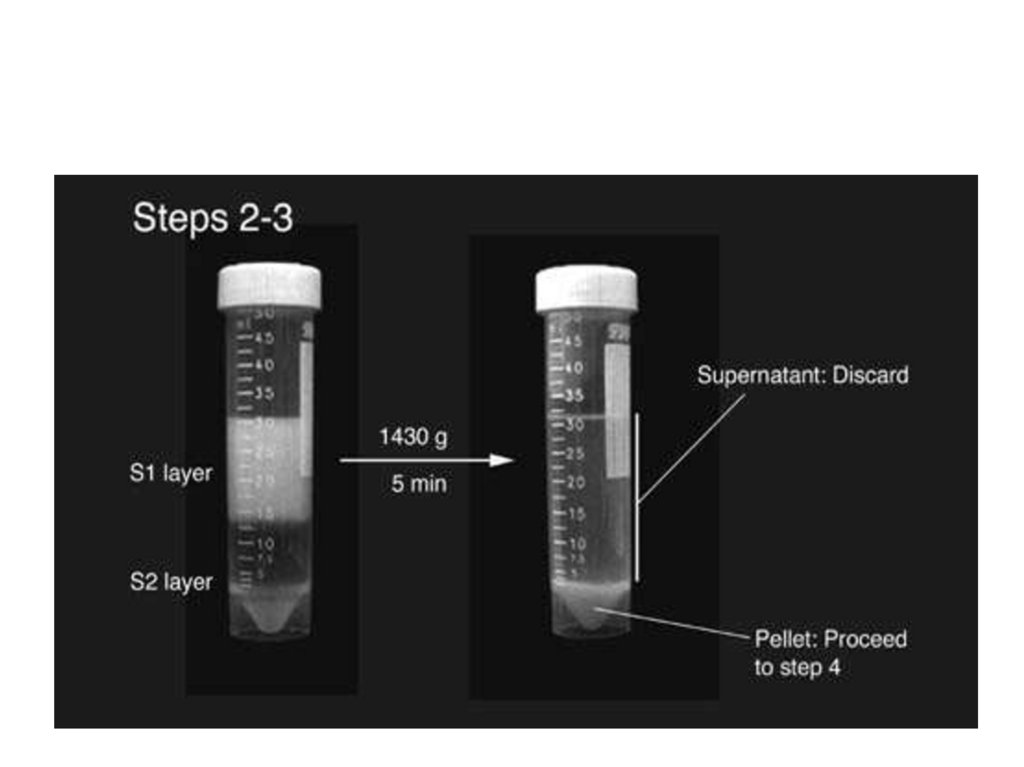
УльтрацентрифугированиеМетод разделения белков, основанный на
различии в молекулярных массах
Виды ультрацентрифугирования:
1.Дифференциальное: этот вид основан на
многоэтапном изменении скорости и времени.
2.Зональноскоростное: проводиться в один этап,
требуется длительное время (до 24 часов),
белки разделяются одномоментно в градиенте
плотности
30.
Угловые роторы31.
Бакет-роторы32.
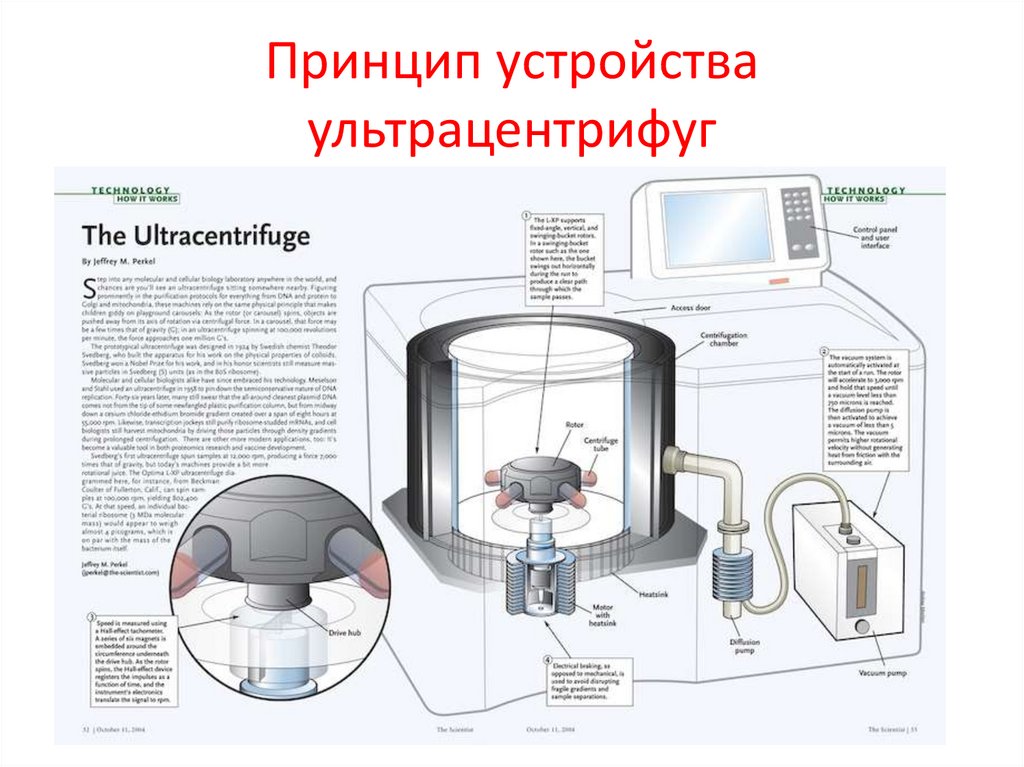
Принцип устройстваультрацентрифуг
33.
Зональноскоростное34.
Ультрацентрифугирование вградиенте плотности
35.
36.
37.
Центрифуги38.
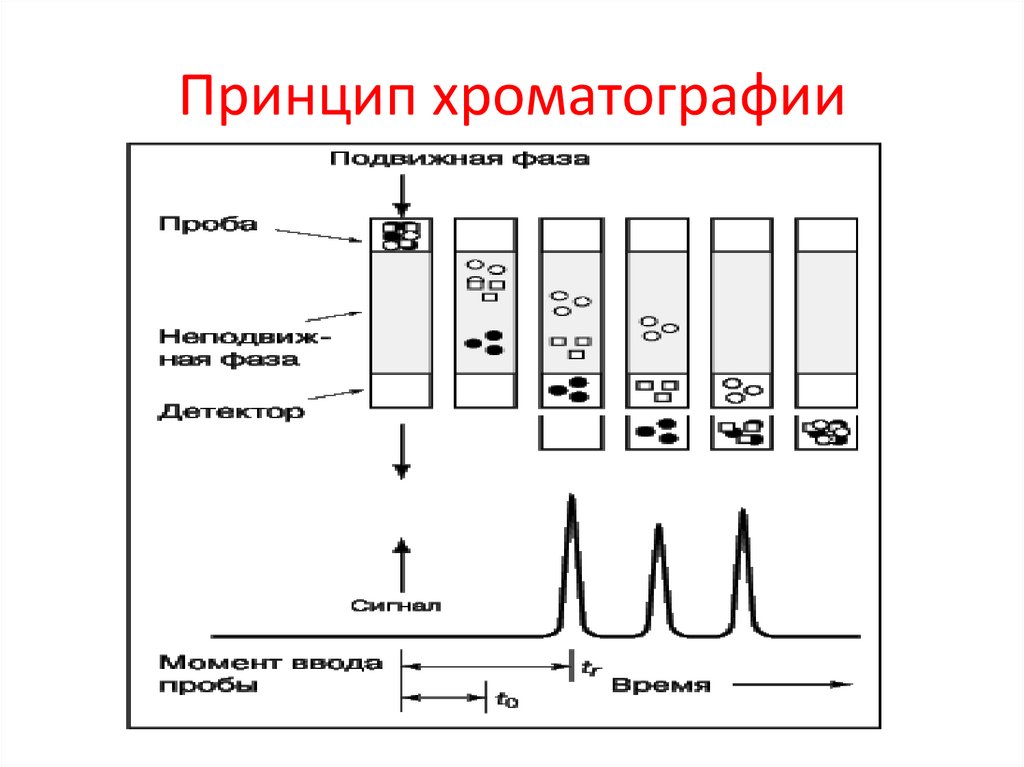
ХроматографияБелки разделяются,
распределяясь между
подвижной и неподвижной фазой, при этом
подвижная
фаза
перемещается
через
неподвижную.
Типы хроматографии:
• Адсорбционная
• Распределительная
• Ионообменная
• Аффинная
• Гель-хроматография
39.
Принцип хроматографии40.
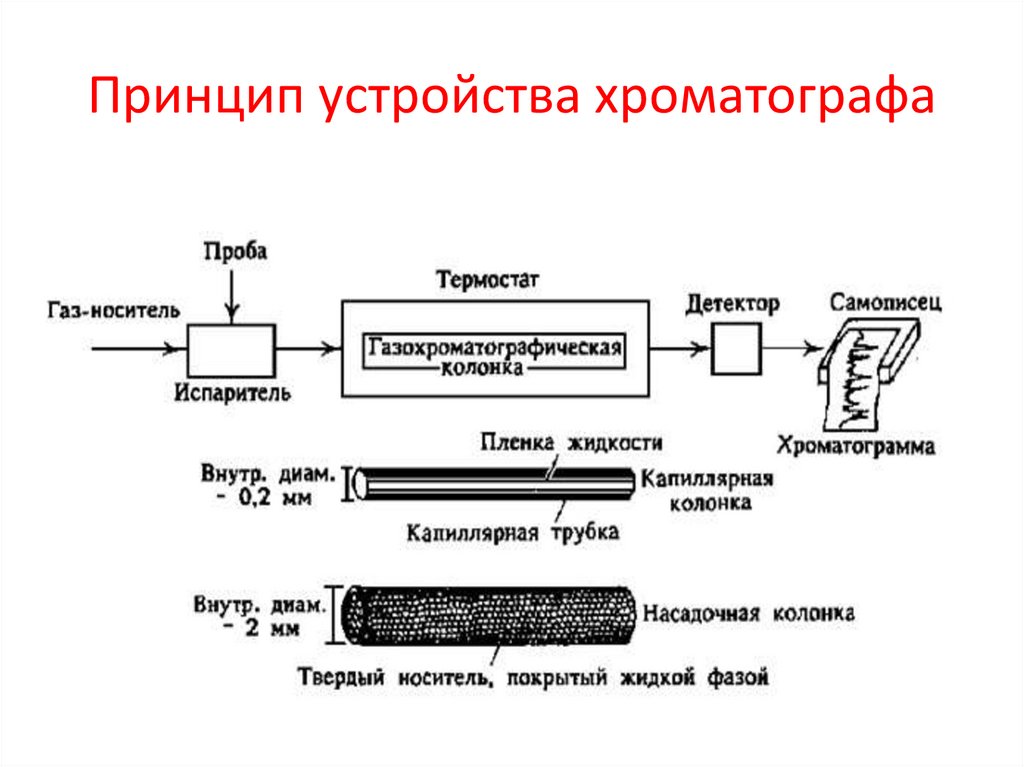
Принцип устройства хроматографа41.
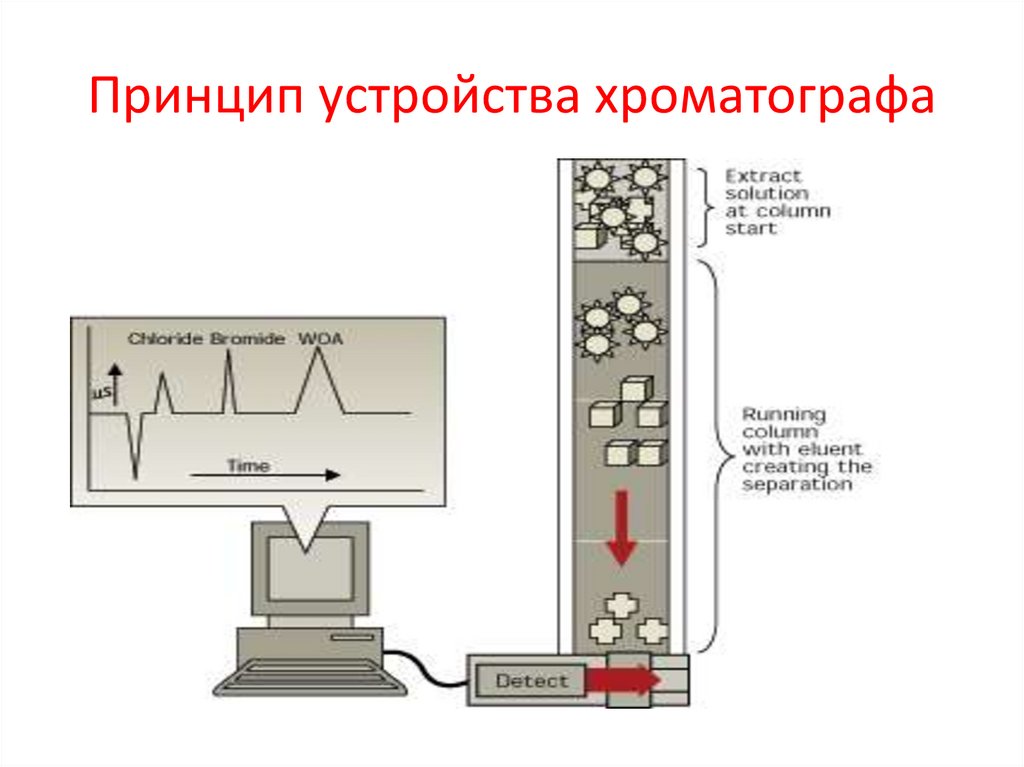
Принцип устройства хроматографа42.
АдсорбционнаяРазделение компонентов смеси, основанное на их
различной сорбируемости на твердом адсорбенте
Распределительная
Метод разделение белка за счет различной
полярности.
43.
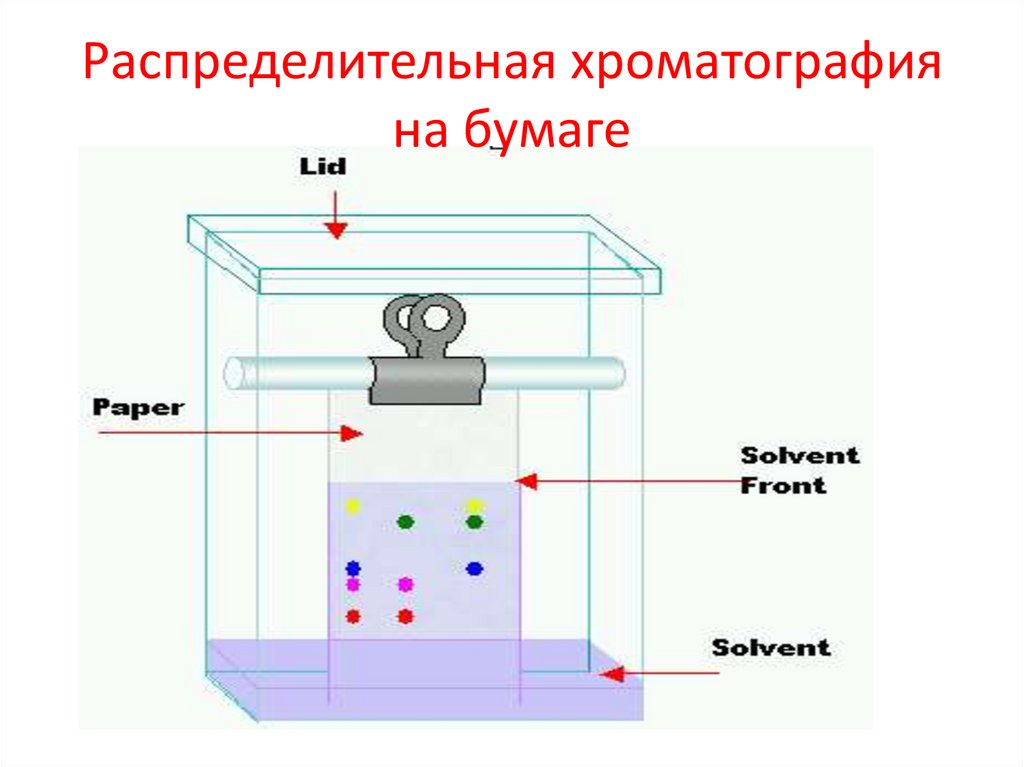
Распределительная хроматографияна бумаге
44.
Распределительная хроматографияна бумаге
45.
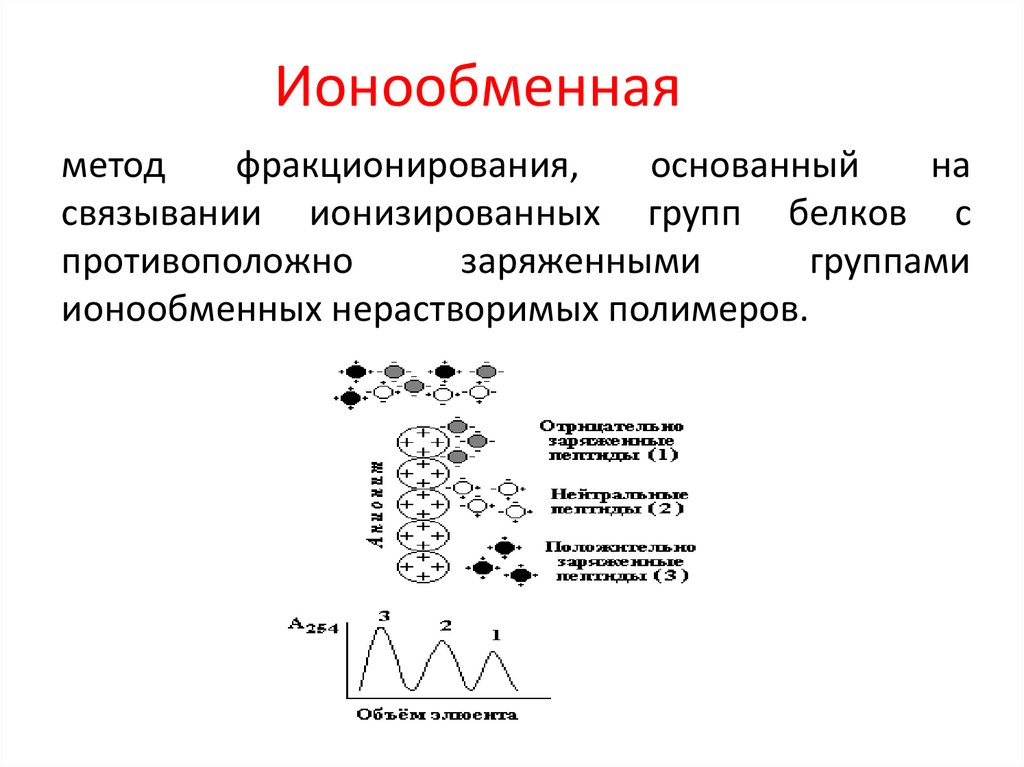
Ионообменнаяметод
фракционирования,
основанный
на
связывании ионизированных групп белков с
противоположно
заряженными
группами
ионообменных нерастворимых полимеров.
46.
47.
Гель-фильтрация48.
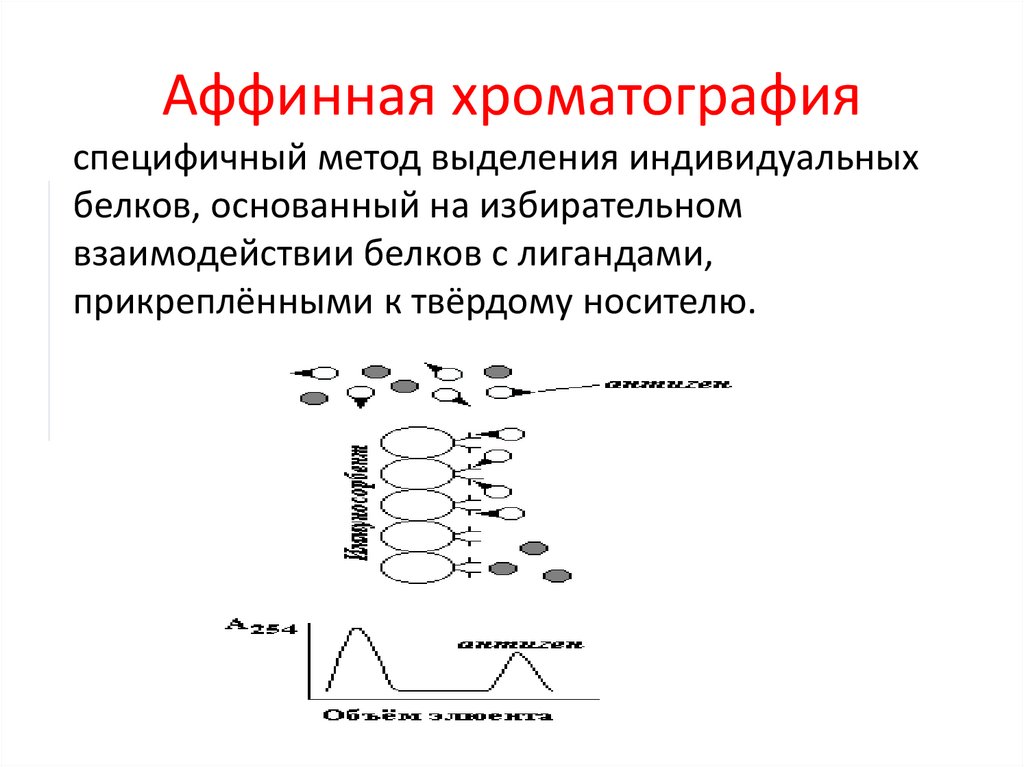
Аффинная хроматографияспецифичный метод выделения индивидуальных
белков, основанный на избирательном
взаимодействии белков с лигандами,
прикреплёнными к твёрдому носителю.
49.
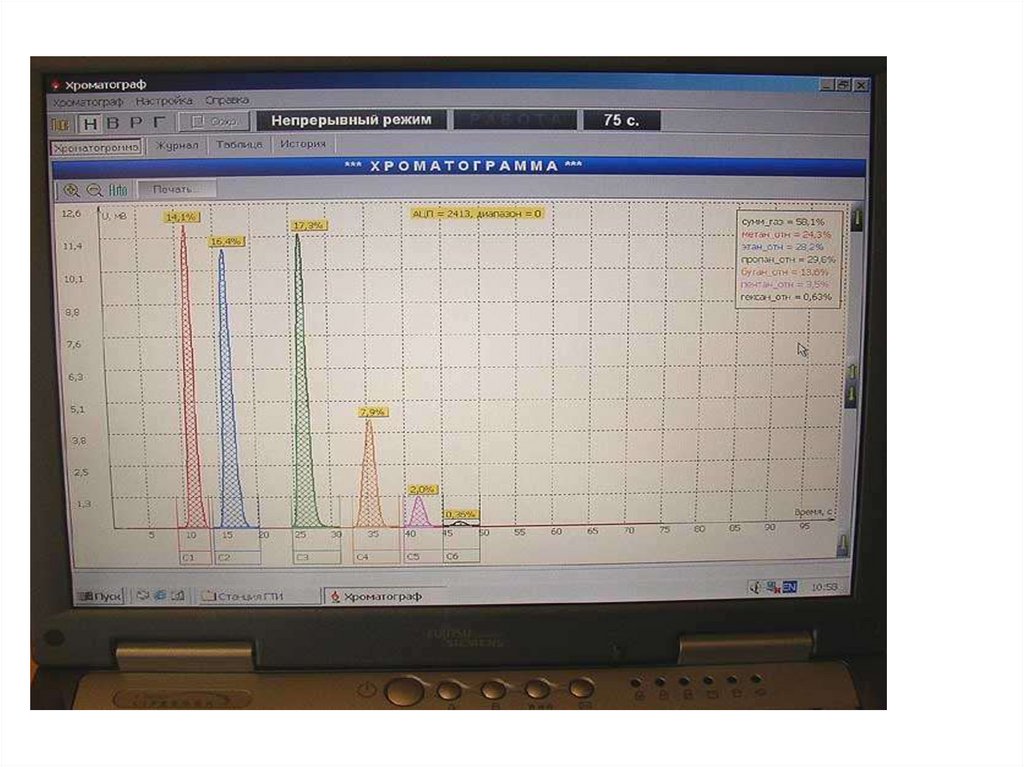
Хроматографы50.
51.
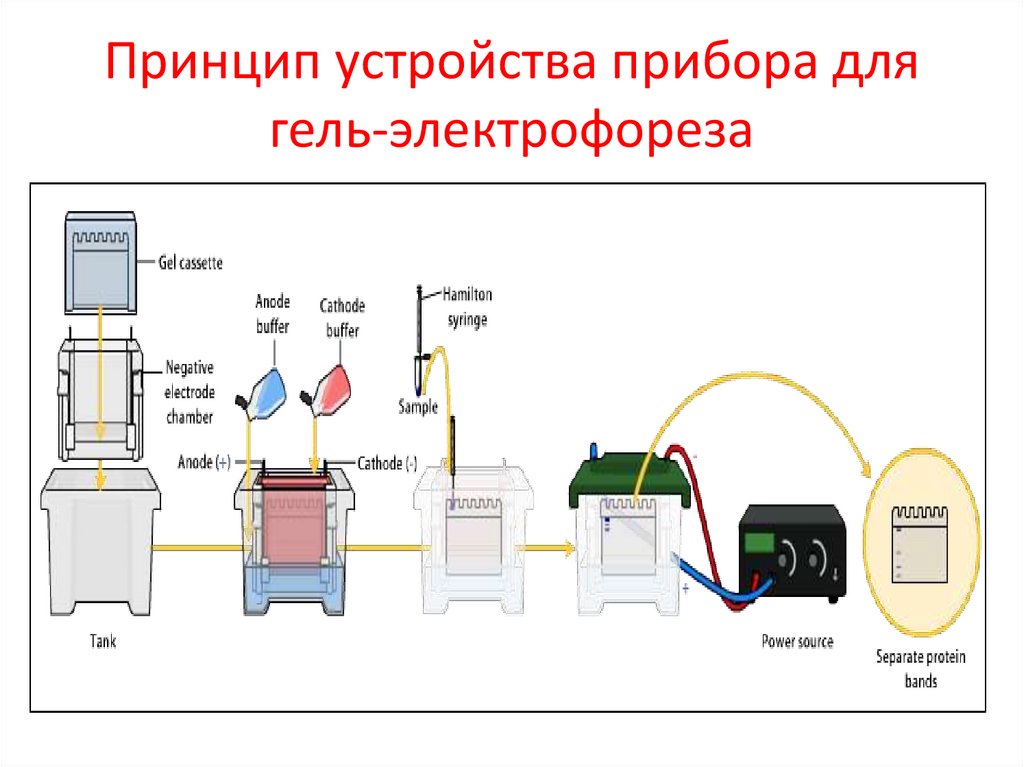
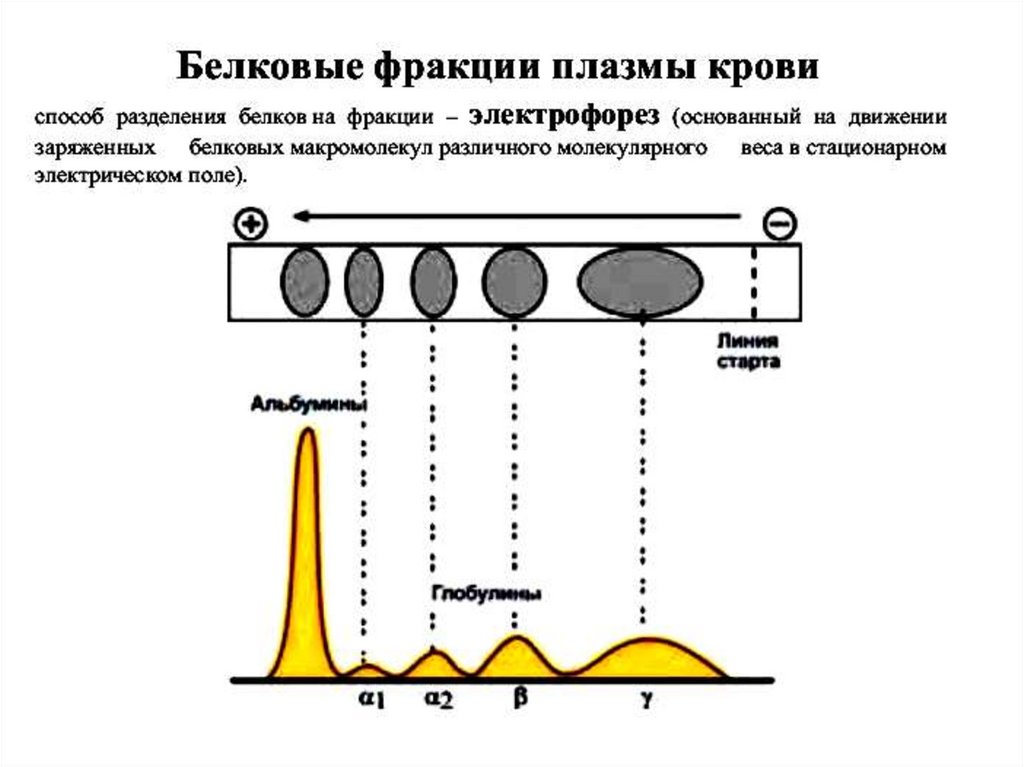
Электрофорез белковМетод основан на том, что при определённом
значении рН и ионной силы раствора белки
двигаются в электрическом поле со скоростью,
пропорциональной их суммарному заряду.
52.
Скорость движения частиц вэлектрическом поле зависит от:
1.Величины суммарного заряда
2.Размеры и формы частиц
3.Силы электрического тока и
напряжения
4.Свойств носителя, на котором проводят
раздельно
5. pH буферного раствора
6.Температуры
53.
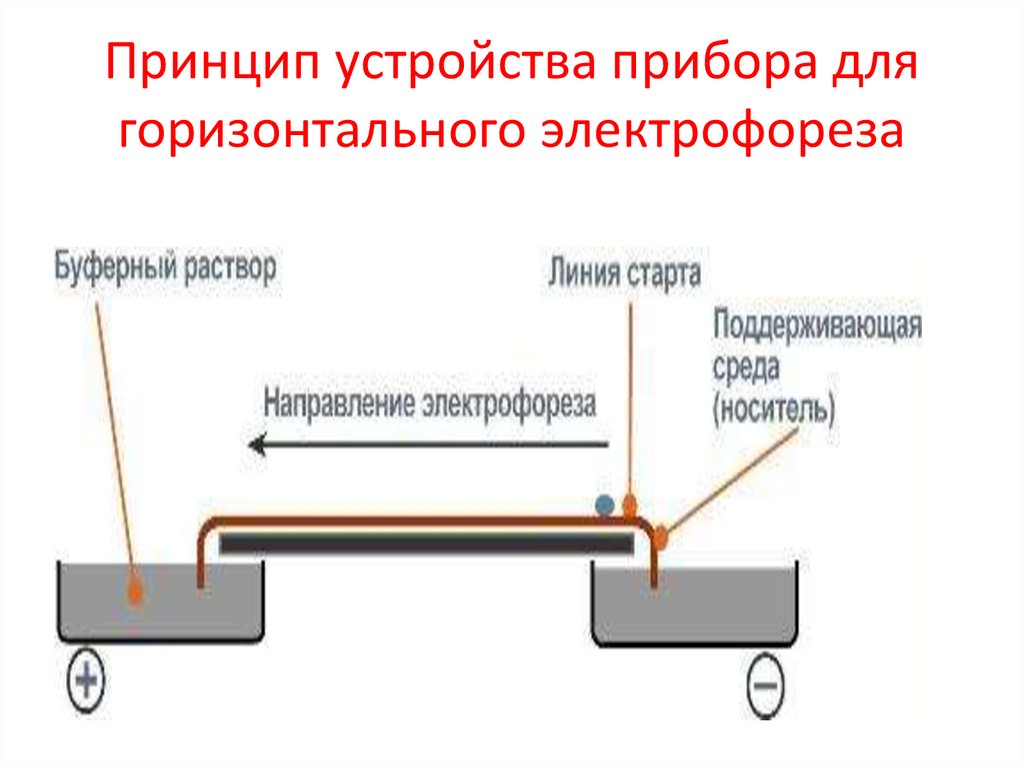
Принцип устройства прибора длягоризонтального электрофореза
54.
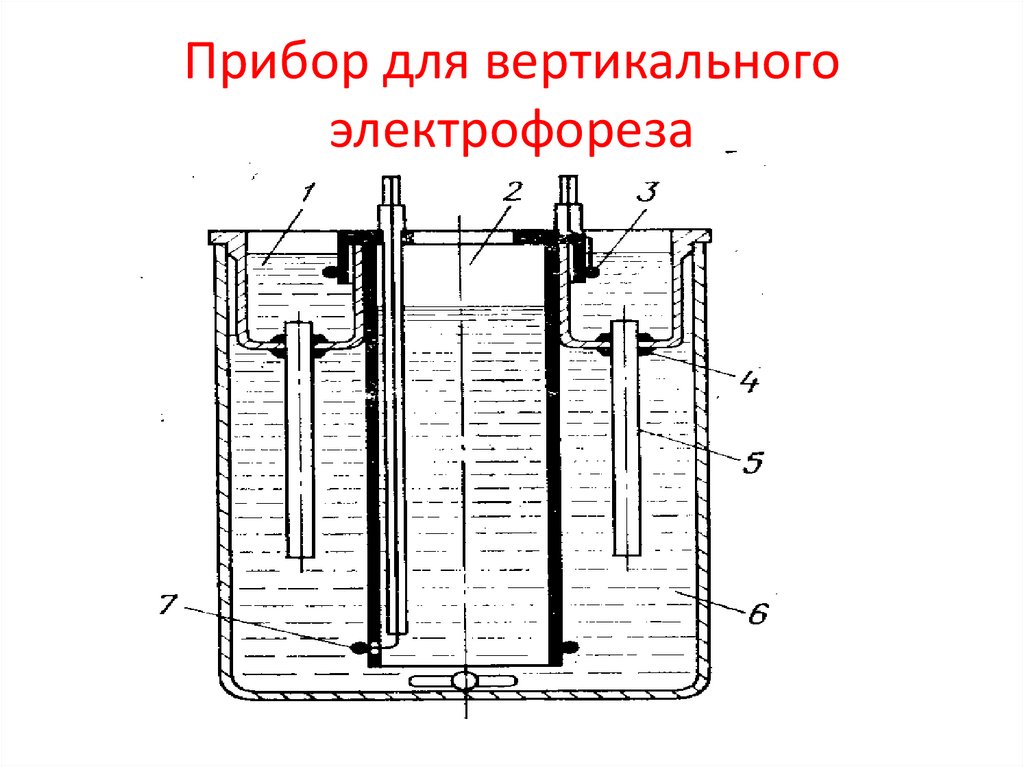
Прибор для вертикальногоэлектрофореза
55.
Камеры для электрофореза56.
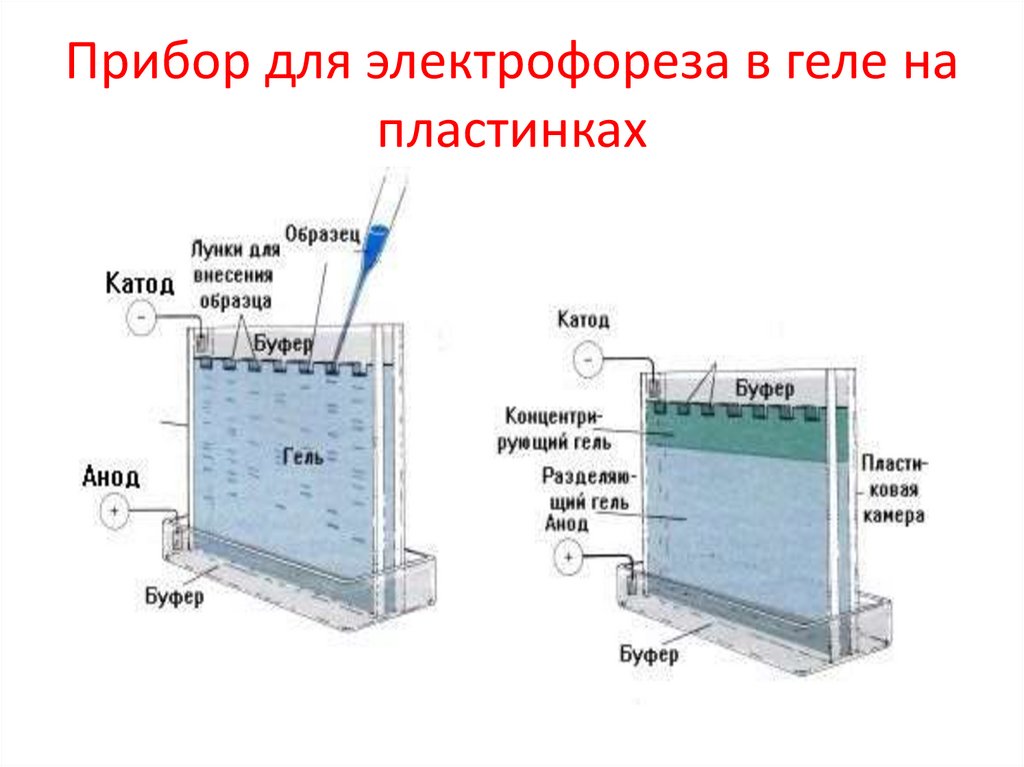
Прибор для электрофореза в геле напластинках
57.
Гель-электрофорез58.
Принцип устройства прибора длягель-электрофореза
59.
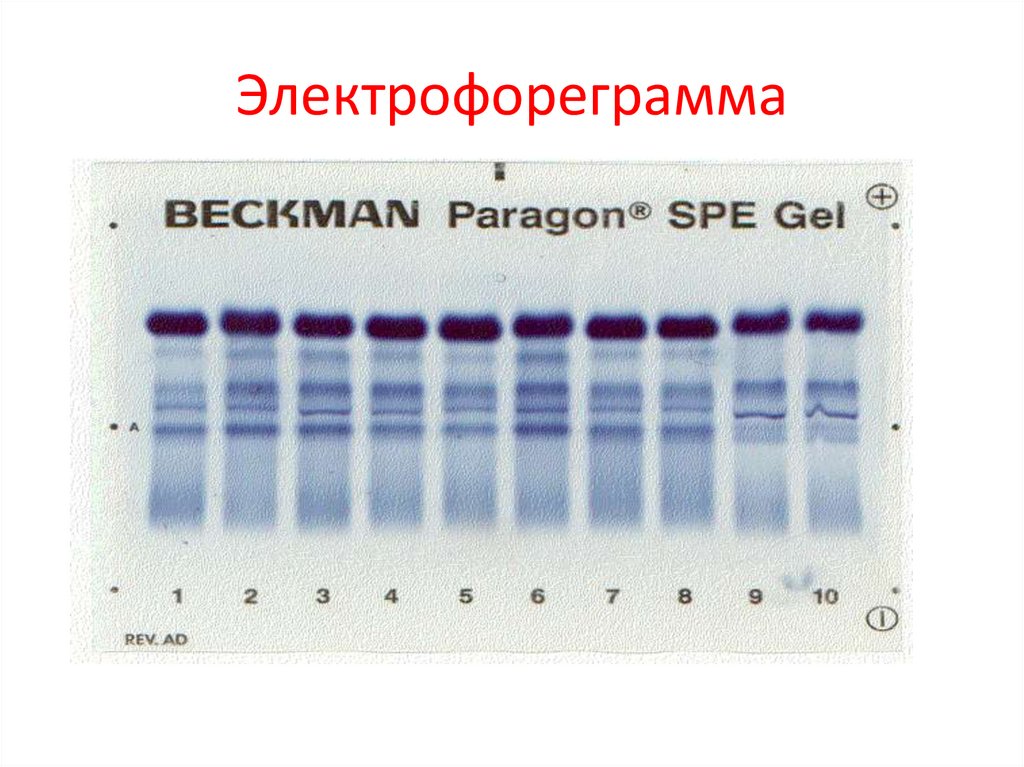
Электрофореграмма60.
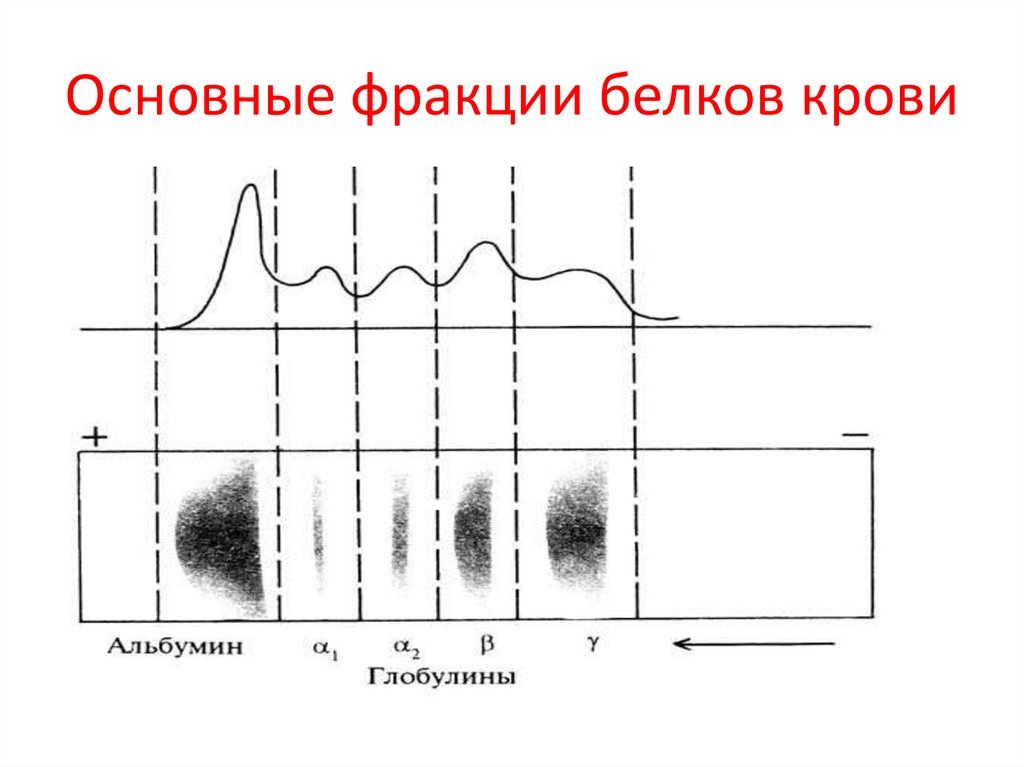
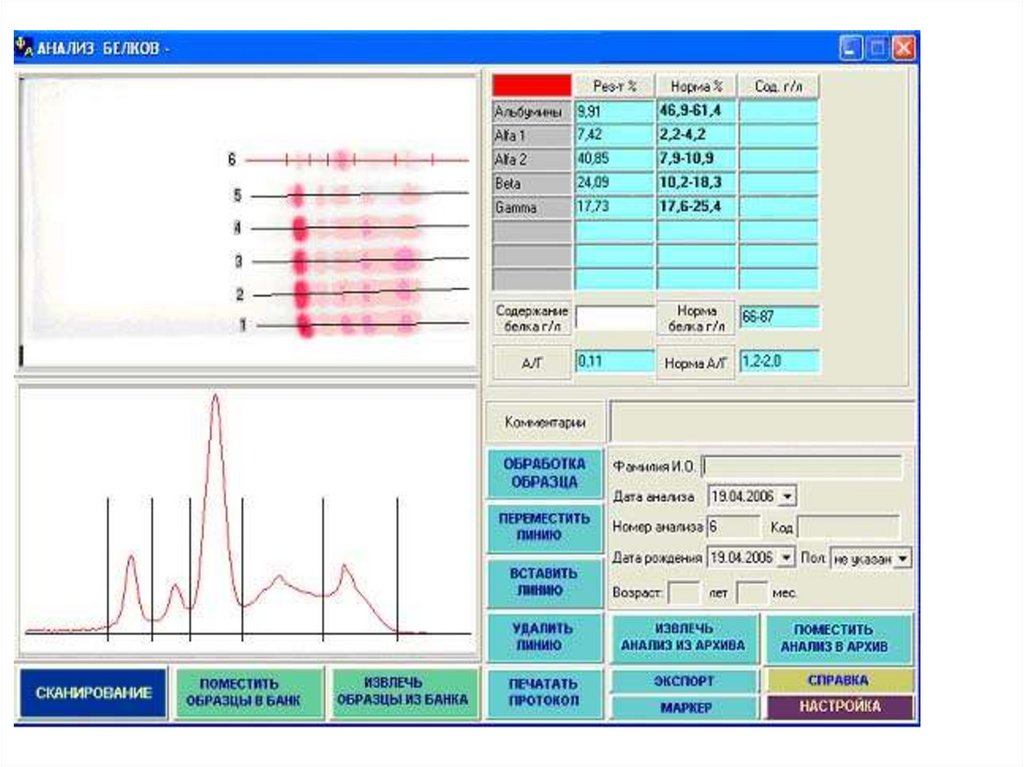
Основные фракции белков крови61.
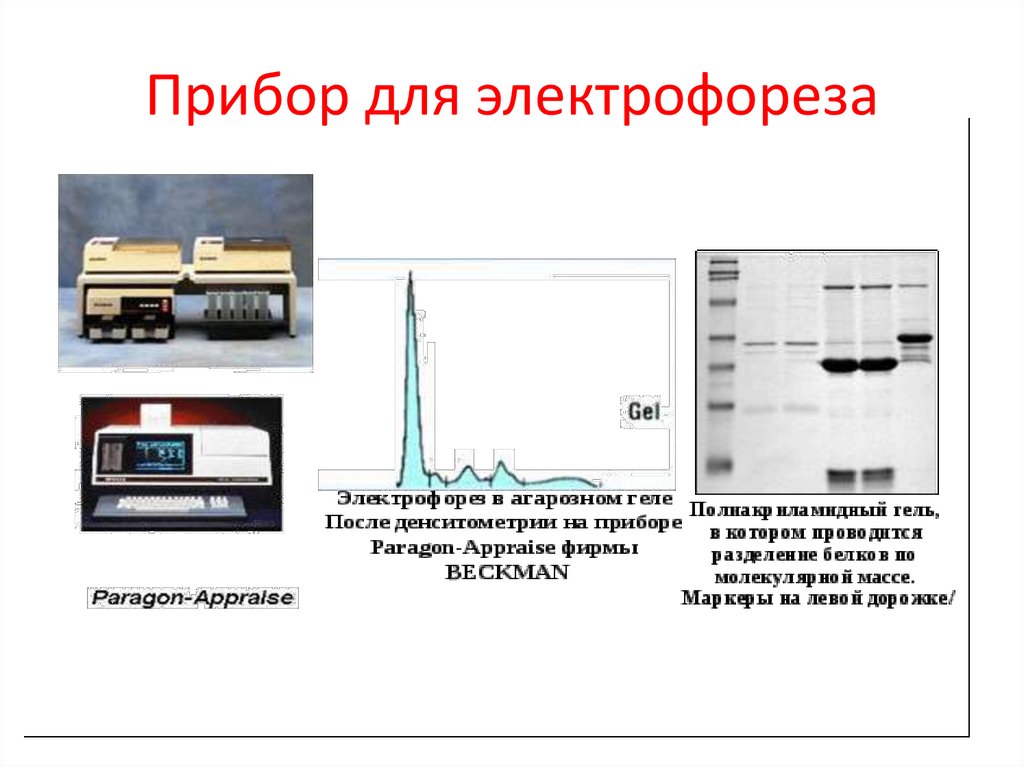
Прибор для электрофореза62.
63.
64.
Примеры электрофореграмм внорме и при патологии


































 biology
biology








