Similar presentations:
Физико-химические свойства белков
1.
СЗГМУ им. И.И.МЕЧНИКОВАКАФЕДРА КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ,
БИОЛОГИЧЕСКОЙ И ОБЩЕЙ ХИМИИ им. В.В. СОКОЛОВСКОГО
БИОЛОГИЧЕСКАЯ ХИМИЯ - БИОХИМИЯ ПОЛОСТИ РТА
РАЗДЕЛ 1
ЛК-2
ЛЕКЦИЯ
ФИЗИКО-ХИМИЧЕСКИЕ
СВОЙСТВА БЕЛКОВ
Доцент Антонова Ж.В.
2023 / 2024 уч. год
1
2.
ПЛАН ЛЕКЦИИI. Физико-химические свойства белков (молекулярная масса, форма молекул,
амфотерность, электрофоретическая подвижность; растворимость в воде и
механизм образования гидратной оболочки).
II. Свойства белковых растворов, как растворов ВМС биополимеров
(признаки истинных растворов и коллоидных систем; турбидиметрия, нефелометрия).
III. Факторы, влияющие на растворимость белков.
ЛК-2
IV. Обратимое осаждение белков - высаливание
(высаливающие агенты и механизм их действия).
V. Необратимое осаждение белков - денатурация
(денатурирующие агенты и механизм их действия).
VI. Прилож. Использование явления денатурации в стоматологии.
VII. Методы разделения и очистки белков (диализ, фракц.высаливание,
ультрацентрифугирование, электрофорез, гель-фильтрация, ионообменная
хроматография, афинная хроматография).
VIII. Список литературы.
2
3.
I. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ1. Белки – ВМС, биополимеры-(от 6000-1000000Д и выше)
2. По форме молекулы белки делятся на
фибриллярные и глобулярные.
3. Белки – амфотерные полиэлектролиты.
По суммарному заряду
ЛК-2
(соотношению анионных и катионных групп аминокислот):
кислые, основные и нейтральные.
Амфотерность лежит в основе проявления буферных свойств
(белковая буферная система).
4. Белки обладают электрофоретической
3
подвижностью.
4.
I. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ5. Многие белки могут растворяться в воде.
По растворимости в воде белки разделяются на растворимые
(глобулярные: альбумины, глобулины и др.) и нерастворимые
(фибриллярные: коллаген, эластин, кератин и др.)
ЛК-2
В водной среде, при формировании глобулы, большинство полярных и
ионизированных групп АК располагаются на поверхности глобулы, а
гидрофобные радикалы АК преимущественно локализуются внутри
молекулы, формируя там гидрофобные связи м/у участками
полипептидных цепей.
Ионизированные и полярные группы АК на поверхности белковой глобулы
электростатически взаимодействуют с диполями воды, что приводит к
формированию гидратных оболочек вокруг молекул белков, т. е.
образованию белкового раствора, р-ра ВМС, с особыми свойствами.
(Рис.1.)
4
5.
РИС. 1. МЕХАНИЗМ РАСТВОРЕНИЯ БЕЛКОВ В ВОДЕCOO-
COO-
+NН3
HO
Рис.1
NH3+
COO+H3N
О-Н
Гидратная
оболочка
препятствует
объединению
белковых
молекул м/у
собой.
БЕЛОК
OH
- OOC
NH3+
Диполь воды
δ+
COO-
δ-
CONH2
COO-
5
6.
II. Свойства белковых растворовВодные растворы белков (р-ры ВМС биополимеров) обладают свойствами как
истинных молекулярных растворов,
так и коллоидных систем (молекулярные коллоиды),
так как размеры белков соизмеримы с размерами
коллоидных частиц (1-100 нм).
ЛК-2
а) свойства истинных растворов
самопроизвольность образования раствора,
что сопровождается уменьшением свободной энергии Гиббса (∆G<0)
термодинамическая устойчивость
молекулярная дисперсность
гомогенность
6
7.
б) свойства коллоидных растворовнеспособность молекул белков, как ВМС,
диффундировать через полупроницаемые
искусственные или биологические
мембраны
ЛК- 2
низкое осмотическое давление (Р осм)
высокое онкотическое давление (Р онк)
высокая вязкость
способность к набуханию
малые скорости диффузии молекул
7
8.
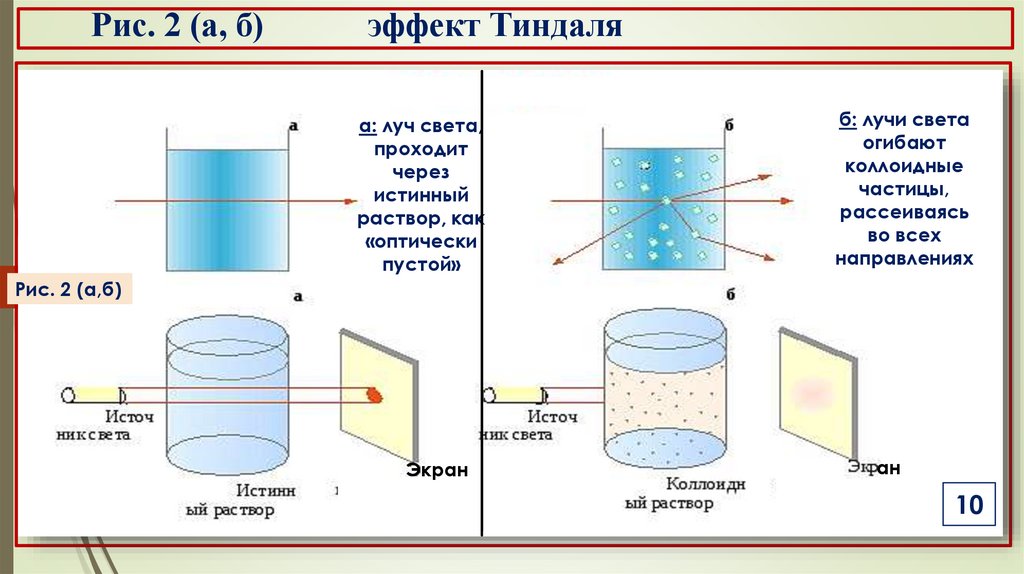
б) свойства коллоидных растворовоптические свойства
а) эффект Тиндаля проявляется в виде опалесценции, в
результате рассеяния света на коллоидных частицах за
счёт дифракции (Рис. 2).
Наблюдается в виде светящегося конуса, видимого на
ЛК-2
тёмном фоне (Рис. 3).
Используется для количественного определения белка методом
нефелометрии (по интенсивности рассеянного света).
б) поглощение УФ - лучей (λ= 280 нм).
Используется для количественного определения белков
спектрофотометрическим методом.
Оптические свойства также используются в турбидиметрии (метод
8
количественного определения белка, основанный на измерении
интенсивности света, прошедшего через кювету с коллоидным раствором).
9.
б) свойства коллоидных растворовЛК-2
Так как турбидиметрия и нефелометрия основаны на
регистрации проходящего или рассеянного света через
мутные растворы, то использование света
монохроматических лазерных источников значительно
повышают чувствительность этих методов анализа.
Лазерная нефелометрия применяется для определения
белков в низкой концентрации.
В слюне нефелометрическим методом определят
содержание лизоцима, а с помощью турбидиметрии –
содержание иммуноглобулинов.
Нефелометрия и турбидиметрия – это основные методы
для определения с высокой точностью в крови:
содержания белков острой фазы
концентрации IgG, IgA, IgM,
подклассов IgG и других сывороточных белков.
9
10.
Рис. 2 (а, б)эффект Тиндаля
а: луч света,
проходит
через
истинный
раствор, как
«оптически
пустой»
б: лучи света
огибают
коллоидные
частицы,
рассеиваясь
во всех
направлениях
Рис. 2 (а,б)
Экран
ан
10
11.
Рис. 3Эффект Джона Тиндаля /конус Тиндаля
Рис.3
11
12.
III. Факторы, влияющие на растворимость белков в водерН раствора, в котором находится белок;
Задание: 1) написать на доске / в тетради схемы ионизации кислых
белков крови при различных рН среды;
2) При каких значениях рН среды заряд данной
молекулы максимален? Какова ее растворимость?
3) В каком диапозоне рН среды лежит ИЭТ для
ЛК-2
кислых белков крови? Какова их растворимость в ИЭТ?
Значение рН среды, при котором суммарный заряд молекулы
равен нулю, называется изоэлектрической точкой (ИЭТ, или рНi , pI).
* В условиях ИЭТ степень гидратации, набухания и вязкость растворов
белков становятся минимальными, растворимость белка в воде снижается,
он может выпадать в осадок. В ИЭТ белки теряют электрофоретическую
подвижность.
** Для любого белка существует оптимальная величина рН, при которой
он имеет стабильную структуру и физиологическую активность.
12
13.
III. Факторы, влияющие на растворимость белков в водемолекулярная масса белков;
форма молекулы;
величина суммарного заряда;
ЛК-2
соотношение полярных и неполярных групп на
поверхности белка;
состав растворителя;
Например: альбумины растворимы в дистиллированной воде,
а глобулины растворяются лишь в слабых солевых
растворах;
действие высаливающих и денатурирующих
агентов;
13
14.
IV. Обратимое осаждение белков / высаливаниеВысаливание - это обратимое осаждение белков из
растворов под действием водоотнимающих веществ,
связанное с разрушением гидратных оболочек.
ЛК-2
Механизм: разрушение гидратных оболочек под действием
высаливающих агентов приводит к взаимодействию молекул
белков м/у собой, образованию агрегатов и выпадению осадка.
Структуры белковых молекул при этом не нарушаются.
После удаления высаливающего агента (диализ, гельфильтрация) или добавления растворителя (воды), белок
восстанавливает гидратную оболочку, все свои природные
свойства и функции.
14
15.
IV. Обратимое осаждение белков/ высаливаниеВысаливающие агенты
1) концентрированные растворы нейтральных
солей щелочных и щелочноземельных металлов;
2) сульфат аммония;
3) органические растворители: ацетон, этанол,
метанол и др.
ЛК-2
На практике для высаливания белков чаще всего применяют сульфат
натрия и сульфат аммония.
На величину высаливания влияют
1) ионная сила раствора (µ)
Она равна половине суммы произведений концентрации каждого иона
2
(С) на квадрат его валентности (V) т.е., µ = ½ ∑С х V
2) рН-среды 3) температура
15
16.
V. Необратимое осаждение белков / денатурацияДенатурация – это нарушение нативной структуры белка,
приводящее к утрате его биологических функций и
физико-химических свойств. Денатурация вызывает
необратимое осаждение белков из растворов.
Факторы, вызывающие денатурацию, делятся на физические и
химические.
К физическим факторам относятся:
ЛК-2
высокие t
давление
ультразвук
излучение (ультрафиолетовое, инфракрасное, ионизирующее,
рентгеновское)
вибрация
Механизм: дополнительная энергия, усиление колебательных движений
отдельных участков молекул, разрыв гидрофобных и водородных связей
в белке, разрушение нативной конформации, потеря биологической
активности.
16
17.
V. Необратимое осаждение белков/денатурацияК химическим факторам относятся
Окислители (кислородосодержащие, галогеносодержащие)
М-зм: окисление функциональных групп белков (—SH
HS—)
(—S—S—)
Минеральные и органические кислоты (H2SO4, HNO3, HCl, ПВК, ТХУ и др.)
-
М-зм: ∆ рН, изменение ионизации (R—СОО
R—COOH), разрыв ионных
связей в белке, изменение сумм. заряда, нарушение конформации, потеря
активности.
ЛК-2
Щелочи (NaOH, KOH)
+
М-зм: ∆ рН, изменение ионизации (R—NH3
R—NH2), разрыв ионных связей
в белке, изм-е сумм. заряда, нарушение конформации, потеря активности.
Восстановители
М-зм: восстановление функциональных групп (например: -СООН в СОН);
разрыв дисульфидных связей в белке (—S—S—)
конформации, утрата активности.
(—SH
17
Соли тяжелых металлов (Hg2+, Pb2+ Cd2+ и др.)
М-зм: связывание функциональнх групп в белке (—SH
HS—), изменение
HS—)
(—S—Hg—S—)
18.
VI. Приложение. Использование явления денатурации в стоматологиииспользуется в клинико-лабораторной диагностике
для предварительного осаждения белков в биологических жидкостях,
чтобы затем использовать для анализа безбелковый фильтрат
(определение витаминов в крови, антибиотиков в слюне после орошения
ротовой полости и т. д.).
ЛК-2
широко используется с целью дезинфекции, стерилизации,
асептики, антисептики;
применяется с лечебной целью в клинической практике.
Высокие температуры
а) термодезинфекция стоматологических инструментов в Н2О
(температура 93-95°);
18
б) автоклавирование (наконечники-135°, зеркала- не более 140°);
19.
VI. Приложение. Использование явления денатурации в стоматологииДавление: автоклавирование;
Ультрафиолетовое облучение:
кварцевание бактерицидными УФ-лампами воздуха в
стоматологических кабинетах и рабочих поверхностей;
Ультразвук:
ЛК-2
а) ультразвуковые ванночки для дезинфекции
стоматологических инструментов, стекла, наконечников;
б) ультразвуковые установки для:
обработки корневых каналов и кариозных полостей;
лечения пародонтоза;
снятия зубных отложений;
отбеливания зубов.
19
20.
VI.Приложение. Использование явления денатурации в стоматологииНеорганические вещества
окислители кислородосодержащие
Механизм: окисление функциональных групп белков (— SH HS —)
(— S—S —)
Н2О2 - пероксид водорода
а) 6 % Н2О2 - для дезинфекции съемных пластмассовых протезов,
(может использоваться в сочетании с 96 % этиловым спиртом как
ЛК-2
антисептический раствор);
б) 3 % Н2О2 - для обработки рабочих поверхностей;
в) 0,5 % Н2О2 - для обработки полости рта пациента.
О3 – озон
а) Озоновые стерилизаторы (газовый метод) используют для стерилизации
технически сложного оборудования;
б) озонаторы портативные используют для обработки поврежденного зуба;
полости рта перед протезированием; лечения воспалительной патологии;
лечения кариеса на начальных стадиях.
20
21.
VI. Приложение. Использование явления денатурации в стоматологииNa2[B2(O2)2(OH)4] - пероксобораты
(содержат до 10 % активного кислорода)
Пероксобораты применяются для дезинфекции полости рта;
КМnO4 - перманганат калия
Растворы КМnO4 применяют для обработки полости рта пациента в сочетании с другими
антисептиками, которые имеют иной механизм действия.
окислители галогеносодержащие
NH2Cl - хлорамин
ЛК-2
(содержит до 30 % активного хлора)
3 % хлорамин используется для обработки инструментов,
непосредственно не соприкасающихся со слизистой оболочкой рта;
для обработки рабочих поверхностей столов и клеенчатых фартуков.
[3Ca(OH)2 * 2Cl2] -хлорная известь
(содержит до 26-35 % активного хлора)
20 % раствор применяется для замачивания плевательниц, одноразового
мелкого инструментария перед выбрасыванием;
21
22.
V.Приложение. Использование явления денатурации в стоматологииорганические вещества
группа фенолов С6Н(6-n) (ОН)n
Механизм: связывают функциональные группы белков,
используются как компоненты сложных дезинфицирующих средств
альдегиды (HCOH – формальдегид)
Механизм: восстанавливают функциональные группы белка, забирая атом кислорода;
связывают аминогруппы белков.
а) Используются как компоненты сложных дезинфицирующих средств.
ЛК-2
б) Формальдегид применяется в газовых камерах для стерилизации
стоматологических инструментов и зеркал (в виде паров, в сочетании
с парами окиси этилена)
алифатические спирты (С2Н5ОН - этанол более 70◦)
Механизм: изменяют гидратацию и конформацию белков
кислоты ( CH3-CO-COOH (ПВК), CH3-CH(OH)-COOH- молочная кислота)
Механизм: изменяют рН, нарушают ионизацию –СОО
ионных связей в белках.
- групп, что приводит к разрушению
22
23.
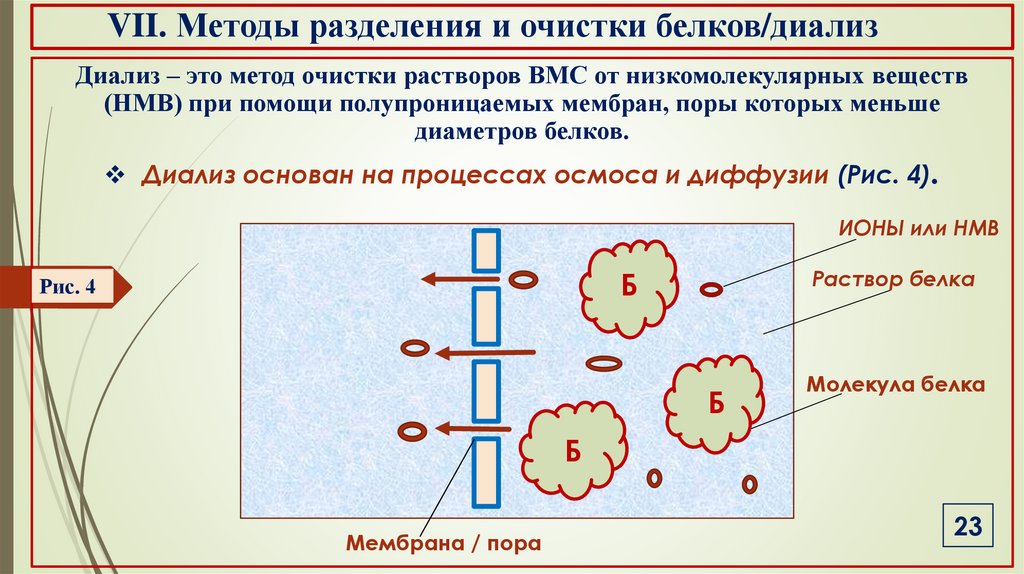
VII. Методы разделения и очистки белков/диализДиализ – это метод очистки растворов ВМС от низкомолекулярных веществ
(НМВ) при помощи полупроницаемых мембран, поры которых меньше
диаметров белков.
Диализ основан на процессах осмоса и диффузии (Рис. 4).
ИОНЫ или НМВ
Раствор белка
Б
Рис. 4
Б
Молекула белка
Б
Мембрана / пора
23
24.
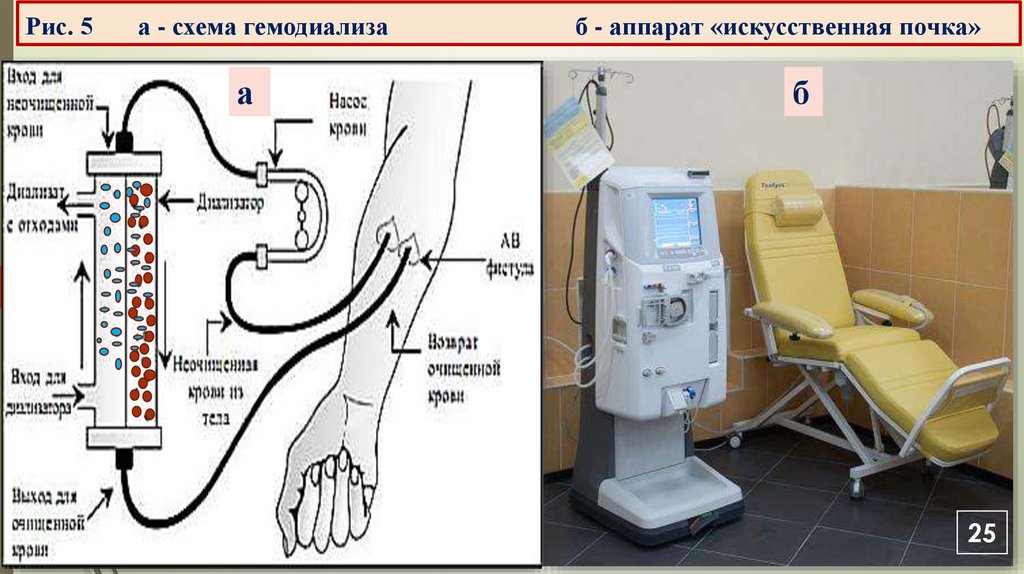
VII. Методы разделения и очистки белков/диализОбразование первичной мочи происходит путем
ультрафильтрации (диализа под давлением) безбелковой
жидкости из плазмы крови в капсулу почечного клубочка.
При острой и хронической почечной недостаточности в крови
больного накапливаются продукты обмена веществ
ЛК-2
(мочевина, креатинин, мочевая кислота, ионы и др.), которые
выводятся путем гемодиализа на аппарате «искусственная
почка» (рис.3 а, б).
При очистке крови крупные молекулы белков и форменные
элементы не проходят через искусственные мембраны
диализатора.
24
25.
Рис. 5а - схема гемодиализа
а
б - аппарат «искусственная почка»
б
25
26.
VII. Методы разделения и очистки белков/Фракционное высаливаниеЛК-2
Высаливание широко используют для разделения и очистки
белков, т. к. белки различаются по размеру гидратной
оболочки, зависящей от величины заряда и молекулярной
массы.
Для каждого из них имеется своя концентрация соли,
позволяющая дегидратировать и осадить белок.
Так можно получать кристаллические белковые препараты,
хранить плазму крови в сухом виде и др.
Используя водные растворы сульфата аммония разной
концентрации, можно разделять белки крови на
фракции (фракционное высаливание).
Крупные молекулы глобулинов, имеющие меньший заряд и
небольшую гидратную оболочку, осаждают 50% р-ом
сульфата аммония, а более мелкие молекулы альбуминов, с
большой гидратной оболочкой – при 100% концентрации.
26
27.
VII. Методы разделения и очистки белков / Фракционное высаливаниеТакже применяются различные концентрации
спирта при низких температурах и определенных
pH (Метод Кона, водно-спиртовое осаждение на
холоду).
ЛК-2
Изменяя концентрацию этанола, температуру
(обычно ниже 0*), рН раствора, из плазмы крови
последовательно выделяют фракции белков,
используемых в качестве кровезаменителей.
По методу Кона получают некоторые виды
концентрированных лечебных сывороток и
противокоревого иммуноглобулина.
27
28.
VI. Методы разделения и очистки белков / Ультрацентрифугированиеа
Метод разделения смеси в-в на
фракции по плотности
(молекулярной массе) под
действием центробежных сил.
Рис. 6
б
в
В кювету с буферным раствором
наносят слой смеси белков и помещают
её в ротор ультрацентрифуги (Рис.6 а);
При вращении ротора (Рис.6 б) в
течение 10-12 час и центробежном
ускорении 100000-500000g, более
тяжелые белки будут оседать с большей
скоростью;
Смесь белков расслаивается на
отдельные фракции с разной
молекулярной массой; (Рис.6 в)
После разделения на фракции дно
кюветы прокалывают иглой и собирают
содержимое небольшими порциями.
28
29.
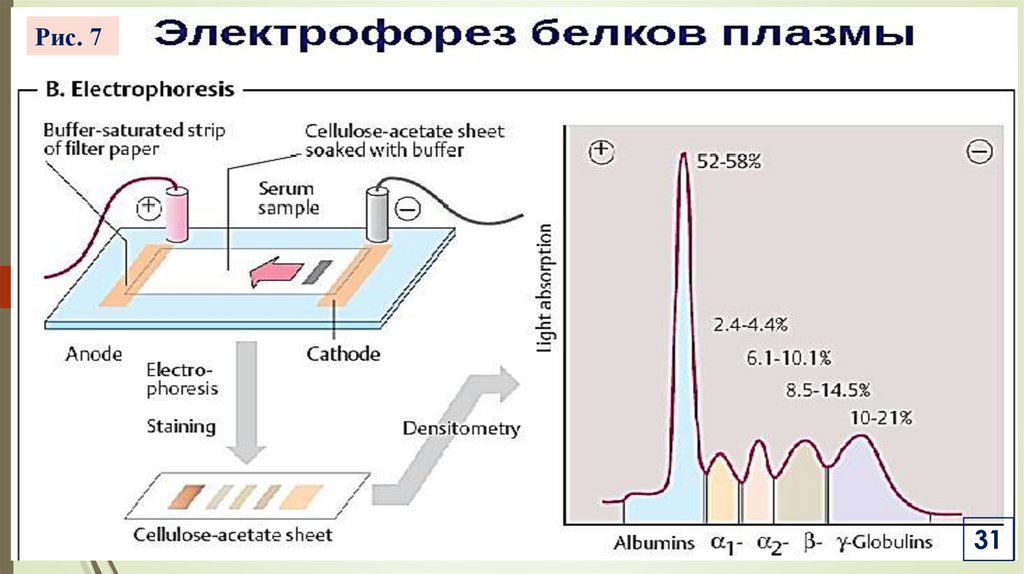
VII. Методы разделения и очистки белков / Электрофорез белковПринцип метода основан на способности белков, как
заряженных частиц, двигаться с различной скоростью под
действием электрического поля к определенному электроду.
1. Скорость движения белков зависит от
ЛК-2
суммарного заряда
размера и формы молекул
силы тока и напряжения
свойств носителя, на к-м происходит разделение
рН буферного раствора, t
2. Носители
бумага, крахмальный гель, полиакриламидный гель,
агарозный гель, ацетатцеллюлозные пленки.
29
30.
VII. Методы разделения и очистки белков / Электрофорез белков3. Этапы электрофореза
На смоченный в буфере носитель наносят пробы и помещают
в камеру, заполненную буфером (для белков крови рН = 8,6)
Подключают электроды и пропускают ток, проводя
разделение
ЛК-2
Пробы фиксируют, окрашивают (амидочерный,
бромфеноловый синий, пунцовый S), удаляют избыток
красителя, промывают электрофореграммы (ЭФГ)
Определяют %-содержание фракций, напр. сканированием
ЭФГ с помощью денситометра
Белки плазмы крови разделяют на 5 фракций на
ацетатцеллюлозе или агарозном геле (Рис. 7).
30
31.
Рис. 731
32.
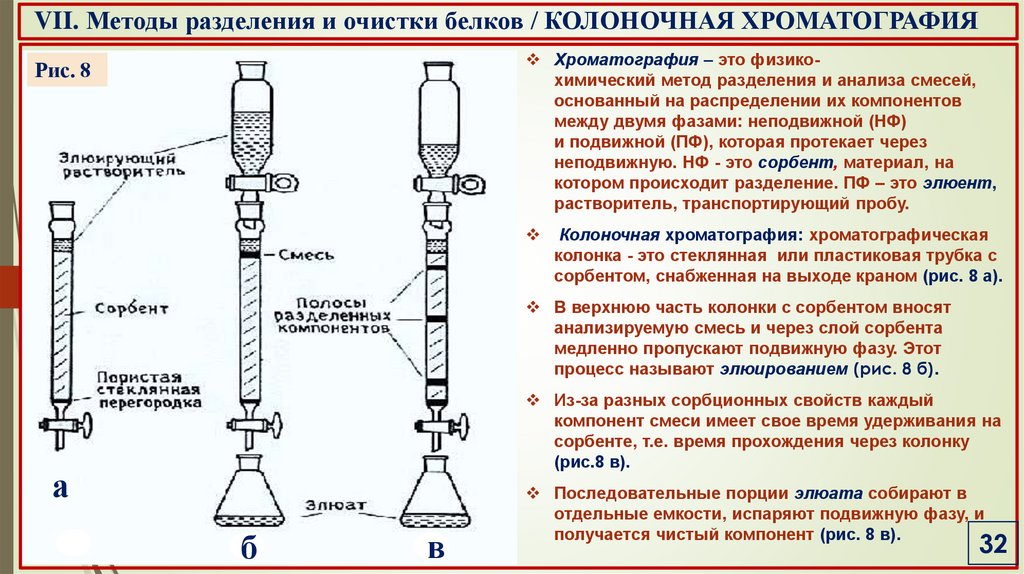
VII. Методы разделения и очистки белков / КОЛОНОЧНАЯ ХРОМАТОГРАФИЯХроматография – это физикохимический метод разделения и анализа смесей,
основанный на распределении их компонентов
между двумя фазами: неподвижной (НФ)
и подвижной (ПФ), которая протекает через
неподвижную. НФ - это сорбент, материал, на
котором происходит разделение. ПФ – это элюент,
растворитель, транспортирующий пробу.
Рис. 8
Колоночная хроматография: хроматографическая
колонка - это стеклянная или пластиковая трубка с
сорбентом, снабженная на выходе краном (рис. 8 а).
В верхнюю часть колонки с сорбентом вносят
анализируемую смесь и через слой сорбента
медленно пропускают подвижную фазу. Этот
процесс называют элюированием (рис. 8 б).
Из-за разных сорбционных свойств каждый
компонент смеси имеет свое время удерживания на
сорбенте, т.е. время прохождения через колонку
(рис.8 в).
а
б
в
Последовательные порции элюата собирают в
отдельные емкости, испаряют подвижную фазу, и
получается чистый компонент (рис. 8 в).
32
33.
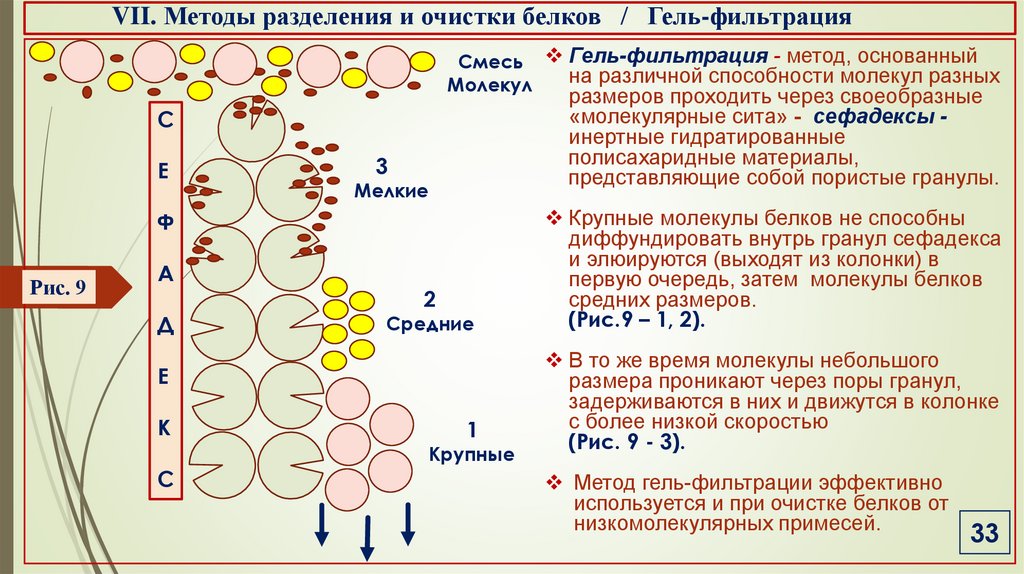
VII. Методы разделения и очистки белков / Гель-фильтрацияСмесь Гель-фильтрация - метод, основанный
на различной способности молекул разных
Молекул
размеров проходить через своеобразные
«молекулярные сита» - сефадексы инертные гидратированные
полисахаридные материалы,
представляющие собой пористые гранулы.
С
Е
3
Мелкие
Ф
Рис. 9
А
Д
2
Средние
Е
К
1
Крупные
С
Крупные молекулы белков не способны
диффундировать внутрь гранул сефадекса
и элюируются (выходят из колонки) в
первую очередь, затем молекулы белков
средних размеров.
(Рис.9 – 1, 2).
В то же время молекулы небольшого
размера проникают через поры гранул,
задерживаются в них и движутся в колонке
с более низкой скоростью
(Рис. 9 - 3).
Метод гель-фильтрации эффективно
используется и при очистке белков от
низкомолекулярных примесей.
33
34.
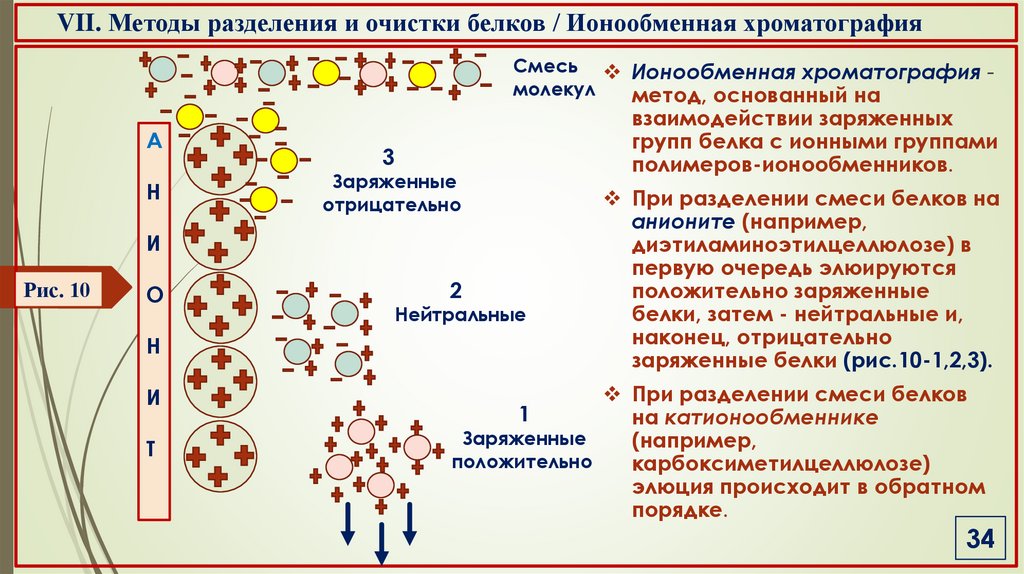
VII. Методы разделения и очистки белков / Ионообменная хроматографияСмесь Ионообменная хроматография молекул
метод, основанный на
А
Н
3
Заряженные
отрицательно
И
Рис. 10
О
Н
И
Т
2
Нейтральные
взаимодействии заряженных
групп белка с ионными группами
полимеров-ионообменников.
При разделении смеси белков на
анионите (например,
диэтиламиноэтилцеллюлозе) в
первую очередь элюируются
положительно заряженные
белки, затем - нейтральные и,
наконец, отрицательно
заряженные белки (рис.10-1,2,3).
При разделении смеси белков
1
на катионообменнике
Заряженные
(например,
положительно
карбоксиметилцеллюлозе)
элюция происходит в обратном
порядке.
34
35.
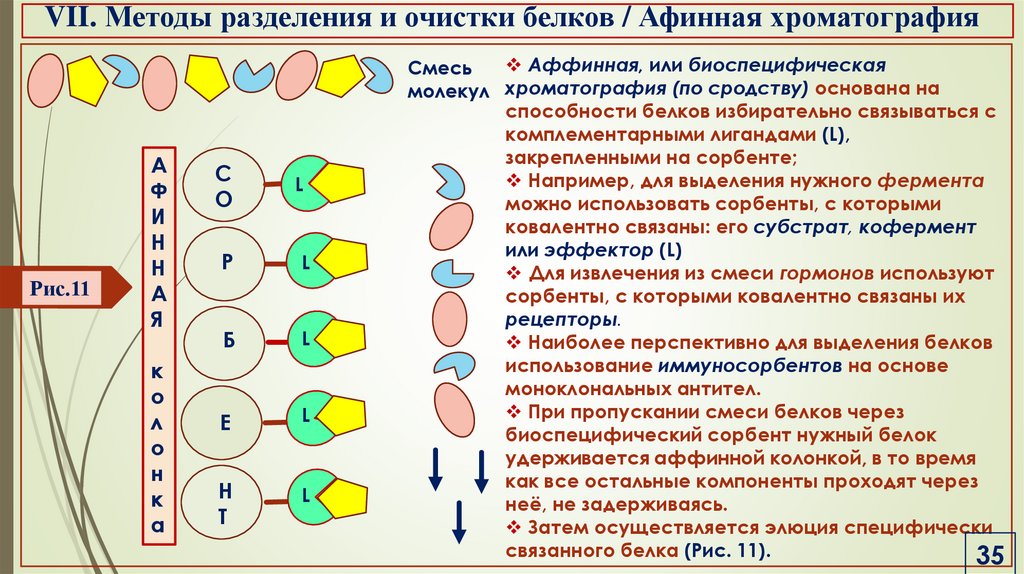
VII. Методы разделения и очистки белков / Афинная хроматографияРис.11
А
Ф
И
Н
Н
А
Я
к
о
л
о
н
к
а
С
О
L
Р
L
Б
L
Е
L
Н
Т
L
Аффинная, или биоспецифическая
Смесь
молекул хроматография (по сродству) основана на
способности белков избирательно связываться с
комплементарными лигандами (L),
закрепленными на сорбенте;
Например, для выделения нужного фермента
можно использовать сорбенты, с которыми
ковалентно связаны: его субстрат, кофермент
или эффектор (L)
Для извлечения из смеси гормонов используют
сорбенты, с которыми ковалентно связаны их
рецепторы.
Наиболее перспективно для выделения белков
использование иммуносорбентов на основе
моноклональных антител.
При пропускании смеси белков через
биоспецифический сорбент нужный белок
удерживается аффинной колонкой, в то время
как все остальные компоненты проходят через
неё, не задерживаясь.
Затем осуществляется элюция специфически
связанного белка (Рис. 11).
35
36.
VIII. Список литературыОсновная литература:
1. а) Биохимия: учебник/ под ред. Е.С. Северина.- М.: ГЭОТАР- Медиа, 2011. - 759 с.: ил. (2006 - 779 с.:
ил.,), (РАЗДЕЛ 1, п.VII – VIII)
б) Биохимия [Электронный ресурс] : учебник / под ред. Е. С. Северина. - 5-е изд., испр. и доп. - М. :
ГЭОТАР- Медиа, 2015. - http://www.studmedlib.ru / book / ISBN9785970433126.html (РАЗДЕЛ 1, п.VII –
VIII)
2. а) Биологическая химия. Биохимия полости рта: учебник / Т.П. Вавилова, А.Е. Медведев. - М.:
ГЭОТАР-Медиа, 2014. - 560 с.: ил., (ЧАСТЬ I, глава1)
ЛК-2
б) Биологическая химия. Биохимия полости рта [Электронный ресурс]: учебник / Т.П. Вавилова,
А.Е. Медведев - М. : ГЭОТАР- Медиа, 2014. - http://www.studmedlib.ru / book / ISBN9785970430392.html
(ЧАСТЬ I, глава1)
3. Метаболические нарушения и зубочелюстная система: учебно-методическое пособие для
студентов стоматологических факультетов медицинских вузов / под ред. Л.Б. Гайковой, Ж.В.
Антоновой, Р.Н. Павловой. - СПб.: Изд-во СЗГМУ им. И. И. Мечникова, 2017. – 128 с. (стр. 28-38)
Дополнительная литература:
1. Биологическая химия: учебник / Т.Т. Березов, Б.Ф. Коровкин. – 3-е изд., перераб. и доп.– М.:
Медицина, 1998. – 704 с.: ил. (cтр.19- 49)
2. Физическая и коллоидная химия: учебник/ А.П. Беляев, В.И. Кучук. - 2-е изд., перераб. и доп. –
М.: ГЭОТАР-Медиа, 2018.-752 с., ил.(стр.528-586, 625-631,700-726, 740)
36
37.
ЛК-2Благодарю за внимание !
37





























 biology
biology








