Similar presentations:
Этика продвижения лекарственных препаратов на фармацевтический рынок
1.
Министерство Здравоохранения УкраиныГЗ «Луганский государственный медицинский университет»
Этика продвижения
лекарственных препаратов на
фармацевтический рынок
Лектор: к.фарм.н, доцент Барнатович С.В.
2.
Этические критерии ВОЗ попродвижению ЛП на рынок
Изложены в резолюции ВОЗ 41.17,
принятой 41-ой Ассамблеей ВОЗ 13 мая 1988 года
Цель этических критериев – создание поддержки и
содействия в
проведении медико-санитарной
помощи путем рационального использования ЛП
Сфера их применения:
При разработке сводов этических норм
во всех областях деятельности,
имеющей отношение к продвижению
ЛС на рынок
В конкретных организациях могут быть
приняты свои неофициальные
регулирующие положения,
основанные на этих критериях
3.
Реклама ЛП среди врачей и населения«Продвижение на рынок»
термин, который используют по отношению ко всем видам
информационно-рекламной деятельности, которую проводят
фирмы-поставщики для стимулирования назначения, применения
и/или приобретения лекарственных препаратов.
Национальная
политика в области
здравоохранения
Национальное
законодательство
Добровольные
кодексы правил
4. Продвижение ЛП
В ежедневной практике любой фармацевтическойкомпании первоочередной задачей является продвижение
её товаров на рынке.
Продвижение лекарственных средств
реклама о ЛС;
предоставление информации о ЛС;
визиты медицинских представителей к
профессионалам сферы здравоохранения;
сэмплинг;
организация специализированных мероприятий;
спонсорство
5. «Информация о ЛС» VS «Реклама»
Целевая аудиторияПредмет
Назначение
Место размещения
Ограничения по
Информация о ЛС
Реклама
Специалисты сферы
здравоохранения.
- Зарегистрированные
безрецептурные ЛС,
запрещенные к
рекламированию;
- Зарегистрированные
рецептурные ЛС;
- Незарегистрированные и
разрабатывающиеся ЛС .
Предназначена предоставить
профессиональную информацию
о товаре.
Исключительно
специализированные издания и
специализированные
мероприятия.
Ст. 26 Закон о лекарственных
Неограниченный круг лиц.
Зарегистрированные
безрецептурные ЛС,
разрешенные к
рекламированию.
Предназначена сформировать
или поддержать интерес к
товару.
Практически неограниченный
перечень способов, мест и
формы размещения.
ст. 21 Закона о рекламе.
6.
Реклама и информация о ЛП средиврачей и населения
Все информационно-рекламные материалы
должны быть:
A. Точными и надежными
B. Достоверными и своевременными
C. Доказательными
D. Оформленными должным образом
7.
Информация ЛП среди врачейИнформация для врачей и др. работников, занятых
в сфере здравоохранения, должна содержать
формулировки и иллюстрации в полном
соответствии с научными данными, изложенными
в официально утвержденной документации о конкретном
лекарственном препарате
При составлении рекламных материалов
рекомендуется придерживаться
образца подачи информационного материала,
который предусматривает
обязательное включение таких данных как:
8.
Информация о ЛП среди врачейМеждународное непатентованное название каждого
действующего вещества или генерическое название
Оригинальное название препарата
ЛФ с указанием в ней содержания активного
действующего вещества
Терапевтические показания и режим дозирования
Побочные явления, противопоказания и особые указания
Основные лекарственные взаимодействия
Название и адрес изготовителя или дистрибьютора ЛП
Ссылки
на научную литературу
Основные
лекарственные
взаимодействия
(в случаях, когда это необходимо)
9.
Реклама ЛП среди населенияРеклама для широких слоев населения
призвана оказывать помощь в принятии разумного
решения относительно использования
безрецептурных ЛП, которые официально
есть в продаже
Нельзя рекламировать ЛП, отпускаемые
по рецепту врача, в том числе
наркотические и психотропные средства
Сведения, представленные в рекламном
сообщении должны быть изложены
непрофессиональным языком
и не должны содержать формулировки,
вызывающие страх или беспокойство
10.
Реклама ЛП среди населения10
Международное непатентованное название
или генерическое название каждого действующего вещества
Оригинальное название препарата
Основные показания к применению
Противопоказания
Особые указания
Основные лекарственные взаимодействия
Название и адрес изготовителя или дистрибьютора ЛП
Потребителям
необходимо предоставлять
Основные
лекарственные
взаимодействия
правдивую информацию о цене ЛП
11.
12.
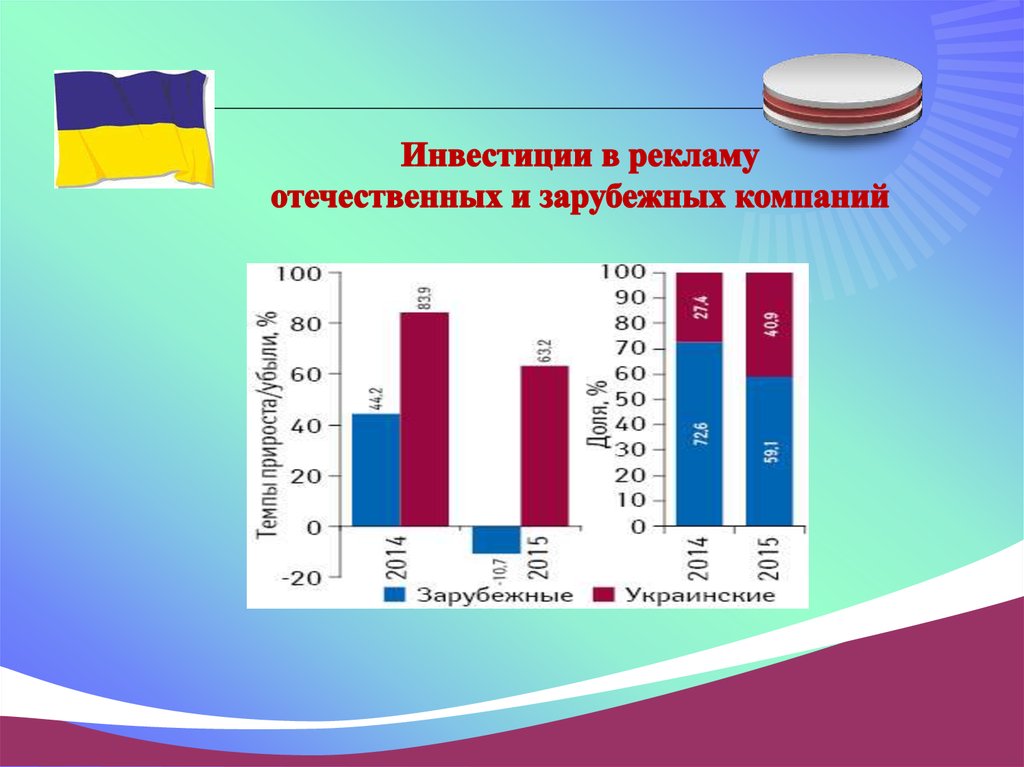
Инвестиции в рекламу на телевидении составили7,2 млрд.грн.
2015 году ТОП-10 телеканалов по объемам продаж рекламы лекарств возглавила
"Студія "1+1
(объем продаж — 1 млрд. 539 млн.грн., количество выходов — более 54 тыс.).
Телеканал "Інтер", впервые уступивший свое лидерство, оказался на втором месте
(объем продаж — 1млрд. 535 млн грн, количество показов — почти 63 тыс.).
И почетное третье место занял СТБ
с объемом продаж 1 млрд. 51 млн. грн. и количеством показов 57,5 тыс.
13.
Лидерами в ТОП-10 компаний по объемаминвестиций в телерекламу оказались
"Фармак"
(объем продаж — 698 млн грн),
Sanofi (465 млн грн)
"Корпорация "Артериум" (более 373 млн грн).
Рейтинг прошлого года возглавили "нурофен", "эссенциале",
«стрепсилс" и "но-шпа".
Что совпадает с выводами врачей о том,
какими препаратами чаще всего пользуются пациенты,
занимаясь самолечением
14.
15.
Закон Украины «Про лікарські засоби» от 04.04.1996 г.Закон Украины «Про рекламу» от 03.07.1996 г. № 270/96-ВР
Закон Украины «Про внесення змін до деяких законів України у сфері
охорони здоров'я щодо посилення контролю за обігом лікарських
засобів, харчових продуктів для спеціального дієтичного споживання,
функціональних харчових продуктів та дієтичних добавок» от
20.12.2011 г. № 4196-VI
Приказ МЗ Украины от 06.06.2012 г. № 422 «Про деякі питання
заборони рекламування лікарських засобів»
16.
Приказ МЗ Украины от 06.11.2012 г. № 876 «Про затвердженняпереліку лікарських засобів, заборонених до рекламування, які
відпускаються без рецепта»
Приказ МЗ Украины от 25.02.2013 г. № 162 «Про затвердження
переліку лікарських засобів, заборонених до рекламування, які
відпускаються без рецепта» (чинний з 05.04.2013)
Приказ МЗ Украины от 17.06.2013 г. № 514 «Про затвердження
переліку лікарських засобів, заборонених до рекламування, які
відпускаються без рецепта» (чинний з 25.07.2013) (включает 300
наименований, уменьшился на 27 позиций)
17.
Разрешена реклама лекарственных средств, которые в установленном порядкеразрешены специальным уполномоченным органом исполнительной власти в
области здравоохранения к применению в Украине, т.е зарегистрированы;
Разрешена реклама только таких лекарственных средств, которые отпускаются
без рецепта врача;
Запрещена реклама лекарственных средств, которые отпускаются по рецепту
врача;
Реклама лекарственных средств должна содержать объективную информацию
о лекарственном средстве и осуществляться так, чтобы было понятно, что
предоставленное сообщение является рекламой и что рекламируемый товар
является лекарственным средством;
Реклама лекарственных средств должна содержать
требование
о
необходимости консультации с врачом перед применением лекарственного
средства;
Реклама лекарственных средств должна содержать рекомендацию по
обязательному ознакомлению с инструкцией о применении, которая прилагается
к лекарственным средствам.
18.
реализация осуществляется лишь по рецепту врача;содержит наркотические средства, психотропные вещества и прекурсоры;
применение может вызывать синдром привыкания, что указано в инструкции для
медицинского применения, кроме лекарственных средств для наружного (местного)
применения;
применяется исключительно для лечения женщин в период беременности и кормления
грудью;
применяется исключительно для лечения детей в возрасте до 12 лет;
применяется для лечения:
• туберкулеза,
• венерических заболеваний,
• импотенции (эректильной дисфункции),
• особо опасных инфекционных болезней,
• ВИЧ/СПИДа,
• рака и других опухолевых заболеваний,
• хронической бессонницы,
• диабета,
• ожирения (включая лекарственные средства, используемые для уменьшения массы
тела).
19.
ЗАКОН УКРАЇНИПро внесення зміни до статті 21 Закону
України "Про рекламу"
Верховна Рада України постановляє:
1. Частину четверту статті 21 Закону України "Про
рекламу" (Відомості Верховної Ради України, 2004 р., N 8, ст.
62; 2008 р., N 18, ст. 197) доповнити абзацом п'ятим такого
змісту:
"текст попередження такого змісту: "Самолікування
може бути шкідливим для вашого здоров'я", який займає не
менше 15 відсотків площі чи обсягу (тривалості) всієї
реклами".
2. Цей Закон набирає чинності через три місяці з дня
його опублікування.
(Закон, ВР України, від 19.04.2011, № 3235-VI "Про
внесення зміни до статті 21 Закону України "Про рекламу"")
20.
ЗАКОН УКРАЇНИПро внесення зміни Закону України "Про
рекламу»
Верховна Рада України постановляє:
7. Розміщення інформації про виробника товару та/або
товар у місцях, де цей товар реалізується чи
надається споживачеві, у тому числі на елементах
обладнання та/або оформлення місць торгівлі, а
також безпосередньо на самому товарі та/або його
упаковці, не вважається рекламою.
{ Частина сьома статті 8 із змінами, внесеними
згідно із Законом
N 145-VI ( 145-17 ) від 18.03.2008 }
21.
ЗАКОН УКРАЇНИ"Про рекламу» III розділ
8. Забороняється вміщувати в рекламі
лікарських засобів інформацію, яка дозволяє
припустити, що лікарський засіб є харчовим,
косметичним чи іншим споживчим товаром або
що безпечність чи ефективність цього засобу
обумовлена його природним походженням.
9. У рекламі товарів та методів, що не належать до
лікарських засобів, медичної техніки, методів
профілактики, діагностики, лікування і реабілітації
забороняється посилання на те, що ці товари мають
лікувальні властивості, якщо такі властивості не
підтверджені у встановленому законодавством
порядку спеціально уповноваженим центральним
органом виконавчої влади з охорони
здоров'я.
{ Частина дев'ята статті 21 із змінами, внесеними
згідно
із Законом N 1465-VI ( 1465-17 ) від 04.06.2009 }
22.
ЗАКОН УКРАЇНИПро внесення зміни Закону України "Про
рекламу"
Стаття 16. Зовнішня реклама
Розміщення зовнішньої реклами у населених
пунктах провадиться на підставі дозволів, що
надаються виконавчими органами сільських, селищних,
міських рад, та в порядку, встановленому цими
органами на підставі типових правил, що
затверджуються Кабінетом Міністрів України.
При видачі дозволів на розміщення зовнішньої реклами
втручання у форму та зміст зовнішньої реклами
забороняється.
Зовнішня реклама на територіях, будинках та
спорудах розміщується за згодою їх власників або
уповноважених ними органів (осіб).
Стягнення плати за видачу дозволів забороняється.
23.
Размер штрафных санкций занарушения в области рекламы ЛС:
1. За недобросовестную рекламу (в т.ч. цена и скидки)
Штраф до 5% от дохода от реализации за последний
отчетный год, предшествующему штрафу или до 10
тысяч необлагаемых минимумов доходов граждан.
2. За нарушения размещения внешней рекламы
Штраф в 5-ти кратном размере от стоимости рекламы.
24.
Работа медицинских представителейпо продвижению ЛП на рынок
Предоставление полных и
объективных данных о каждом
продукте на основе официальных
Следует
Во избежание
источников
информации
различать практику
недобросовестности
предоставления
при продвижении
бесплатных образцов
ЛП на рынок
безрецептурных ЛП
основная часть
медицинским
заработной платы медицинских
учреждениям для лечения
Этические
представителей
определенных групп
аспекты
не должна быть непосредственно
населения от практики
поведения
связанной с объемом продаж
распространения их среди
препаратов, которым они
населения для
содействовали
продвижения ЛП на
рынок, которая должна
Недопустимы различные
быть максимально
«стимулы» со стороны
ограничена
медицинских представителей
25. Сэмплы
Законодательство Украины не содержит определение понятия«сэмпл», «сэмплинг» или даже «образец ЛС».
В соответствии с ЗУ «О внесении изменений в Основы
законодательства о здравоохранении относительно установления
ограничений для медицинских и фармацевтических работников
во время осуществления ними профессиональной деятельности»
от 04.07.2012 г., № 5036-VI получение образцов ЛС было
запрещено.
В то время как:
сэмплинг - это широко распространенная в Европе практика,
признанная Директивой 2001/83/ЕС в отношении лекарственных
средств для человека и Кодексом IFPMA (2012).
26. Сэмплы
Вопрос распространения образцов должен быть поднятна новый уровень и урегулирован надлежащим образом.
В этой сфере можно предложить использование
принципов европейской практики, а именно:
принципа строгого и эффективного контроля и учета
со стороны фармацевтических компаний;
принципа количественной ограниченности;
принципа
двусторонней
связи
врача
и
фармацевтической компании.
27.
Симпозиумы и другие научные совещанияИх первостепенная задача – обеспечить
объективное
научное содержание
предоставляемой информации
Меры соблюдения этических норм:
Факт финансовой поддержки со стороны фирмыизготовителя и фирм-поставщиков должен быть заранее
зафиксирован и задокументирован
в организационных материалах
Любой способ привлечения отдельных практикующих
врачей для участия в работе симпозиума не должен
зависеть от каких-либо обязательств в содействии
по продвижению ЛП на рынок
28.
Постмаркетинговые научные исследованияСогласно этическим критериям ВОЗ:
1
Научно-исследовательским учреждениям
рекомендуется информировать национальные
органы здравоохранения о любых
исследованиях
Ученые советы и комитеты по вопросам этики
должны подтверждать достоверность данных,
полученных в ходе научных исследований
3
2
Полезно межнациональное и региональное
сотрудничество
Информация о научных исследованиях должна
подаваться в соответствующие органы в
кратчайший срок
4
29.
Требования к информации, помещаемой ваннотациях, вкладышах и брошюрах
Фирмапроизводитель и
предприятие по
оптовой продаже
должны
обеспечить
наличие
аннотациивкладыша в
упаковке ЛП
Если аннотациивкладыши
используются для
продвижения ЛП на
рынок, то они должны
соответствовать
этическим критериям,
сформулированным в
резолюции ВОЗ
Если же аннотации
предусмотрены для
использования
пациентами – должны
быть изложены на
непрофессиональном
языке при условии
соответствия
правильному
медицинскому и научному
содержанию
30.
Требования к упаковке и маркировкеВесь упаковочный
материал и этикетки
должны содержать
сведения,
соответствующие
данным, утвержденным
органом контроля о ЛС
конкретной страны.
Если такового нет, то –
органом контроля
страны-экспортера или
другим надежным
источником
Любая формулировка,
иллюстрация на
упаковке и этикетке
должны
соответствовать
этическим критериям,
сформулированным в
резолюции ВОЗ
31.
Самостоятельное лечениебезрецептурными ЛП в мировой практике
ВОЗ и Европейским региональным бюро ВОЗ проводятся
исследования по проблеме самостоятельного лечения
ВОЗ
определила
назначение ЛП
для
самостоятельного
лечения следующим
образом:
1.
Быстро и
эффективно
облегчать
симптомы
заболеваний,
которые не
требуют
медицинской
консультации
2.
В создавшихся
условиях
финансовых и
кадровых
трудностей дать
возможность
пациентам
самостоятельно
облегчать
незначительные
симптомы при
плохом
самочувствии
3.
Повышать доступность
лечебной помощи
населению,
проживающему в
сельской местности и в
отдельных районах, где
получение
квалифицированной
мед. помощи затруднено
32.
Самостоятельное лечение безрецептурными ЛПв мировой практике
Директивой Совета ЕС 92/26ЕЕС от 31.03.1992 г. «Об
определении категорий лекарственных препаратов для
человека» все ЛС разделяются на 2 группы:
рецептурные
безрецептурные
Принадлежность ЛП к категории рецептурных в настоящее время зависит
от фармакологических свойств, риска его неправильного использования и
наличия возмещения (частичной или полной) стоимости.
В соответствии с правилам ЕС существуют критерии, на основании
которых ЛП относят к тому или иному типу. В Украине данные критерии
утверждены Приказом МЗУ от 17.05.2001 г. № 185 «Про затвердження
критеріїв визначення категорій відпуску лікарських засобів».
33. Критерии отнесения ЛП к рецептурным
ЛП, которые могут наносить прямую или косвенную угрозуздоровью потребителя в случае их использования без врачебного
контроля даже при правильном применении
ЛП, относительно которых есть сведения, что значительное
количество потребителей часто использует их неправильно.
Вследствие этого ЛП могут наносить прямую или косвенную
угрозу их здоровью
ЛП, в состав которых входят субстанции, действие
и / или побочные эффекты которых требуют дальнейшего
изучения
ЛП, которые врач обычно назначает для парентерального
применения
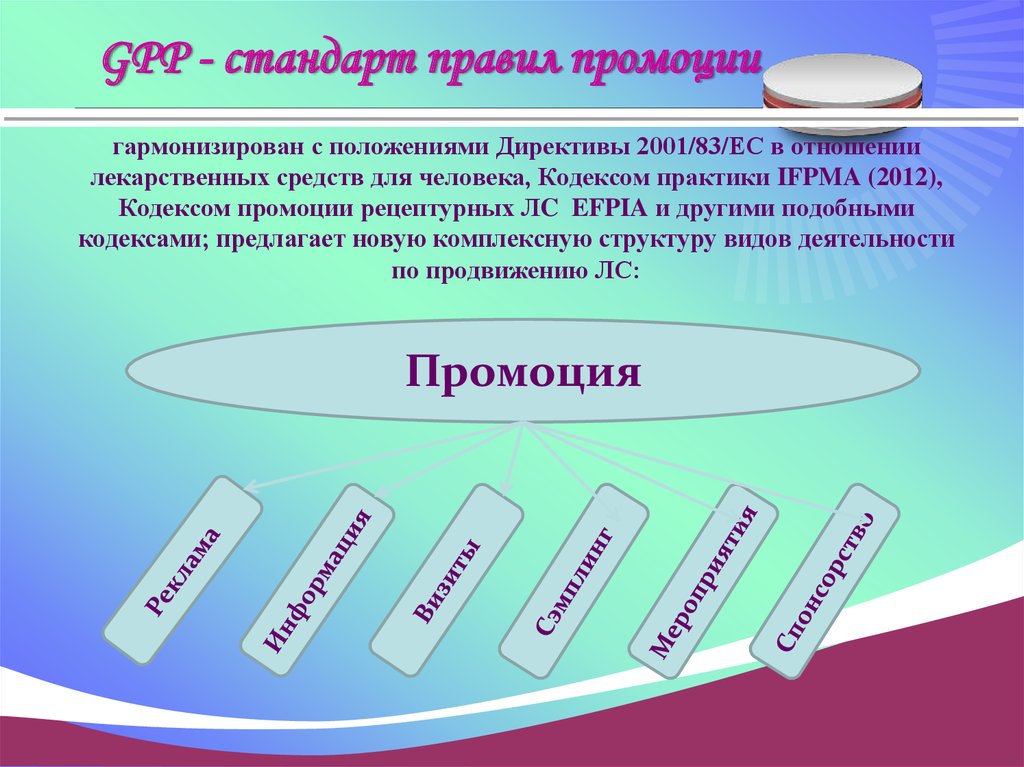
34. GPP - стандарт правил промоции
гармонизирован с положениями Директивы 2001/83/ЕС в отношениилекарственных средств для человека, Кодексом практики IFPMA (2012),
Кодексом промоции рецептурных ЛC EFPIA и другими подобными
кодексами; предлагает новую комплексную структуру видов деятельности
по продвижению ЛС:
Промоция

































 medicine
medicine law
law








