Similar presentations:
Физическая химия биополимеров
1.
CH3N
Физическая химия биополимеров
Лаврик О.И.
НГУ-2012
O
2.
4. Ингибирование ферментативных реакций.Методы описания и определения констант
ингибирования. Применение элементов теории
графов для вывода кинетических уравнений в
стационарном режиме
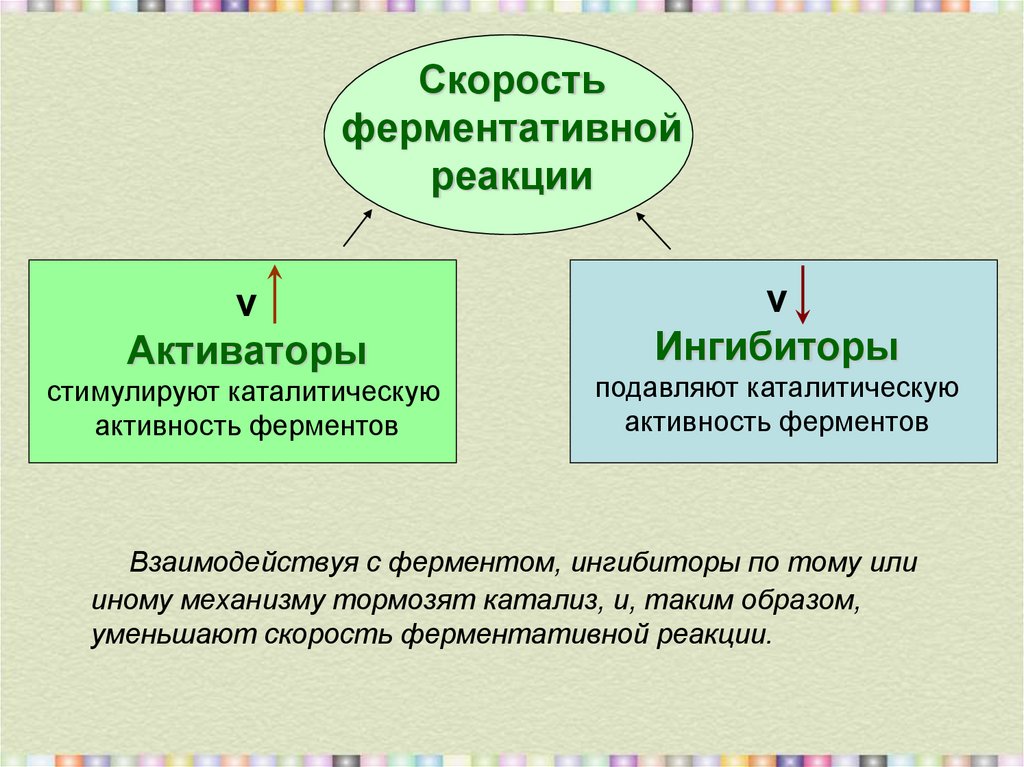
3. Cкорость ферментативной реакции
vАктиваторы
стимулируют каталитическую
активность ферментов
v
Ингибиторы
подавляют каталитическую
активность ферментов
Взаимодействуя с ферментом, ингибиторы по тому или
иному механизму тормозят катализ, и, таким образом,
уменьшают скорость ферментативной реакции.
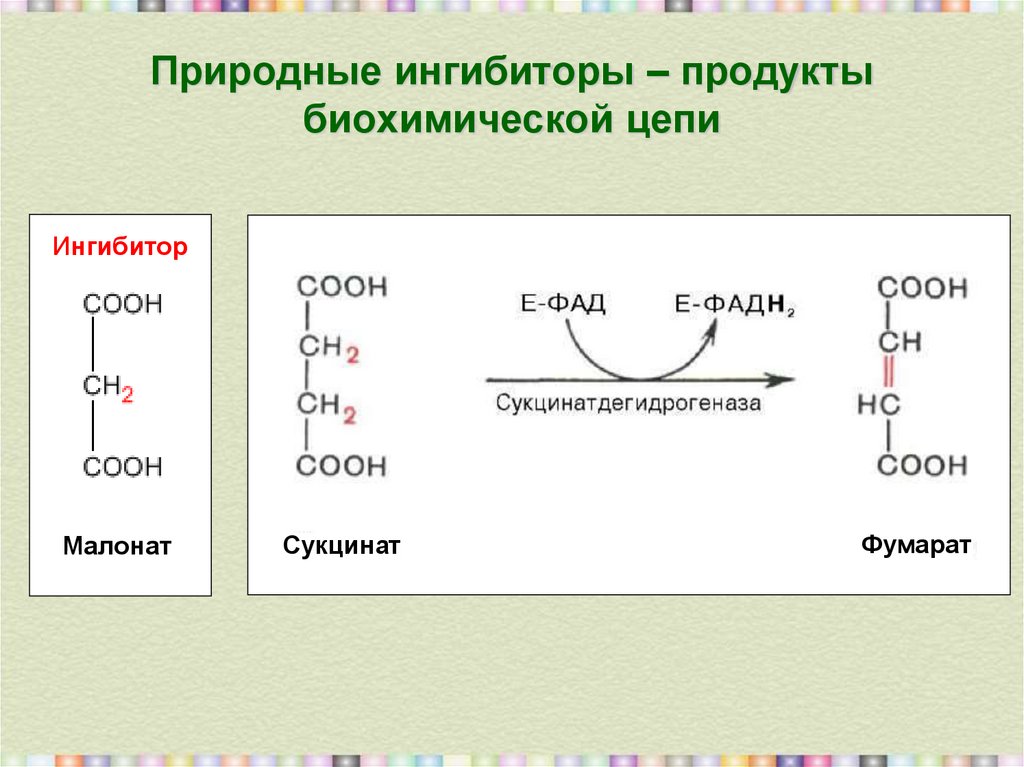
4. Природные ингибиторы – продукты биохимической цепи
ИнгибиторМалонат
Сукцинат
Фумарат
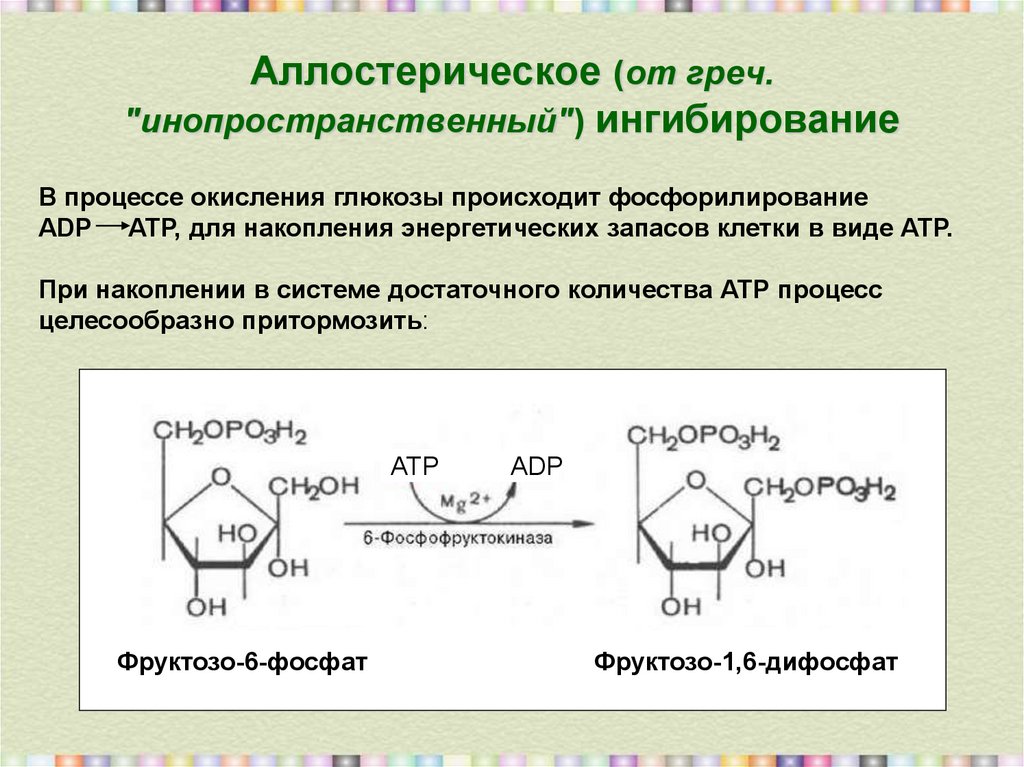
5. Аллостерическое (от греч. "инопространственный") ингибирование
Аллостерическое (от греч."инопространственный") ингибирование
В процессе окисления глюкозы происходит фосфорилирование
АDР АТР, для накопления энергетических запасов клетки в виде АТР.
При накоплении в системе достаточного количества АТР процесс
целесообразно притормозить:
АТР
Фруктозо-6-фосфат
АDP
Фруктозо-1,6-дифосфат
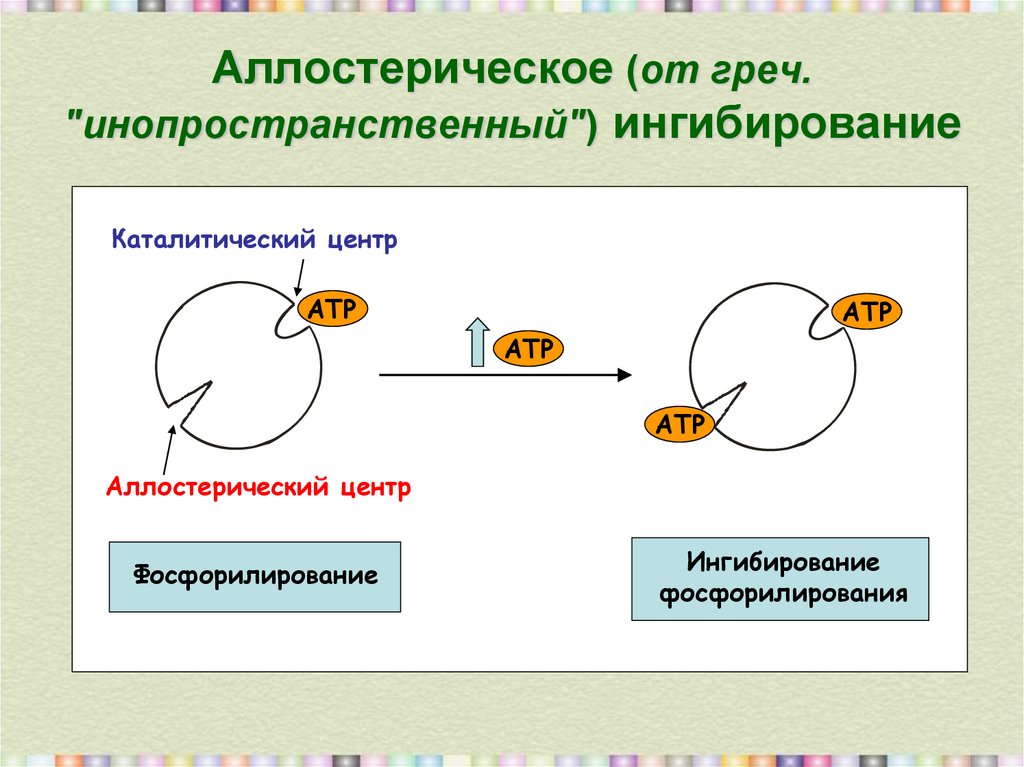
6. Аллостерическое (от греч. "инопространственный") ингибирование
Аллостерическое (от греч."инопространственный") ингибирование
Каталитический центр
АТР
АТР
АТР
АТР
Аллостерический центр
Фосфорилирование
Ингибирование
фосфорилирования
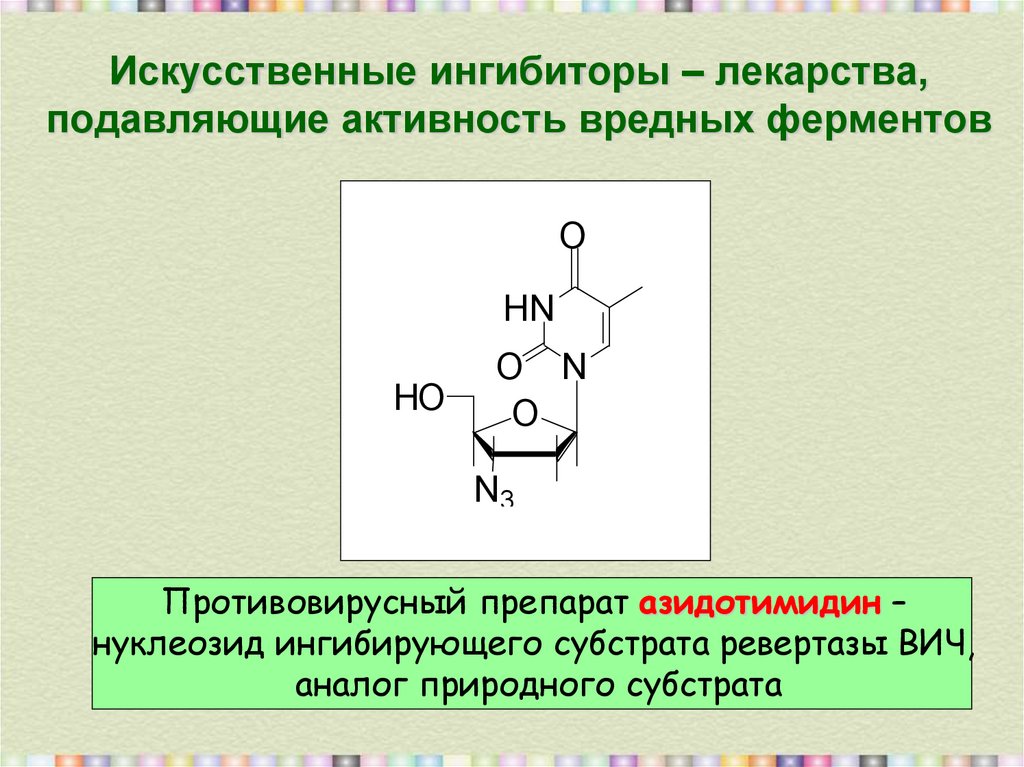
7. Искусственные ингибиторы – лекарства, подавляющие активность вредных ферментов
OHN
HO
O N
O
N3
Противовирусный препарат азидотимидин –
нуклеозид ингибирующего субстрата ревертазы ВИЧ,
аналог природного субстрата
8.
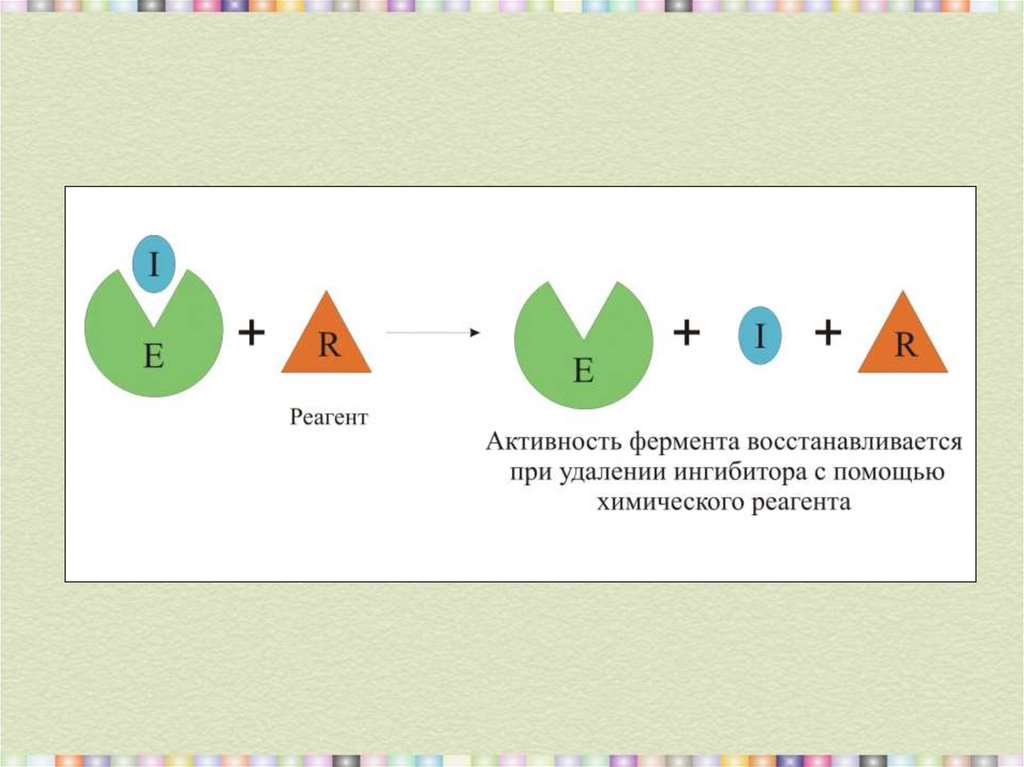
Связываниеингибитора
с ферментом
Обратимое
Необратимое
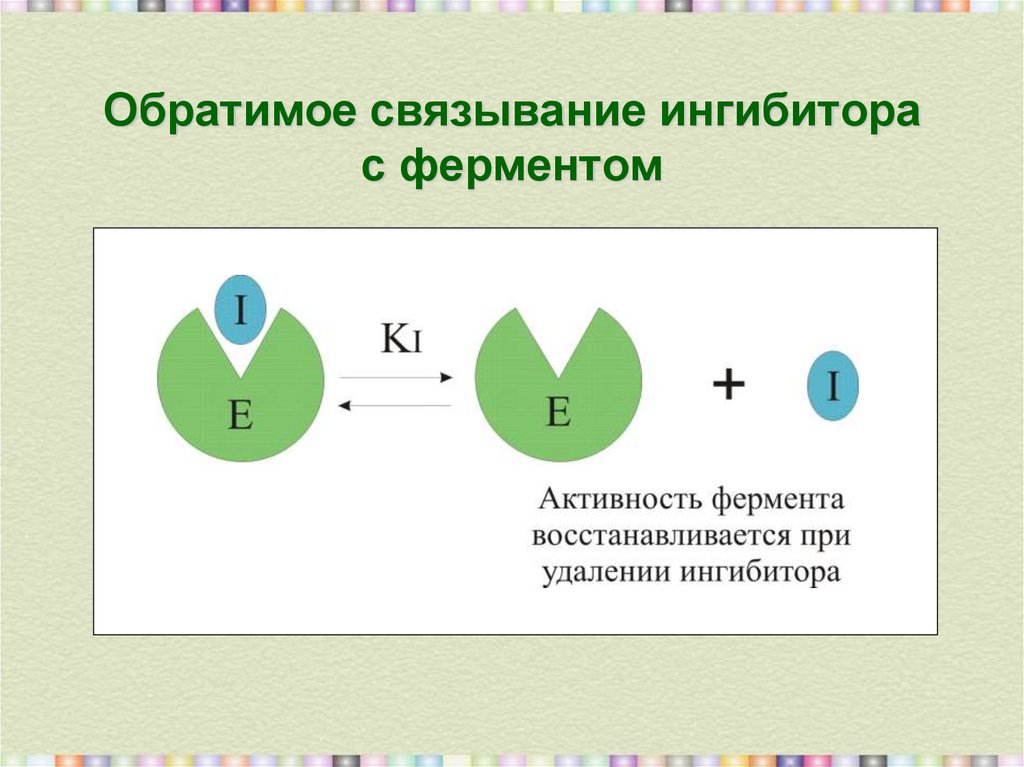
9. Обратимое связывание ингибитора с ферментом
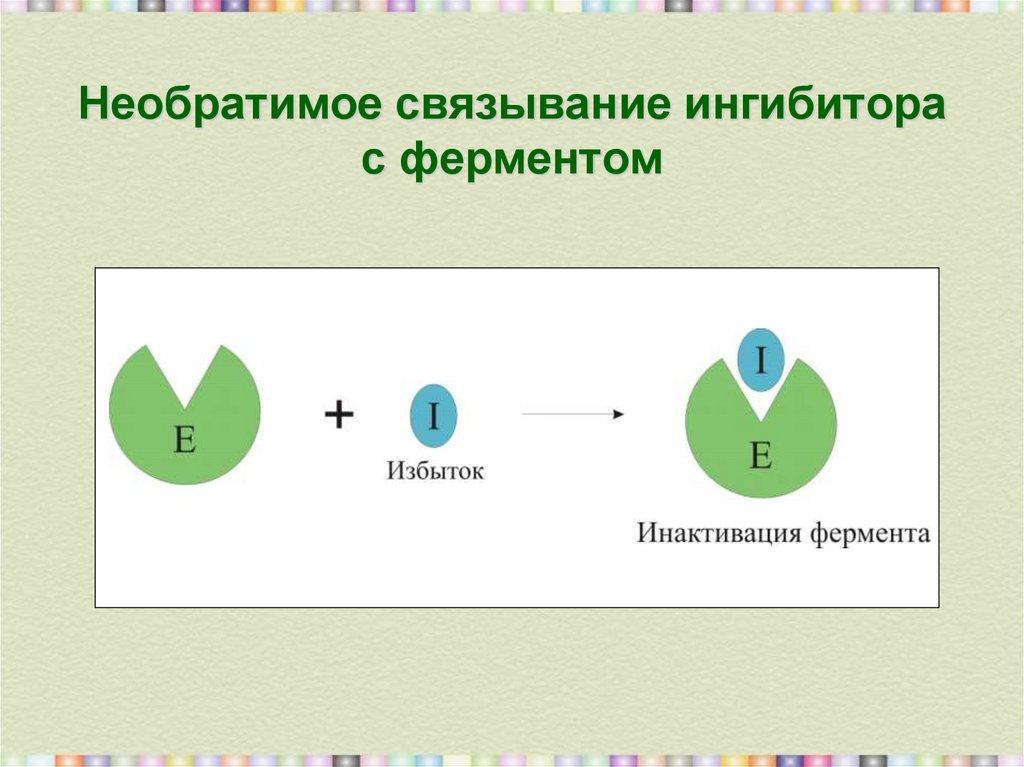
10. Необратимое связывание ингибитора с ферментом
11.
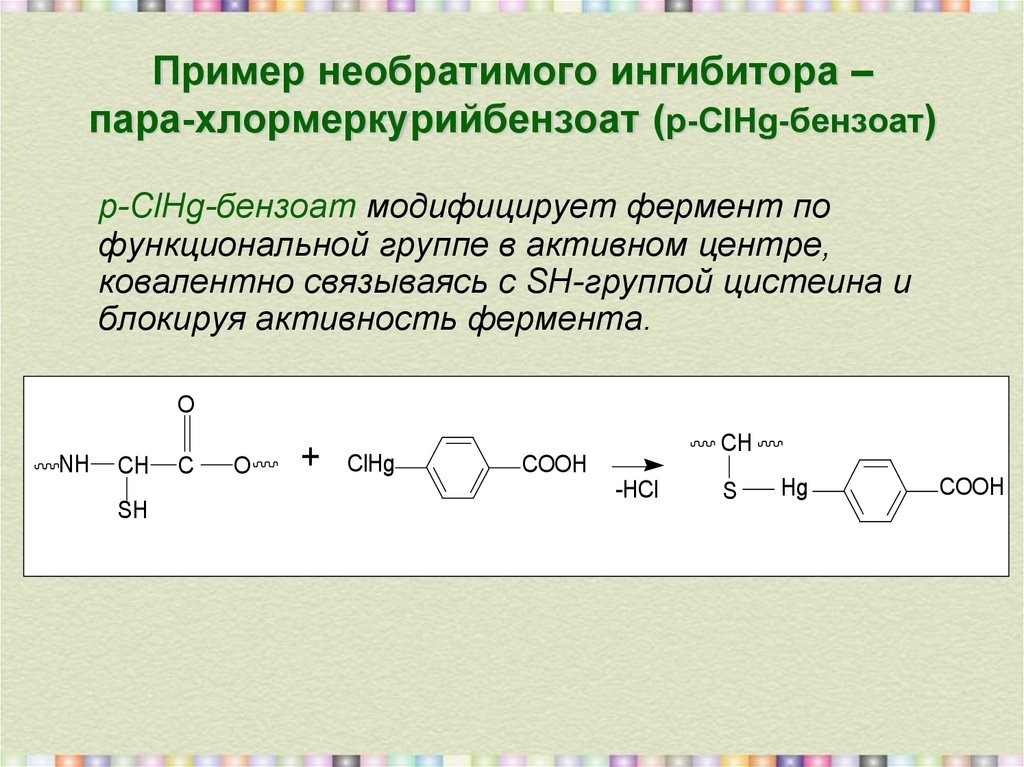
12. Пример необратимого ингибитора – пара-хлормеркурийбензоат (р-ClHg-бензоат)
р-ClHg-бензоат модифицирует фермент пофункциональной группе в активном центре,
ковалентно связываясь с SH-группой цистеина и
блокируя активность фермента.
O
NH
CH
SH
C
O
+ ClHg
CH
COOH
-HCl
S
Hg
COOH
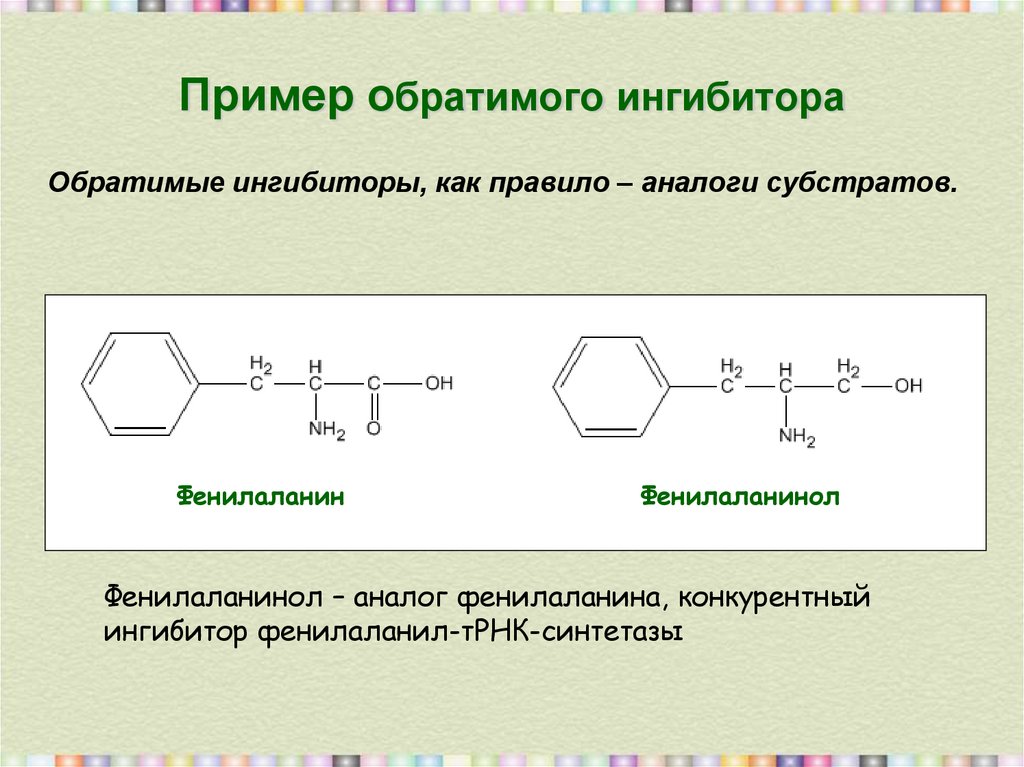
13. Пример обратимого ингибитора
Обратимые ингибиторы, как правило – аналоги субстратов.Фенилаланин
Фенилаланинол
Фенилаланинол – аналог фенилаланина, конкурентный
ингибитор фенилаланил-тРНК-синтетазы
14. Типы ингибирования
1.Конкурентное ингибирование,
2.
Неконкурентное ингибирование,
3.
Бесконкурентное ингибирование,
4.
Смешанное ингибирование.
k1,,k2,, k3, k4, k-1, k-2, k-3, k-4 – константы скорости соответствующих реакций,
KS, KS', KI, KI' – константы диссоциации комплексов фермента с субстратом
и/или ингибитором,
γ, γ', δ – численные коэффициенты.
Рассмотрен случай kβ = 0, то есть когда тройной комплекс ESI не
распадается с образованием продукта. При этом скорость реакции
образования продукта равна:
v = kα[ES] (при [S]0, [I]0 >> [E]0).
15. Конкурентное ингибирование
(δ = γ = 0)Vmax
V=
KS [I ]
1
1
[S ] K I
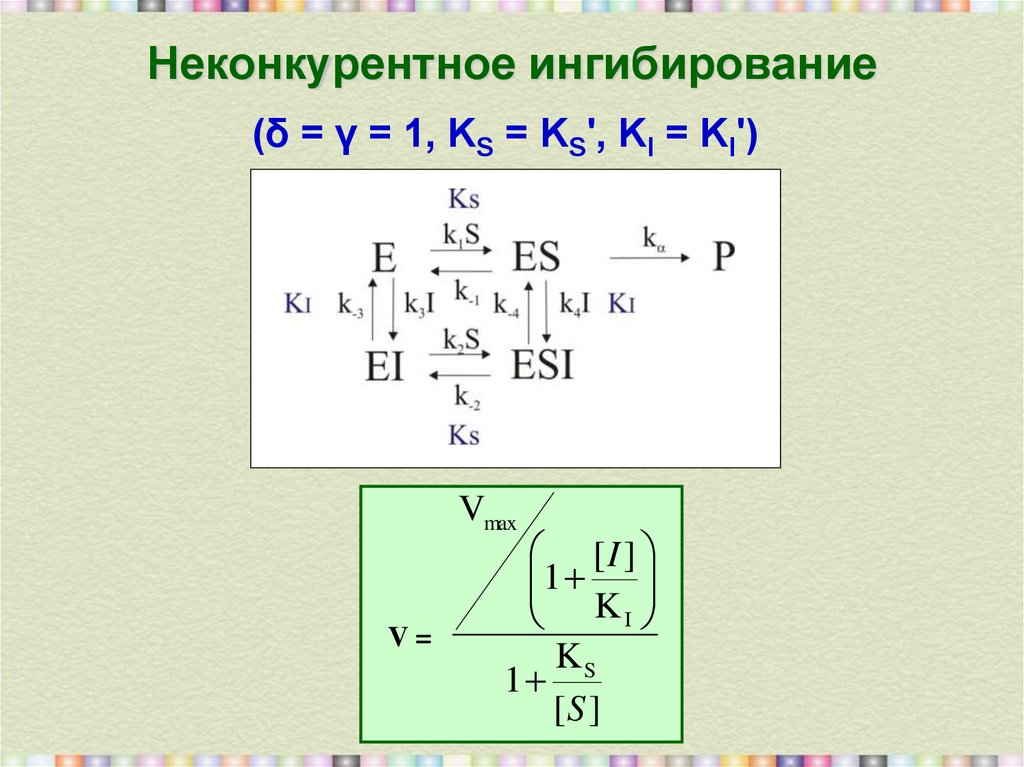
16. Неконкурентное ингибирование
(δ = γ = 1, KS = KS', KI = KI')Vmax
V=
[I ]
1
KI
KS
1
[S ]
17. Смешанное ингибирование
(δ = γ ≠ 1, KS ≠ KS', KI ≠ KI')Vmax
1 [ I ]
K'
I
V=
1 [ I ]
K I
K S
1
[ S ] 1 [ I ]
K'
I
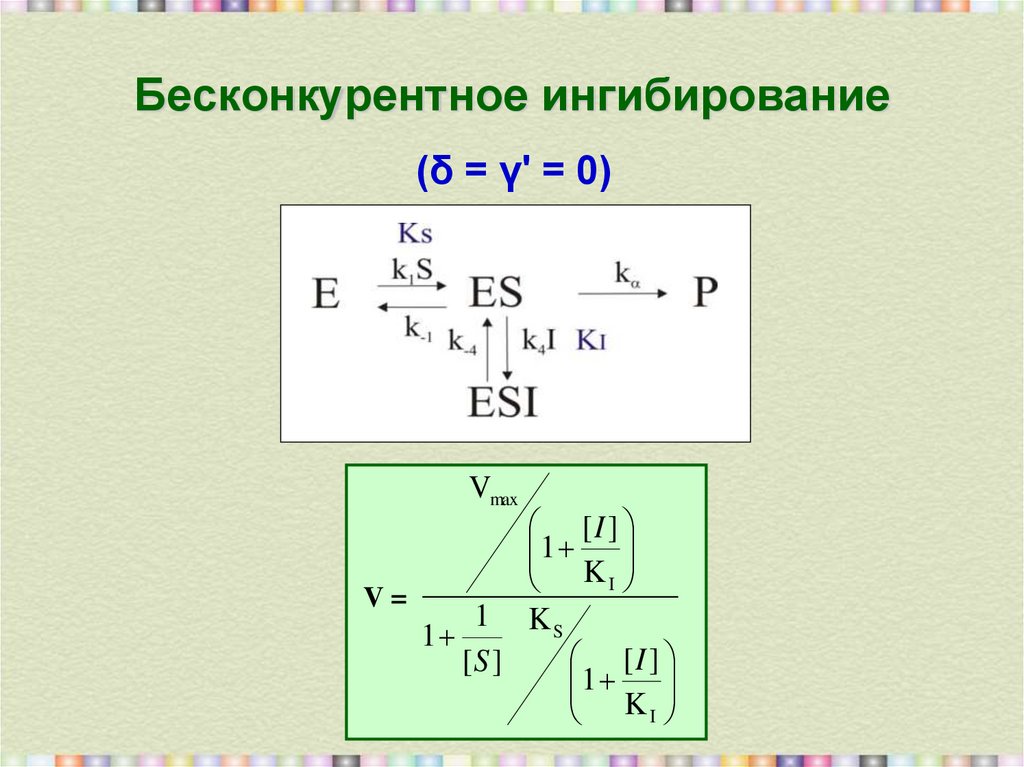
18. Бесконкурентное ингибирование
(δ = γ' = 0)Vmax
[I ]
1
KI
V=
1 KS
1
[I ]
[S ]
1
KI
19. Графические методы определения кинетических параметров реакции в присутствии ингибитора
На приведенных ниже схематически изображенныхграфиках:
V – максимальная скорость реакции,
К – эффективная константа, полученная
экспериментально,
KI – константа ингибирования;
а - конкурентное, б - неконкурентное,
в - смешанное, г - бесконкурентное ингибирование.
20. Метод Лайнуивера-Берка 1/v (1/[S])
I2 > I1, -1/K = -1/KM(1+[I]/KI)Vmax
V=
K [I ]
1 S 1
[S ] K I
1/v
Vmax
V=
[I ]
1
K
I
KS
1
[S ]
1/v
Vmax
Vmax
1 [ I ]
K'I
V=
1 [ I ]
KI
KS
1
[ S ] 1 [ I ]
K'I
V=
1/v
1
1
[S ]
[I ]
1 K
I
KS
[I ]
1 K
I
1/v
1/[S]
а - конкурентное, б - неконкурентное,
в - смешанное, г - бесконкурентное ингибирование
- [I]=0
21. Метод Эди-Хофсти v (v/[S])
I2 > I1, tg α = -K = -KM(1+[I]/KI)Vmax
V=
K [I ]
1 S 1
[S ] K I
v
Vmax
[I ]
1 K
I
KS
1
[S ]
V=
v
Vmax
Vmax
1 [ I ]
K'I
V=
1 [ I ]
KI
KS
1
[ S ] 1 [ I ]
K'I
V=
v
1
1
[S ]
[I ]
1 K
I
KS
[I ]
1 K
I
v
v/[S]
а - конкурентное, б - неконкурентное,
в - смешанное, г - бесконкурентное ингибирование
- [I]=0
22. Метод Диксона 1/v([I])
S2 > S1Vmax
V=
K [I ]
1 S 1
[S ] K I
1/v
Vmax
V=
[I ]
1 K
I
KS
1
[S ]
1/v
Vmax
Vmax
1 [ I ]
K'I
V=
1 [ I ]
KI
KS
1
[ S ] 1 [ I ]
K'I
V=
1/v
1
1
[S ]
[I ]
1 K
I
KS
[I ]
1 K
I
1/v
[I]
а - конкурентное, б - неконкурентное,
в - смешанное, г - бесконкурентное ингибирование
23. Метод Корниш-Боуден [S]/v ([I])
S 2 > S1Vmax
V=
K [I ]
1 S 1
[S ] K I
[S]/v
Vmax
V=
[I ]
1 K
I
KS
1
[S ]
[S]/v
Vmax
Vmax
1 [ I ]
K'I
V=
1 [ I ]
KI
KS
1
[ S ] 1 [ I ]
K'I
V=
[S]/v
1
1
[S ]
[I ]
1 K
I
KS
[I ]
1 K
I
[S]/v
[I]
а - конкурентное, б - неконкурентное,
в - смешанное, г - бесконкурентное ингибирование
24. Применение теории графов в ферментативной кинетике
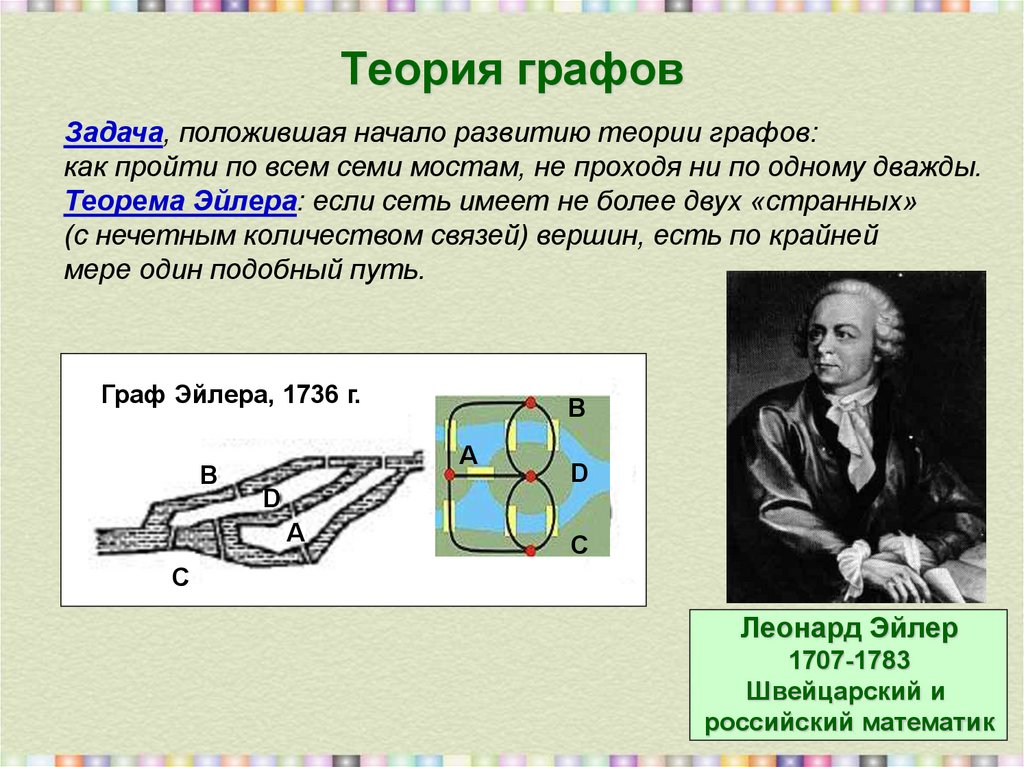
25. Теория графов
Задача, положившая начало развитию теории графов:как пройти по всем семи мостам, не проходя ни по одному дважды.
Теорема Эйлера: если сеть имеет не более двух «странных»
(с нечетным количеством связей) вершин, есть по крайней
мере один подобный путь.
Граф Эйлера, 1736 г.
B
B
A
D
A
D
A
C
C
Леонард Эйлер
1707-1783
Швейцарский и
российский математик
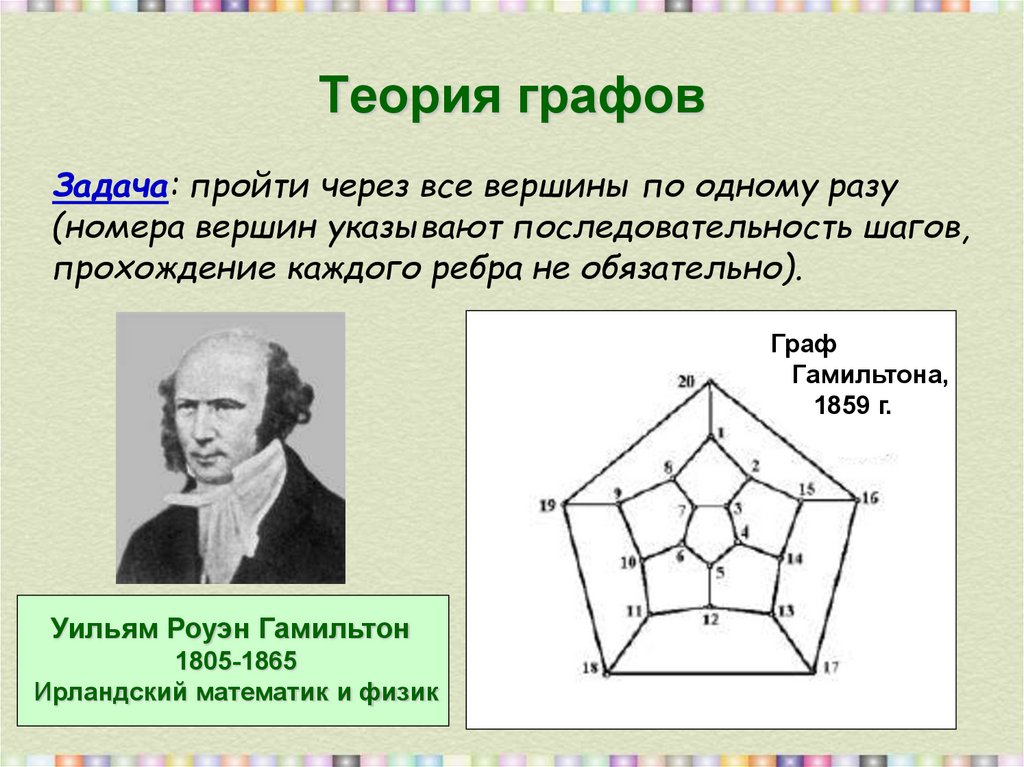
26. Теория графов
Задача: пройти через все вершины по одному разу(номера вершин указывают последовательность шагов,
прохождение каждого ребра не обязательно).
Граф
Гамильтона,
1859 г.
Уильям Роуэн Гамильтон
1805-1865
Ирландский математик и физик
27. Теория графов
Граф – это схематическое изображение некоторого множества элементов иих взаимосвязей. Граф состоит из вершин – узлов и соединяющих их
линий. В применении к ферментативной кинетике узлам сопоставляются
ферментные формы.
Ветви графа – линии, соединяющие узлы, имеют направление. Ветвям
графа сопоставляются элементарные стадии ферментативной реакции.
Вес ветви – число, характеризующее ветвь графа, эквивалентно константе
скорости реакции.
Путь графа – непрерывная совокупность ветвей, в которой ни одна из
вершин не встречается более одного раза, не замкнутая (не должно быть
циклов).
База – одна из вершин.
Базовое дерево – совокупность ветвей, проходящих через все узлы и
ведущих к базе.
Определитель узла (базы) (D) – сумма величин (базовых) деревьев.
Скорость ферментативной реакции можно выразить формулой:
kD
v=E
,
D
r
r
0
где kr – константа скорости реакции, приводящей к
i
образованию продукта.
28. Теория графов. Пример 1: односубстратная ферментативная реакция
Граф:kr = k2
Вес параллельных ветвей, ведущих от узла ES к узлу E, складывается:
Dr = DES = k1S
DE = k-1 + k2
k 2 k 1S
v = E0
k 1S k -1 k 2
k 2E0
k k2 1
1 -1
k1 S
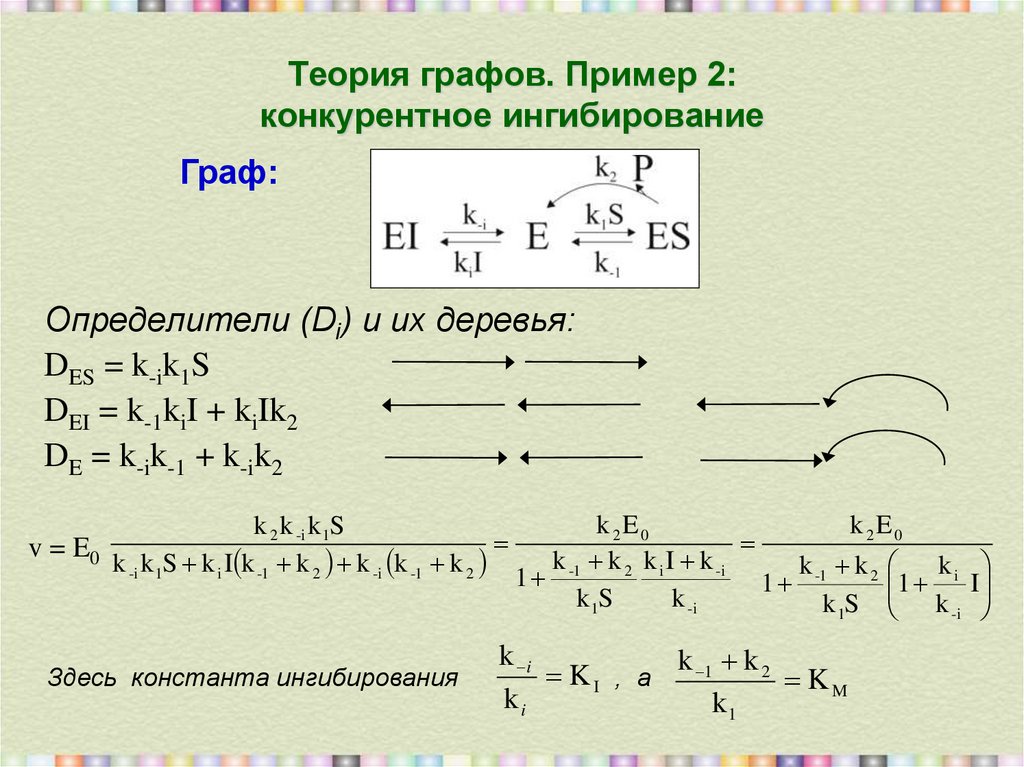
29. Теория графов. Пример 2: конкурентное ингибирование
Граф:Определители (Di) и их деревья:
DES = k-ik1S
DEI = k-1kiI + kiIk2
DE = k-ik-1 + k-ik2
k 2 k -i k 1S
v = E0
k -i k 1S k i I k -1 k 2 k -i k -1 k 2
Здесь константа ингибирования
k 2E0
k 2E0
k k 2 k i I k -i
k k2
k
1 -1
1 i I
1 -1
k 1S
k -i
k 1S k -i
k i
k 1 k 2
KI , а
KM
ki
k1
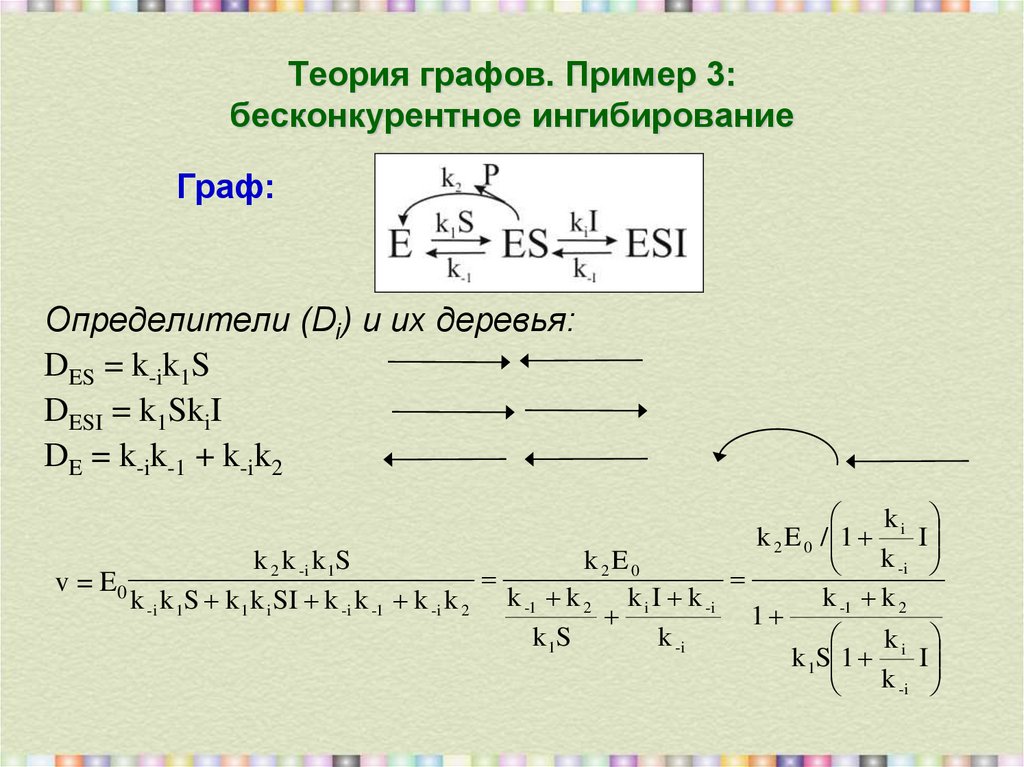
30. Теория графов. Пример 3: бесконкурентное ингибирование
Граф:Определители (Di) и их деревья:
DES = k-ik1S
DESI = k1SkiI
DE = k-ik-1 + k-ik2
k
k 2 E 0 / 1 i I
k -i
k 2E0
k 2 k -i k 1S
v = E0
k -1 k 2
k -i k 1S k 1 k i SI k -i k -1 k -i k 2 k -1 k 2 k i I k -i
1
k 1S
k -i
k
k 1S 1 i I
k -i






![Метод Лайнуивера-Берка 1/v (1/[S]) Метод Лайнуивера-Берка 1/v (1/[S])](https://cf4.ppt-online.org/files4/slide/w/wrkQx58XIac6tMy1p0FvKqfeGdN9EoiUbBAZJ4/slide-19.jpg)
![Метод Эди-Хофсти v (v/[S]) Метод Эди-Хофсти v (v/[S])](https://cf4.ppt-online.org/files4/slide/w/wrkQx58XIac6tMy1p0FvKqfeGdN9EoiUbBAZJ4/slide-20.jpg)
![Метод Диксона 1/v([I]) Метод Диксона 1/v([I])](https://cf4.ppt-online.org/files4/slide/w/wrkQx58XIac6tMy1p0FvKqfeGdN9EoiUbBAZJ4/slide-21.jpg)
![Метод Корниш-Боуден [S]/v ([I]) Метод Корниш-Боуден [S]/v ([I])](https://cf4.ppt-online.org/files4/slide/w/wrkQx58XIac6tMy1p0FvKqfeGdN9EoiUbBAZJ4/slide-22.jpg)



 biology
biology physics
physics chemistry
chemistry








