Similar presentations:
Халькогены - «рождающие медные руды»
1.
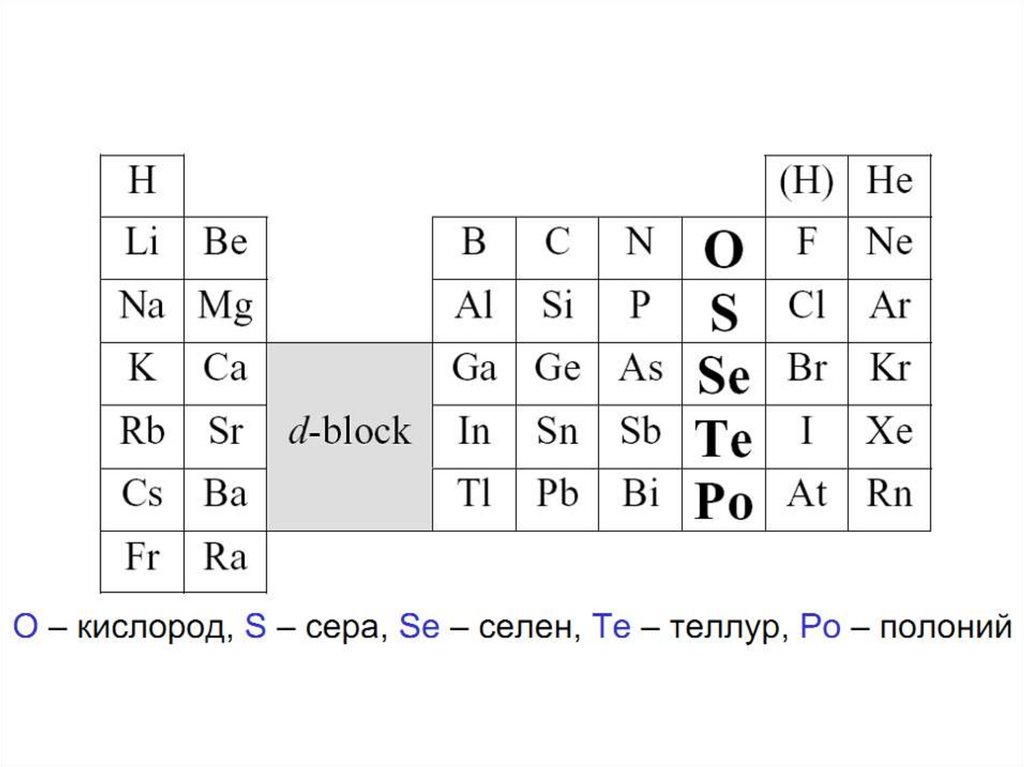
ХАЛЬКОГЕНЫ(-
«рождающие медные руды»)
2.
3.
4.
5.
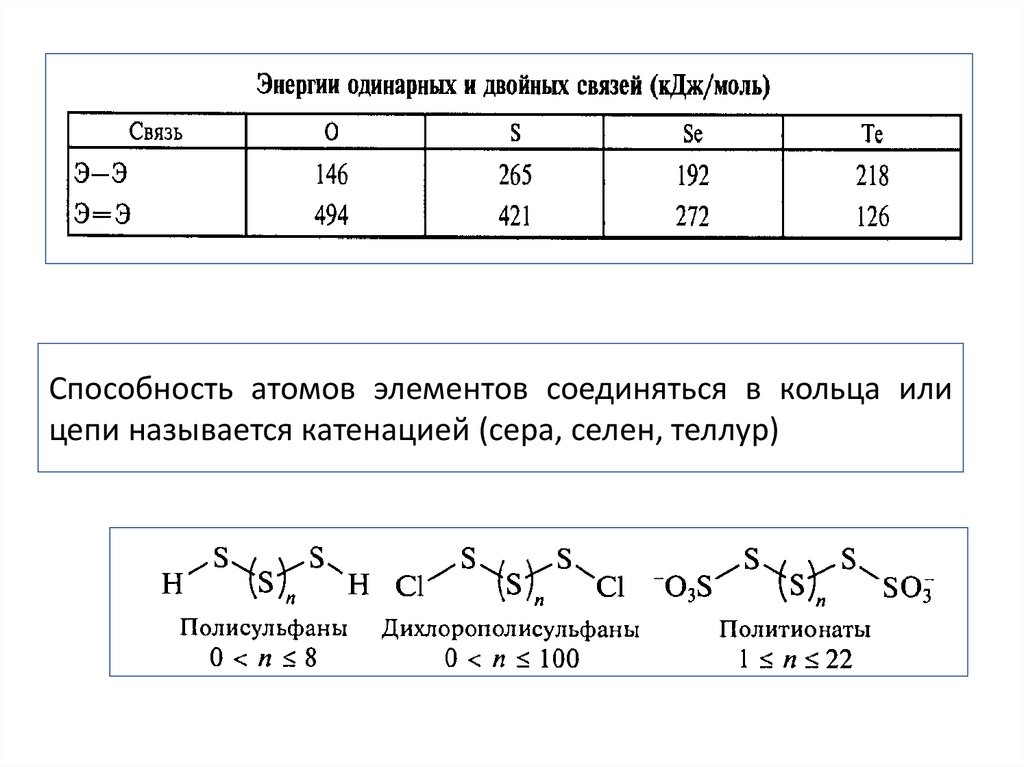
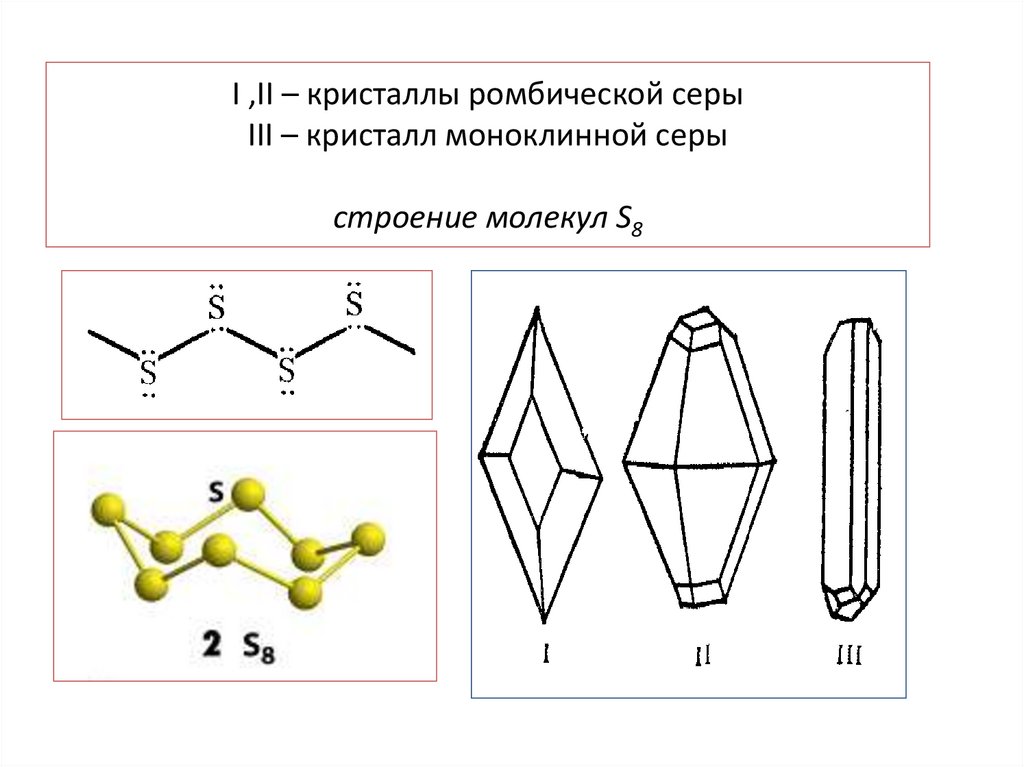
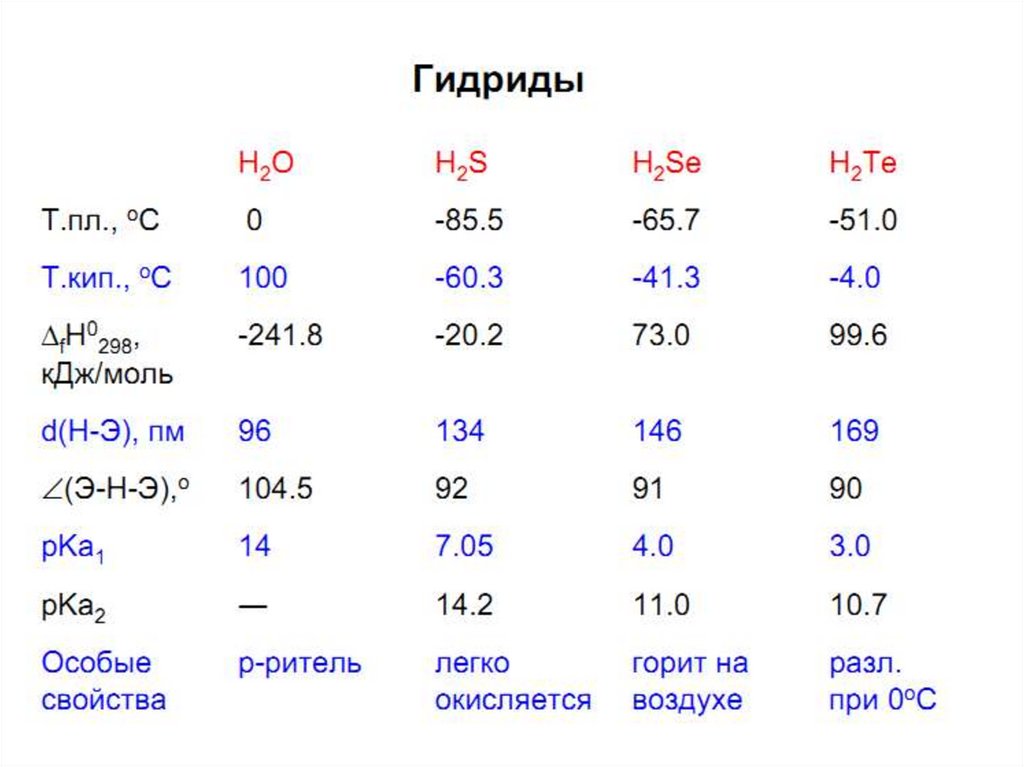
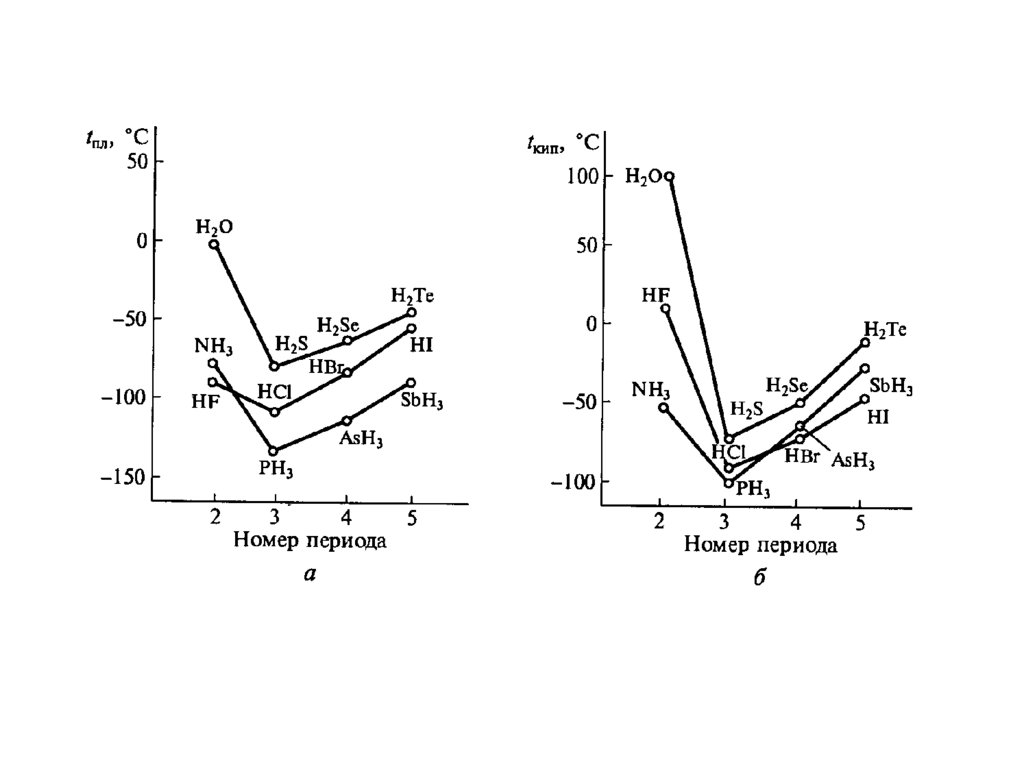
Способность атомов элементов соединяться в кольца илицепи называется катенацией (сера, селен, теллур)
6.
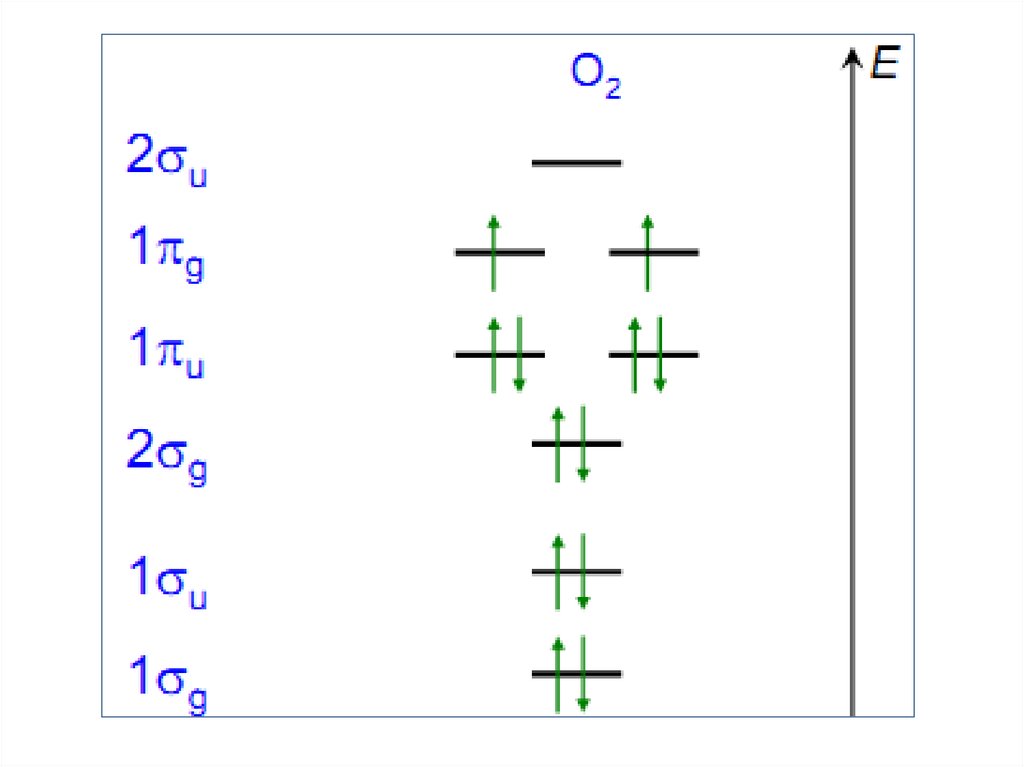
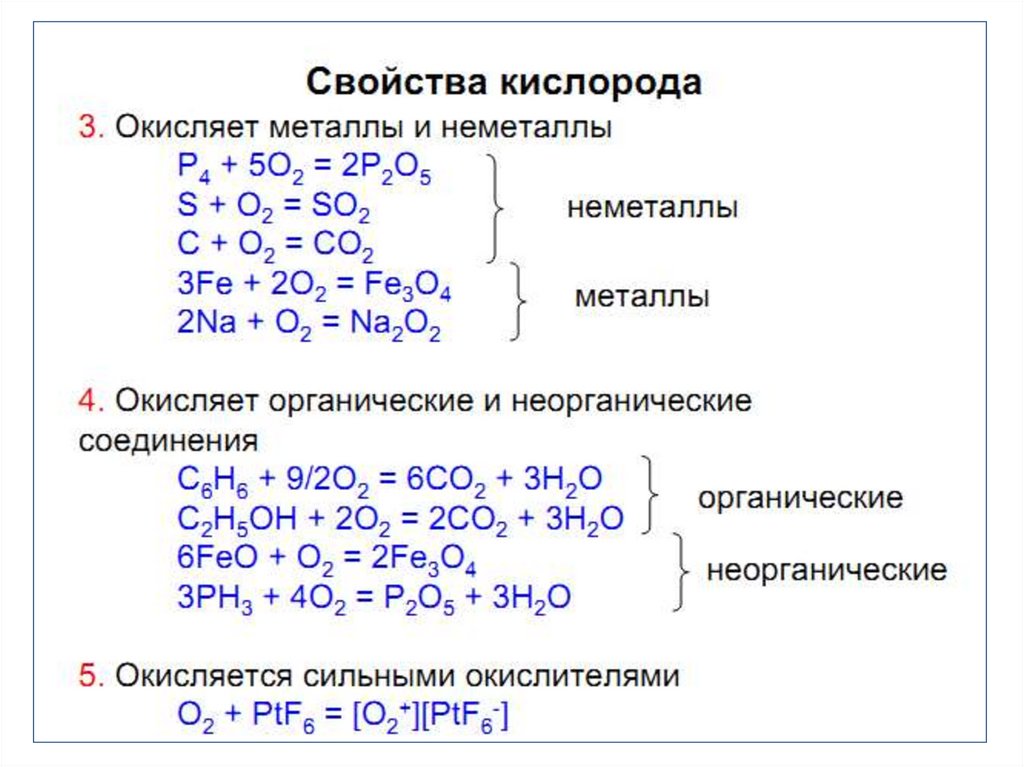
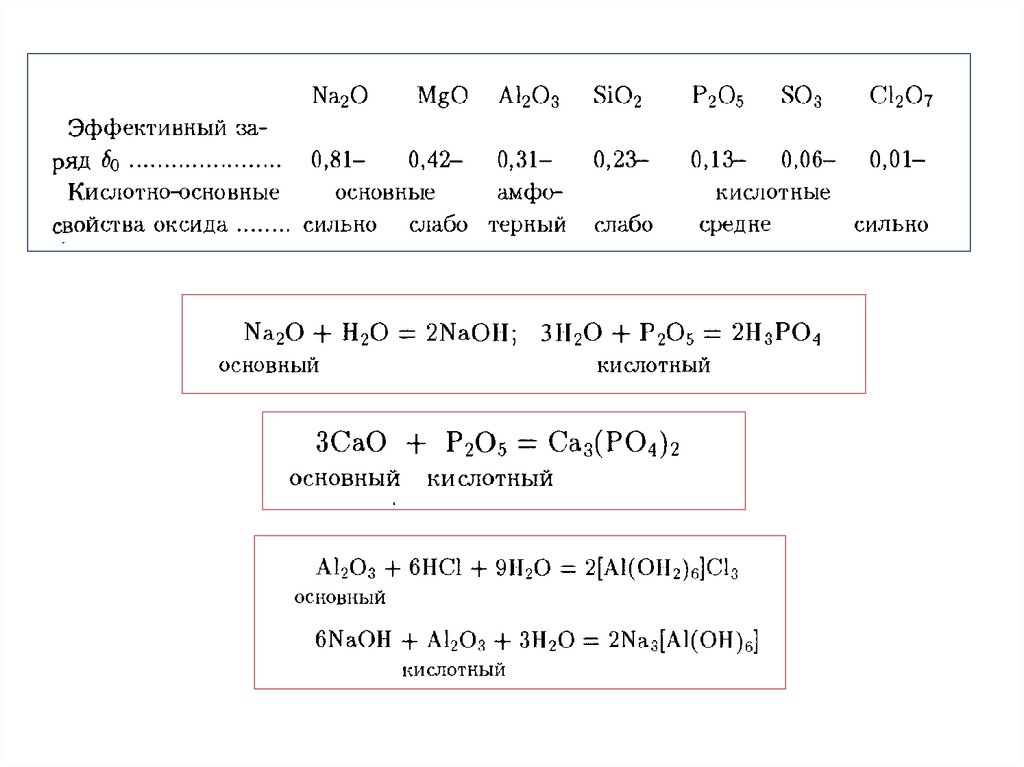
КИСЛОРОД7.
• Самый распространенный элемент земнойкоры 49% общей массы:
• Вода,
кремнезем,
силикаты
и
алюмосиликаты, известняки, мраморы,
бокситы, гематиты и др минералы и горные
породы;
• Как О2 – 21% земной атмосферы
8.
Получение• в природе - Фотосинтез:
• В
промышленности:
сжижением
и
фракционной
перегонкой
воздуха,
электролизом воды;
9.
получение• В лаборатории:
• 1772 г. К. Шееле: 2KNO3 2KNO2 + O2 (t)
• Дж. Пристли: 2 HgO 2 Hg + O2 (t)
Разложение оксидов, пероксидов и кислородсодержащих солей:
10.
11.
12.
13.
14.
15.
16.
17.
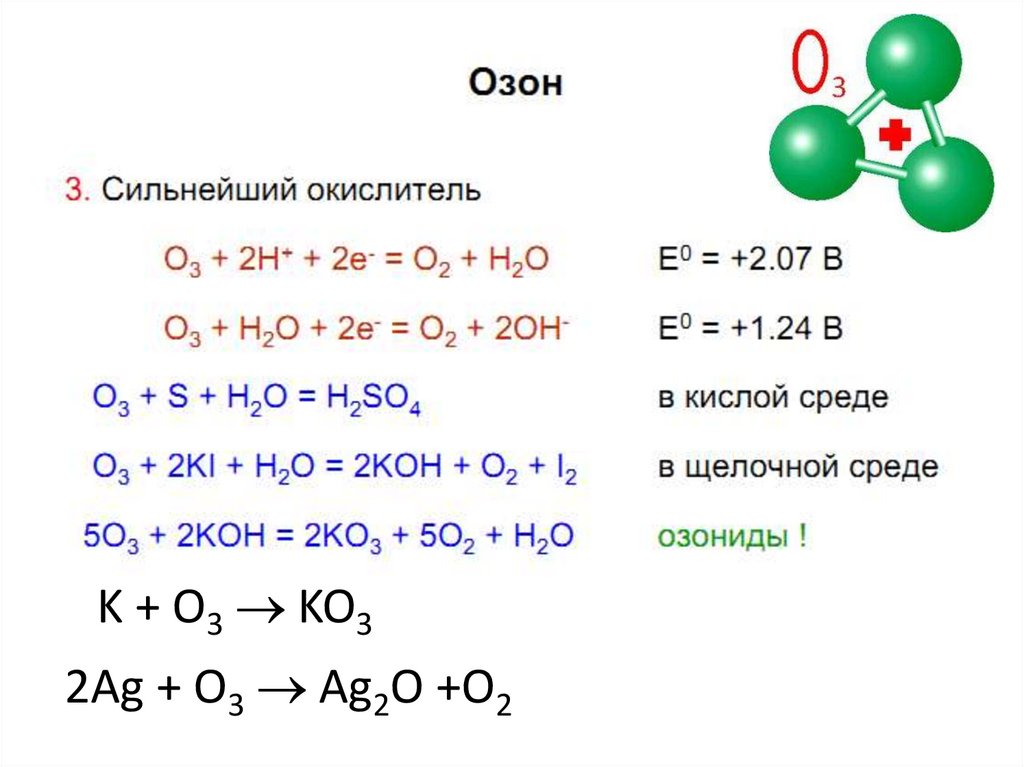
K + O3 KO32Ag + O3 Ag2O +O2
18.
19.
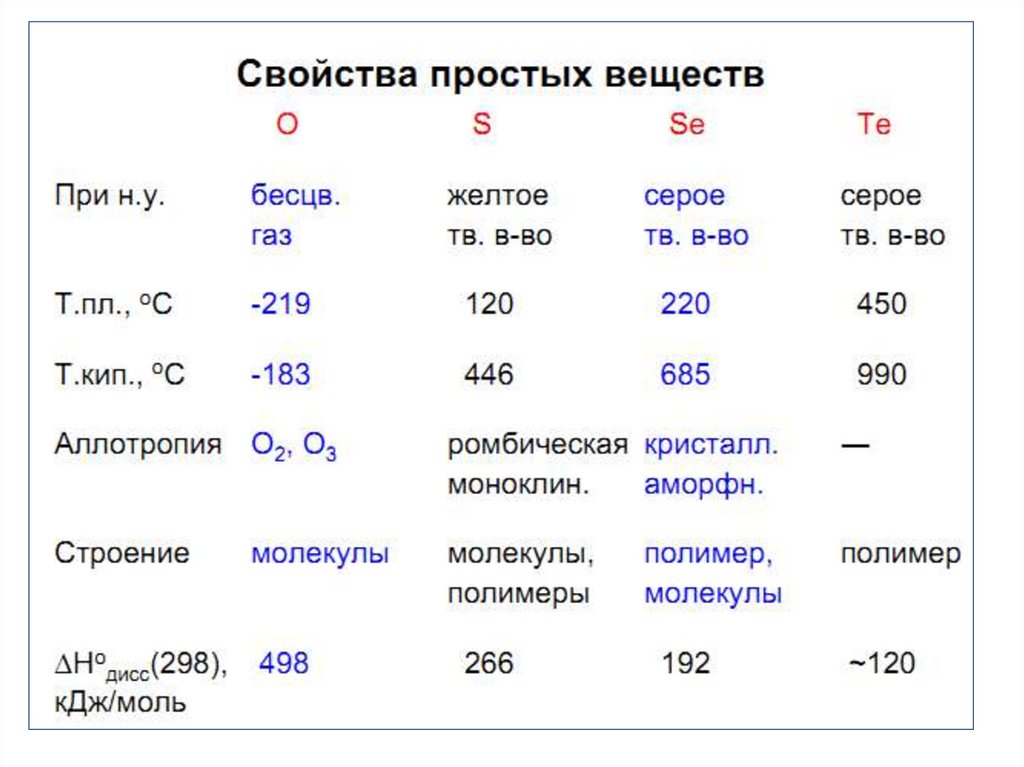
I ,II – кристаллы ромбической серыIII – кристалл моноклинной серы
строение молекул S8
20.
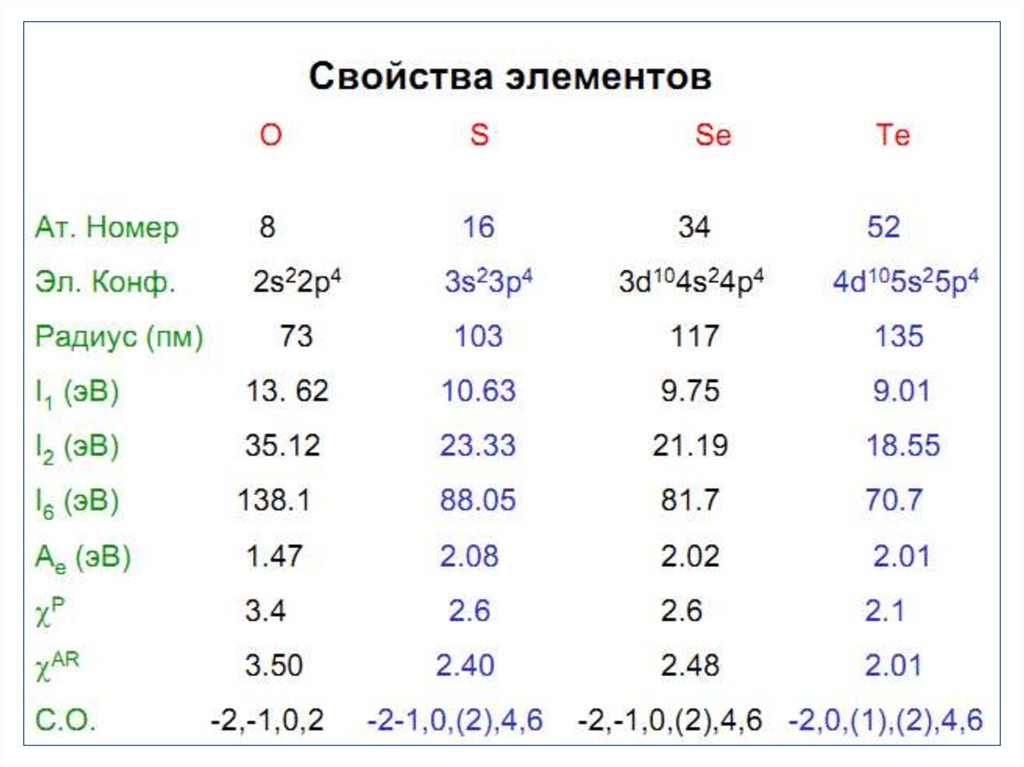
Химические свойства серы• Сера по активности уступает кислороду.
Непосредственно соединяется со всеми
элементами кроме благ.газов, азота, йода,
теллура, платины, золота.
• Исходя из ЭО (2,6) сера выступает как в
роли окислителя, так и восстановителя.
21.
Сера - окислитель• при нагревании непосредственно может
взаимодействовать с металлами:
S + Fe = FeS,
3 S + 2 Al = Al2S3,
Zn + S =ZnS
S + Hg = HgS (при к.Т. )
• с неметаллами (t, C):
S + H2 = H2S,
С + 2S = CS2,
22.
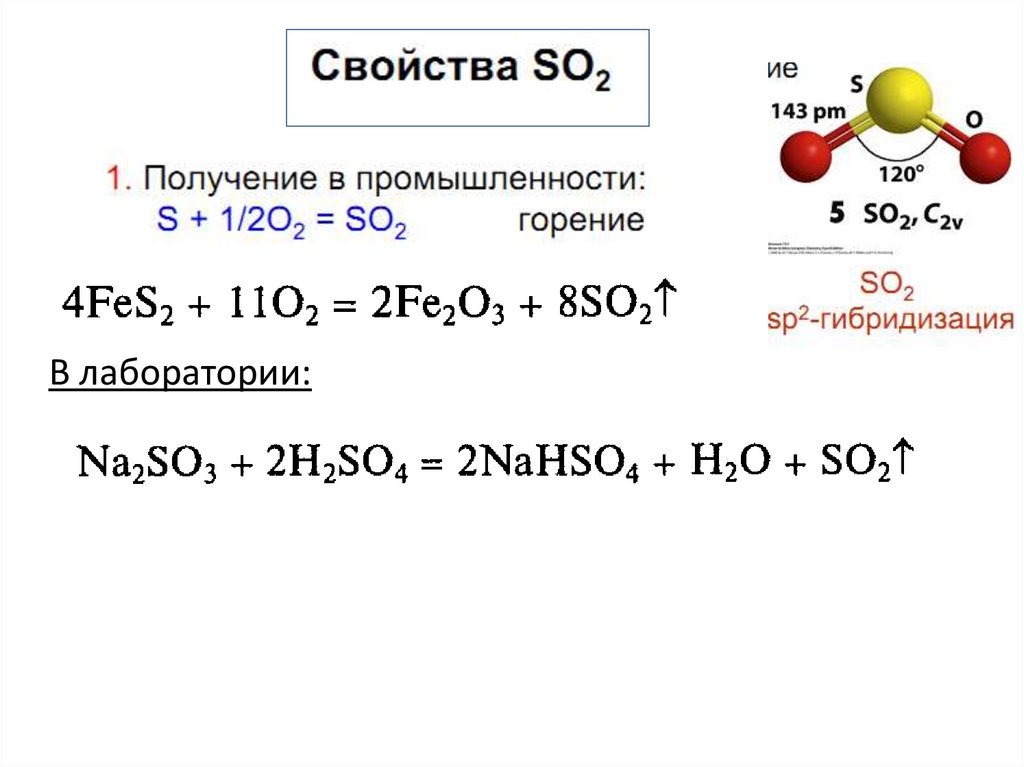
С сильными окислителями сера восстановитель:S + O2 = SO2,
S + 2H2SO4(конц) = 3SO2 + 2 H2O,
S + 6HNO3(конц) = H2SO4 + 6NO2 + 2H2O,
S + 3Na2O2 = Na2SO4 + 2 Na2O.
в горячих растворах щелочей диспропорционирует:
23.
Сульфиды24.
Способы получения• Растворимые сульфиды- нейтрализация щелочей
сероводородной кислотой и восстановление
сульфатов углем:
• Нерастворимые – синтез из простых веществ и
обменные реакции:
25.
Все сульфиды – восстановители.Продукты окисления: S, SO2, сульфаты
26.
27.
28.
Сероводород (Н2S)Получение:
29.
Полисульфиды (персульфиды)M2SnПолисульфиды водорода Н2Sn (n = 2-23)
30.
В лаборатории:31.
32.
Сернистая кислота• Получение:
• Поглощает кислород из воздуха:
• Хороший восстановитель:
• С сильными восстановителями- окислитель:
33.
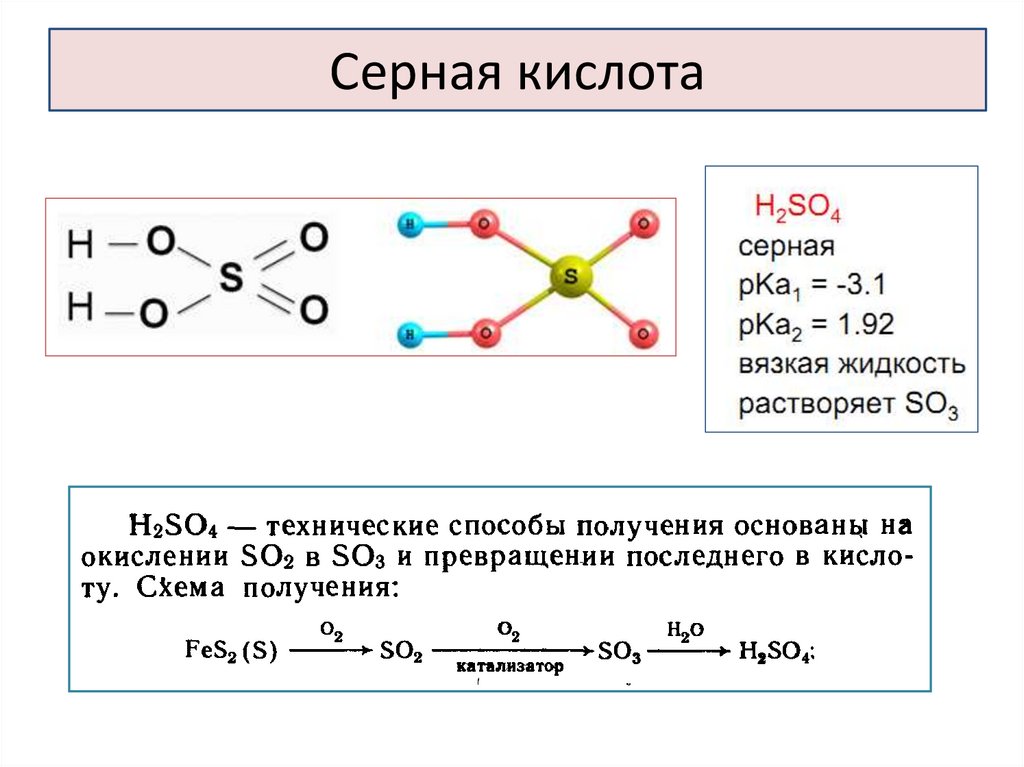
Серная кислота34.
35.
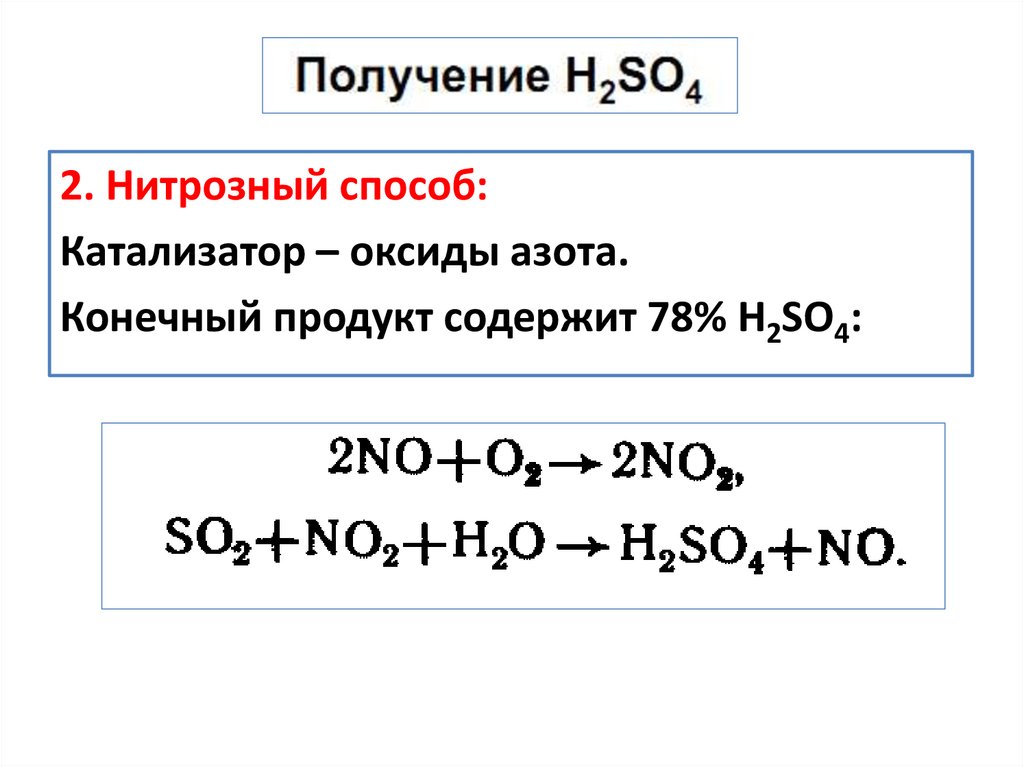
2. Нитрозный способ:Катализатор – оксиды азота.
Конечный продукт содержит 78% Н2SO4:
36.
Н2SO4(разб.)разбавленный раствор серной кислоты взаимодействует
только с металлами активными и средней активности ( до
водорода).
37.
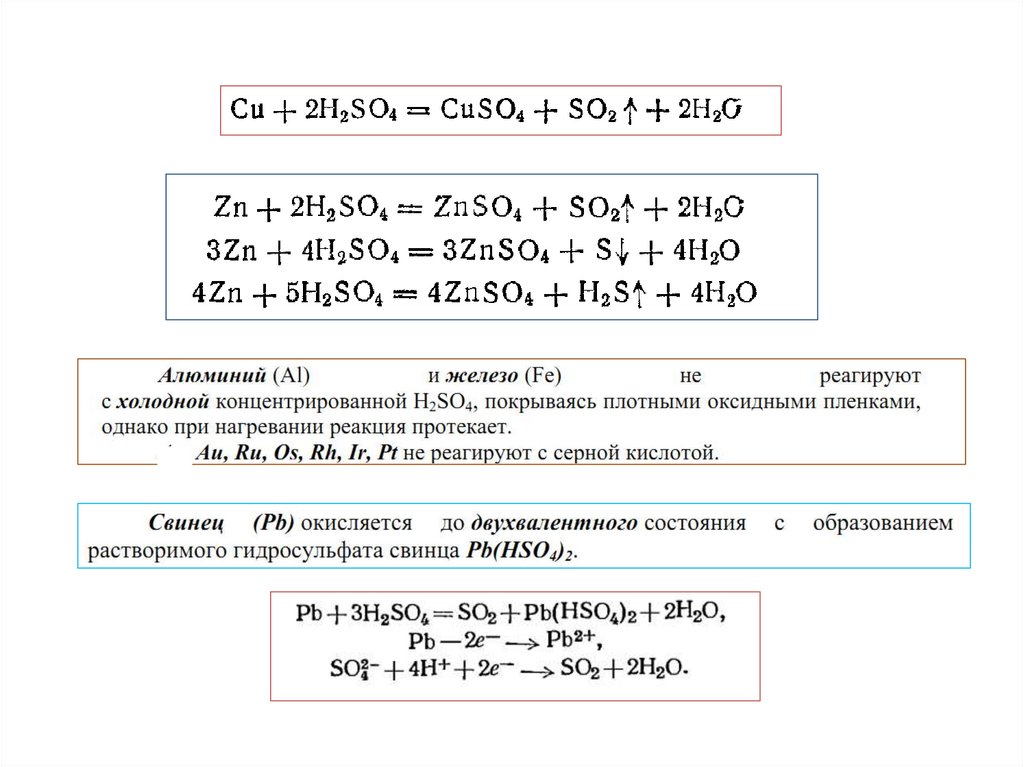
Н2SO4(разб.)• Металлы с переменной валентностью окисляются
разбавленным раствором серной кислоты до низших
положительных степеней окисления:
Свинец (Pb) не растворяется в серной кислоте (если ее
концентрация ниже 80%), так как образующаяся соль PbSO4
нерастворима и создает на поверхности металла защитную пленку.
38.
Н2SO4(конц)• В конц. ра-ре серной кислоты (выше 68%) большинство молекул
находятся в недиссоциированном состоянии, поэтому функцию
окислителя выполняет сера, находящаяся в высшей степени окисления
(S+6).
• Концентрированная H2SO4 окисляет все металлы, стандартный
электродный потенциал которых меньше потенциала окислителя –
сульфат - иона SO42-(0,36 В).
• Процесс взаимодействия металлов с концентрированной серной
кислотой в большинстве случаев протекает по схеме:
39.
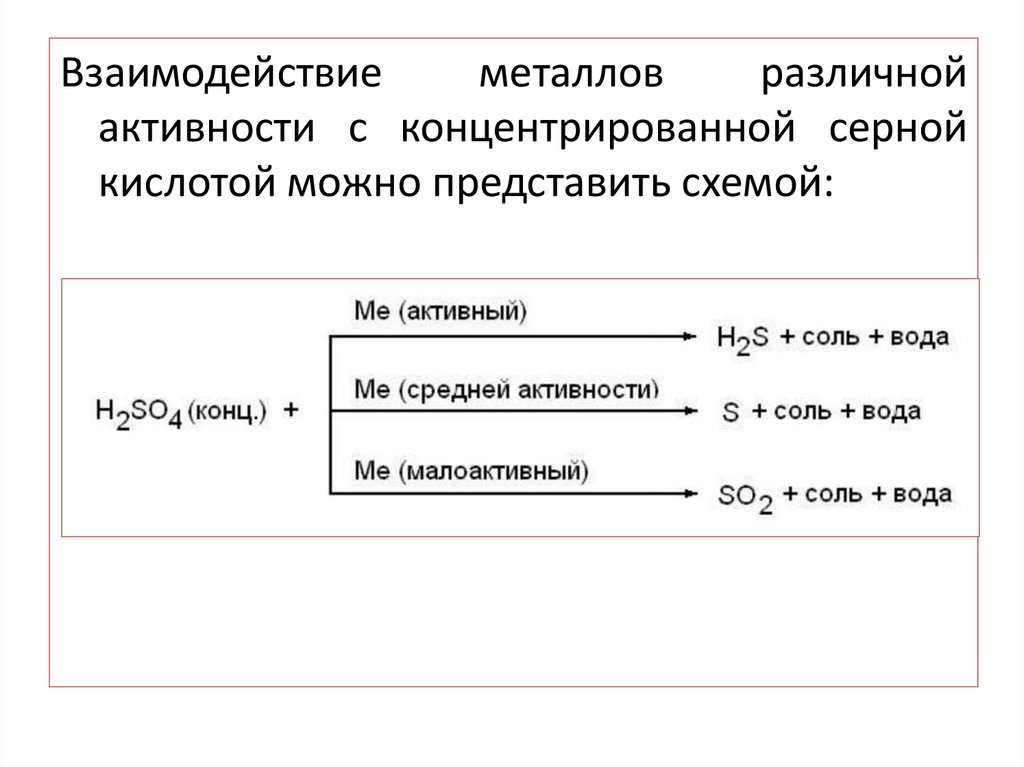
Взаимодействиеметаллов
различной
активности с концентрированной серной
кислотой можно представить схемой:

























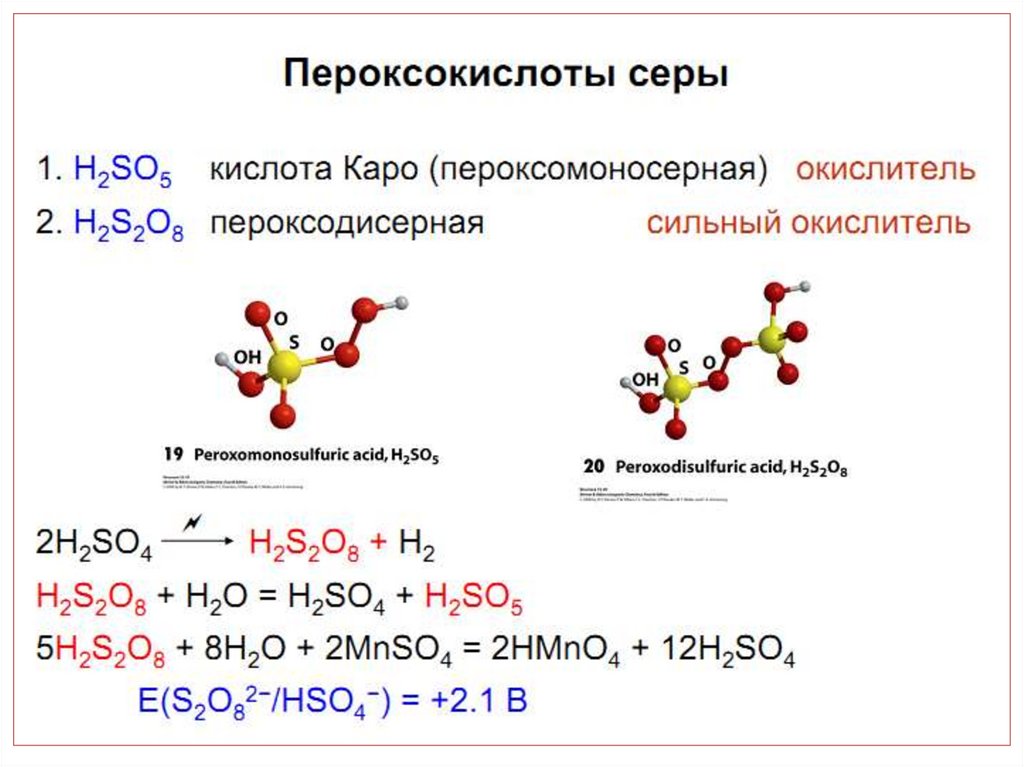
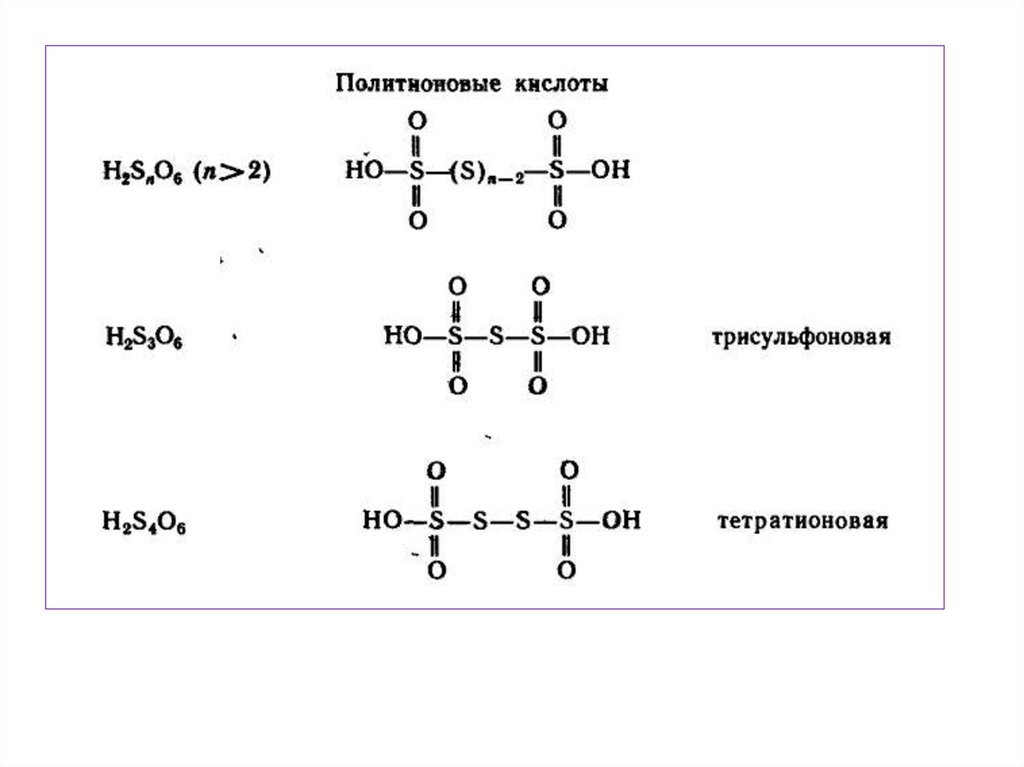
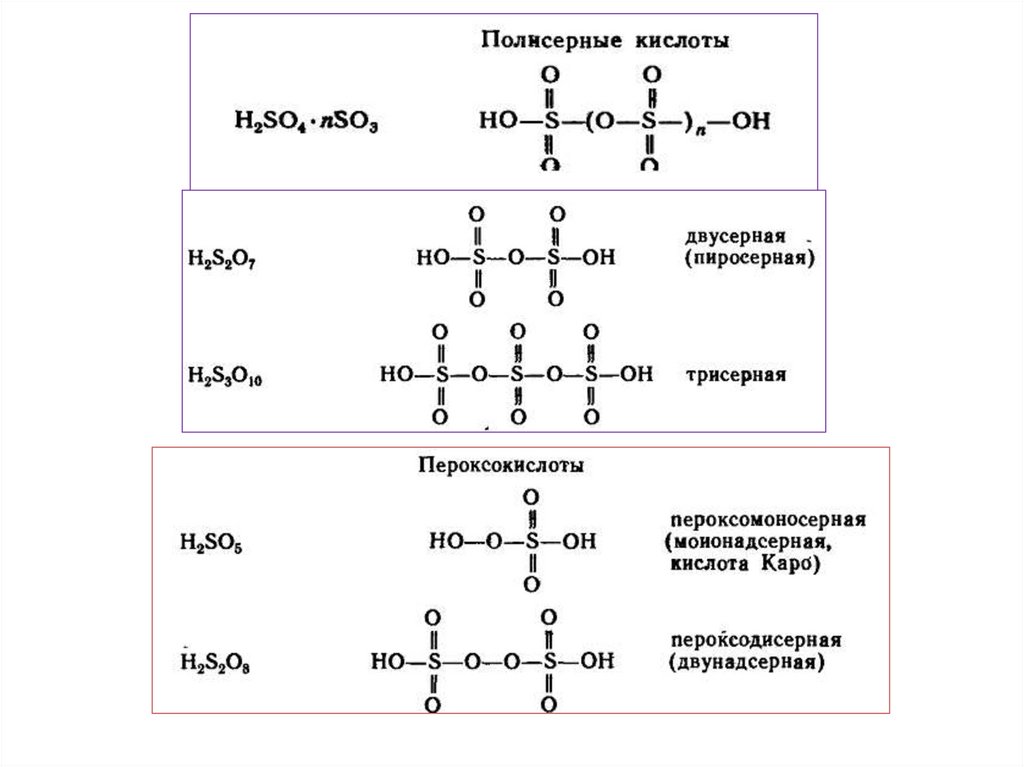



 chemistry
chemistry








