Similar presentations:
Спирты: общая характеристика
1.
Спирты: общаяхарактеристика
Преподаватель Юридического колледжа
Валентина Владимировна Киреева
2.
РЕМОНТЧеловек был знаком с процессом спиртового
брожения не менее чем за 8000 лет до нашей эры.
В Китае производились спиртосодержащие
напитки из риса, мёда, винограда и других фруктов
в 6500 - 7000 гг. до н. э.
Впервые спирт из вина получили в VI-VII
веках арабские химики; способ получения спирта
содержится в записях персидского алхимика АрРази.
В Европе этиловый спирт был получен из
продуктов брожения в XI—XII веке, в Италии
3.
РЕМОНТСпирты́
(алкого́ли)
—
органические
соединения,
содержащие одну или несколько
гидроксильных групп (OH),
связанных с атомом С в
углеводородном
радикале
4.
РЕМОНТПо номенклатуре ИЮПАК
названия спиртов образуются от
названий алканов с
добавлением суффикса «-ол»,
положение ОН-группы
указывается в конце названия.
5.
РЕМОНТКлассификация спиртов
6.
РЕМОНТПо характеру углеродного радикала
1. Предельные
CH3- CH2- OH
2. Непредельные
CH2=CH-OH
3. Ароматические
-СН 2 -ОН
7.
РЕМОНТПо количеству гидроксильных групп
1. Одноатомные
СН3-CH2-ОН
2. Многоатомные
Двухатомные
Трехатомные
Шестиатомные
СН2-СН2
|
|
ОН ОН
СН2-СН-СН2
|
| |
ОН ОН ОН
СН2-СН-СН-CH-CH-СН2
|
| | |
|
|
ОН ОН ОН ОН OH OH
8.
РЕМОНТПредельные одноатомные спирты
(алканолы)
- органические соединения, в молекулах
которых алкильный радикал (CnH2n+1) связан
с гидроксильной группой
Общая формула Cn H 2n+1OH
9.
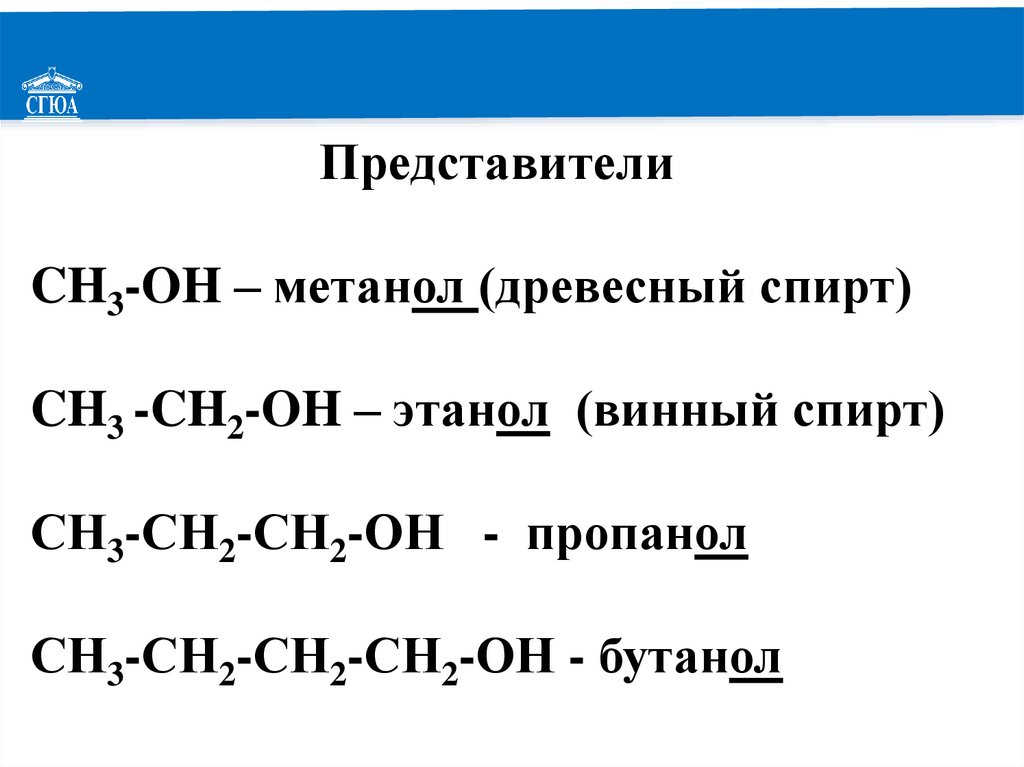
РЕМОНТПредставители
CH3-OH – метанол (древесный спирт)
CH3 -CH2-OH – этанол (винный спирт)
СН3-СН2-СН2-ОН - пропанол
СН3-СН2-СН2-СН2-ОН - бутанол
10.
РЕМОНТИзомерия спиртов
1. Изомерия положения OH- группы
CH3-CH2-CH2-OH
1
2
пропанол-1
3
CH3-CH-CH3
l
OH
пропанол-2
11.
РЕМОНТИзомерия спиртов
2. Изомерия углеродного скелета
CH3-CH2-CH2-CH2-OH
3
2
Бутанол
1
CH3-CH-CH2-OH
l
CH3
2 - метилпропанол
12.
РЕМОНТФизические свойства спиртов
Легче
воды,
бесцветны,
жидкие
имеют
специфический запах.
Метанол, этанол и пропанол неограниченно
растворяются в воде, с увеличением числа углеродных
атомов растворимость уменьшается, высшие спирты –
твердые, не растворяются в воде.
Метанол - сильный яд нервного и сердечнососудистого действия; поражает органы зрения вплоть до
полной слепоты. В больших дозах (30 г и более) вызывает
смерть.
Этанол - его употребление приводит к нарушению
важнейших функций организма, тяжелому поражению
органов и систем.
13.
РЕМОНТХимические свойства спиртов
14.
РЕМОНТ1.Спирты как слабые кислоты
реагируют со щелочными металлами:
2С2Н5ОН + 2Na → 2C2H5ONa + H2
алкоголят натрия
15.
РЕМОНТ2. Как слабые основания реагируют с
сильными кислотами:
Н2SO4
С2Н5ОН + НСl →
С2Н5Сl + Н2О
16.
РЕМОНТ3. Окисление
a) Горение:
C2H5OH+ 3O2 → 2CO2+3H2O + Q
б) Окисление спиртов оксидом меди
до альдегидов:
17.
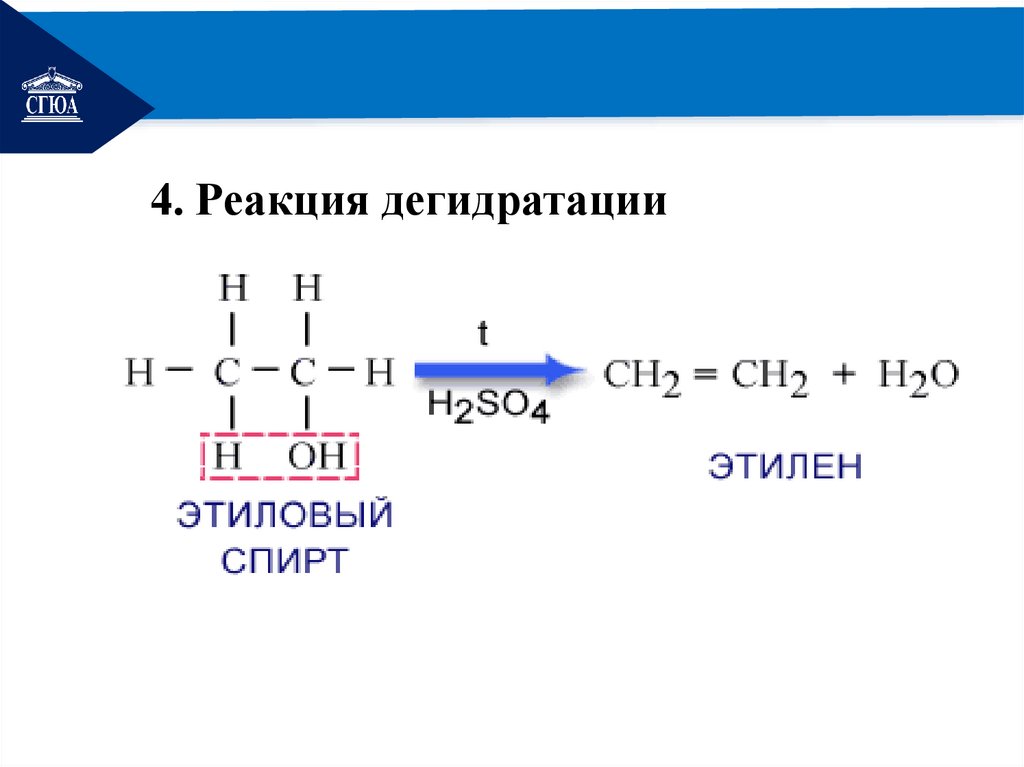
РЕМОНТ4. Реакция дегидратации
18.
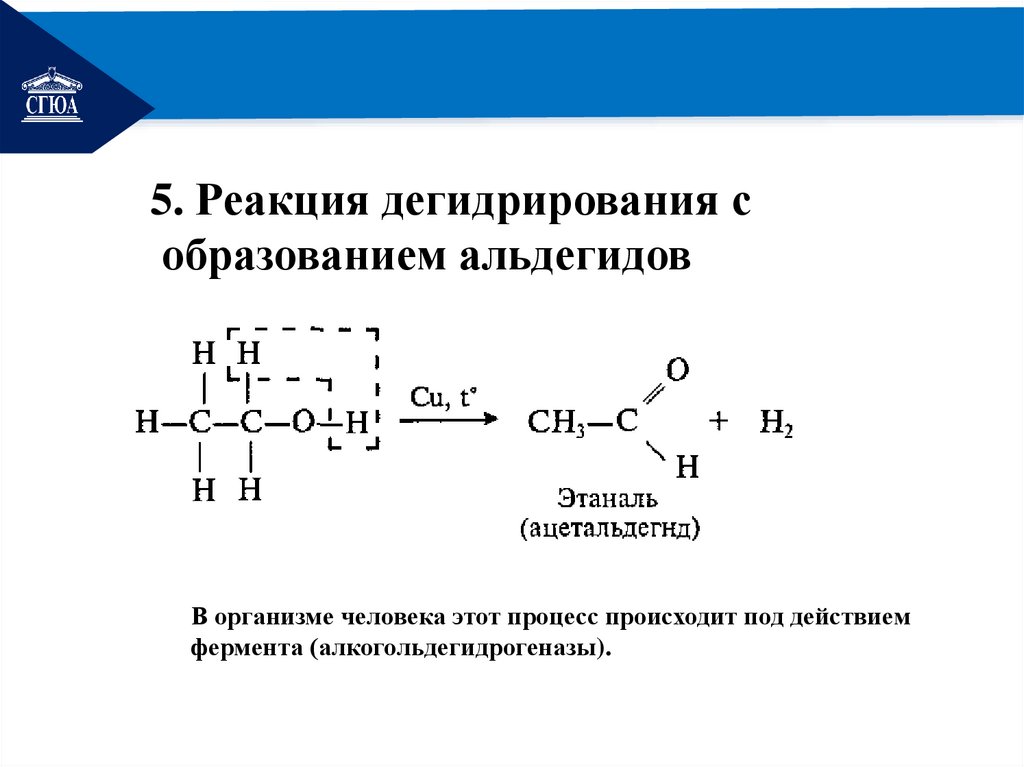
РЕМОНТ5. Реакция дегидрирования с
образованием альдегидов
В организме человека этот процесс происходит под действием
фермента (алкогольдегидрогеназы).
19.
РЕМОНТ6. Дегидрирование и дегидратация реакция Лебедева
20.
РЕМОНТ7. Этерификация – реакция между
спиртами и кислотами с образованием
сложных эфиров
21.
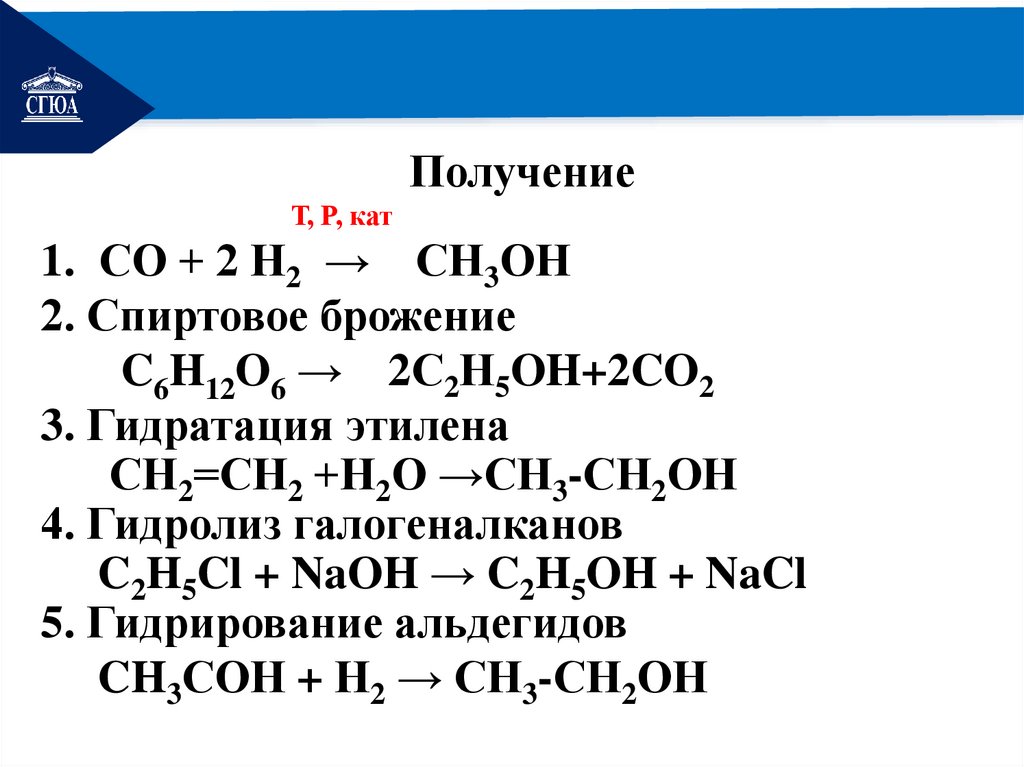
РЕМОНТПолучение
Т, Р, кат
1. СО + 2 Н2 → СН3ОН
2. Спиртовое брожение
C6H12O6 → 2С2Н5OH+2CO2
3. Гидратация этилена
СН2=СН2 +Н2О →СН3-СН2ОН
4. Гидролиз галогеналканов
C2H5Cl + NaOH → C2H5OH + NaCl
5. Гидрирование альдегидов
CH3СОН + Н2 → СН3-СН2ОН
22.
РЕМОНТПрименение
1. производство уксусной кислоты и
алкогольных напитков, лаков, сложных
эфиров, синтетических каучуков;
2. косметика и парфюмерия;
3. медицинские препараты;
4. топливо.
23.
РЕМОНТС2Н6 → С2Н4 → С2Н5ОН → СН3СОН
24.
РЕМОНТМногоатомные спирты
25.
РЕМОНТЭтандиол (этиленгликоль) - CH2 – CH2
сиропообразная жидкость
сладкого вкуса, без запаха, OH OH
ядовит. Смертельная доза для
человека - 50-150 мл.
Хорошо смешивается с водой и
спиртом, гигроскопичен.
Компонент автомобильных
антифризов и незамерзающих
жидкостей.
Применяется для получения лавсана.
26.
РЕМОНТПропантриол – глицерин
• Сиропообразная,
CH2 – CH – CH2
гигроскопичная,
сладкая на вкус жидкость. OH OH OH
• Неограниченно растворим в
воде.
• С азотной кислотой с образует
нитроглицерин.
• С карбоновыми кислотами
образует жиры и масла.
• Не ядовит.
27.
РЕМОНТПрименение глицерина
В производстве взрывчатых
веществ и сосудорасширяющего
лекарства (нитроглицерина),
пластмасс .
В текстильной и кожевенной
промышленности.
Как пищевая добавка E422.
Входит в состав кремов, помад,
зубных паст, моющих средств,
предотвращая их от высыхания и
способствуя увлажнению и
смягчению кожи
28.
РЕМОНТКачественная реакция на многоатомные спирты
- взаимодействие со свежеполученным осадком
гидроксида меди( II), который растворяется с
образованием ярко-синего раствора
29.
СПАСИБО ЗАВНИМАНИЕ!

























 chemistry
chemistry








