Similar presentations:
Жесткость воды. Причины образования жесткой воды
1.
лаЖесткость воды
Рого
Презентация по химии
ва
Дарь
я
2.
Жесткость воды — совокупность свойств,обусловленных количеством и видом
растворенных в ней солей
щелочноземельных металлов, в основном,
кальция и магния.
3.
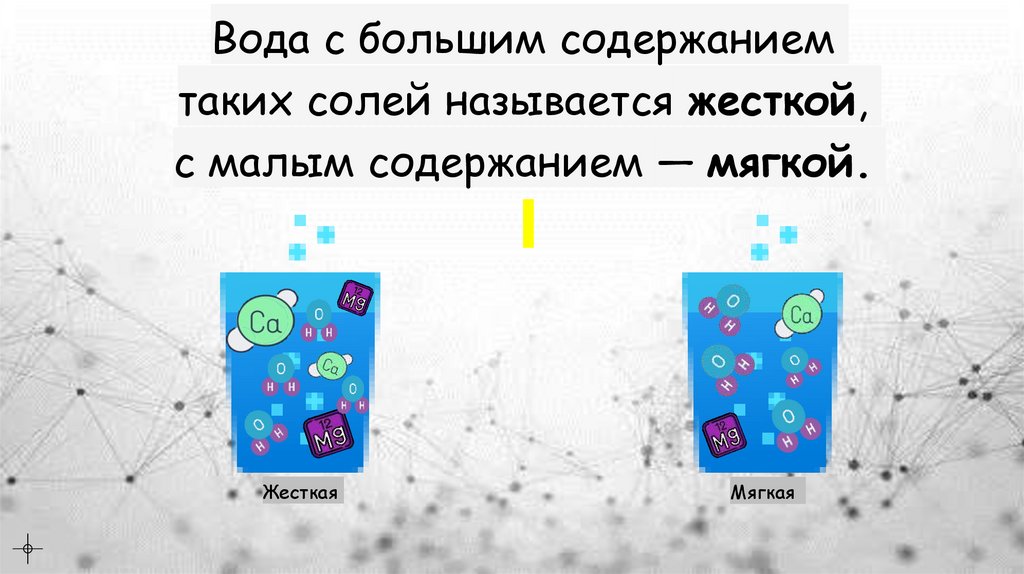
Вода с большим содержаниемтаких солей называется жесткой,
с малым содержанием — мягкой.
Жесткая
Мягкая
4.
Причины образования жесткой водыобусловлены вымыванием солей из
пластов горных пород: известняка, гипса,
доломита, которые залегают на пути
водного потока.
5.
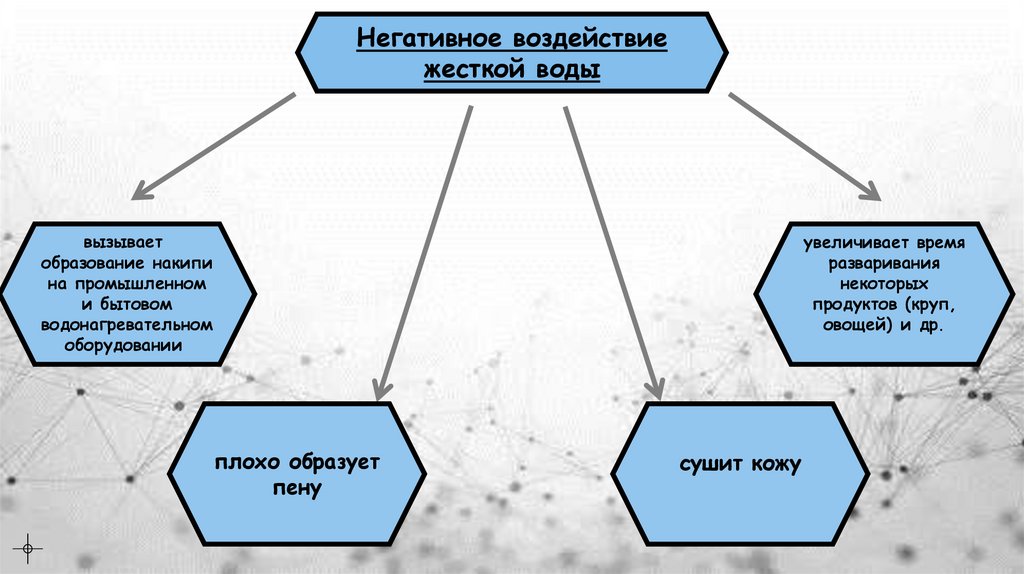
Негативное воздействиежесткой воды
вызывает
образование накипи
на промышленном
и бытовом
водонагревательном
оборудовании
увеличивает время
разваривания
некоторых
продуктов (круп,
овощей) и др.
плохо образует
пену
сушит кожу
6.
Использование слишком мягкой воды можетприводить к коррозии труб из-за отсутствия
нужного кислотно-щелочного баланса,
поддерживаемого гидрокарбонатами.
7.
Вкусовые качества жесткой воды1.Повышенное содержание солей магния,
особенно сульфатов, может давать
горечь.
2.Соли железа и марганца придают воде
3.выраженный неприятный привкус, а при
кипячении еще и бурый цвет.
4.Хлориды определяют соленость воды.
Многим людям кажется, что мягкая вода более приятна на вкус.
8.
Виды жесткости воды и способы ее устранения9.
Устранение жесткости1. Термическая обработка:
нагревание воды до 70-80 °С или кипячение позволяет почти
полностью устранить временную жесткость. В процессе
нагревания гидрокарбонаты распадаются с образованием угольной
кислоты:
Реакция 1
10.
а карбонат кальция и основный карбонат (или гидроксидпри рН>10.3) магния выпадают в виде осадка:
Реакция 2
11.
2. Химическая обработка.а) Карбонатный тип жесткости можно устранить
добавлением гашеной извести Ca(OH)2
Реакция 3
б) При одновременном добавлении гашеной извести и
кальцинированной соды Na2CO3 карбонатная жесткость
устраняется известью, а некарбонатная — содой:
12.
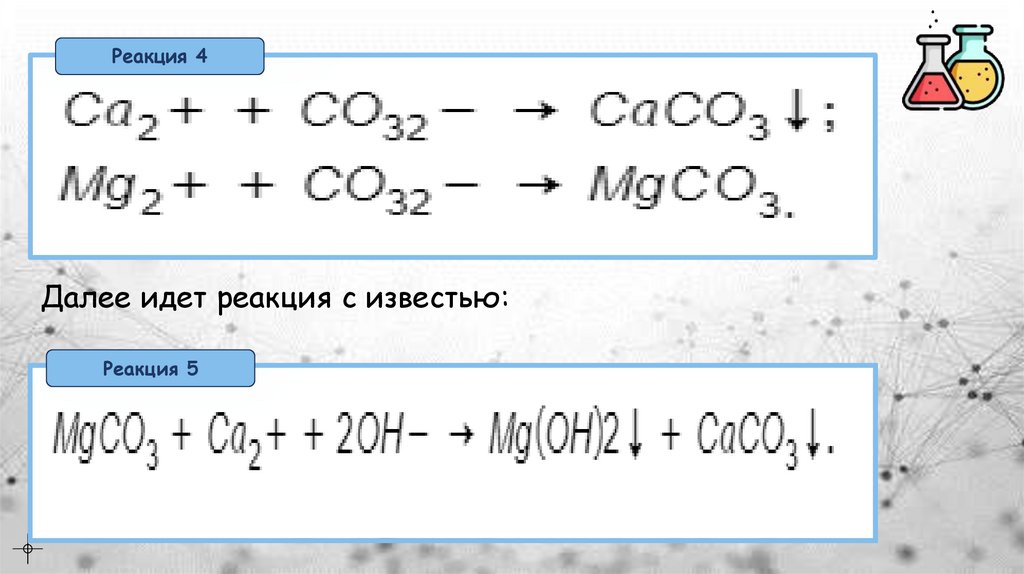
Реакция 4Далее идет реакция с известью:
Реакция 5
13.
в) Применение полифосфата натрия Na5P3O10 приводитк связыванию ионов и за счет образования хорошо
растворимых в воде хелатных комплексных соединений:
Реакция 6
14.
Методы определения уровня жесткости водыДля определения общей жесткости Жо
1. Используется сложное комплексонометрическое титрование
трилоном Б . Этот метод самый точный.
Мет одика: 100 мл воды отбирают в коническую колбу,
добавляют 5 мл аммиачно-буферной смеси, затем 7-8 капель
спиртового раствора индикатора эриохрома черного Т или
щепотку его сухой смеси с хлоридом натрия или калия. После
перемешивания раствор окрасится в винно-красный цвет. Его
титруют 0,05 н. раствором трилона Б до изменения окраски на
сине-зеленую.
15.
Формула 116.
2. Покупные экспресс-тесты. Подходят для домашнегоиспользования. Не всегда точные, зато просты в использовании и
стоят недорого.
17.
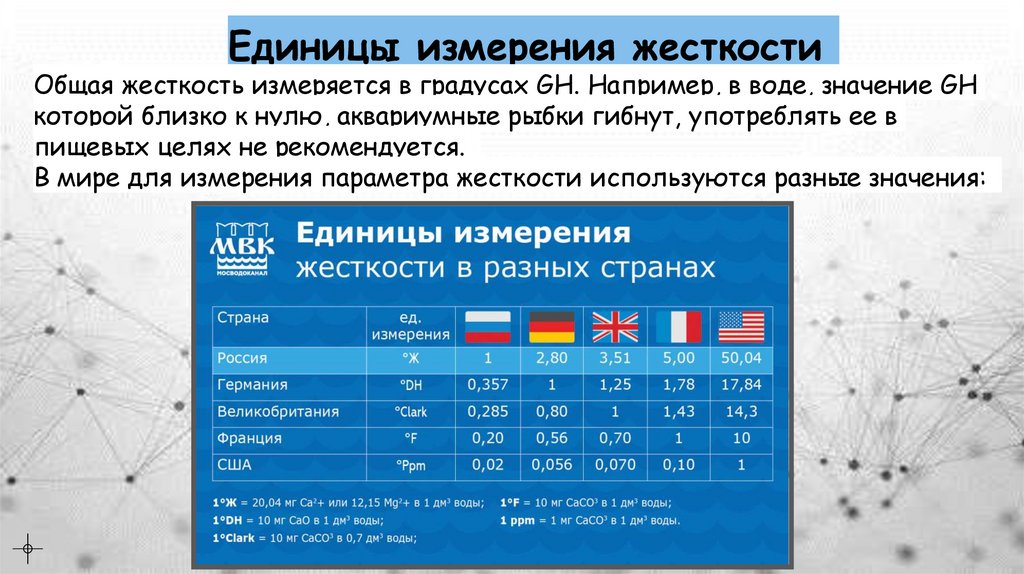
Единицы измерения жесткостиОбщая жесткость измеряется в градусах GH. Например, в воде, значение GH
которой близко к нулю, аквариумные рыбки гибнут, употреблять ее в
пищевых целях не рекомендуется.
В мире для измерения параметра жесткости используются разные значения:
18.
19.
The End...















 chemistry
chemistry








