Similar presentations:
«Жесткость воды и способы ее устранения»
1. Исследовательский проект по химии на тему: «Жесткость воды и способы ее устранения»
ЗАПАДНОЕ ОКРУЖНОЕ УПРАВЛЕНИЕ ОБРАЗОВАНИЯГОУ ЦЕНТР ОБРАЗОВАНИЯ «ШКОЛА ЗДОРОВЬЯ» №1941
Исследовательский проект
по химии на тему:
«Жесткость воды и способы ее
устранения»
Выполнил
Ученик 11 класса «А»
Олин Дмитрий
Руководитель проекта
Учитель химии
Шушляпина Ю.П.
2. Цель работы:
1. Изучить понятие «жесткость воды»,её влияние и способы устранения
жесткости.
2. Провести исследование жесткости
различных видов воды.
3. Проверить полученные знания по
теме.
3. Содержание работы:
1. Вода-источник всего живого.2. Определение жесткости воды и ее
негативное влияние.
3. Виды жесткости.
4. Способы устранения жесткости.
5. Уравнения устранения жесткости.
6. Практическая часть.
7. Тест «Проверь себя».
8. Использованные источники.
4. Вода-источник всего живого.
Вода́ —химическоевещество в виде
прозрачной жидкости, не
имеющей цвета,
запаха и вкуса. Около 71 %
поверхности Земли покрыто
водой.
5. Вода-источник всего живого.
По особенностямпроисхождения,
состава или
применения,
выделяют несколько
видов воды: мягкая и
жесткая вода,
минеральная вода,
дистиллированная
вода…
6. Вода-источник всего живого.
Вода играет уникальную роль как вещество,определяющее возможность существования и
саму жизнь всех существ на Земле. Она выполняет
роль универсального растворителя, в котором
происходят основные биохимические процессы
живых организмов.
7. Жесткость воды.
Природная вода,проходя через
известковые
горные породы и
почвы, обогащается
солями кальция и
магния ( а также
железа) и
становится
жесткой.
8. Жесткость воды.
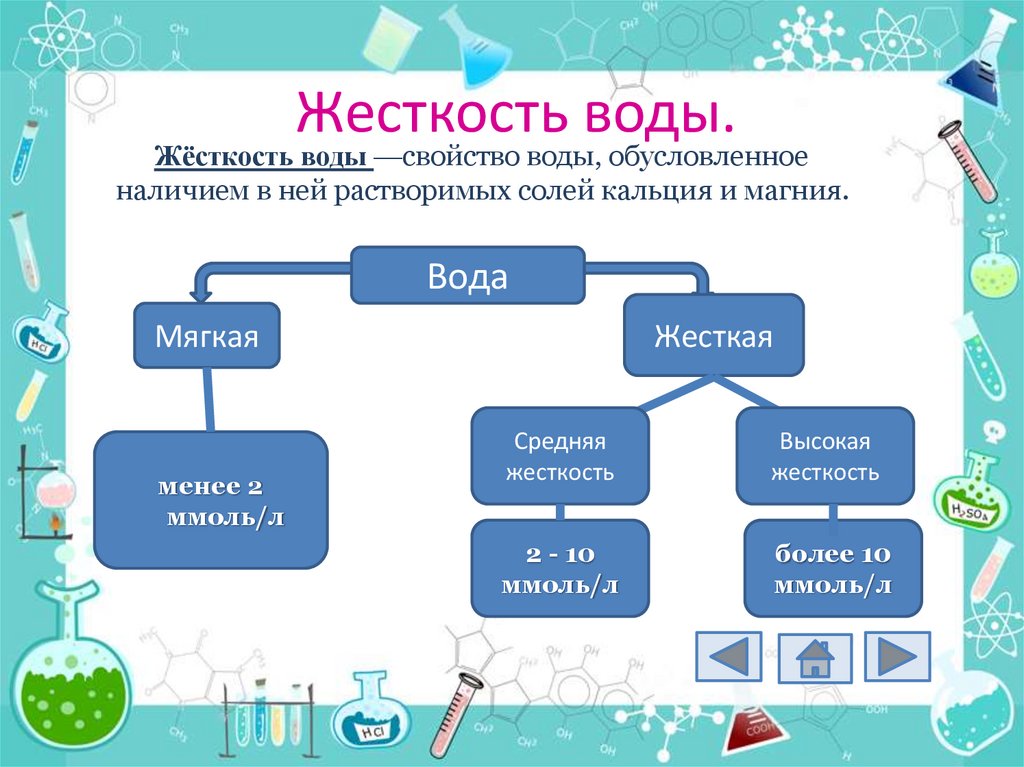
Жёсткость воды —свойство воды, обусловленноеналичием в ней растворимых солей кальция и магния.
Вода
Жесткая
Мягкая
менее 2
ммоль/л
Средняя
жесткость
Высокая
жесткость
2 - 10
ммоль/л
более 10
ммоль/л
9. Негативное влияние.
1. Заболевание суставов.2. Накопление солей в организме.
3. Образованию камней в почках,
желчном и мочевом пузырях.
4. Образование накипи.
5. Ухудшение вкуса пищи,
приготовленной на жёсткой воде.
6. Плохо растворяет мыло.
видео
10. Виды жесткости.
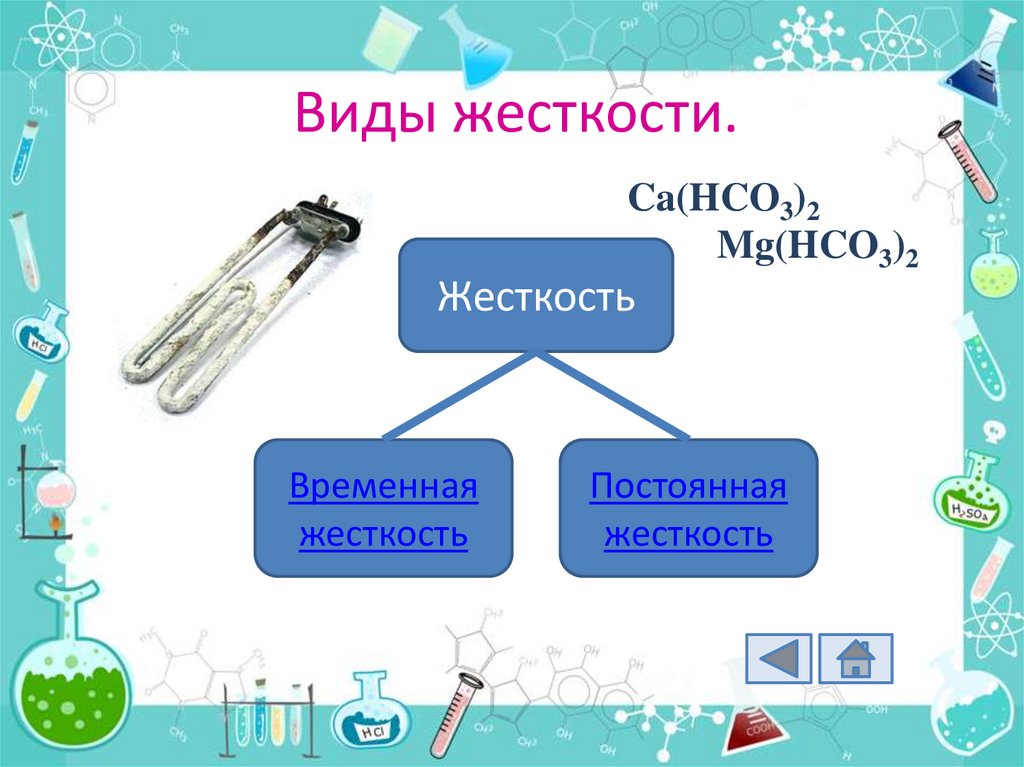
Ca(HCO3)2Mg(HCO3)2
Жесткость
Временная
жесткость
Постоянная
жесткость
11. Временная жесткость.
Временная жесткостьвызвана присутствием в
воде гидрокарбонатов
кальция, магния и железа и
устраняется простым
кипячением. При этом
гидрокарбонаты
разлагаются, и в осадок
выпадают вещества,
образующие накипь.
12. Постоянная жесткость.
Постоянная жесткость обусловлена другимисолями кальция и магния(сульфаты, хлориды, нитраты
и др.). Такая жесткость не устраняется кипячением
воды, так как растворы этих солей устойчивы к
нагреванию.
13. Способы устранения жесткости.
Бытовые:1.Кипячение и
вымораживание
2.Фильтрование
3.Добавление
умягчителей
Промышленные:
1. Добавление
кальцинированной
соды Na2CO3
2. Добавление гашеной
извести Ca(OH) 2
14. Кипячение и вымораживание.
Кипячениеснижает общую
жесткость на 30-40%.
При нагревании
жесткой воды
образуется накипь нерастворимые
соединения кальция,
магния и оксид
железа(III).
Вымораживание
снижает общую
жесткость на 70-80%.
15. Фильтрование.
Фильтрование снижаетобщую жесткость до 80%.
Внутри картриджа фильтра
содержится смесь из
активированного угля и
катионообменники. Уголь
адсорбирует вредные
органические вещества и
хлориды. Катионообменники
снижают общую жесткость.
16. Добавление умягчителей.
Снижение общейжёсткости достигает
100%. Умягчители
предназначены для
снижения общей
жёсткости воды в
стиральных машинах.
Воду нельзя
использовать для
приготовления пищи,
нельзя пить.
17. Добавление Na2CO3 или Ca(OH) 2
Кроме кипячения,устранить временную
жесткость можно гашеной
известью Ca(OH) 2 .
Постоянную жесткость
устраняют, обрабатывая
воду раствором соды
Na2CO3 .
18. Уравнения устранения жесткости.
1. Временной жесткостиКипячение
Добавление гашеной извести Ca(OH)2
2. Постоянной жесткости
Добавление соды Na2CO3
видео
19. Устранение временной жесткости
1. КипячениеCa(HCO3)2 = CO2 ↑ + CaCO3↓ + H2O
Mg(HCO3)2 = Mg(OH)2↓ + CO2↑
2. Добавление гашеной извести Ca(OH)2
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
Mg(HCO3)2 + Ca(OH)2 = CaCO3 + MgCO3 + H2O
20. Устранение постоянной жесткости.
1. Добавление соды Na2CO3Ca(NO3) 2 + Na2CO3 = CaCO3↓ + 2NaNO3
2MgSO4 + H2O + 2Na2CO3 = Mg(OH)2CO3↓ + CO2
+ 2Na2SO4
21. Практическая часть
Практическая работа:«Устранение жесткости различных видов воды».
Цель работы:
1. Определить жесткость воды различных видов.
2. Изучить способ устранения жесткости с
помощью соды.
Оборудование и реактивы:
1. Пробирки, химический стакан
2. Раствор соды Na2CO3.
3. Цифровой фотоаппарат.
22. Практическая часть
Исследуемыерастворы:
1. Водопроводная вода
2. Вода «Святой
источник»
3. Минеральная вода
«Нарзан»
4. Родниковая вода
микрорайона
«Матвеевское»
23. Практическая часть
Ход работы:В моей практической работе я исследовал
жесткость природной воды: «Святой
источник», родниковая вода микрорайона
«Матвеевское», минеральная вода
«Нарзан» и водопроводная вода. Для
устранения жесткости можно использовать
раствор соды Na2CO3. Я прилил раствор в
четыре пробирки и наблюдал за
происходящим.
видео
24. Практическая часть
Уравнения:MgCl2 + Na2CO3 = MgCO3 ↓ + 2NaCl
CaCl2 + Na2CO3 = CaCO3 ↓ + 2NaCl
Mg(HCO3) 2 + Na2CO3 = 2NaHCO3 + MgCO3 ↓
Ca(HCO3) 2 + Na2CO3 = 2NaHCO3 + CaCO3 ↓
25. Практическая часть
Вывод:Минеральная вода «Нарзан» и родниковая
вода микрорайона «Матвеевское» обладают
большей жесткостью, то есть содержат
наибольшее количество солей магния и
кальция. Эти виды воды наиболее пригодны
для питья, так как дают организму соли кальция
и магния, но не пригодны для хозяйственных
целей.
26. Тест «Проверь себя»
Вопрос №1Вопрос №2
Вопрос №3
Вопрос №4
Вопрос №5
Вопрос № 6
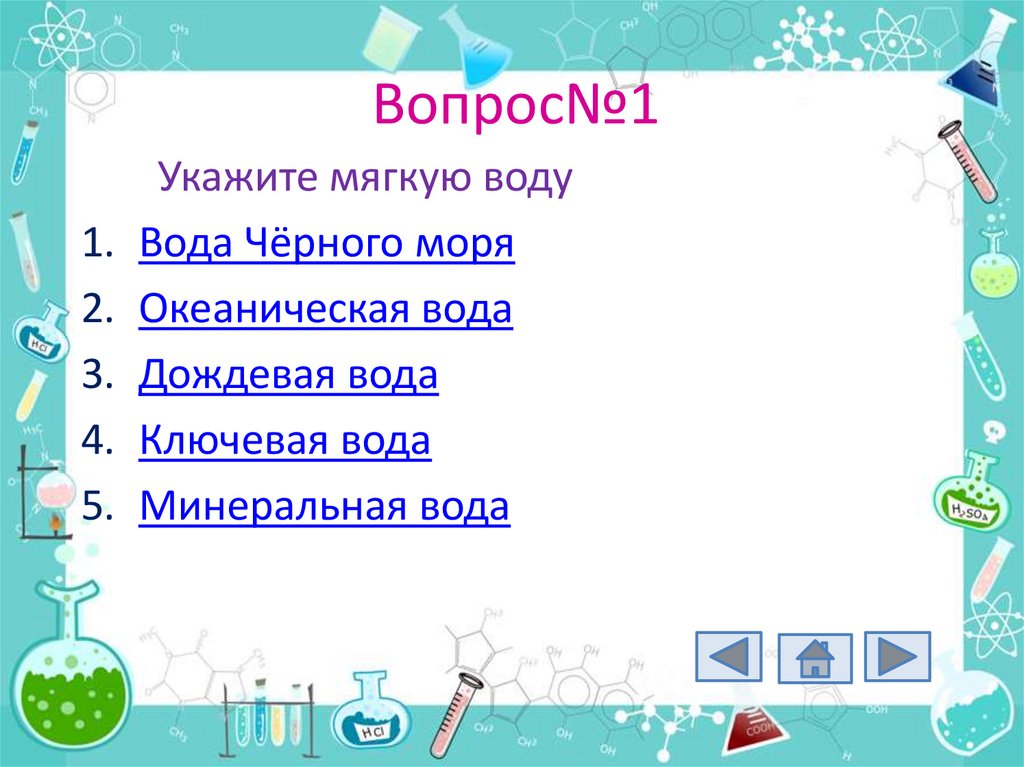
27. Вопрос№1
1.2.
3.
4.
5.
Укажите мягкую воду
Вода Чёрного моря
Океаническая вода
Дождевая вода
Ключевая вода
Минеральная вода
28. Вопрос№2
Какое свойство НЕ проявляет жёсткаявода?
1.Хорошо проводит электрический ток
2.Полезна для здоровья в больших
количествах
3.Образует накипь при кипячении
4.Плохо растворяет мыло (мыло плохо
пенится)
29. Вопрос№3
Какие вещества можно использоватьдля смягчения жесткой воды?
1. Ca(OH)2 и Na 2 CO3
2. H2SO4 и CaSO4
3. NaHCO3 и H2SO4
4. Na2CO3 и H2SO4
30. Вопрос№4
Укажите для каких целей пригоднажесткая вода.
1.Для охлаждения двигателей
внутреннего сгорания
2.Орошения полей
3.Для питания паровых двигателей
4.Стирки белья
31. Вопрос№5
Какое вещество можно использоватьдля удаления накипи на внутренних
стенках чайника?
1. Пищевую соду
2. Уксусную кислоту
3. Поваренную соль
4. Кальцинированную соду
32. Вопрос№6
Каким способом можно устранитьпостоянную жесткость воды?
1.Добавлением соды
2.Кипячением
3.Добавлением гашеной извести
4.Добавлением кислоты
33. МОЛОДЕЦ!
На ПЯТЕРОЧКУнарабооотал!
34. FAILURE!
На ДВОЕЧКУпотяяянет!
35. Использованные источники
1.2.
3.
4.
5.
6.
«Химия. 8-11 классы. Полный школьный курс»,Москва,
«Аст-Пресс», 2000
http://ru.wikipedia.org
http://webelements.narod.ru/
http://www.xumuk.ru
Единая коллекция цифровых образовательных ресурсов
http://school-collection.edu.ru/
http://periodictable.com/
Отдельное спасибо за помощь учителю химии Шушляпиной Ю.П.
































 chemistry
chemistry








