Similar presentations:
Соли кальция. Жесткость воды
1.
Соли кальция.Жесткость воды
2.
► Кальций широко распространенныйэлемент в природе.
► Кальций – активный металл. Сильный
восстановитель.
► Немного уступает по активности
щелочным металлам.
► Имеет постоянную валентность (II) и
степень окисления +2.
► Энергично взаимодействует с простыми и
сложными веществами
► Способ получения в промышленностиэлектролиз расплава солей
3.
Вода – сложное природноевещество, в состав которого
входит целый набор
микроэлементов. В том или
ином виде вода содержится во
всех живых организмах.
4.
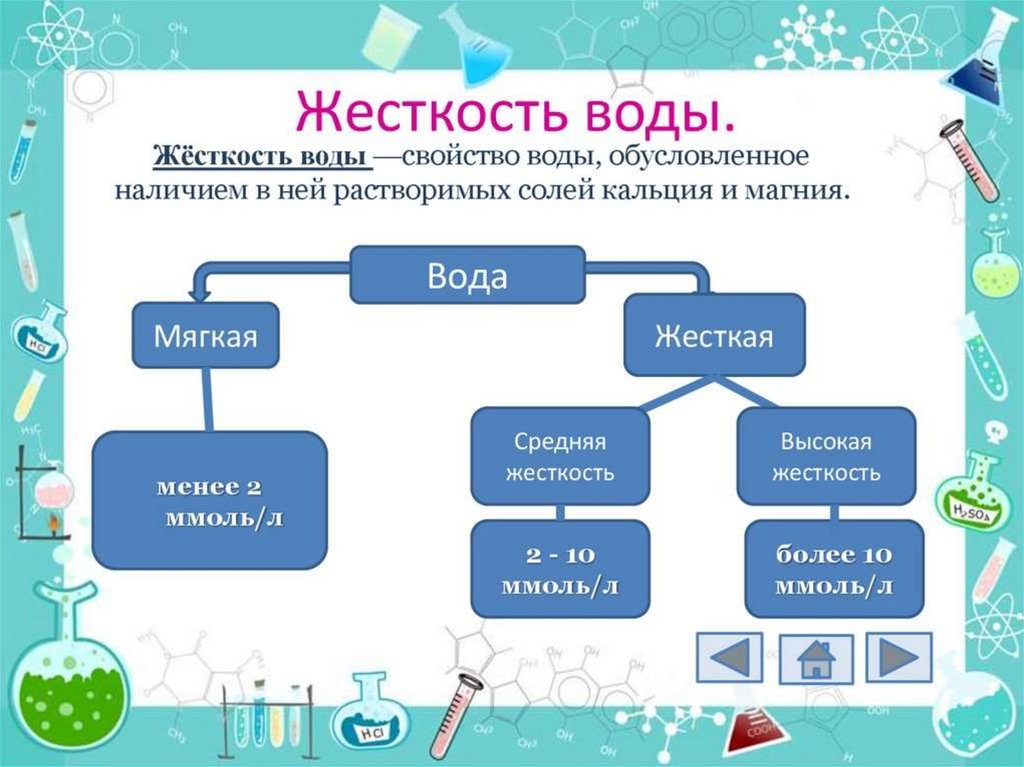
Жесткость водывызывается
присутствием
солей кальция
и магния
5.
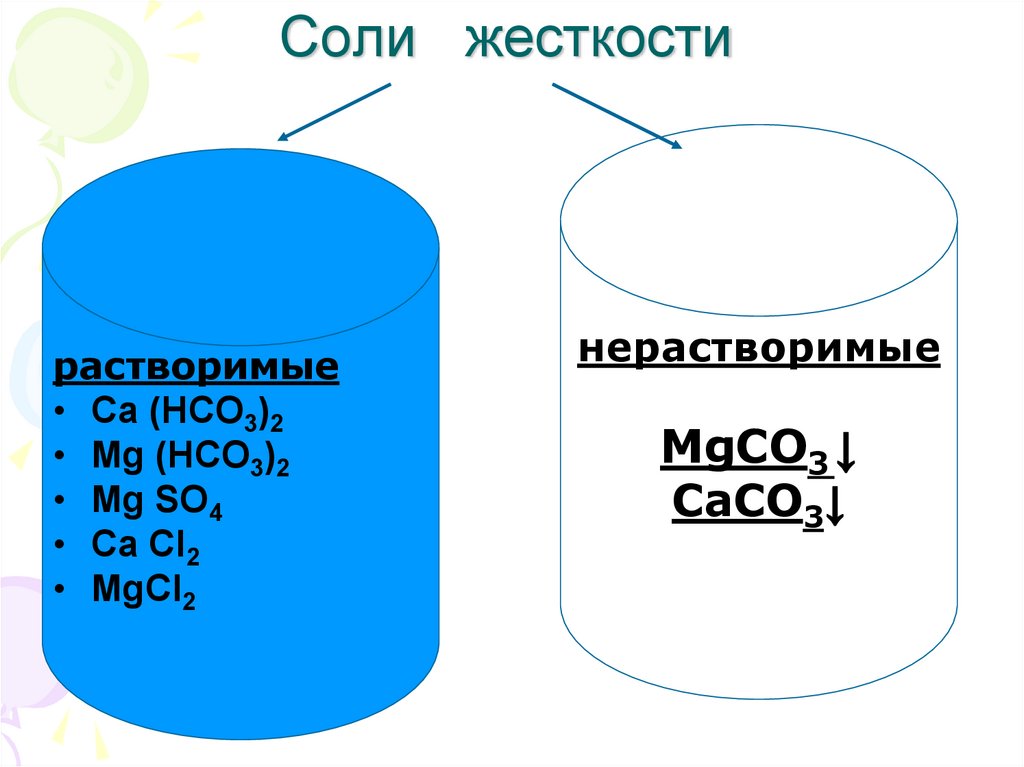
6. Соли жесткости
растворимые• Ca (НСO3)2
• Mg (НСO3)2
• Mg SO4
• Ca Cl2
• MgCl2
нерастворимые
MgCO3 ↓
CaCO3↓
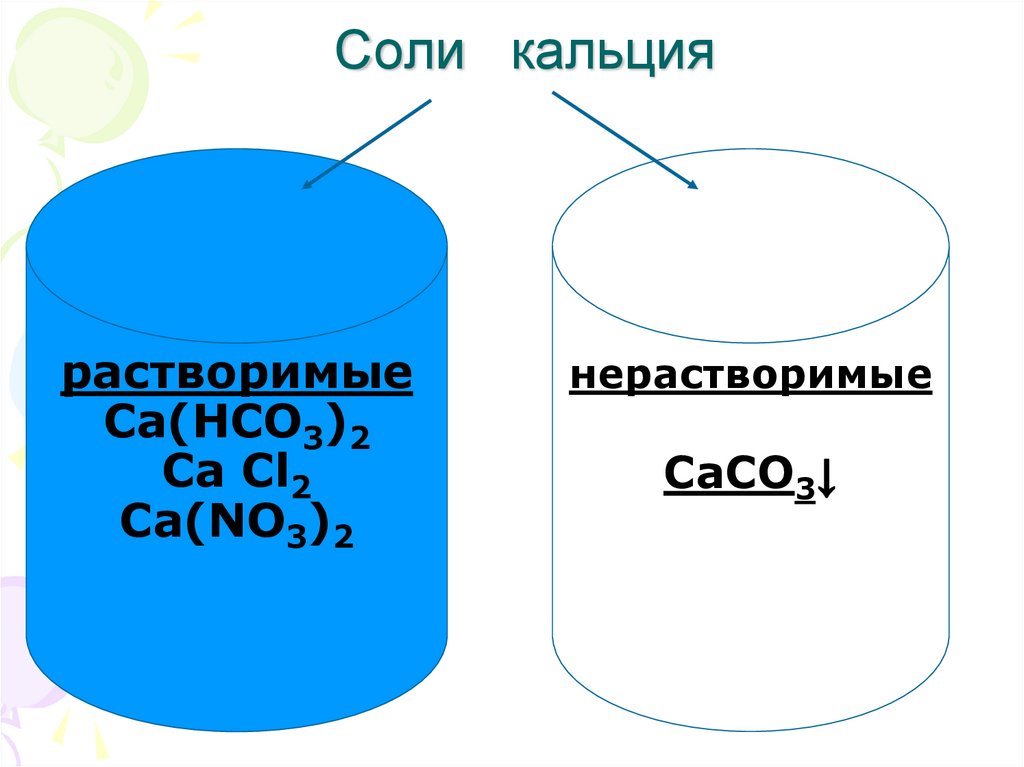
7. Соли кальция
растворимыеCa(HCO3)2
Ca Cl2
Сa(NO3)2
нерастворимые
CaCO3↓
8.
9.
Жесткость воды –это хорошо
или плохо?
10. Отрицательное влияние жесткой воды на организм человека
1)Снижение моторики желудка ;2)Заболевание суставов (артриты и
полиартриты);
3)Заболевание сердечно-сосудистой системы;
4)Образование камней в почках, желчном и
мочевом пузырях.
5) Вымывает кальций из костей;
6) Ломкость костей у взрослого человека;
7) Риск развития рахита у детей;
8) Вымывает минеральные вещества.
11. Вред, наносимый жесткой водой технике и предметам быта
• соли кристаллизуются и выпадают в виденакипи, образуя пятна, разводы и грязные
налеты
12.
Умягчение воды – процесс сниженияжесткости воды, т.е. уменьшение концентрации
ионов кальция и магния.
В последнее время появилось множество
смягчителей воды, защищающих стиральные
машины от накипи. Одновременно
производители стиральных порошков ввели
компоненты предотвращающие образование
накипи.
Calgon - снижает жесткость воды на 100%.
13.
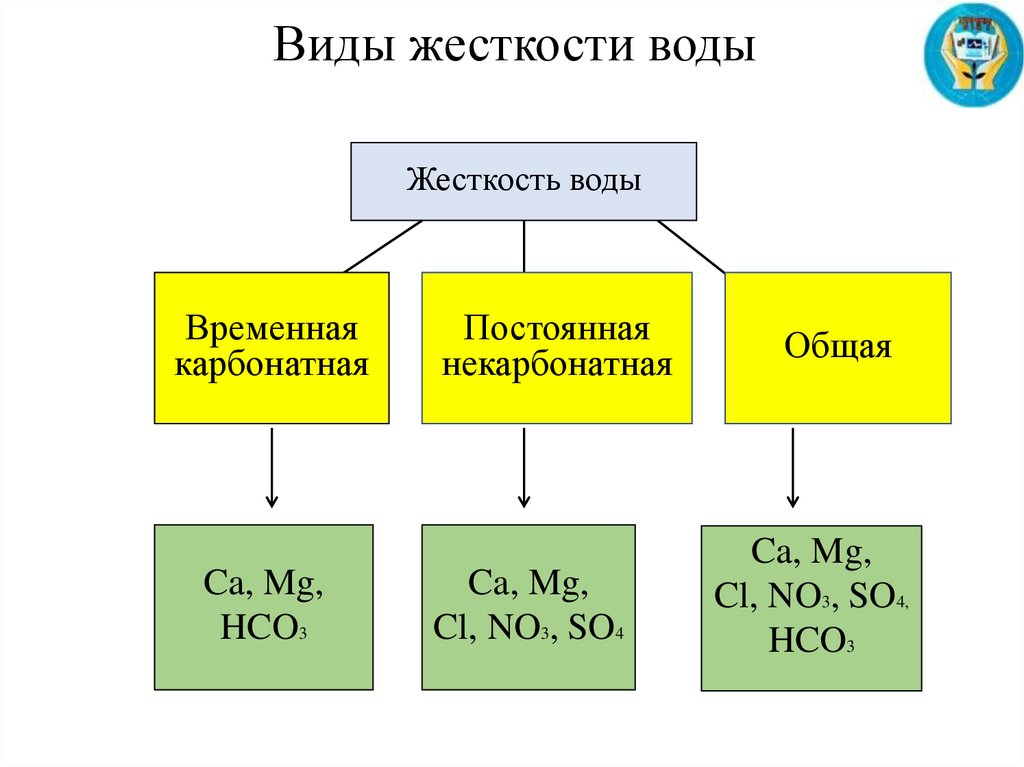
Виды жесткости водыЖесткость воды
Временная
карбонатная
Ca, Mg,
HCO3
Постоянная
некарбонатная
Ca, Mg,
Cl, NO3, SO4
Общая
Ca, Mg,
Cl, NO3, SO4,
HCO3
14. Способы устранения жесткости воды
I. Временная (карбонатная) устраняется:1) кипячением:
Ca(HCO3)2 =t=˃ CaCO3↓+CO2↑+H2O
2) добавлением известкового молока:
Ca(HCO3)2 +Ca(OH)2=2 CaCO3↓+2H2O
3) добавлением соды:
Mg(HCO3)2 +Na2CO3=MgCO3↓+2NaHCO3
15. Общая жесткость
II. Постоянная (некарбонатная)1) добавлением соды:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
2) с помощью ионообменных фильтров ионы кальция
и магния заменяют на ионы натрия и калия
3) с помощью бытовых фильтров (отфильтрованная
вода дает меньше накипи, что важно при
использовании электрочайников)
III. Общая жесткость
1) добавлением ортофосфата натрия:
3MgSO4 + 2Na3PO4 = Mg3(PO4)2↓ + 3Na2SO4
Полностью очистить воду от солей можно методом
перегонки (дистилляцией)
16.
17. Кипячение воды
Ca (HCO3)2 = Ca CO3↓ + CO2↑+Н2Oнакипь
18.
19. Вывод
•Соединения кальция широкораспространены в природе.
• Жесткость воды обусловливается
присутствием ионов кальция и магния.
•Жесткую воду перед использованием
надо умягчить
20. Закрепление нового материала:
Какая вода называется жесткой?Перечислите виды жесткой воды?
Назовите способы устранения?
Какие из следующих веществ можно использовать для
смягчения жесткой воды: NaOH, H2SO4, CaCl2, Na3PO4,
CaSO4, известковая вода, Na2CO3?
5) Как химическим путем можно очистить в домашних
условиях поверхность посуды от накипи?
1)
2)
3)
4)
















 chemistry
chemistry








