Similar presentations:
Жесткость воды и способы ее устранения
1.
Министерство образования и науки Челябинской областиГБПОУ « Челябинский государственный промышленно- гуманитарный
техникум имени А.В. Яковлева»
Тема урока:
«Жесткость воды
и способы ее устранения»
Подготовила:
преподаватель химии,
ГБПОУ ЧГПГТ им. А. В. Яковлева
Габбасова Н.В.
Челябинск, 2020г.
2.
Цели и задачи урока:1
Рассмотреть понятие и причину жесткости воды как
1
Click
to add Title
основополагающей
характеристики качества воды,
2
2
Click
toспособы
add Title
Изучить
устранения жесткости воды;
2
Click
to полученный
add Title материал лабораторным занятием
Закрепить
3
пригодной для использования человеком;
3.
Вода – сложное природное вещество, в состав которого входитцелый набор микроэлементов. В том или ином виде вода
содержится во всех живых организмах.
4.
Жесткость водыСовокупность свойств,
обусловленных содержанием в
ней ионов кальция и магния.
Абсолютно чистой воды в
природе не существует.
Природная вода всегда
содержит растворенные в ней
соли. Анализ жесткой воды
показывает, что в ней
содержатся значительные
количества растворимых солей
кальция и магния. Эти соли
образуют с мылом
нерастворимые соединения.
5.
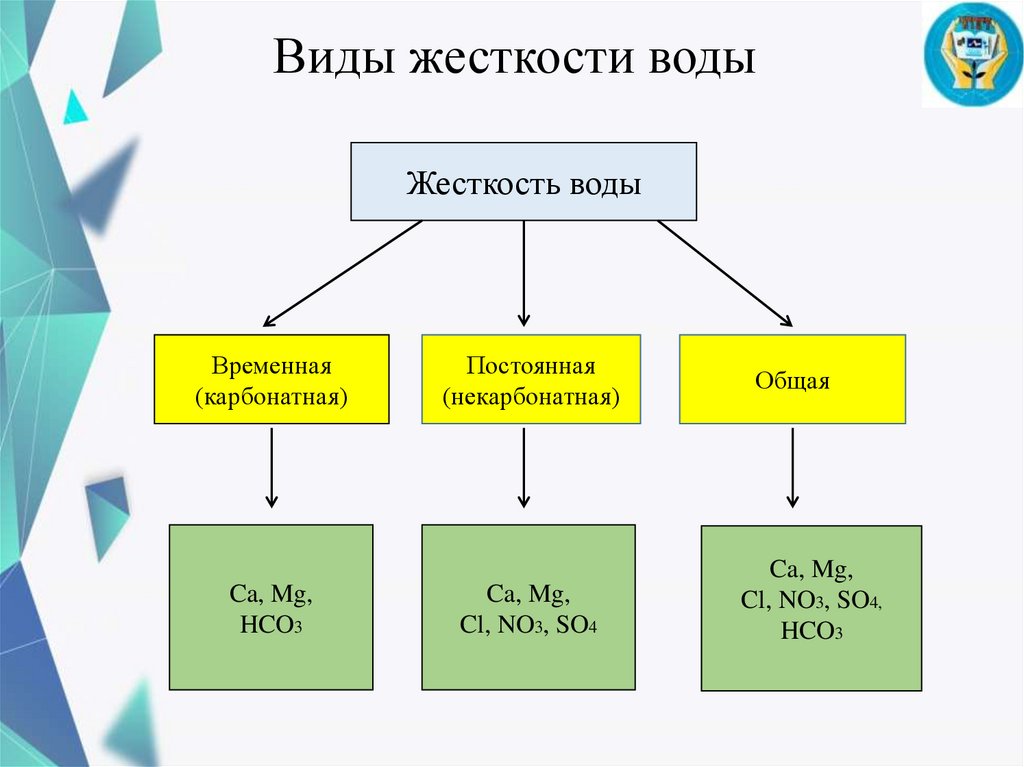
Виды жесткости водыЖесткость воды
Временная
(карбонатная)
Ca, Mg,
HCO3
Постоянная
(некарбонатная)
Общая
Ca, Mg,
Cl, NO3, SO4
Ca, Mg,
Cl, NO3, SO4,
HCO3
6.
Способы устранения жесткости водыI. Временная (карбонатная) устраняется:
1) кипячением:
Ca(HCO3)2 =t=˃ CaCO3↓+CO2↑+H2O
2) добавлением известкового молока:
Ca(HCO3)2 +Ca(OH)2=2 CaCO3↓+2H2O
3) добавлением соды:
Mg(HCO3)2 +Na2CO3=MgCO3↓+2NaHCO3
7.
II. Постоянная (некарбонатная)1) добавлением соды:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
2) с помощью ионообменных фильтров ионы кальция
и магния заменяют на ионы натрия и калия
3) с помощью бытовых фильтров (отфильтрованная
вода дает меньше накипи, что важно при
использовании электрочайников)
III. Общая жесткость
1) добавлением ортофосфата натрия:
3MgSO4 + 2Na3PO4 = Mg3(PO4)2↓ + 3Na2SO4
Полностью очистить воду от солей можно методом
перегонки (дистилляцией)
8.
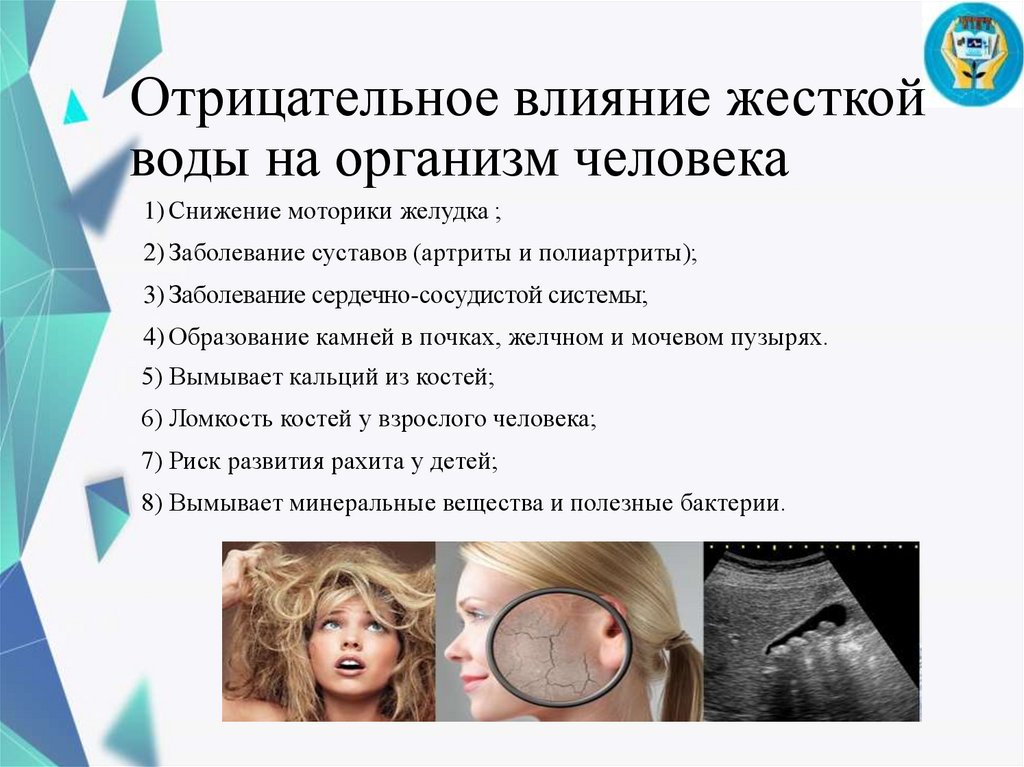
Отрицательное влияние жесткойводы на организм человека
1) Снижение моторики желудка ;
2) Заболевание суставов (артриты и полиартриты);
3) Заболевание сердечно-сосудистой системы;
4) Образование камней в почках, желчном и мочевом пузырях.
5) Вымывает кальций из костей;
6) Ломкость костей у взрослого человека;
7) Риск развития рахита у детей;
8) Вымывает минеральные вещества и полезные бактерии.
9.
Вред, наносимый жесткой водойтехнике и предметам быта
• образуются разводы и твердый налет
• соли кристаллизуются и выпадают в виде накипи.
• пятна, разводы и грязные налеты
10.
Умягчение воды – процесс снижения жесткости воды, т.е.уменьшение концентрации ионов кальция и магния. Жесткая вода
негативно сказывается на здоровье человека, на работе
сантехнического и котельного оборудования. Поэтому, чтобы не
испортить оборудование, требуется умягчение воды.
В последнее время появилось множество смягчителей воды,
защищающих стиральные машины от накипи. Одновременно
производители стиральных порошков ввели компоненты
предотвращающие образование накипи.
Calgon - снижает жесткость воды на 100%.
11.
12.
Природная и искусственная вода• Самая жесткая – природная вода – это морская вода.
• Самая мягкая искусственная вода – дистиллированная.
13.
Вода в г. Челябинскеи Челябинской области
Водный объект
Содержание вредных веществ
1. Шершнёвское
водохранилище
Мутность, цветность, жесткость в 5 раз больше
2. река Миасс
Нитраты, фосфаты, аммиак, нефтепродукты, тяжелые
металлы
3. река Ай
Нитраты, фосфаты, аммиак, нефтепродукты, тяжелые
металлы
4. река Урал
Нитраты, фосфаты, аммиак, нефтепродукты, тяжелые
металлы
5. река Теча
Нитраты, фосфаты, аммиак, нефтепродукты, тяжелые
металлы
6. озеро Аргази
Тяжелые металлы
7. река Уй
Высокая концентрация марганца
14.
Лабораторная работа• Цель работы: закрепление знаний по теме «Растворы»,
формирование понятия «жесткость» воды, развитие умений по
устранению жесткости воды; продолжить формирование умения
проводить химические реакции.
• Оборудование и реактивы:
раствор мыла, сода, вода из под крана, кипяченая вода из под крана,
вода из фильтра, стаканы, деревянная палочка.
• Правила техники безопасности для учеников
- Работай с малыми количествами реактивов
- Выполняй все операции аккуратно.
- Растворы, взятые в большем объеме, чем нужно, обратно в сосуд не
выливай.
15.
Методические рекомендации для родителей припроведении лабораторной работы по химии в
домашних условиях
• - Спокойствие
• - Рабочее место
• - Рабочая обстановка
• - Подберите одежду для занятий
• - Обратная связь
16.
Лабораторный опыт № 1Качественное определение жесткости воды с
помощью раствора мыла.
• В стаканах под номерами 1,2,3 находятся соответственно
водопроводная, водопроводная кипяченая, вода из очистного
фильтра. В каждый стакан опускают по 3 капли жидкого
мыла, перемешивают в течение 1-2 мин, добиваясь более
полного его растворения. Далее вода отстаивается.
• Делаем выводы
17.
Лабораторный опыт № 2Качественное определение жесткости воды с
помощью Na2CO3 (сода)
• В стаканах под номерами 1,2,3 находятся соответственно
водопроводная, водопроводная кипяченая, вода из очистного
фильтра. В каждый стакан опускают по чайной ложке соды
перемешиваем в течение 1 мин. Далее вода отстаивается.
Делаем выводы
18.
Лабораторный опыт № 3Определение свойств воды с помощью
органов чувств.
• В стаканах под номерами 1,2,3 находятся соответственно
водопроводная, водопроводная кипяченая, вода из очистного
фильтра. С помощью органа зрения-глаз, органа обоняния –
носа и органа вкуса – языка, определим свойства воды. У
каждого ученика свойства будут почти схожи из-за состава
воды, которую мы берем за образец
• Делаем выводы
19.
Классификация вод по рНГруппа
Значение рН
Сильнокислая
До 3,0
Кислая
Более 3,0 до 5,0
Слабокислая
Более 5,0 до 6,5
Нейтральная
Более 6,5 до 7,5
Слабощелочная
Более 7,5 до 8,5
Щелочная
Более 8,5 до 9,5
Сильнощелочная
Более 9,5
Характеристика вод по прозрачности
Прозрачность
Единица измерения, см
Прозрачная
Более 30
Маломутная
Более 25 до 30
Средней мутности
Более 20 до 25
Мутная
Более 10 до 20
Очень мутная
Менее 10
20.
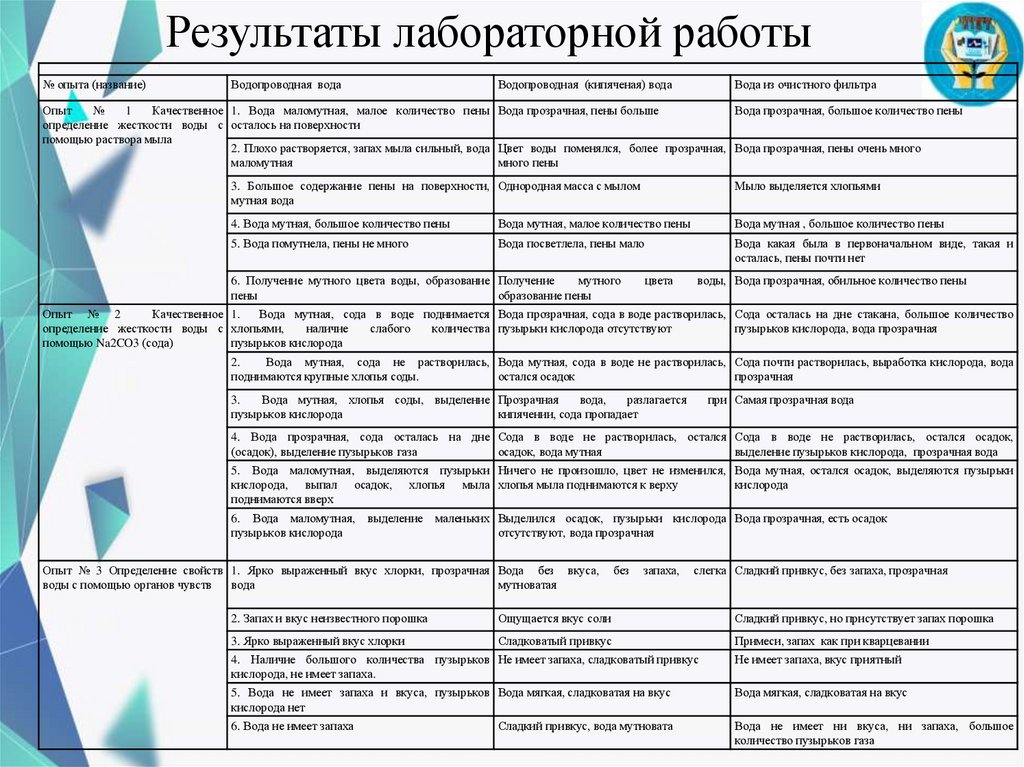
Результаты лабораторной работы№ опыта (название)
Водопроводная вода
Водопроводная (кипяченая) вода
Вода из очистного фильтра
Опыт
№
1
Качественное 1. Вода маломутная, малое количество пены Вода прозрачная, пены больше
Вода прозрачная, большое количество пены
определение жесткости воды с осталось на поверхности
помощью раствора мыла
2. Плохо растворяется, запах мыла сильный, вода Цвет воды поменялся, более прозрачная, Вода прозрачная, пены очень много
маломутная
много пены
3. Большое содержание пены на поверхности, Однородная масса с мылом
мутная вода
Мыло выделяется хлопьями
4. Вода мутная, большое количество пены
Вода мутная, малое количество пены
Вода мутная , большое количество пены
5. Вода помутнела, пены не много
Вода посветлела, пены мало
Вода какая была в первоначальном виде, такая и
осталась, пены почти нет
6. Получение мутного цвета воды, образование Получение
мутного
пены
образование пены
цвета
воды, Вода прозрачная, обильное количество пены
Опыт № 2
Качественное 1.
Вода мутная, сода в воде поднимается Вода прозрачная, сода в воде растворилась, Сода осталась на дне стакана, большое количество
определение жесткости воды с хлопьями,
наличие
слабого
количества пузырьки кислорода отсутствуют
пузырьков кислорода, вода прозрачная
помощью Na2CO3 (сода)
пузырьков кислорода
2.
Вода мутная, сода не растворилась, Вода мутная, сода в воде не растворилась, Сода почти растворилась, выработка кислорода, вода
поднимаются крупные хлопья соды.
остался осадок
прозрачная
3.
Вода мутная, хлопья соды, выделение Прозрачная
вода,
разлагается
пузырьков кислорода
кипячении, сода пропадает
при Самая прозрачная вода
4. Вода прозрачная, сода осталась на дне Сода в воде не растворилась, остался Сода в воде не растворилась, остался осадок,
(осадок), выделение пузырьков газа
осадок, вода мутная
выделение пузырьков кислорода, прозрачная вода
5. Вода маломутная, выделяются пузырьки Ничего не произошло, цвет не изменился, Вода мутная, остался осадок, выделяются пузырьки
кислорода, выпал осадок, хлопья мыла хлопья мыла поднимаются к верху
кислорода
поднимаются вверх
6. Вода маломутная,
пузырьков кислорода
выделение
маленьких Выделился осадок, пузырьки кислорода Вода прозрачная, есть осадок
отсутствуют, вода прозрачная
Опыт № 3 Определение свойств 1. Ярко выраженный вкус хлорки, прозрачная Вода без вкуса,
воды с помощью органов чувств
вода
мутноватая
без
запаха,
слегка Сладкий привкус, без запаха, прозрачная
2. Запах и вкус неизвестного порошка
Ощущается вкус соли
Сладкий привкус, но присутствует запах порошка
3. Ярко выраженный вкус хлорки
Сладковатый привкус
Примеси, запах как при кварцевании
4. Наличие большого количества пузырьков Не имеет запаха, сладковатый привкус
кислорода, не имеет запаха.
Не имеет запаха, вкус приятный
5. Вода не имеет запаха и вкуса, пузырьков Вода мягкая, сладковатая на вкус
кислорода нет
Вода мягкая, сладковатая на вкус
6. Вода не имеет запаха
Вода не имеет ни вкуса, ни запаха, большое
количество пузырьков газа
Сладкий привкус, вода мутновата
21.
График 1. Прозрачность воды(Лабораторный опыт № 1)
45
40
35
30
Водопроводная вода
25
Водопроводная
(кипяченая) вода
Вода из очистного
фильтра
20
15
10
5
0
1 уч.
2 уч.
3 уч.
4 уч.
5 уч.
6 уч.
На 1 графике видно, что большую прозрачность имеет вода из очистного фильтра. Из 6 учеников,
проводивших опыт с мылом и водой, у 4 учеников прозрачность воды не изменилась, это значит, что
вода очищена от нитратов, хлора, которые не вступают в реакцию с мылом, а вещества, через которые
очищается вода из фильтра, обогащают воду дополнительными свойствами и положительно влияют
на организм человека.
22.
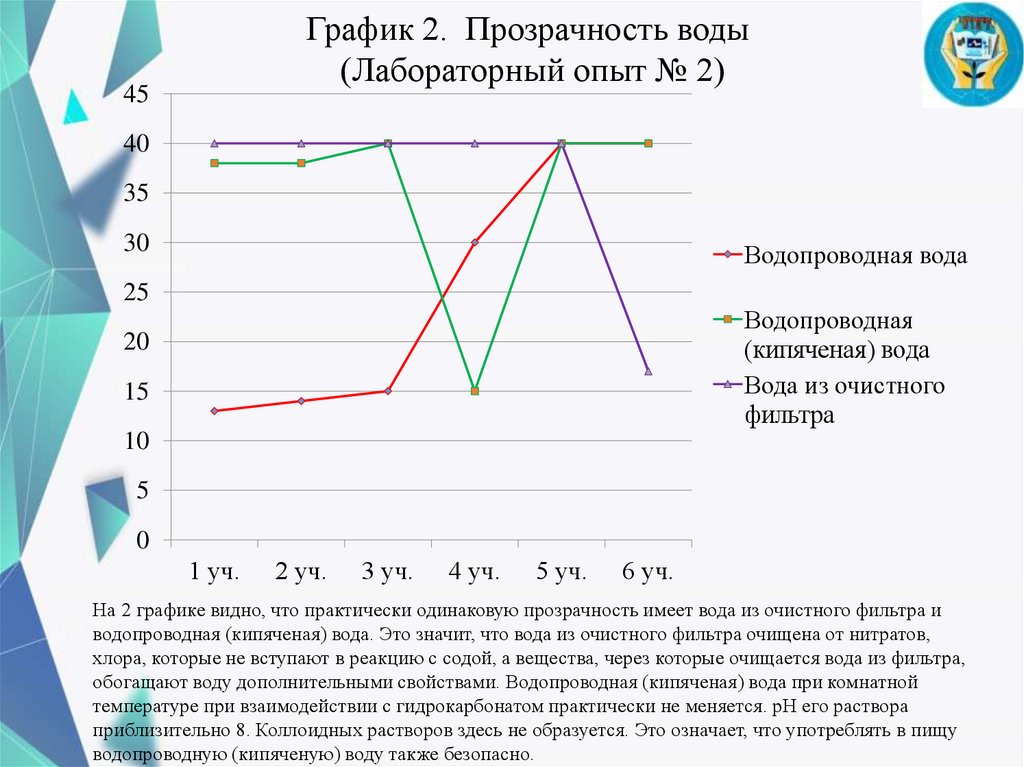
График 2. Прозрачность воды(Лабораторный опыт № 2)
45
40
35
30
Водопроводная вода
25
Водопроводная
(кипяченая) вода
Вода из очистного
фильтра
20
15
10
5
0
1 уч.
2 уч.
3 уч.
4 уч.
5 уч.
6 уч.
На 2 графике видно, что практически одинаковую прозрачность имеет вода из очистного фильтра и
водопроводная (кипяченая) вода. Это значит, что вода из очистного фильтра очищена от нитратов,
хлора, которые не вступают в реакцию с содой, а вещества, через которые очищается вода из фильтра,
обогащают воду дополнительными свойствами. Водопроводная (кипяченая) вода при комнатной
температуре при взаимодействии с гидрокарбонатом практически не меняется. рН его раствора
приблизительно 8. Коллоидных растворов здесь не образуется. Это означает, что употреблять в пищу
водопроводную (кипяченую) воду также безопасно.
23.
Результаты лабораторного опыта № 3По результатам 3 лабораторного опыта, делаем вывод, что по взгляду все 3
образца воды, практически одинаковы. Во всех образцах воды присутствуют
пузырьки кислорода - «вода дышит». На вкус вода практически схожа, но
отличается тем, что на вкус воды, в первую очередь, влияет её источник,
далее минеральный состав, который может меняться из-за различных
воздействий на него и структура человеческой слюны, которая зависит от
человека и от того, что мы ели до приема жидкости.
24.
25.
Закрепление нового материала:Какая вода называется жесткой?
Перечислите виды жесткой воды?
Назовите способы устранения?
Какие из следующих веществ можно использовать для
смягчения жесткой воды: NaOH, H2SO4, CaCl2, Na3PO4,
CaSO4, известковая вода, Na2CO3?
5) Как химическим путем можно очистить в домашних
условиях поверхность посуды от накипи?
1)
2)
3)
4)
26.
Домашнее задание• Домашнее задание - § 32 Жесткость воды и способы
ее устранения. Проверьте свои знания, вопрос 1,2,3,4.
27.
Министерство образования и науки Челябинской областиГБПОУ « Челябинский государственный промышленно- гуманитарный
техникум имени А.В. Яковлева»
Тема урока:
«Жесткость воды
и способы ее устранения»
Подготовила:
преподаватель химии,
ГБПОУ ЧГПГТ им. А. В. Яковлева
Габбасова Н.В.
Челябинск, 2020г.























 chemistry
chemistry








