Similar presentations:
Оксиды и гидроксиды металлов
1.
ГПОУ «Макеевскиймедицинский колледж»
Оксиды и
гидроксиды
металлов
Ляскевич Л.Н.,
Преподаватель химии,
высшая категория
2.
KOHNa2O
MgO
Ba(OH)2
Тема нашего
урока…
Mg(OH)2
CaO
3.
Тема :«Оксиды и
гидроксиды
металлов»
4.
В результате изучения темы, выбудете способны:
1.Давать определение МеО и МеОН
2. Рассматривать способы получения МеО
и МеОН
3. Рассматривать хим.св-ва МеО и МеОН
4. Осуществлять ЦП.
5. Решать задачи на смеси Ме
6.Осуществлять рефлексию своей
деятельности
5.
Оксиды – это сложные вещества, состоящие из двухэлементов, один из которых кислород
6. .
• Свойства оксидов и гидроксидов в периодеизменяются от основных через амфотерные к
кислотным, т.к. увеличивается положительная
степень окисления элементов.
+1
+3
Na2 O, Mg+2O , Al2 O3
основные
+1
амфотерный
+3
NaOН, Mg+2(OН)2 , Al(OН)3
щелочь
Амфотерный
Слабое
основание гидроксид
• В главных подгруппах основные свойства
оксидов и гидроксидов возрастают сверху
вниз.
7. Оксиды металлов главной подгруппы II группы
8. Оксиды металлов II группы, главной подгруппы
• Общая формула МеО• Твердые, кристаллические вещества
белого цвета
• ВеО – амфотерный оксид
• Оксиды Mg, Ca, Sr, Ba – основные
оксиды
9. Оксиды металлов II группы, главной подгруппы
1. Взаимодействуют с водой(кроме ВеО),образуя щелочи(MgO – слабое
основание):
СаО + H2O →
2. Взаимодействуют с кислотами, образуя
соль и воду: MgО + НCl →
3. Взаимодействуют с кислотными
оксидами, образуя соли: СаО + SO3 →
4. ВеО взаимодействует со щелочами:
ВеО + 2NaOH + H2O → Na2[Ве(OH)4]
10. Гидроксиды металлов главной подгруппы II группы
11. Гидроксиды металлов II гр.гл.подгр
• Общая формула – Ме(ОН)2• Белые кристаллические вещества, в воде
растворимы хуже, чем гидроксиды
щелочных металлов. Ве(ОН)2 – в воде
нерастворим.
• Основные свойства усиливаются в ряду:
Ве(ОН)2→ Mg(ОН)2 → Ca(ОН)2 → Sr(ОН)2
→ Вa(ОН)2
12. Гидроксиды металлов II гр.гл.подгр
• Ве(ОН)2 – амфотерный гидроксид• Mg(ОН)2 – слабое основание
• Са(ОН)2, Sr(ОН)2, Ва(ОН)2 – сильные
основания – щелочи.
1. Изменяют цвет индикаторов:
Лакмус – ….
Фенолфталеин – …..
Метил-оранж – ….
2. Взаимодействуют с кислотами, образуя соль
и воду:
Ве(ОН)2 + Н2 SO4 →
3. Взаимодействуют с кислотными оксидами.
Са(ОН)2 + SO3 →
13. Гидроксиды металлов II гр.гл.подгр
4. Взаимодействуют с растворами солей,если образуется газ или осадок.
Ва(ОН)2 + K2SO4 →
5. Гидроксид бериллия взаимодействует со
щелочами:
Ве(ОН)2 + 2NaOH → Na2[Ве(OH)4]
14. Зарядка для глаз ( вверх вниз по ступеням, считаем фонари зигзагами)
15.
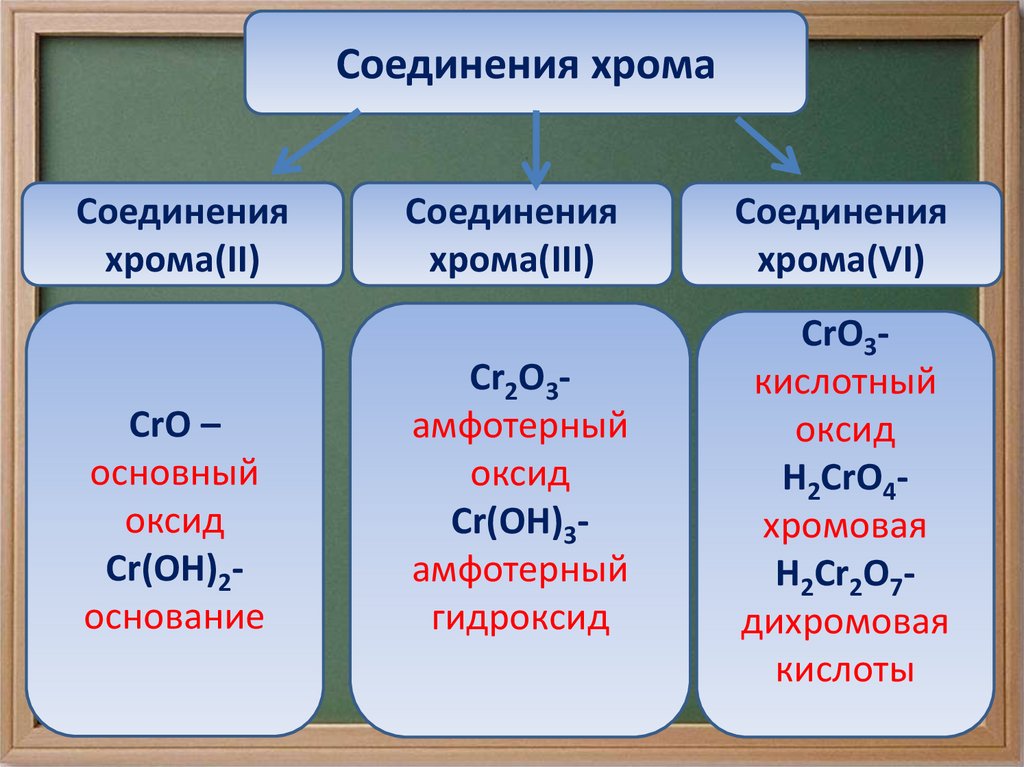
Соединения хромаСоединения
хрома(II)
CrO –
основный
оксид
Cr(OH)2основание
Соединения
хрома(III)
Соединения
хрома(VI)
Cr2O3амфотерный
оксид
Cr(OH)3амфотерный
гидроксид
CrO3кислотный
оксид
H2CrO4хромовая
H2Cr2O7дихромовая
кислоты
16.
17.
18.
19.
ТЕСТ ДЛЯ ЗАКРЕПЛЕНИЕ ТЕМЫ1. Не является оксидом
1) OF2
2) CO2
3) Na2O
4) N2O
2. Растворяются в воде и кислотах оба следующих оксида
1) ВаО и Cr2O3
2) СаО и Nа2О
3) K2O и CuO
4) CrO3 и Al2O3
3. Растворяются в щелочах и кислотах оба следующих оксида
1) ZnO и FeO
2) А12O3 и CrO3
3) Fe2O3 и CrO
4) ВеО и Cr2O3
20.
4. Основные свойства постоянно увеличиваются в ряду1) NaOH → Mg(OH)2 → Аl(ОН)3
2) LiOH → Ве(ОН)2 → Mg(OH)2
3) Mg(OH)2 → Са(ОН)2 → КОН
4) КОН → CuOH → RbOH
5. С щелочами взаимодействуют оба металла
1) Cu и Fe
2) Мg и Ca
3) Zn и Ba
4) Be и Al
6.При сплавлении Cr2O3 с гидроксидом натрия образуется
1) Na2Cr2O7
2) Na2CrO4
3) Na3[Cr(OH)6]
4) NaCrO2
21.
Домашнее заданиеНаписать конспект
Разобрать параграф: § 34
Выполнить тест для закрепления
темы




















 chemistry
chemistry








