Similar presentations:
Оксиды и гидроксиды металлов
1.
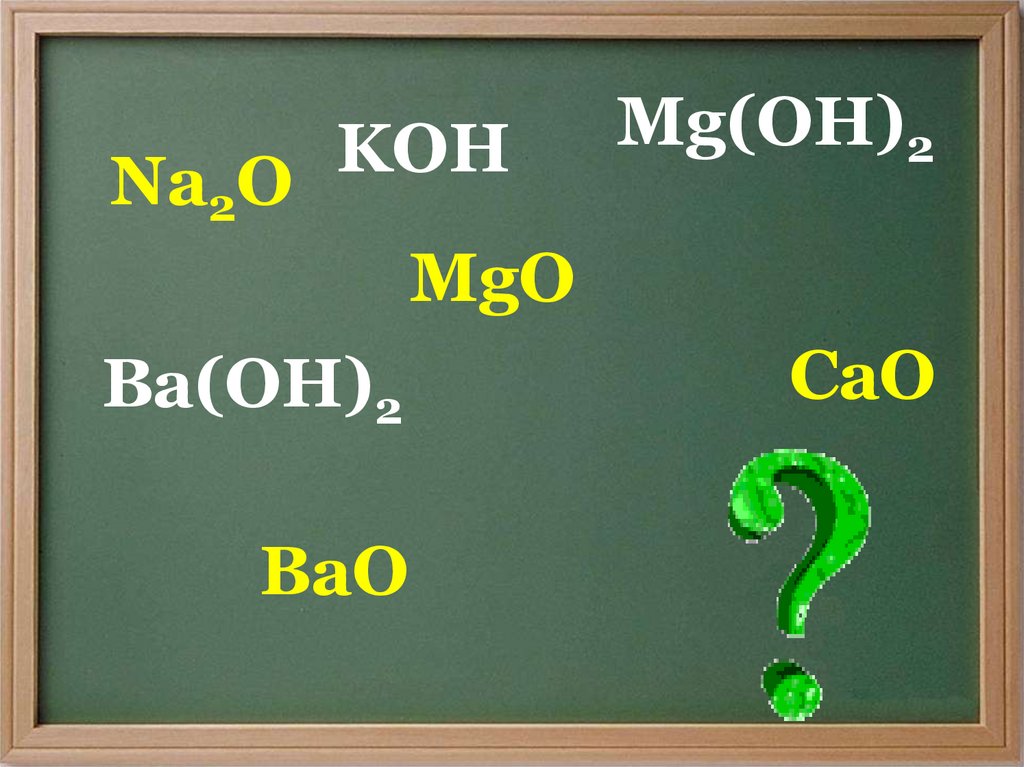
KOHNa2O
MgO
Ba(OH)2
BaO
Mg(OH)2
CaO
2.
...05.17гТема урока:
«Оксиды и
гидроксиды
металлов»
3. Оксиды металлов
4. Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород.
• Основные (Me +1,+2)Na2 O, Mg+2O
• Амфотеные (Me +3,+4)
Al2 O3, PbO 2
и Zn+2O, Pb+2O, Be+2O, Sn+2O
5. Оксиды основные
6. Основные оксиды
• Химические свойства:1. Взаимодействуют с водой (10!!!) → щелочь:
Na2О + H2O →2NaOH
2. Взаимодействуют с кислотами →соль и вода:
Na2О + 2НCl → 2NaCl + H2О
3. Взаимодействуют с кислотными оксидами→соль:
Na2О + SO3 → Na2SO4
4. Взаимодействуют с амфотерными оксидами →
соль: Na2О + ZnO → Na2ZnO2
5. Взаимодействуют с восстановителями →Металл:
(не 10!!!)
CuО + C → Cu+CO
7. Амфотерные оксиды
• Химические свойства:1. НЕ Взаимодействуют с водой
2. Взаимодействуют с кислотами →соль и воду:
Al 2О 3 + 6НCl → 2AlCl3 + 3H2О
3. Взаимодействуют с кислотными оксидами →
соль:
Al 2О 3 + 3SO3 → Al2 (SO4) 3
4. Взаимодействуют с восстановителями
→Металл:
Al 2О 3 + 3C → 2Al+3CO
5. Взаимодействуют со щелочами → соль:
Al 2О 3 + 2NaOH→ NaAlO2+ 2H2О
8. Получение оксидов металлов
9.
ПОЛУЧЕНИЕ ОКСИДОВ1.Окислением простых веществ:
2Cu+ О2 → 2CuО
2.Горением сложных веществ:
2H2 S+3О2 →2H2O+2SО2
3.Разложением сложных веществ при to :
1. Нерастворимых оснований
t
Cu(OН)2=CuО + H2O
2. Некоторых солей
t
СаСО3= СО2 + СаО
0
0
10. Гидроксиды металлов
11. Гидроксиды щелочных металлов
• Общая формула – МеОН• Белые кристаллические вещества,
гигроскопичны, хорошо растворимы в
воде (с выделением тепла). Растворы
мылкие на ощупь, очень едкие.
NaOH – едкий натр
КОН – едкое кали
Щелочи. Основные свойства усиливаются
в ряду:
LiOH → NaOH → KOH → RbOH → CsOH
12. Гидроксиды щелочных металлов
1. Изменяют цвет индикаторов:Лакмус – синий
Фенолфталеин – малиновый
Метил-оранж – желтый
2. Взаимодействуют со всеми кислотами.
NaOH + HCl → NaCl+ H2O
3. Взаимодействуют с кислотными оксидами.
2NaOH + SO3 → Na2SO4+H2O
4. Взаимодействуют с растворами солей, если
образуется газ или осадок.
2NaOH + CuSO4 → Na2SO4+ Cu(OH)2
13. Гидроксиды щелочных металлов
5. Взаимодействуют с некоторыми неметаллами(серой, кремнием, фосфором)
2NaOH +Si + H2O → Na2SiO3 + 2H2↑
6. Взаимодействуют с амфотерными
гидроксидами
2 NaOH + Zn(ОН)2 → Na2[Zn(OH)4]
Zn(OH)2+2NaOH=Na2ZnO2+2H2O
и амфотерными оксидами
Al 2О 3 + 2NaOH→ NaAlO2+ 2H2О
14. Гидроксиды металлов II гр.гл.подгр
• Общая формула – Ме(ОН)2• Белые кристаллические вещества, в воде
растворимы хуже, чем гидроксиды
щелочных металлов. Ве(ОН)2 – в воде
нерастворим.
• Основные свойства усиливаются в ряду:
Ве(ОН)2→ Mg(ОН)2 → Ca(ОН)2 → Sr(ОН)2
→ Вa(ОН)2
15. Гидроксиды металлов II гр.гл.подгр
• Ве(ОН)2 – амфотерный гидроксид• Mg(ОН)2 – слабое основание
• Са(ОН)2, Sr(ОН)2, Ва(ОН)2 – сильные
основания – щелочи.
1. Изменяют цвет индикаторов:
Лакмус – синий
Фенолфталеин – малиновый
Метил-оранж – желтый
2. Взаимодействуют с кислотами, образуя соль
и воду:
Ве(ОН)2 + Н2 SO4 →BeSO4 + 2H2О
3. Взаимодействуют с кислотными оксидами.
Са(ОН)2 + SO3 →CaSO4
16. Гидроксиды металлов II гр.гл.подгр
4. Взаимодействуют с растворами солей,если образуется газ или осадок.
Ва(ОН)2 + K2SO4 →BaSO4 + 2KOH
5. Гидроксид бериллия взаимодействует со
щелочами:
Ве(ОН)2 + 2NaOH → Na2[Ве(OH)4]
17. Получение гидроксидов
1.Получение растворимых в воде оснований-щелочейА)Активный металл + вода= щелочь + водород
2Na + 2H2O→2NaOH + H2
Б)Основной оксид + вода = щелочь
K2O + H2O 2KOH
2.Получение нерастворимых в воде оснований
а)Растворимая соль + щелочь = нерастворимое
основание
2NaOH + CuSO4 → Na2SO4+ Cu(OH)2
18.
РефлексияЗадание 1.
Осуществите цепочку превращений:
К2O → КOH → K2SO4
Задание 2.
C какими веществами взаимодействует К2O:
серная кислота, гидроксид натрия, вода,
оксид серы (IV), оксид кальция
Задание 3.
C какими веществами взаимодействует КOН:
соляная кислота, гидроксид бария, вода,
оксид серы (IV), оксид натрия
19.
РефлексияЗадание 2. Решите задачу:
Задача 1. В результате полного восстановления
30,4 г смеси оксида железа (II) FeO и оксида
железа (III) Fe2O3 избытком CO было получено
11,2 л (н. у.) углекислого газа. Определите
массовую долю оксидов железа в смеси.
Решение:
хг
хмоль
FeO +CO═Fe+CO2
72г/моль
1моль
30,4г
11,2л или 0,5 моль
уг
у моль
Fe2O3 +3CO═2Fe+3CO2
160г/моль
3моль
{
|
20.
Задание 2. Решите задачу:Рефлексия
Задача 1. В результате полного восстановления
30,4 г смеси оксида железа (II) FeO и оксида
железа (III) Fe2O3 избытком CO было получено
11,2 л (н. у.) углекислого газа. Определите
массовую долю оксидов железа в смеси.
Решение:
x+3y=0,5
72х+160у=30,4
{х= 0,2моль
у=0,1моль
Ответ: w(FeO)=0,4737 или 47,37%
w(Fe2O3)=0,5263 или 52,63%
21.
РефлексияЗадание 2. Решите задачу:
Задача 2. Масса воды после восстановления
водородом 31,9 г смеси оксида меди (II) и
оксида железа (III) составляет 9 г. Вычислить
состав смеси оксидов (в процентах по массе).
Решение:
хг
хмоль
СuO+H2═Cu+H2O
80г/моль
1моль
30,4г
уг
у моль
Fe2O3 +3H2═2Fe+3H2O
160г/моль
3моль
{
|
9г или 0,5 моль
22.
Задание 2. Решите задачу:Рефлексия
Задача 2. Масса воды после восстановления
водородом 31,9 г смеси оксида меди (II) и
оксида железа (III) составляет 9 г. Вычислить
состав смеси оксидов (в процентах по массе).
Решение:
x+3y=0,5
80х+160у=30,4
{х= 0,14моль
у=0,12моль
Ответ: w(СuO)=0,3684 или 36,84%
w(Fe2O3)=0,6316 или 63,16%
23.
Задача 3. На полную нейтрализацию раствора,содержащего 34,2 г смеси гидроксидов натрия и
кальция, было израсходовано 29,4 г фосфорной
кислоты. Определите количественный состав
исходной смеси.
Задача 4*. При взаимодействии 12 г смеси
оксидов меди (II) и магния с азотной кислотой
образовалось 33,6 г нитратов этих металлов.
Определить массовые доли оксидов в
исходной смеси.
24. Рефлексия
1.На уроке я работал…2.Своей работой на уроке я…
3.Урок для меня показался…
4.За урок я…
5.Мое настроение…
6.Материал урока мне был…
активно, доволен, коротким, не устал,
полезен, стало лучше, понятен,
интересен, легким.























 chemistry
chemistry








