Similar presentations:
Метод Улиха
1.
12.
Исследование зависимости изменения энергии Гиббса (ΔG°T) иконстанты равновесия (Kp) от температуры методом Улиха
Литература:
1. Владимиров Л.П. Термодинамические расчеты равновесия
металлургических реакций. – М., Металлургия, 1970.
Пусть теплоемкости веществ, участвующих в реакции, не зависят от
температуры, тогда:
ср = а = const.
(5.1)
Уравнение зависимости энтальпии от температуры:
T
H T0 H 00 c p dT
0
записывается в виде:
T
0
H T0 H 298
adT .
(5.2)
298
2
3.
Такой же вид имеет уравнение для энтропииT
a
0
0
ST S 298 dT .
T
298
(5.3)
Подставим значения ΔH°T и ΔS°T из уравнений (5.2) и (5.3) в уравнение
для энергии Гиббса (5.4):
(5.4)
ΔG°T = ΔH°T ̶ T·ΔS°T.
Получим:
T
T
a
0
adT
Т
S
T
dT .
ΔG°T = ΔH°298 +
(5.5)
298
T
298
298
ср = а = const.
Проинтегрируем уравнение (5.5):
Т
ΔG°T = ΔH°298 + а(T – 298) ̶ Т·ΔS°298 – а·Т·ln
= ΔH°298 ̶ T·ΔS°298 –
298
298
Т
– a·T (ln 298 + Т – 1) .
Выражение в скобках зависит только от температуры
рассчитывают заранее для требуемой температуры.
(5.6)
и
его
3
4.
Обозначим:Т
298
f(T) = ln
+ Т – 1.
298
(5.7)
Подставим (5.7) в (5.6):
ΔG°T = ΔH°298 – Т·ΔS°298 – а·Т·f(T).
(5.8)
Точность метода Улиха зависит от изменения теплоемкости веществ в
заданном температурном интервале.
Методика расчета теплоемкости
Температурный интервал, в котором вычисляют изменение ΔG°T, делят
на участки. Для каждого участка определяют среднее значение
теплоемкости. Рекомендовано определять значения теплоемкостей (ср) для
веществ, участвующих в реакции при Т = 300, 600, 1200 и 2400 K. Затем
вычисляют средние значения Δс р между этими температурными границами.
1
Δс р 300 600 = (Δср 300 + Δср 600).
2
4
5.
1Δс р 600 1200 = (Δср 600 + Δср 1200).
2
1
Δс р 1200 2400 = (Δср 1200 + Δср 1400).
2
Средние значения теплоемкостей принимают за истинные значения для
средних температур выбранных участков – 450, 900 и 1800 K.
Пример.
Определить значения ∆G°T и lgKp методом Улиха для реакции:
UF4 + F2 = UF6
при температуре 500, 1000, 1300 и 2000 K. Сравнить полученные значения
со значениями, вычисленными методом изобары.
Решение.
1. Рассчитаем величину теплоемкости исследуемой реакции при
температурах, указанных в условиях задачи.
5
6.
Для этого рассчитаем теплоемкости веществ, участвующих в реакциипри температурах 300, 600 и 1200 K, т.е. в точках на которые разбита
температурная шкала.
Зависимость теплоемкости от температуры выражается уравнением:
ср = а + b·T + c ·T–2
Дж
.
моль K
UF6
ср = 151,14 + 5,44·10–3·T – 20,39·105·T–2.
Т = 300 K ср=151,14+5,44·10–3·300–20,39·105·300–2=151,14+1,63–22,66=130,11
Т = 600 K ср=151,14+5,44·10–3·600–20,39·105·600–2=151,14+3,263–5,66=148,74
Т = 1200 K ср=151,14+5,44·10–3·1200–20,39·105·1200–2=151,14+6,53–1,42=156,25
ср = 107,6 + 29,31·10–3·T – 0,25·105·T–2.
UF4
Т = 300 K ср=107,6+29,31·10–3·300–0,25·105·300–2=107,6+8,79–0,28=116,11
Т = 600 K ср=107,6+29,31·10–3·600–0,25·105·600–2=107,6+17,6–0,1=1256,1
Т = 1200 K ср=107,6+29,31·10–3·1200–0,25·105·1200–2=107,6+35,2–0,02=142,8
6
7.
F2ср = 34,71 + 1,84·10–3·T – 3,35·105·T–2.
Т = 300 K ср=34,71+1,84·10–3·300–3,35·105·300–2=34,71+0,55–30,72=31,54
Т = 600 K ср=34,71+1,84·10–3·600–3,35·105·600–2=34,71+1,10–0,93=34,88
Т = 1200 K ср=34,71+1,84·10–3·1200–3,35·105·1200–2=34,71+2,21–0,23=36,69
Рассчитаем ср по уравнению:
Дж
.
2
моль K
ср = с р UF – с р UF – с р F
6
Т = 300 K
Т = 600 K
Т = 1200 K
4
ср=130,11–116,11–31,54 = –17,54 (а1)
ср=148,74–125,1–34,88 = –11,24
ср=1568,25–142,8–36,69 = –23,24
Рассчитаем Δс р 300 600 и Δс р 600 1200 по уравнениям:
1
1
Δс р 300 600 = (Δср 300 + Δср 600) = (–17,54–11,24) = –14,39
2
2
1
1
Δс р 600 1200 = (Δср 600 + Δср 1200) = (–11,24–23,24) = –17,24
2
2
7
8.
11
Δс р 600 1200 = (Δср 600 + Δср 1200) = (–11,24–23,24) = –17,24
2
2
Рассчитаем а5 по уравнению:
1
a5 = ( Δс р 300 600 + Δс р 600 1200 )
2
1
a5 = (–14,39 + –17,24) = –15,82
2
Рассчитаем а3 по уравнению:
a3 = Δс р 300 600
a3 = –14,39
Рассчитаем а4 по уравнению:
1
a4 = (a3 + a5)
2
1
a4 = (–14,39 –15,82) = –15,11
2
8
9.
Рассчитаем а2 по уравнению:1
a2 = (a1 + a3)
2
1
a2 = (–17,54 – 14,39) = –15,97
2
Рассчитаем а1 по уравнению:
0
a1 = ср 300
0
a1 = ср 300
= –17,54
2. Рассчитаем ΔG°T при 1000 K по уравнению (5.6).
ΔG°1000 = – 239 800 – 1000·46,7 – (–14,39)·(ln
+
– 1) = – 239 800 –
Дж
– 46 700 + 14 390 (1,2 + 0,298 – 1) = – 279 333,8
моль
9
10.
Сравним значения ΔG°1000, полученные методом Улиха и методомизобары.
Дж
Из задания №1 ΔG°1000 = – 301 006
. Тогда:
моль
Дж
– 301 006
– 100 %
моль
Дж
– 279 333,8
–х%
моль
х = 92,8 %.
Погрешность между двумя методами составит:
= 100 – 92,8 = 7,2 %.
10
11.
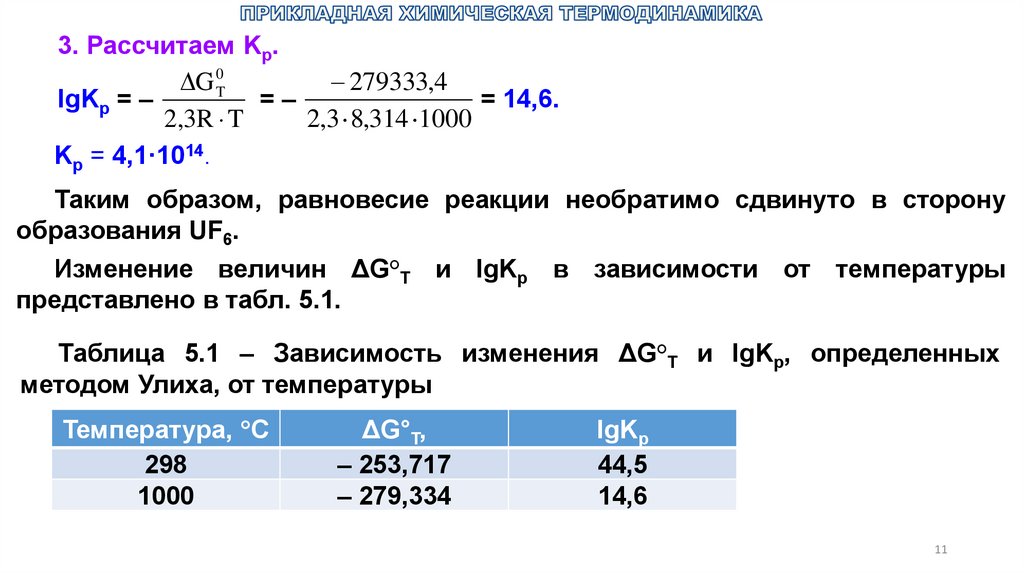
3. Рассчитаем Kp.279333,4
G 0T
lgKp = –
=–
= 14,6.
2,3R T
2,3 8,314 1000
Kp = 4,1·1014.
Таким образом, равновесие реакции необратимо сдвинуто в сторону
образования UF6.
Изменение величин ΔG°T и lgKp в зависимости от температуры
представлено в табл. 5.1.
Таблица 5.1 – Зависимость изменения ΔG°T и lgKp, определенных
методом Улиха, от температуры
Температура, С
298
1000
ΔG°T,
– 253,717
– 279,334
lgKp
44,5
14,6
11










 physics
physics