Similar presentations:
Растворы. Растворение как физико-химический процесс
1. Лекция
Растворы.Растворение как
физикохимический
процесс.
2.
Растворы - это гомогенныеустойчивые системы
переменного состава,
состоящие минимум из двух
компонентов: растворителя
и растворенного вещества.
3.
С точки зрения термодинамикивсе компоненты раствора
равноценны;
растворителем принято считать
компонент, агрегатное
состояние которого совпадает с
агрегатным состоянием
раствора.
4.
Если нельзя определитьрастворитель по этому
признаку,
то им считается
компонент с большей
массой.
5.
Классификация растворова) по агрегатному состоянию
• Газообразные :воздух, смесь О2 и
СО2 (карбоген) для активации
дыхательного центра;
• Жидкие: биологические
жидкости
• Твердые :
человека;
сплавы металлов,
растворы H2 в платиновых
металлах
6.
б) по размеру частиц растворенноговещества
•Истинные (молекулярные) < 10-9 м,
•Коллоидные 10-9 < < 10-7 м (кровь)
•Грубодисперсные >10-7 м
где - диаметр частицы растворенного
вещества , м
7.
Растворы играют важнейшуюроль в биосфере:
1) жизнь зародилась в мировом
океане; современные
животные и человек
унаследовали от океанических
предков неорганический
состав крови, сходный с
составом морской воды
8.
2) усвоение питательныхвеществ и лекарственных
препаратов происходит в
растворенном виде;
3) в растворах протекают
биохимические реакции.
Важнейшим биогенным
растворителем является
вода.
9.
Вода - самое распространенное наземле вещество. Общий объем воды
в биосфере 1,5 × 109км3. В живых
организмах - 2,3 × 103км3.
Считают, что большая часть воды
имеет биогенное происхождение, т.е.
проходит через метаболические
превращения организмов.
Суточное потребление воды ~ 2л.
10.
Вода, благодаря своимуникальным физикохимическим свойствам,
выполняет
многочисленные
функции в организме
человека
11.
а) ее высокаяполярность
(молекулы воды
являются диполями)
делает воду одним из
лучших
растворителей как
для неорганических,
так и для многих
органических
веществ;
12.
б) ее высокая теплоемкостьобеспечивает
температурный гомеостаз
организма;
в) большая теплота
испарения воды защищает
тело человека от перегрева;
13.
г)способность водыдиссоциировать на ионы
позволяет ей участвовать в
кислотно-основном
равновесии;
д) вода является субстратом
многих биохимических реакций (гидролиз, гидратация);
14.
е) вода влияет наактивность
ферментов, регулируя
скорость
биохимических
реакций.
15.
Растворение -это самопроизвольный
обратимый физикохимический процесс,
включающий три
основные стадии.
16.
1)Стадия атомизацииразрушениекристаллической
решетки растворяемого
о вещества; процесс
эндотермический
( атН>О);
17.
2)стадия сольватации(гидратации) - образование
сольватных (гидратных)
оболочек вокруг частиц
растворенного вещества;
процесс экзотермический,
( сол Н<О);
18.
19.
3)стадия диффузии равномерноераспределение
растворенного
вещества по всему
объему раствора,
( диф Н ≈ О).
20.
Как любой обратимыйпроцесс, растворение
доходит до равновесия.
Раствор, находящийся в
равновесии с избытком
растворяемого вещества,
называется насыщенным.
21.
В состоянии равновесия скоростьрастворения равна скорости
кристаллизации
Жидкая фаза
Растворение
Кристаллизация
Твердая фаза
22.
Растворы•Ненасыщенные: содержат меньше
растворенного
вещества,
чем
насыщенные
•Насыщенные
•Пересыщенные: содержат больше
растворенного
вещества,
чем
насыщенные (неустойчивы)
23.
Растворимость (S) - этоспособность вещества
растворяться в данном
растворители. Она равна
содержанию растворенного
вещества в его насыщенном
растворе при данной
температуре.
24.
Факторы, влияющие нарастворимость
Растворимость зависит
от природы веществ и
термодинамических
параметров системы.
25.
Влияние природывеществ на растворимость
описывается правилом:
«Подобное
растворяется в
подобном».
26.
Другими словами, полярныевещества хорошо растворяются
в полярных растворителях, а
неполярные - в неполярных.
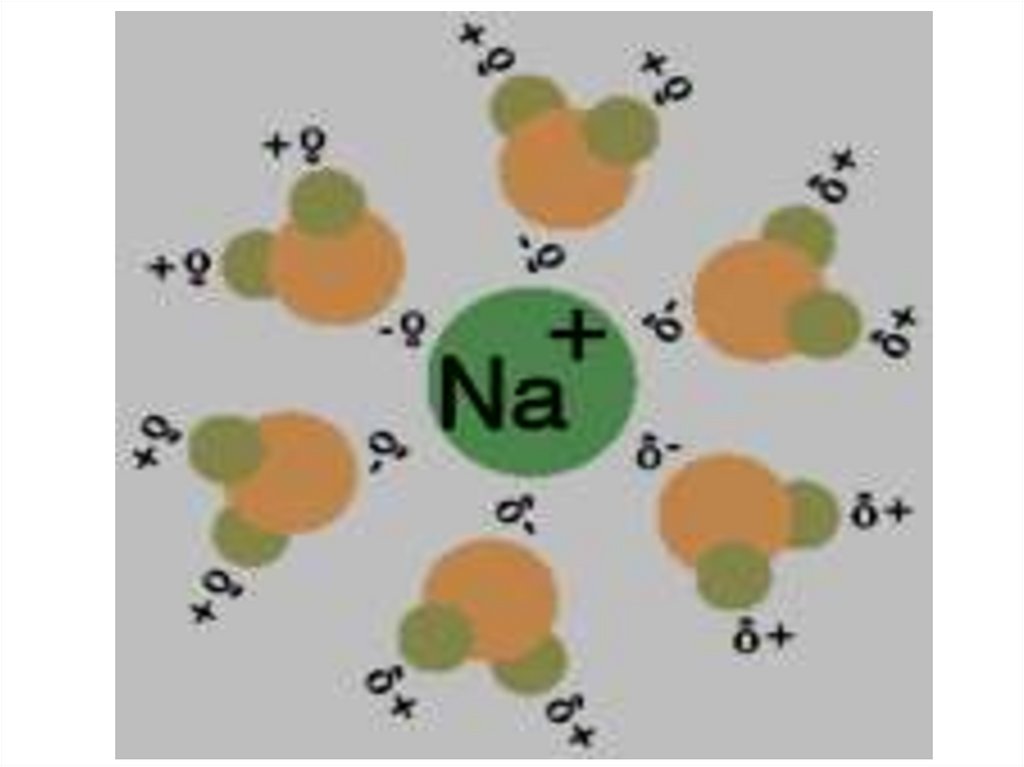
Например: NaCl хорошо
растворим в воде и плохо в
бензоле; I2 хорошо растворим в
бензоле и плохо в воде.
27.
Растворение газов вводе можно
представить схемой:
А(г) + Н2О ⇄ А(р-р)
рН<О
28.
а) В соответствии спринципом Ле Шателье при
повышении температуры
равновесие смещается
влево, т.е. растворимость
уменьшается, а при
понижении температуры –
вправо, растворимость
увеличивается.
29.
б) В соответствии спринципом Ле Шателье
при увеличении
давления равновесие
смещается вправо, т.е.
растворимость газов
растет.
30.
в) На растворимость газов влияетприсутствие электролитов в
растворе. Эта зависимость
описывается уравнением Сеченова
(1859 г.):
S = S0
-kc
e
где S и S0 - растворимость газа в
растворе электролита и чистой воде,
с - концентрация электролита,
k - константа Сеченова
31.
Чем выше концентрацияэлектролита в растворе,
тем ниже растворимость
газов. Вот почему
растворимость газов в
воде больше, чем в
плазме.
32. Растворение жидкости в воде можно представить схемой: А(ж) + Н2О ⇄ А(р-р)
33.
Основной стадиейрастворения жидкости в
жидкости является
диффузия, скорость
которой возрастает с
увеличением
температуры.
34.
Соответственно,взаимная
растворимость
жидкостей
усиливается с
ростом
температуры.
35.
Различают три типажидкостей:
а)неограниченно растворимые
друг в друге: Н2SO4/Н2О,
С2Н5ОН/Н2О;
б) ограниченно растворимые:
С6Н6/Н2О
в) абсолютно нерастворимые:
Hg/H2O.
36.
Если в систему из двухнесмешивающихся жидкостей
добавить третий компонент, то
отношение его концентраций в
каждой жидкости есть величина
постоянная при данной
температуре
(закон Нернста- Шилова)
37.
Закон НернстаШилова –теоретическая основа
экстракции- одного из
способов разделения
смесей.
38. Растворение твердых веществ описывается схемой: А(к) + Н2О ⇄ А(р-р), р Н > О
Растворение твердыхвеществ описывается
схемой:
А(к) + Н2О ⇄ А(р-р),
р Н > О
39.
Гетерогенное равновесие междутруднорастворимым
электролитом (солью,
основанием или кислотой) и его
ионами в насыщенном растворе
описывается схемой:
AnBm
+
(к) ⇄ nA (aq) + mB (aq).
40.
Одним из наиболееважных
гетерогенных
процессов in vivo
является
образование костной
ткани.







































 chemistry
chemistry








