Similar presentations:
Химическая теория растворения
1.
Выполнил ученик 8 ,,В”класса Лелюкаев Ислам
2.
В 1859-1861 годах находился вкомандировке в Гейдельберге "для
усовершенствования в науках".
Вернувшись, Менделеев написал
"Органическую химию" - первый
русский учебник по этой
дисциплине, который был
удостоен Демидовской премии.
3.
В 1865 году Менделеевзащитил докторскую
диссертацию, в которой
заложил основы нового
учения о растворах, и стал
профессором
Петербургского
университета. Преподавал
Менделеев и в других высших
учебных заведениях.
4.
В 1890-1895 годахМенделеев был
консультантом Научнотехнической лаборатории
Морского министерства; в
1892 году наладил
производство изобретенного
им бездымного пороха.
Организатор и первый
директор (1893-1907)
Главной палаты мер и весов.
5.
Менделеев возглавлял большуюэкспедицию по изучению
промышленности Урала, участвовал в
работе Всемирной выставки в Париже
в 1900 году, разрабатывал программу
экономического преобразования
России. В последних крупных работах
"Заветные мысли" и "К познанию
России" Менделеев суммировал свои
идеи, связанные с общественной,
научной и экономической
деятельностью. Уже при жизни
пользовался мировой славой.
6.
Менделеев оставил свыше 500 печатных трудов. Онявляется автором фундаментальных исследований по
химии, химической технологии, физике, метрологии,
воздухоплаванию, метеорологии, сельскому хозяйству,
экономике, народному просвещению и др., тесно связанных
с потребностями развития производительных сил России.
Помимо открытия периодического закона химических
элементов и написания "Основ химии" (первого стройного
изложения неорганической химии) ученый заложил основы
теории растворов, предложил промышленный способ
фракционного разделения нефти, изобрел вид бездымного
пороха, пропагандировал использование минеральных
удобрений, орошение засушливых земель.
7.
В 1890-х годах провёл рядисследований по термохимии и
установил (совместно с В. Ф.
Лугининым), что теплота
присоединения брома к этиленовым
углеводородам увеличивается по
мере перехода от низших гомологов
к высшим. В 1905 году впервые
применил метод термического
анализа к изучению взаимного
обмена солей в расплавах.
8.
Научная и преподавательская деятельность Основная областьнаучных интересов академика И. А. Каблукова относится к
электрохимии неводных растворов: В годах он изучал
электрическую проводимость электролитов в органических
растворителях и установил аномальную проводимость неводных
растворов электролитов и увеличение электрической проводимости
при добавлении воды к спиртовым растворам. Исходя из этих
наблюдений, А. И. Каблуков предположил химическое
взаимодействие между растворителем и растворяемым
веществом. Эти работы по электрохимии неводных растворов
стали предметом его докторской диссертации «Современные
теории растворов (Вант- Гоффа и Аррениуса) в связи с учениями о
химическом равновесии» (1891) и положили начало сближению
физической и химической теорий растворов
9.
Химическая теорияСторонники теории доказывали, что растворение
является результатом химического взаимодействия
растворенного вещества с молекулами воды
Дмитрий Иванович
Менделеев
Иван Алексеевич
Каблуков
10.
Процесс Растворения - это процесс химическоговзаимодействия растворяемого вещества с водой.
Растворы - это соединения – гидраты.
Гидраты - непрочные соединения веществ с водой,
существующие в растворе.
Кристаллогидраты – соли и другие твердые вещества в
состав которых входит соль
11.
Растворение- это процесс равномерногораспределения одного вещества в другом
12.
КристаллCuSO45H2O
Гидрат метана
(CH₄)₄(H₂O)₂₃
13.
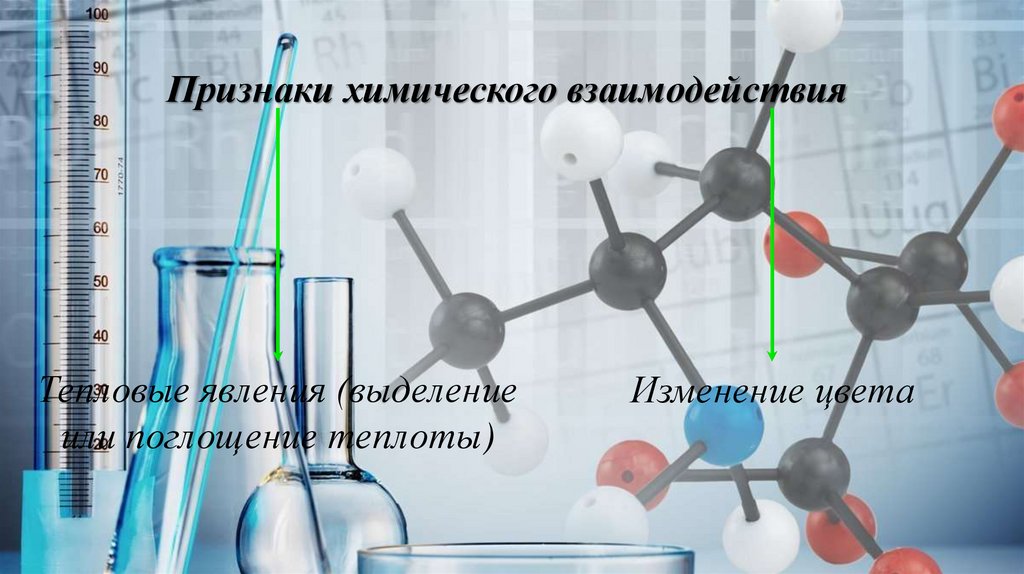
Признаки химического взаимодействияТепловые явления (выделение
или поглощение теплоты)
Изменение цвета
14.
Тепловые явленияЭкзотермические
(растворение H2SO4 )
Эндотермические
(растворение NaCI)
Изменение цвета
выпаривание Синие кристаллы
Белые кристаллы CuSO4(Безводного)
CuSO4 ·5H2O, раствор раствор
голубого цвета
приливание воды
15.
От чего зависитрастворимость веществ
1.Природы вещества
2.Природы растворителя
3.От температуры
16.
Растворы (приданной
температуре)
Насыщенные
Ненасыщенные
Перенасыщенные
Вещество
больше не
растворяется
Меньше
растворяемого
вещества, чем в
насыщенном
растворе
Больше
растворяемого
вещества, чем в
насыщенном
растворе
17.
I) По агрегатному состояниюЖидкие
Твердые
Газообразные
Растворитель и
растворенное
вещество в жидком
агрегатном состоянии
Растворитель и
растворенное вещество в
твердом агрегатном
состоянии
Растворитель и
растворенное вещество в
агрегатном газообразном
состоянии
Сироп, рассол
Сплавы
Золотые
украшения
Воздух
Природный
газ
18.
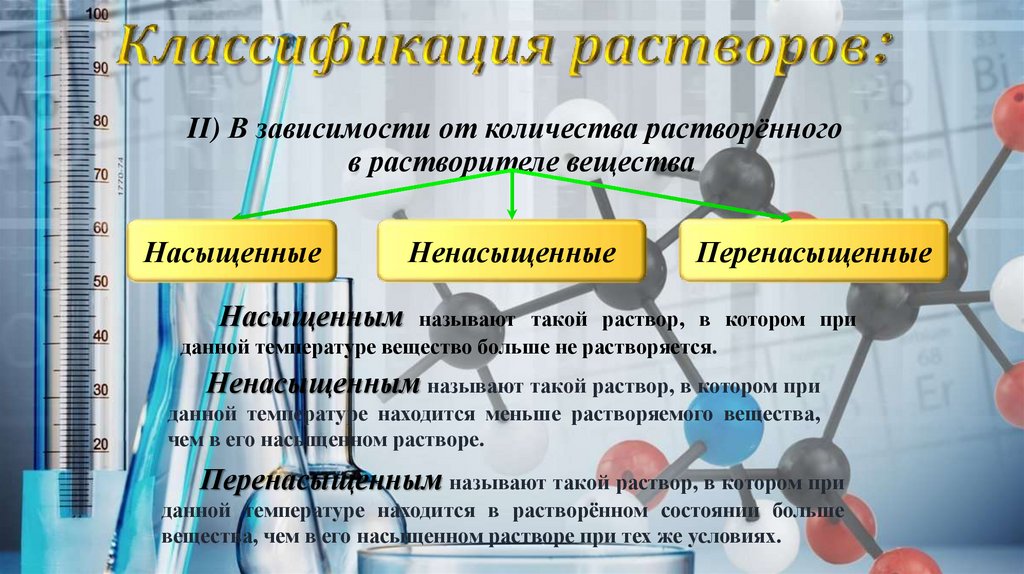
II) В зависимости от количества растворённогов растворителе вещества
Насыщенные
Ненасыщенные
Перенасыщенные
Насыщенным называют такой раствор, в котором при
данной температуре вещество больше не растворяется.
Ненасыщенным называют такой раствор, в котором при
данной температуре находится меньше растворяемого вещества,
чем в его насыщенном растворе.
Перенасыщенным называют такой раствор, в котором при
данной температуре находится в растворённом состоянии больше
вещества, чем в его насыщенном растворе при тех же условиях.
19.
В зависимости от способности веществарастворятся в воде, оно может быть:
Вещество хорошо
растворимо,
если при
комнатной
температуре в 100
граммах воды
растворяется более
1 грамма этого
вещества.
Вещество
малорастворимо,
если при комнатной
температуре в 100
граммах воды
растворяется менее
1 грамма этого
вещества.
Нерастворимыми
называют вещества,
растворимость
которых меньше
0,01 грамма в 100
граммах воды.
20.
III) По количеству растворенного веществаКонцентрированные
Разбавленные
Концентрированный раствор - раствор с высоким
содержанием растворённого вещества.
Разбавленный раствор - раствор, содержащий малое
количество растворённого вещества.
21.
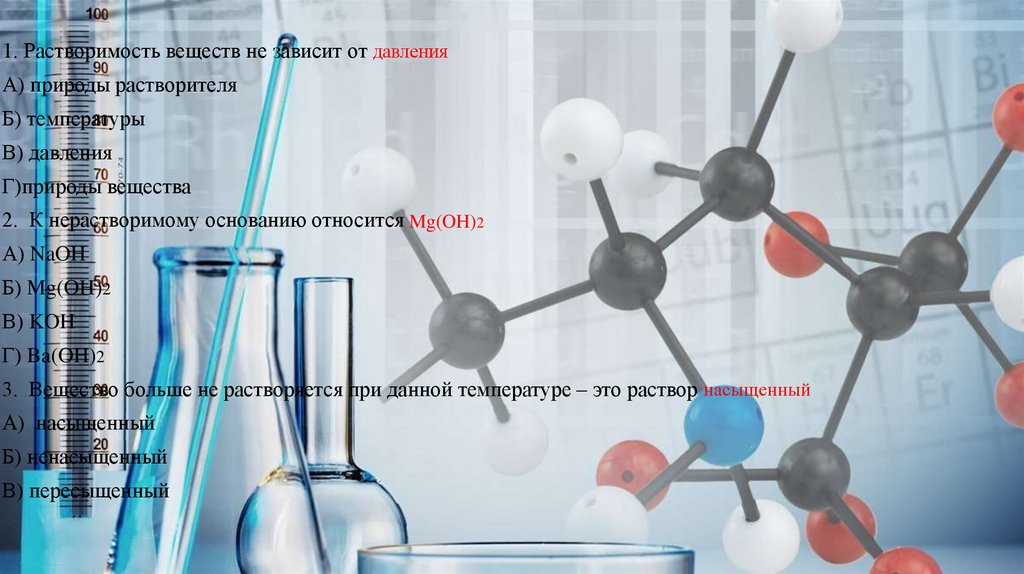
1. Растворимость веществ не зависит от давленияА) природы растворителя
Б) температуры
В) давления
Г)природы вещества
2. К нерастворимому основанию относится Mg(OH)2
А) NaOH
Б) Mg(OH)2
В) KOH
Г) Ba(OH)2
3. Вещество больше не растворяется при данной температуре – это раствор насыщенный
А) насыщенный
Б) ненасыщенный
В) пересыщенный
22.
4. Гидраты – это непрочные соединения веществ с водой, существующие в раствореА) соли и другие твердые вещества в состав которых входит соль
Б) непрочные соединения веществ с водой, существующие в растворе
В) минерал из класса самородных элементов, одна из аллотропных модификаций углерода
Г) однородная (гомогенная) система, в состав которой входят молекулы (атомы, ионы) двух или более типов
5. Процесс растворения это процесс химического взаимодействия растворяемого вещества с водой.
А) это процесс, при котором в клетках, содержащих хлорофилл, под действием энергии света образуются
органические вещества из неорганических.
Б) это процесс отдачи электронов с увеличением степени окисления
В) это процесс химического взаимодействия растворяемого вещества с водой.
Г) это процесс взаимного проникновения молекул одного вещества между молекулами другого
6. Концентрированный раствор - раствор с высоким содержанием растворённого вещества.
А) раствор с высоким содержанием растворённого вещества.
Б) раствор, содержащий малое количество растворённого вещества.
В) раствор, содержащий малое количество растворённого вещества.



















 chemistry
chemistry








