Similar presentations:
Генетическая цепочка
1. VII. Домашнее задание: §31читать, выписать формулы, названия и области применения соединений На выбор: Решить генетическую
Домашнее заданиеVII. Домашнее задание: §31читать, выписать формулы,
названия и области применения соединений
На выбор:
Решить генетическую цепочку
а) Са(ОН)2 ←Са→СаО→Са(ОН)2→Са(NO3)2→CaSO4
или
б) По описанию старинного опыта составить уравнения
описанных реакций: «Прокалив мрамор, получил я воздух
испорченный, в коем задохнулись и кролик, и мышь, однако
фуксия и фиалка росту прибавили. Будучи растворен в
крепком растворе едкого кали, сей воздух сделался поташом. А
воду колодезную квасом сделал».
2. Выбери верные утверждения
1. У атомов щелочных металлов на внешнем уровне 1электрон
2. Щелочные металлы являются окислителями
3. Для металлов характерна металлическая кристаллическая
решетка.
4. Металлы обладают электропроводностью и
теплопроводностью
5. При взаимодействии с кислородом щелочные металлы
образуют пероксиды.
6. Щелочные металлы реагируют с щелочами
7. Металлы Na, K, Li, Rb, Cs не взаимодействуют с водой даже
при нагревании
8. Na, K, Li хранят в керосине
9. Щелочные металлы получают гидрометаллургическим
методом
10. Щелочные металлы – твердые, прочные вещества, имеют
высокие температуры кипения и плавления
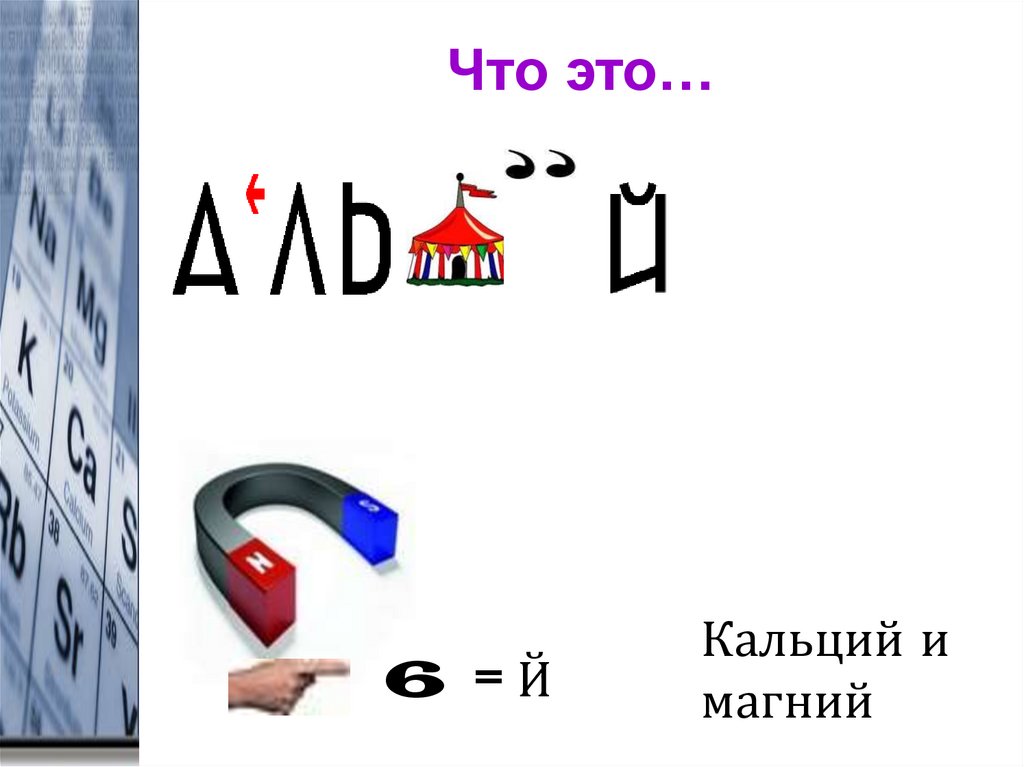
3. Что это…
6 =ЙКальций и
магний
4. Металлы II группы главной подгруппы
Цель урока: изучить строение и свойства металлов IIАгруппы и их соединений, а также влияние на
жизнедеятельность организмов.
5. Что узнаем…
Положение металлов вПериодической системе, строение
их атомов
Нахождение в природе
Физические свойства
Химические свойства
Соединения
Биологическая роль
Закрепление
Литература
6.
Бериллий, магний ищелочноземельные металлы
находятся в IIA-группе
Строение внешнего
энергетического уровня ns2
Максимальная
степень окисления
+2
Валентность - I I
7.
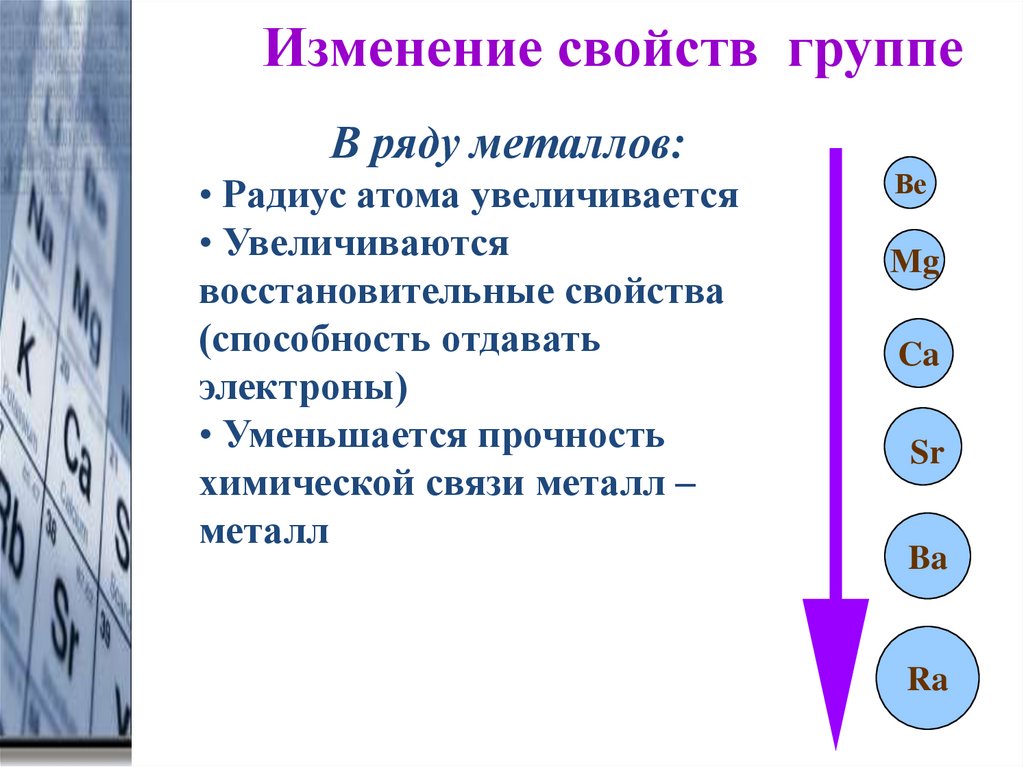
Изменение свойств группеВ ряду металлов:
• Радиус атома увеличивается
• Увеличиваются
восстановительные свойства
(способность отдавать
электроны)
• Уменьшается прочность
химической связи металл –
металл
Ве
Мg
Ca
Sr
Ba
Ra
8.
Физические свойстваКальций - твердый и
пластичный
Магний относительно мягкий,
08.04.2024
пластичный,
ковкий
Щелочноземельные
металлы легкие, мягкие и
легкоплавкие, серебристы,
стронций имеет золотистый
оттенок.
Бериллий - светлосерый, твердый,
хрупкий
Стронций ковкий
9.
Нахождение в природеКак активные металлы, они
встречаются в природе только в
виде соединений
Кальциевые горные породы
– известняк, мрамор, мел.
Магниевая горная
порода – магнезит.
10.
Химические свойства1. Металлы взаимодействуют почти со
всеми неметаллами:
2Ме0 + О20 =2Ме+2О-2 (оксид)
Ме0 + Н20 = Ме+2Н2-1 (гидрид)
Ме0 + Cl20 = Mе+2Cl2-1 (хлорид)
Ме0 + S0 = Mе+2S-2 (сульфид)
3Ме0 + N20 = Mе3+2N2-3 (нитрид)
11.
Химические свойства2. Реакции с водой
• Бериллий с водой не реагирует,
• Магний реагирует медленно, при нагревании
• Остальные металлы реагируют с водой,
образуя щелочи и восстанавливая воду до
водорода:
Ме0 + 2Н2О = Ме+2 (ОН)2 + Н2
3. Реагируют с кислотами.
Ме0 + 2НCl = Ме+2 Cl2 + Н2
4. Магний и кальций реагируют с оксидами
менее активных металлов.
2Мg0 + TiО2 = 2Мg +2О + Ti
5. Магний реагирует с CO2 и SiO2
2Мg0 + CО2 = 2Мg +2О + C
2Мg0 + SiО2 = 2Мg +2О + Si
12. Сравнить атомы элементов (работа с таблицей Д.И. Менделеева)
• Сравните атомы элементов, поставив знаки <,> или = вместо *:
а) заряд ядра: Be* Ba; Мg * Al; Ca * К; Na *Mg
б) число электронных слоев: Be * Ba; Мg * Al;
Ca * К; Na *Mg
в) число электронов на внешнем уровне:
Be * Ba; Мg * Al; Ca * К; Na *Mg
г) радиус атома: Be * Ba; Мg * Al; Ca * K; Na *Mg
д) восстановительные свойства: Be* Ba; Мg *Al;
Ca * K, Na *Mg.
13. Проверь себя
а) Be < Ba; Мg < Al; Ca > К; Na < Mgб) Be < Ba; Мg = Al;Ca = К; Na = Mg
В)Be = Ba; Мg < Al; Ca > К; Na < Mg
г) Be < Ba; Мg > Al; Ca < K; Na > Mg
д) Be < Ba; Мg > Al;Ca < K, Na > Mg.
Подсчитай количество правильных
ответов
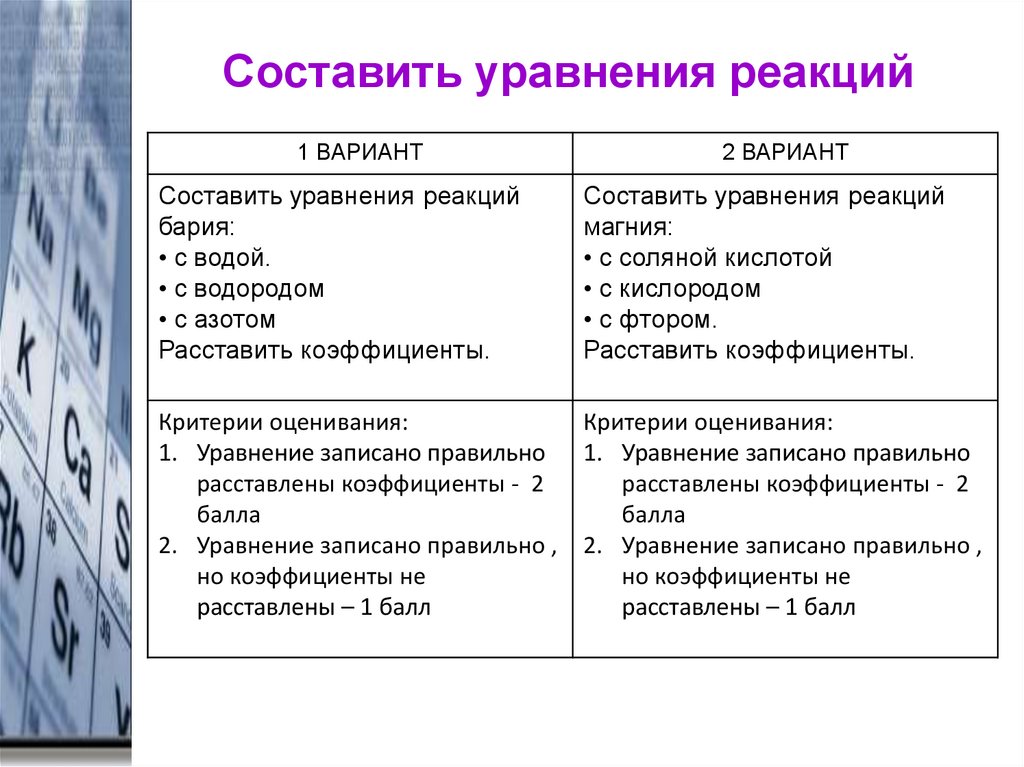
14. Составить уравнения реакций
1 ВАРИАНТСоставить уравнения реакций
бария:
• с водой.
• с водородом
• с азотом
Расставить коэффициенты.
2 ВАРИАНТ
Составить уравнения реакций
магния:
• с соляной кислотой
• с кислородом
• с фтором.
Расставить коэффициенты.
Критерии оценивания:
Критерии оценивания:
1. Уравнение записано правильно 1. Уравнение записано правильно
расставлены коэффициенты - 2
расставлены коэффициенты - 2
балла
балла
2. Уравнение записано правильно , 2. Уравнение записано правильно ,
но коэффициенты не
но коэффициенты не
расставлены – 1 балл
расставлены – 1 балл
15. Взаимопроверка
1 ВАРИАНТ2 ВАРИАНТ
Составить уравнения реакций
бария:
• Ba + 2H2O = Ba (OH)2 + H2
• Ba + H2 = BaH2
• 3Ba + N2 = Ba3 N2
Расставить коэффициенты.
Составить уравнения реакций
магния:
•Mg + 2HCl = MgCl2 + H2
• 2Mg + O2 =2MgO
•Mg + F2 = MgF2
Расставить коэффициенты.
Критерии оценивания:
1. Оценка «5» → 26 – 25 баллов
2. Оценка «4» → 24 – 20 баллов
3. Оценка «3» → 19 - 15 баллов
Критерии оценивания:
1. Оценка «5» → 26 – 25 баллов
2. Оценка «4» → 24 – 20 баллов
3. Оценка «3» → 19 - 15 баллов












 chemistry
chemistry








