Similar presentations:
Общая характеристика предельных углеводородов (алканов). Занятие 26
1.
Занятие 26Общая характеристика
предельных углеводородов
(алканов)
2.
СодержаниеМодуль 1. Понятие, распространение
алканов
Модуль 2. Классификация и номенклатура
алканов
Модуль 3. Физические свойства алканов
Модуль 4. Химические свойства алканов
Модуль 5. Применение и способы получения
алканов
3.
Модуль 1. Понятие, распространение алкановАлканы (парафины, также насыщенные или
предельные углеводороды) — ациклические
углеводороды линейного или разветвлённого строения,
содержащие только простые (одинарные) связи и
образующие гомологический ряд с общей
формулой CnH2n+2.
Все алканы и алкены относятся к классу алифатических
углеводородов. Алканы являются насыщенными
углеводородами, то есть содержат максимально
возможное число атомов водорода для заданного числа
атомов углерода. Каждый атом углерода в молекулах
алканов находится в состоянии sp3-гибридизации
— все 4 гибридные орбитали атома С идентичны по форме
и энергии, 4 связи направлены в вершины тетраэдра под
углами 109°28'. Связи C—C представляют собой σ-связи,
отличающиеся низкой полярностью и поляризуемостью.
Длина связи C—C составляет 0,154 нм, длина связи C—H —
0,1087 нм.
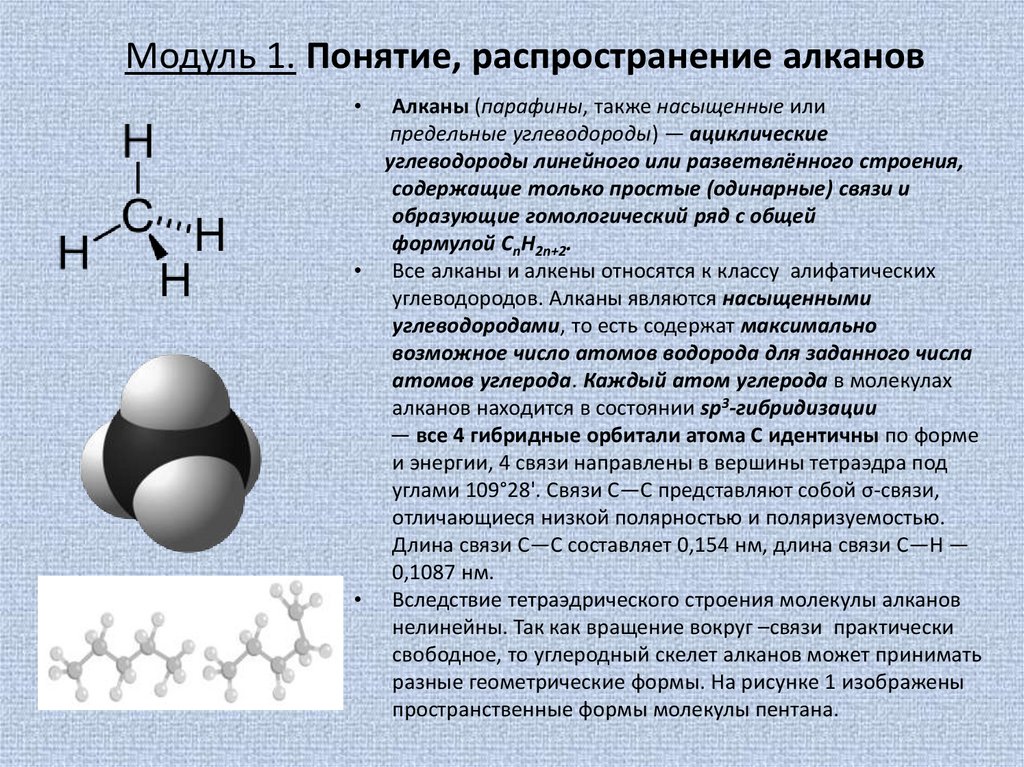
Вследствие тетраэдрического строения молекулы алканов
нелинейны. Так как вращение вокруг –связи практически
свободное, то углеродный скелет алканов может принимать
разные геометрические формы. На рисунке 1 изображены
пространственные формы молекулы пентана.
4.
Модуль 2. Классификация и номенклатура алкановМетан
CH4
CH4
Этан
CH3—CH3
C2H6
Пропан
CH3—CH2—CH3
C3H8
Бутан
CH3—CH2—CH2—CH3
C4H10
Пентан
CH3—CH2—CH2—CH2—CH3
C5H12
Гексан
CH3—CH2—CH2—CH2—CH2—CH3
C6H14
Гептан
CH3—CH2—CH2—CH2—CH2—CH2—CH3
C7H16
Октан
CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH3
C8H18
Нонан
CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3
C9H20
Декан
CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3
C10H22
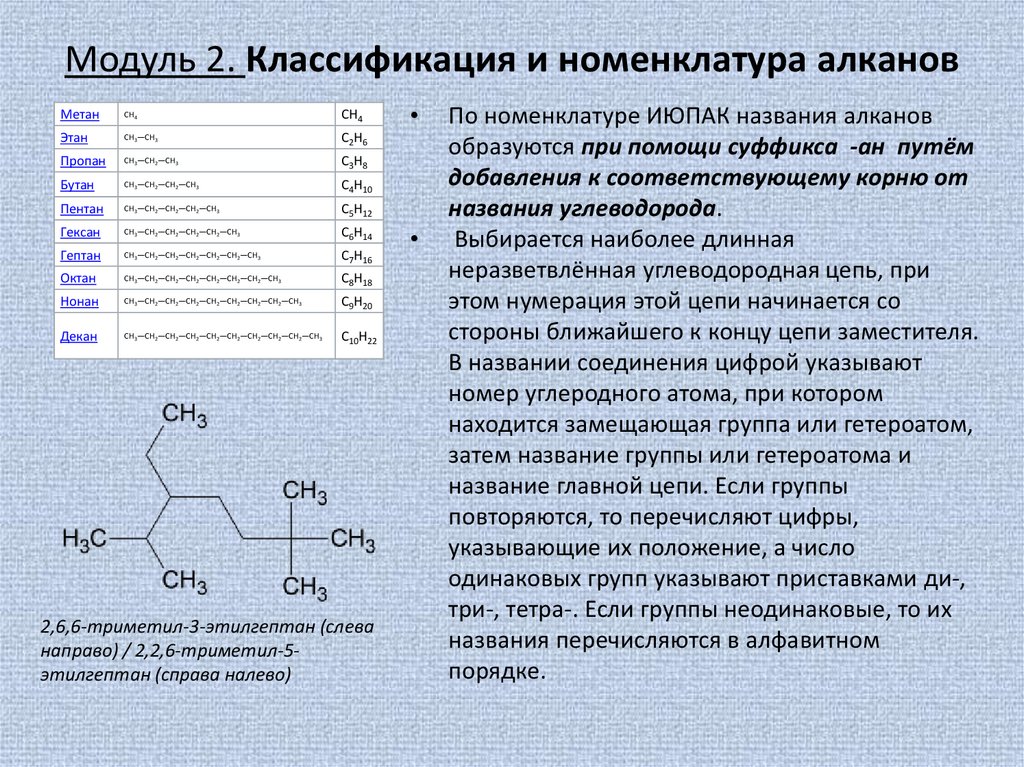
2,6,6-триметил-3-этилгептан (слева
направо) / 2,2,6-триметил-5этилгептан (справа налево)
По номенклатуре ИЮПАК названия алканов
образуются при помощи суффикса -ан путём
добавления к соответствующему корню от
названия углеводорода.
Выбирается наиболее длинная
неразветвлённая углеводородная цепь, при
этом нумерация этой цепи начинается со
стороны ближайшего к концу цепи заместителя.
В названии соединения цифрой указывают
номер углеродного атома, при котором
находится замещающая группа или гетероатом,
затем название группы или гетероатома и
название главной цепи. Если группы
повторяются, то перечисляют цифры,
указывающие их положение, а число
одинаковых групп указывают приставками ди-,
три-, тетра-. Если группы неодинаковые, то их
названия перечисляются в алфавитном
порядке.
5.
Источники метана на Земле
Нахождение в космосе. В небольших количествах алканы
содержатся в атмосфере внешних газовых планет Солнечной
системы: на Юпитере — 0,1 % метана, 0,0002 % этана,
на Сатурне метана 0,2 %, а этана — 0,0005 %, метана и этана
на Уране — соответственно 1,99 % и 0,00025 %, на Нептуне —
1,5 % и 1,5⋅10−10, соответственно. На спутнике Сатурна Титане
метан (1,6 %) содержится в жидком виде, причём, подобно
воде, находящейся на Земле в круговороте, на Титане
существуют (полярные) озёра метана (в смеси с этаном) и
метановые дожди. К тому же, как предполагается, метан
поступает в атмосферу Титана в результате деятельности
вулкана. Кроме того, метан найден в хвосте кометы Хиякутаке и
в метеоритах (углистых хондритах). Предполагается также, что
метановые и этановые кометные льды образовались в
межзвёздном пространстве.
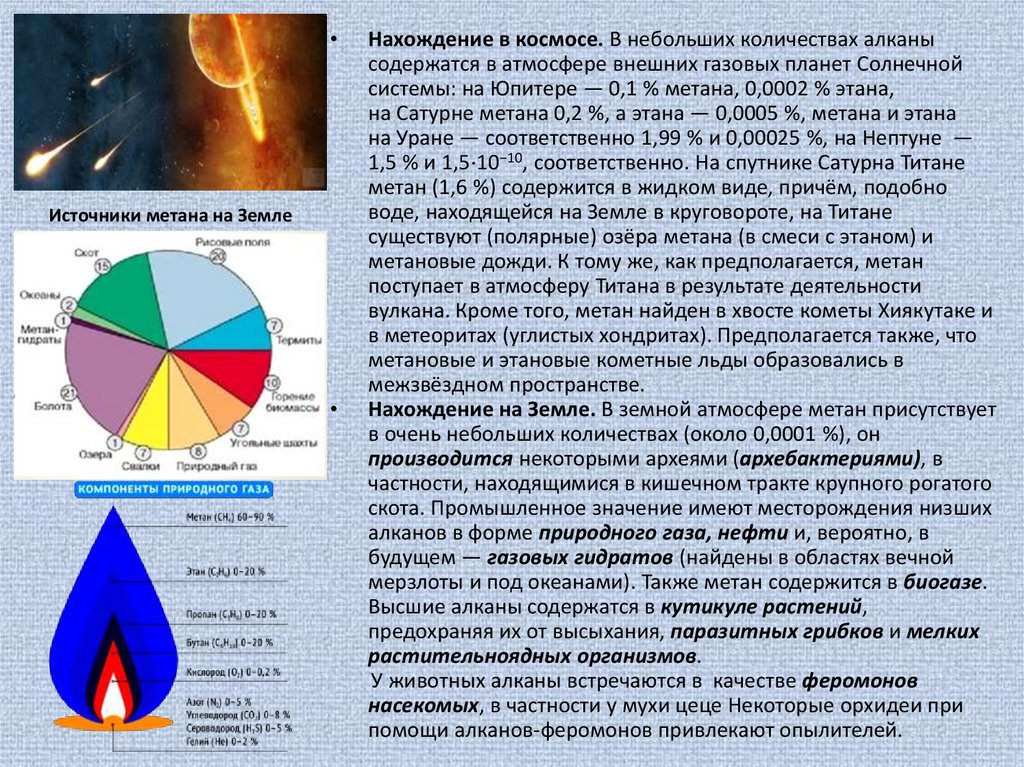
Нахождение на Земле. В земной атмосфере метан присутствует
в очень небольших количествах (около 0,0001 %), он
производится некоторыми археями (архебактериями), в
частности, находящимися в кишечном тракте крупного рогатого
скота. Промышленное значение имеют месторождения низших
алканов в форме природного газа, нефти и, вероятно, в
будущем — газовых гидратов (найдены в областях вечной
мерзлоты и под океанами). Также метан содержится в биогазе.
Высшие алканы содержатся в кутикуле растений,
предохраняя их от высыхания, паразитных грибков и мелких
растительноядных организмов.
У животных алканы встречаются в качестве феромонов
насекомых, в частности у мухи цеце Некоторые орхидеи при
помощи алканов-феромонов привлекают опылителей.
6.
Изомеры алкановПервые три алкана (метан,
этан, пропан) изомеров не
образуют.
• Бутан, пентан, гексан имеют
только структурные изомеры:
У бутана их два: н-бутан и
изобутан.
Пентан образует н-пентан,
изопентан, неопентан.
Гексан имеет пять изомеров: нгексан, изогексан, 3метилпентан, диизопропил,
неогексан.
• Гомологи от гептана и выше
помимо структурных изомеров
образуют стереоизомеры или
пространственные изомеры,
отличающиеся положением
атомов в пространстве.
• Физические и химические
свойства изомеров отличаются.
n
Число
изомеров
С учётом
стереоизомерии
4
2
2
5
3
3
6
5
5
7
9
11
8
18
24
9
35
55
10
75
136
11
159
345
12
355
900
13
802
2412
14
1858
6563
15
4347
18 127
20
366 319
3 396
844
25
36 797
588
749 329
719
30
4 111
846 763
182 896
187 256
7.
Модуль 3. Физические свойства алкановГазообразные и твердые алканы не
пахнут, некоторые жидкие алканы
обладают характерным
«бензиновым» запахом.
Все алканы бесцветны, легче воды и
нерастворимы в ней. Алканы хорошо
растворяются в органических
растворителях, жидкие алканы
(пентан, гексан) используются как
растворители.
Температуры плавления и кипения
увеличиваются с молекулярной
массой и длиной главной
углеродной цепи.
При стандартных условиях,
установленных
ИЮПАК (давление 105 Па, температу
ра 0 °C), неразветвлённые алканы с
CH4 до C4H10 являются газами, с
C5H12 до C15H32 — жидкостями, а
начиная с C16H34 и далее —
твёрдыми веществами.
Температуры плавления и кипения
понижаются от менее
разветвлённых к более
разветвлённым. Так, например,
при 20 °C н-пентан — жидкость,
а неопентан — газ.
8.
Модуль 4. Химические свойства алканов1.
Алканы имеют низкую химическую активность. Это
объясняется тем, что одинарные связи C—H и C—C
относительно прочны, и их сложно разрушить. Поскольку
связи С—C неполярны, а связи С—Н малополярны, оба
вида связей малополяризуемы и относятся к σ-виду, их
разрыв наиболее вероятен по гомолитическому
механизму, то есть с образованием радикалов.
Реакции замещения
Галогенирование алканов протекает по радикальному
механизму. Для инициирования реакции необходимо
смесь алкана и галогена облучить УФ или нагреть. В
первую очередь галогенируется наименее гидрированый
атом углерода (третичный атом, затем вторичный,
первичные атомы галогенируются в последнюю очередь).
Галогенирование алканов хлором проходит поэтапно с
последовательным образованием хлорметана,
дихлорметана, хлороформа и тетрахлорметана: за один
этап замещается не более одного атома водорода.
Бромирование алканов отличается от хлорирования
более высокой стереоселективностью из-за большей
разницы в скоростях бромирования третичных,вторичных
и первичных атомов углерода при низких температурах.
Иодирование алканов не происходит, получение иодидов
прямым иодированием осуществить нельзя.
С фтором и хлором реакция может протекать со
взрывом, в таких случаях галоген разбавляют азотом или
подходящим растворителем.
9.
Сульфирование - при одновременном действии на алканы
оксидом серы (IV) и кислородом, при ультрафиолетовом
облучении или при участии веществ, являющихся донорами
свободных радикалов (диазометан, органические перекиси),
протекает реакция сульфирования с
образованием алкилсульфокислот
2. Реакции окисления
Автоокисление - кисление алканов в жидкой фазе
протекает по свободно-радикальному механизму и
приводит к образованию гидропероксидов, продуктов их
разложения и взаимодействия с исходным алканом.
химическим свойством предельных углеводородов,
определяющих их использование в качестве топлива,
является реакция горения (Q достигает 46 000 — 50
000 кДж/кг). В случае нехватки кислорода вместо углекислого
газа получается оксид углерода(II) или уголь (в зависимости
от концентрации кислорода).
Каталитическое окисление. При мягком окислении СН4 в
присутствии катализатора при 200 °C могут образоваться
образовываться спирты, альдегиды, карбоновые кислоты.
• Взаимодействие со сложными веществами
Нитрование (Реакция Коновалова) - алканы реагируют с
10 % раствором азотной кислоты или оксидом азота NO2 в
газовой фазе при температуре 140 °C и небольшом давлении
с образованием нитропроизводных
10.
3. Термические превращения алканов• Разложение. Реакции разложения происходят лишь под
влиянием больших температур. Повышение температуры
приводит к разрыву углеродной связи и образованию
свободных радикалов.
• Крекинг. При нагревании выше 500 °C алканы подвергаются
пиролитическому разложению с образованием сложной
смеси продуктов, состав и соотношение которых зависят от
температуры и времени реакции. При пиролизе происходит
расщепление углерод-углеродных связей с образованием
алкильных радикалов.
* В 1930—1950 гг. пиролиз высших алканов использовался в промышленности
для получения сложной смеси алканов и алкенов, содержащих от пяти до
десяти атомов углерода. Он получил название «термический крекинг». С
помощью термического крекинга удавалось увеличить количество
бензиновой фракции за счёт расщепления алканов, содержащихся в
керосиновой фракции (10—15 атомов углерода в углеродном скелете) и
фракции солярового масла (12—20 атомов углерода). Однако октановое
число бензина, полученного при термическом крекинге, не превышает 65,
что не удовлетворяет требованиям условий эксплуатации современных
двигателей внутреннего сгорания. В настоящее время термический крекинг
полностью вытеснен в промышленности каталитическим крекингом,
который проводят в газовой фазе при более низких температурах — 400—
450 °C и низком давлении — 10—15 атм на алюмосиликатном катализаторе,
который непрерывно регенерируется сжиганием образующегося на нём
кокса в токе воздуха. При каталитическом крекинге в полученном бензине
резко возрастает содержание алканов с разветвлённой структурой.
11.
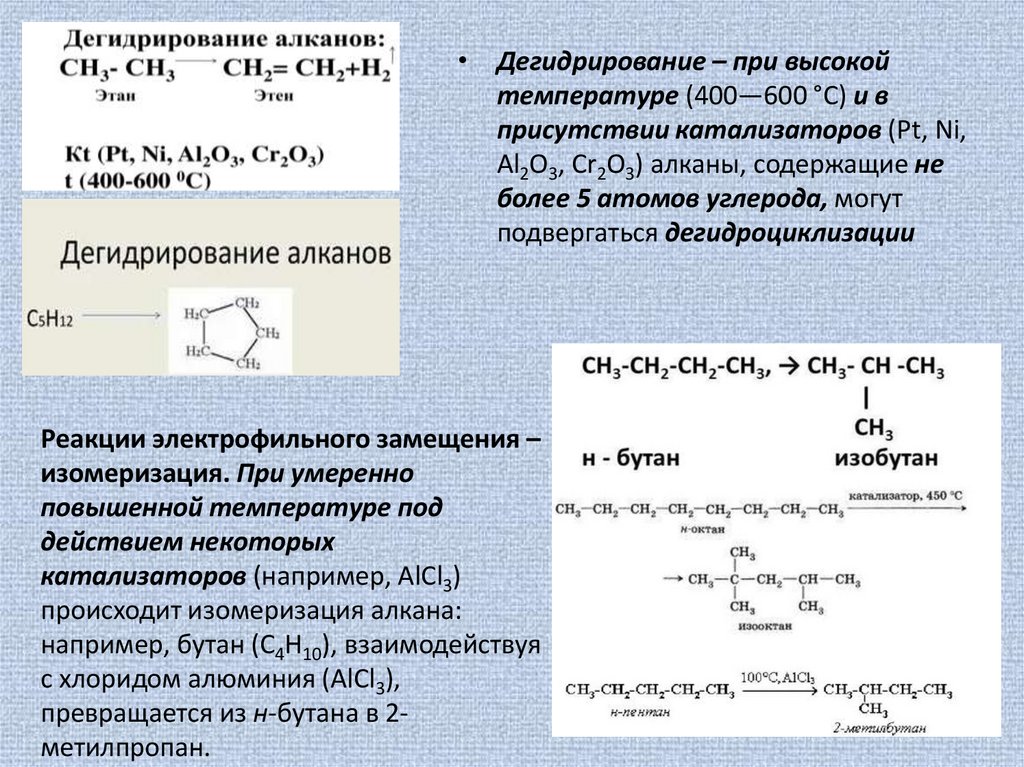
• Дегидрирование – при высокойтемпературе (400—600 °C) и в
присутствии катализаторов (Pt, Ni,
Al2O3, Cr2O3) алканы, содержащие не
более 5 атомов углерода, могут
подвергаться дегидроциклизации
Реакции электрофильного замещения –
изомеризация. При умеренно
повышенной температуре под
действием некоторых
катализаторов (например, AlCl3)
происходит изомеризация алкана:
например, бутан (C4H10), взаимодействуя
с хлоридом алюминия (AlCl3),
превращается из н-бутана в 2метилпропан.
12.
Модуль 5. Применение и способы получения алкановВ нефтехимической
промышленности предельные
улеводороды являются базой для
получения разнообразных
органических соединений,
важным сырьем в процессах
получения полупродуктов для
производства пластмасс,
каучуков, синтетических волокон,
моющих средств и многих других
веществ. Велико значение в
медицине, парфюмерии и
косметике.
Алканы выделяют из природных
источников (природный и
попутный газ, нефть, каменный
уголь).
Газообразные алканы получают
из природного и попутных
нефтяных газов, а твердые
алканы — из нефти. Природной
смесью твердых
высокомолекулярных алканов
является горный воск —
природный битум.
13.
Это интересно!1.Из-за того, что метан в два раза легче воздуха, в случае утечки он быстро
улетучится.
2.В метане содержится всего один атом углерода, поэтому при сгорании он
выделяет гораздо меньше углекислого газа, чем дизель или бензин (разница —
около 20–30%).
3. Болотный газ — бесцветный газ со слабым неприятным запахом, который
выделяется со дна стоячих водоёмов в результате гниения
ила и других остатков растительного и животного происхождения. При выбросах
крупных пузырей на поверхность, способен издавать довольно громкий звук.
Места выхода могут быть пожароопасны. Основной компонент — метан,
образующийся в результате анаэробного разложения органических веществ в
природе. Через некоторое время после вдыхания газа у людей начинает болеть и
кружиться голова, появляется тошнота, теряется реальное чувство времени,
нарушается ориентация в пространстве.
4. Образование метана — главная климатическая проблема в «мусорной»
индустрии. Метан оказывает существенно более серьезный эффект на
изменение климата, нежели углекислый газ, так как намного эффективнее
удерживает тепло в атмосфере Земли. И хотя его содержание в атмосфере Земли
пока относительно невелико, объем выбросов метана в секторе отходов растет:
1990 по 2019 г количество выбросов парниковых газов от отходов
на полигонах увеличилось на 146%. Также морская биота продуцирует около 12
млн. тонн алканов, которые поступает в окружающую среду.
5. В настоящее время бактерии, окисляющие алканы, используются для очистки
почвы и водоемов от нефтяных загрязнений.
6. Считается, что природный газ был впервые обнаружен на Ближнем Востоке
между 6000 и 2000 годами до н.э., когда от ударов молнии воспламенился
просачивающийся из-под земли природный газ.
7. Первые трубопроводы были построены в Китае в 500 году до нашей эры. Линии,
сделанные из бамбука, перемещали газ, который использовался для
приготовления выпаренного соленого рассола.
8. Дарваза — кратер с горящим природным газом диаметром приблизительно 60
метров и глубиной около 20 метров в Каракумах, Туркменистан. Местные жители
и путешественники называют его «Дверью в преисподнюю» или «Вратами ада». В
1971 году в подземную пустоту обвалились верхние слои грунта, буровая вышка со
всем оборудованием и транспортом. Чтобы вредные газы не выходили наружу, их
решили поджечь. Геологи предполагали, что пожар через несколько дней
потухнет, но до сих пор газ непрерывно горит днём и ночью.








 chemistry
chemistry








