Similar presentations:
Предельные углеводороды (алканы)
1. Предельные углеводороды (алканы)
2. Основное содержание темы:
1.Понятие о предельныхуглеводородах (алканах)
2.Гомологический ряд алканов
3.Изомерия и номенклатура алканов
4.Способы получения и физические
свойства алканов
5.Химические свойства алканов
6.Области применения предельных
углеводородов
7.Проверь себя
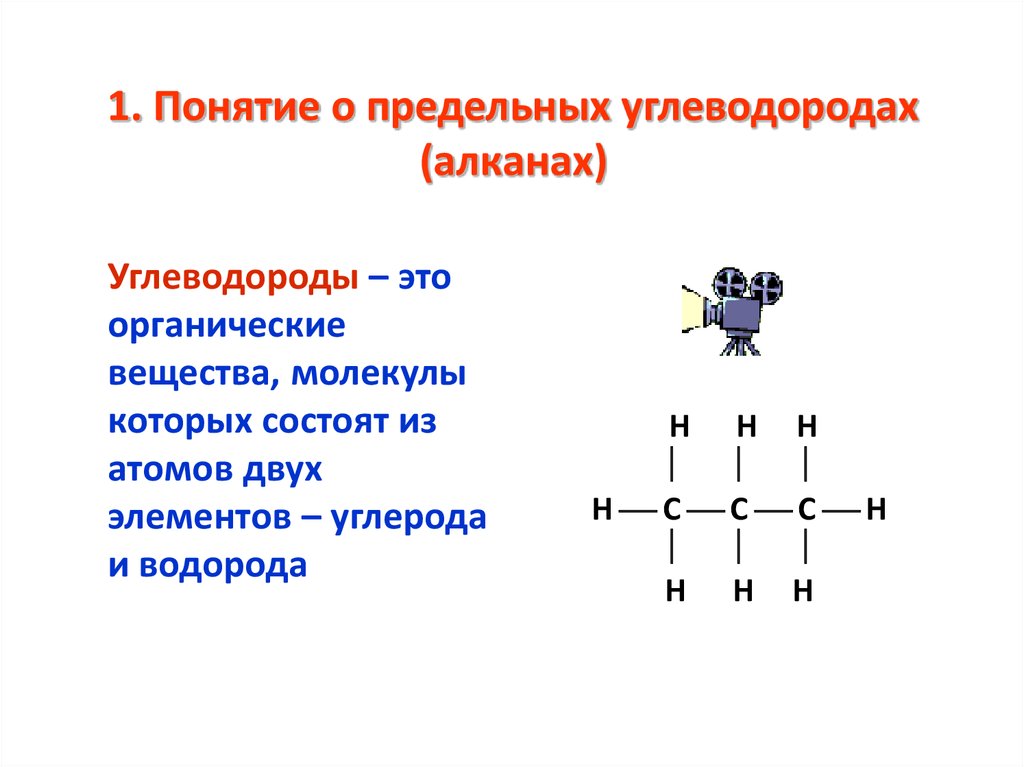
3. 1. Понятие о предельных углеводородах (алканах)
Углеводороды – этоорганические
вещества, молекулы
которых состоят из
атомов двух
элементов – углерода
и водорода
Н Н Н
Н С С С Н
Н Н Н
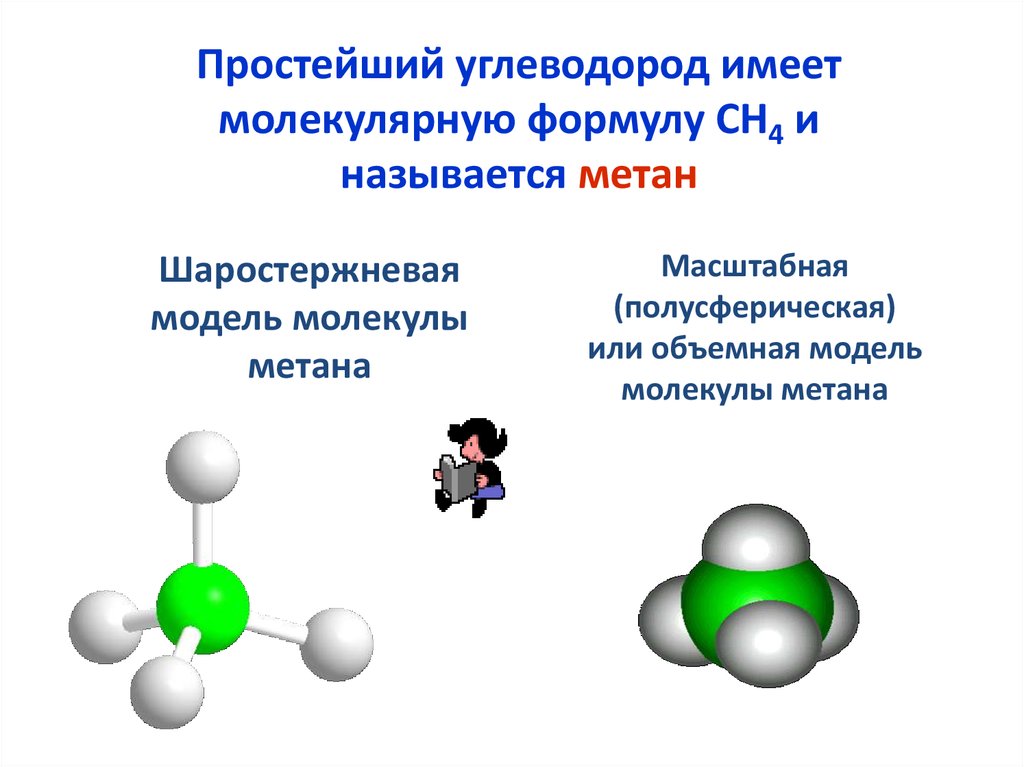
4.
Простейший углеводород имеетмолекулярную формулу СН4 и
называется метан
Шаростержневая
модель молекулы
метана
Масштабная
(полусферическая)
или объемная модель
молекулы метана
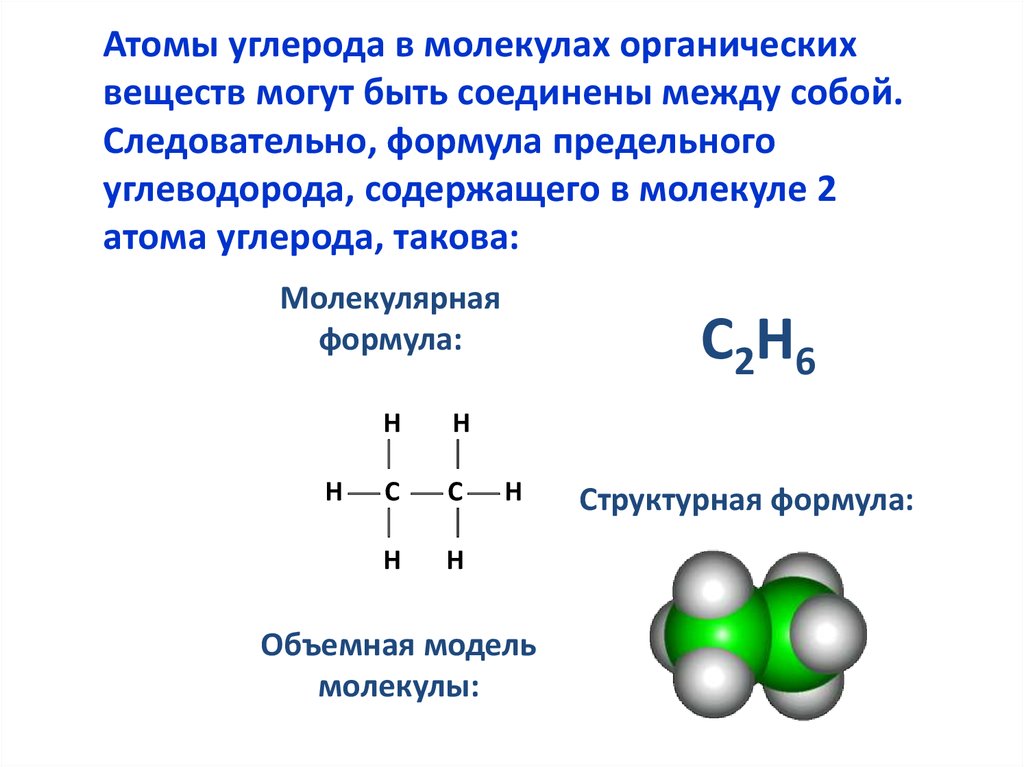
5.
Атомы углерода в молекулах органическихвеществ могут быть соединены между собой.
Следовательно, формула предельного
углеводорода, содержащего в молекуле 2
атома углерода, такова:
Молекулярная
формула:
Н
Н
Н С С Н
Н
Н
Объемная модель
молекулы:
С2Н6
Структурная формула:
6.
Алканами (предельными,насыщенными, парафиновыми
углеводородами) называют
углеводороды, в молекулах
которых атомы связаны
одинарными сигма-связями и
которые соответствуют общей
формуле СnH2n+2
7.
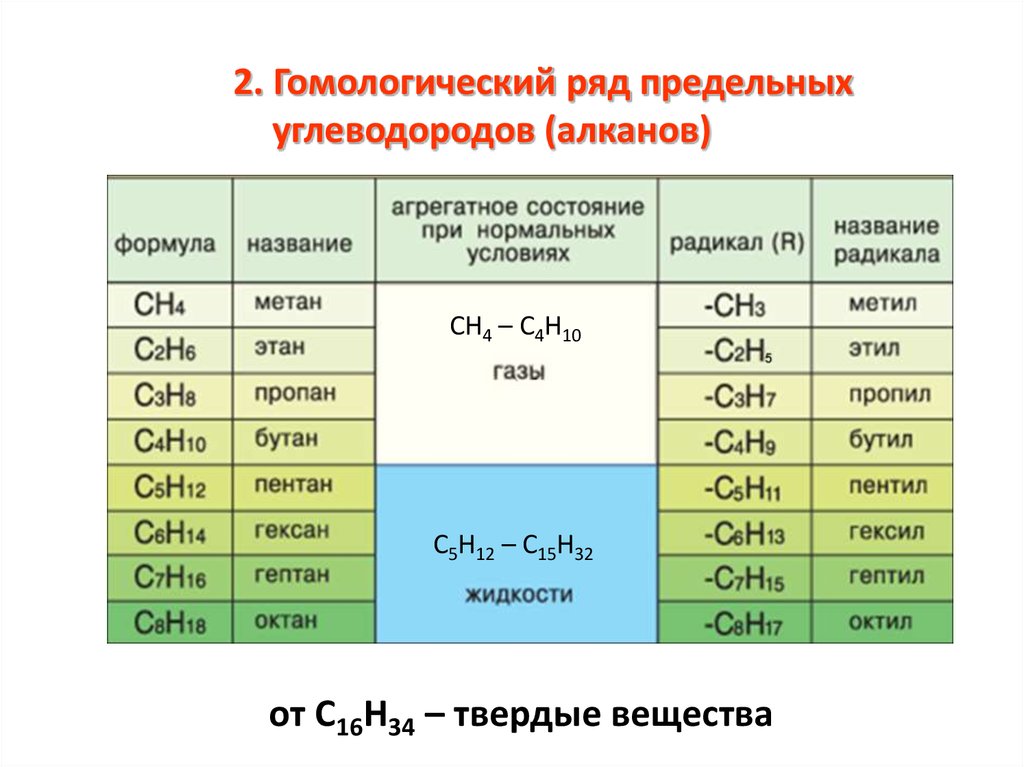
2. Гомологический ряд предельныхуглеводородов (алканов)
СН4 – С4Н10
С5Н12 – С15Н32
от С16Н34 – твердые вещества
8.
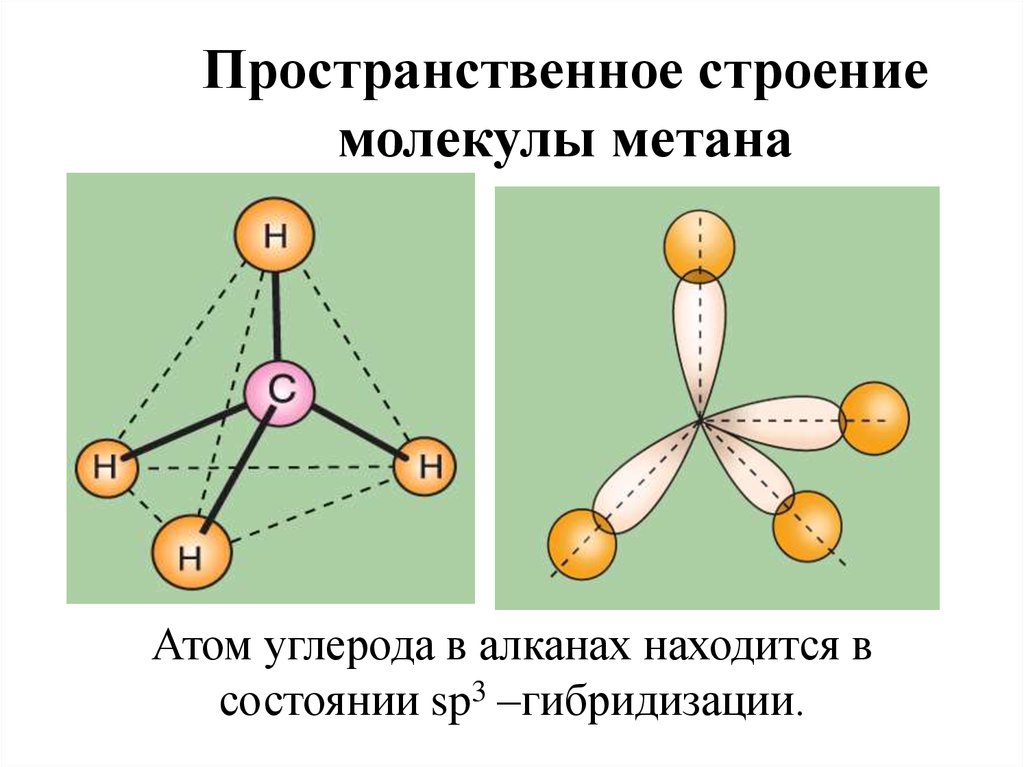
Пространственное строениемолекулы метана
Атом углерода в алканах находится в
состоянии sp3 –гибридизации.
9.
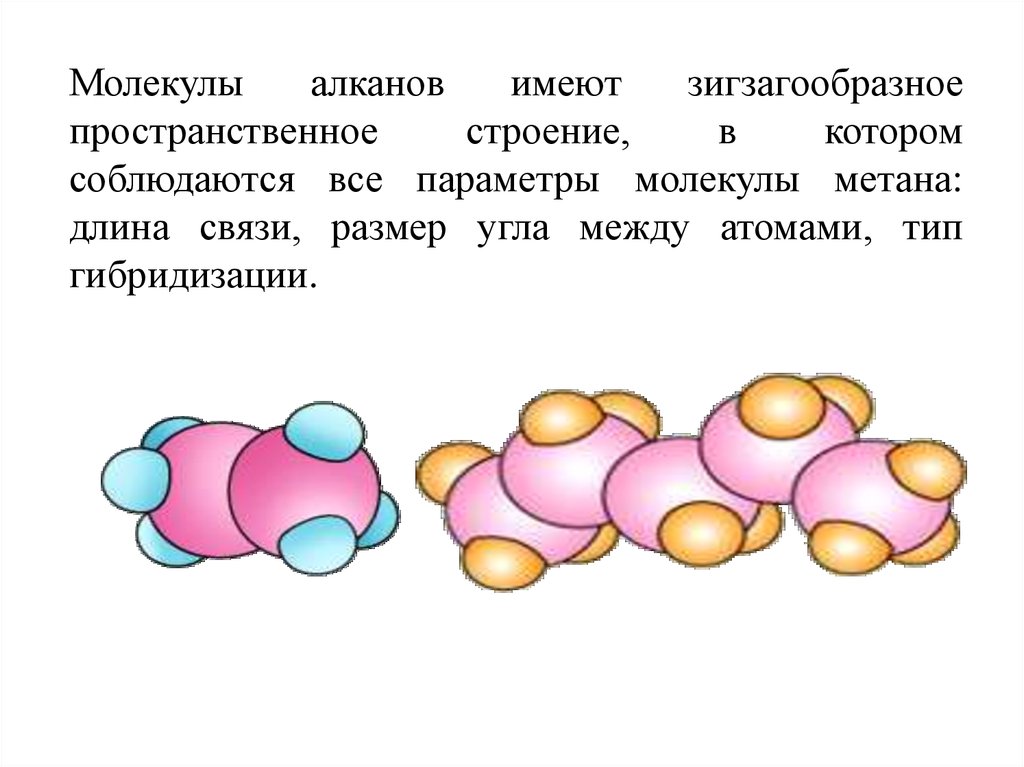
Молекулыалканов
имеют
зигзагообразное
пространственное
строение,
в
котором
соблюдаются все параметры молекулы метана:
длина связи, размер угла между атомами, тип
гибридизации.
10. 4. Физические свойства
СН4…C4Н10 –газы
T кипения:
-161,6…-0,5 °C
T плавления:
-182,5…-138,3°C
С5Н12…C15Н32 –
жидкости
T кипения:
36,1…270,5 °C
T плавления:
-129,8…10 °C
С16Н34…и
далее– твёрдые
вещества
T кипения:
287,5 °C
Tплавления:20°C
С увеличением относительных молекулярных масс
предельных углеводородов закономерно
повышаются их температуры кипения и
плавления.
11.
Ряд веществ, сходных по строению исвойствам, но отличающихся друг от
друга по составу на одну или несколько
групп –СН2-, называют гомологическим
рядом.
Представителей гомологического ряда
называют гомологами
Общая формула представителей
гомологического ряда алканов СnH2n+2
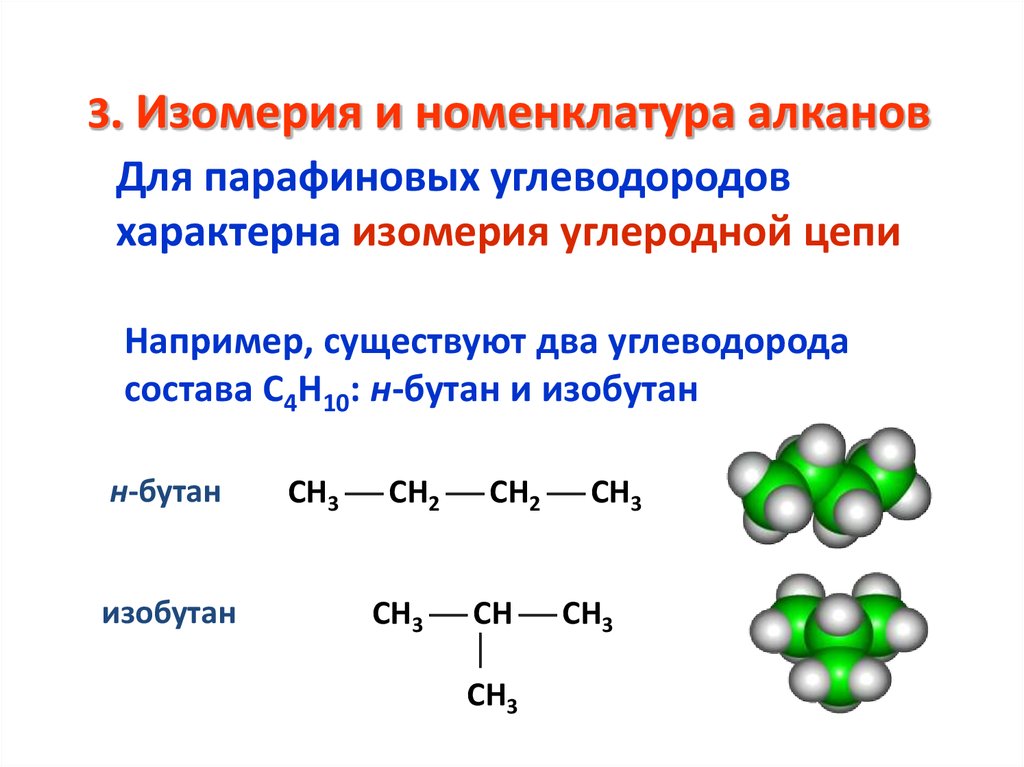
12. 3. Изомерия и номенклатура алканов
Для парафиновых углеводородовхарактерна изомерия углеродной цепи
Например, существуют два углеводорода
состава С4Н10: н-бутан и изобутан
н-бутан
изобутан
СН3 СН2 СН2 СН3
СН3 СН СН3
СН3
13.
Алгоритм составления названий алканов помеждународной номенклатуре
• Выбрать в молекуле самую длинную цепочку
углеродных атомов.
• Пронумеровать цепочку с того конца, к которому
ближе разветвление молекулы.
• Основа названия – название углеводорода с тем же
числом углеродных атомов, что и в самой длинной цепи.
• Перед основой названия перечислить все заместители
основной цепи с указанием номеров углеродных атомов,
при которых они стоят. Если одинаковых заместителей
несколько, перед их названием ставят приставки ди-,
три-, тетра-…
• Все цифры друг от друга отделяются запятыми, буквы
от цифр – дефисом, название пишется в одно слово.
14.
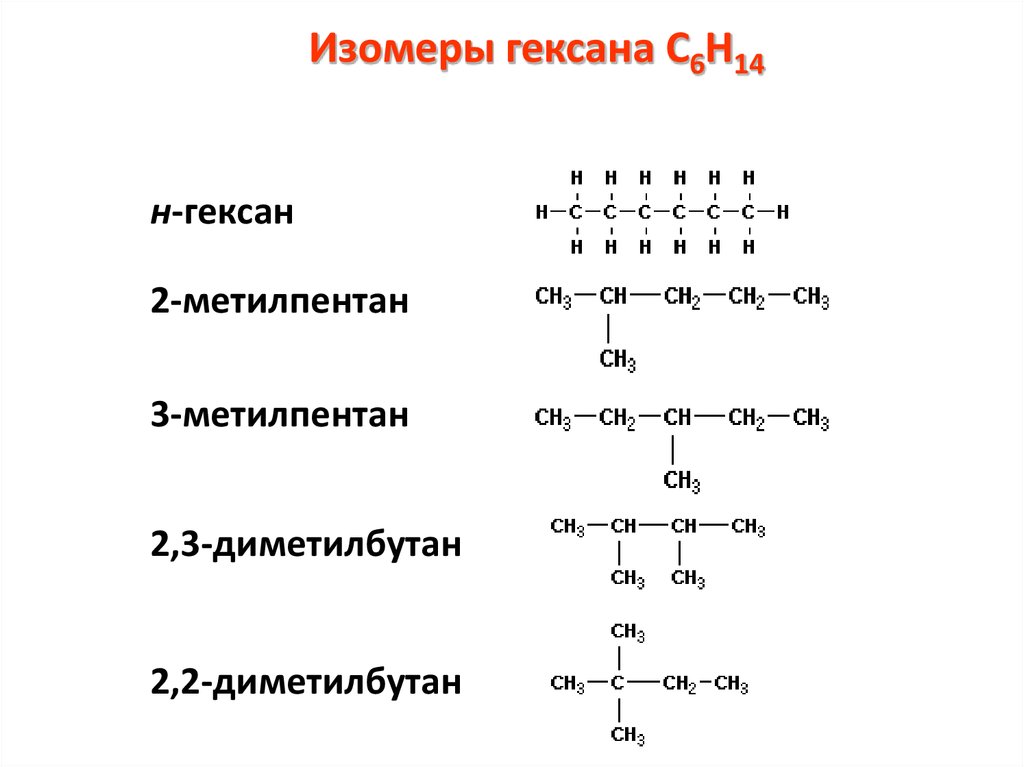
Изомеры гексана С6Н14н-гексан
2-метилпентан
3-метилпентан
2,3-диметилбутан
2,2-диметилбутан
15.
Потренируйтесь в составленииназваний алканов
Потренируйся в написании структурных формул
алканов по их названям
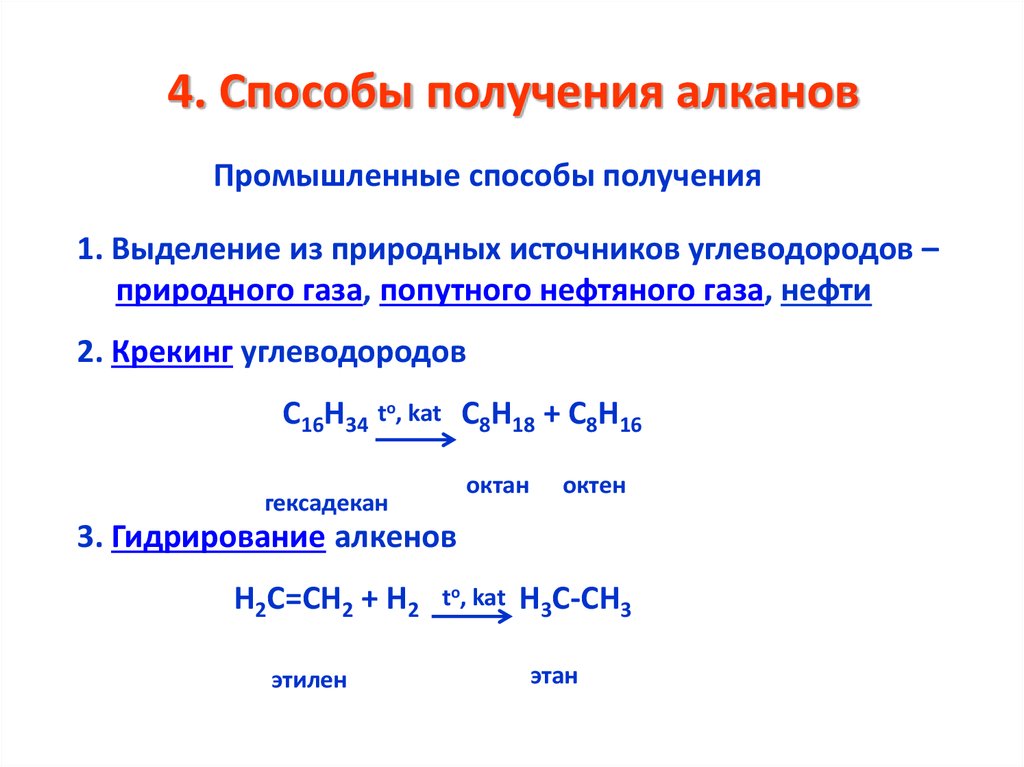
16. 4. Способы получения алканов
Промышленные способы получения1. Выделение из природных источников углеводородов –
природного газа, попутного нефтяного газа, нефти
2. Крекинг углеводородов
С16Н34 to, kat С8Н18 + С8Н16
октан
гексадекан
октен
3. Гидрирование алкенов
Н2С=СН2 + Н2
этилен
to, kat
Н3С-СН3
этан
17.
4. ПолучениеПолучение метана при сплавлении ацетата натрия со
щелочью:
t C
CH3COONa + NaOH CH4 + Na2CO3
ацетат натрия
метан
Свойства метана:
1) метан не вступает в реакцию окисления при действии
водного раствора KMnO4;
2) метан не вступает в реакцию с раствором брома;
18.
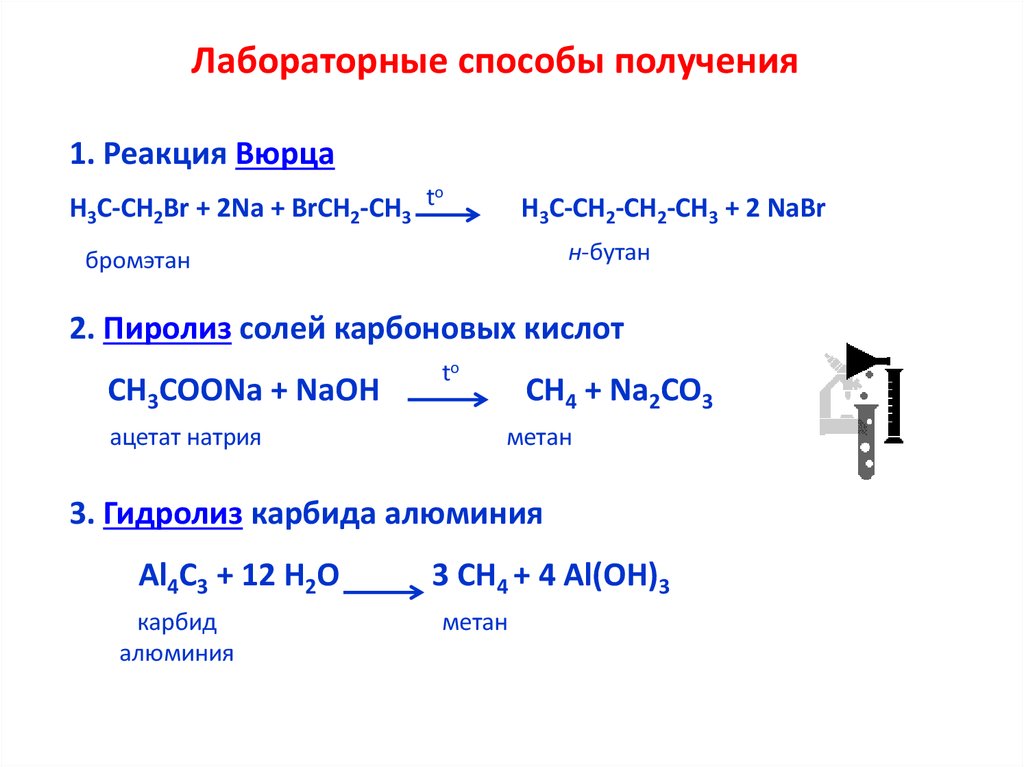
Лабораторные способы получения1. Реакция Вюрца
o
t
Н3С-СН2Br + 2Na + BrCH2-CH3
H3C-CH2-CH2-CH3 + 2 NaBr
н-бутан
бромэтан
2. Пиролиз солей карбоновых кислот
СН3СООNa + NaOH
ацетат натрия
to
СН4 + Na2CO3
метан
3. Гидролиз карбида алюминия
Al4С3 + 12 Н2O
карбид
алюминия
3 СН4 + 4 Al(OH)3
метан
19.
Реакция Вюрца (синтез Вюрца)проводят с целью получения алканов с более
длинной углеродной цепью.
Например: получение этана из метана
1 этап. Галогенирование исходного алкана
СН4 + Сl2 = CH3Cl + HCl
2 этап. Взаимодействие с натрием
2CH3Cl + 2Na = C2H6 + 2NaCl
20.
Метан в лаборатории можно получитьгидролизом карбида алюминия
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
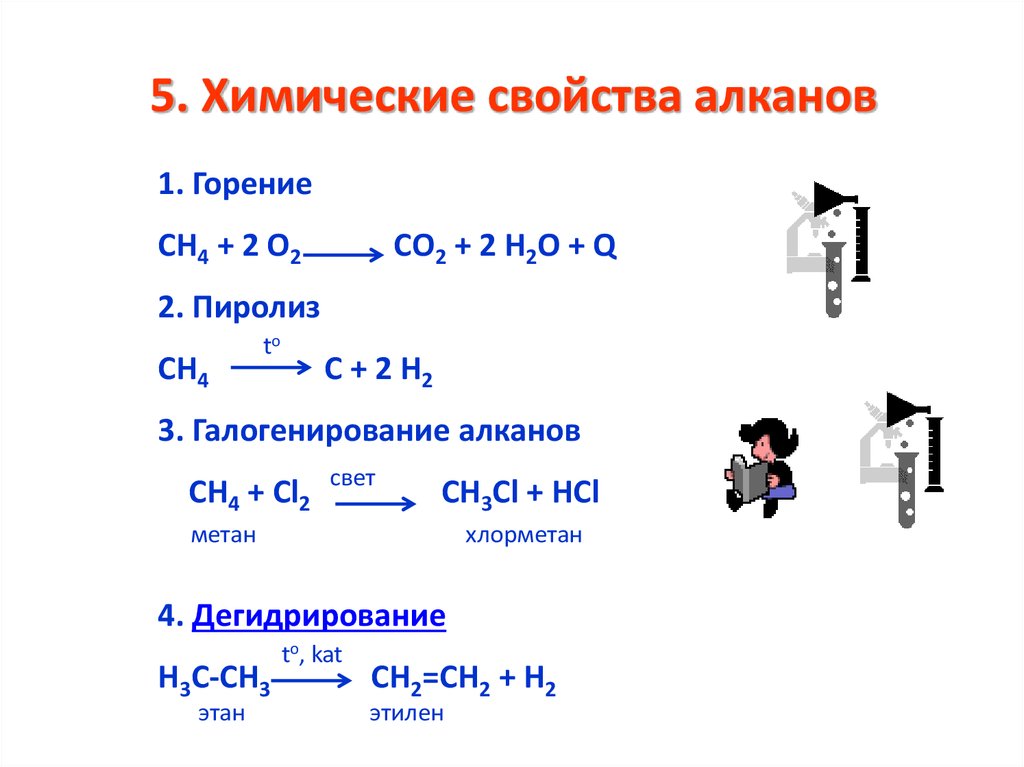
21. 5. Химические свойства алканов
1. ГорениеСН4 + 2 О2
СО2 + 2 Н2О + Q
2. Пиролиз
СН4
to
С + 2 Н2
3. Галогенирование алканов
СН4 + Cl2
свет
СН3Сl + HCl
метан
хлорметан
4. Дегидрирование
Н3С-СН3
этан
to, kat
СН2=СН2 + Н2
этилен
22.
Термин парафины произошел отлатинских слов «parum» — «мало»
и «affinis» — «сродство» из-за его
низкой реакционной способности
по отношению к большинству
реагентов. При комнатной
температуре предельные
углеводороды не реагируют с
концентрированными кислотами и
щелочами, не обесцвечивают
бромную воду и раствор
перманганата калия.
23. 6. Применение предельных углеводородов
1. Газообразное и жидкое топливо (бытовой газ, бензин,дизельное топливо, керосин и др.)
2. Сырье органического синтеза (получение сажи,
водорода, ацетилена, этиленовых углеводородов,
галоген- и кислородсодержащих органических
веществ и др.)
3. Применение:
вазелина в медицине, технике, косметической и
парфюмерной промышленности, в быту;
парафина (смесь твердых алканов) в спичечном
производстве, для нанесения водоотталкивающих
покрытий, в медицине и в быту.
24. 7. Проверь себя
Вопросы и заданияОтветы
1. Назовите по международной
номенклатуре алкан:
2,4-диметилгексан
сн3 -сн2 -сн -сн2 -сн -сн3
сн3
сн3
сн3
сн3 -с -сн2 -сн3
2. Напишите структурную формулу 2,2диметилбутана
3. Напишите структурные формулы всех
изомеров пентана и назовите их по
международной номенклатуре
сн3
сн3 -сн -сн2 -сн -сн3
н-пентан
сн3
сн3 -сн -сн2 -сн3
сн3
2-метилбутан
сн3 -с -сн3
сн3
2,2-диметилпропан
25.
Вопросы и заданияОтветы
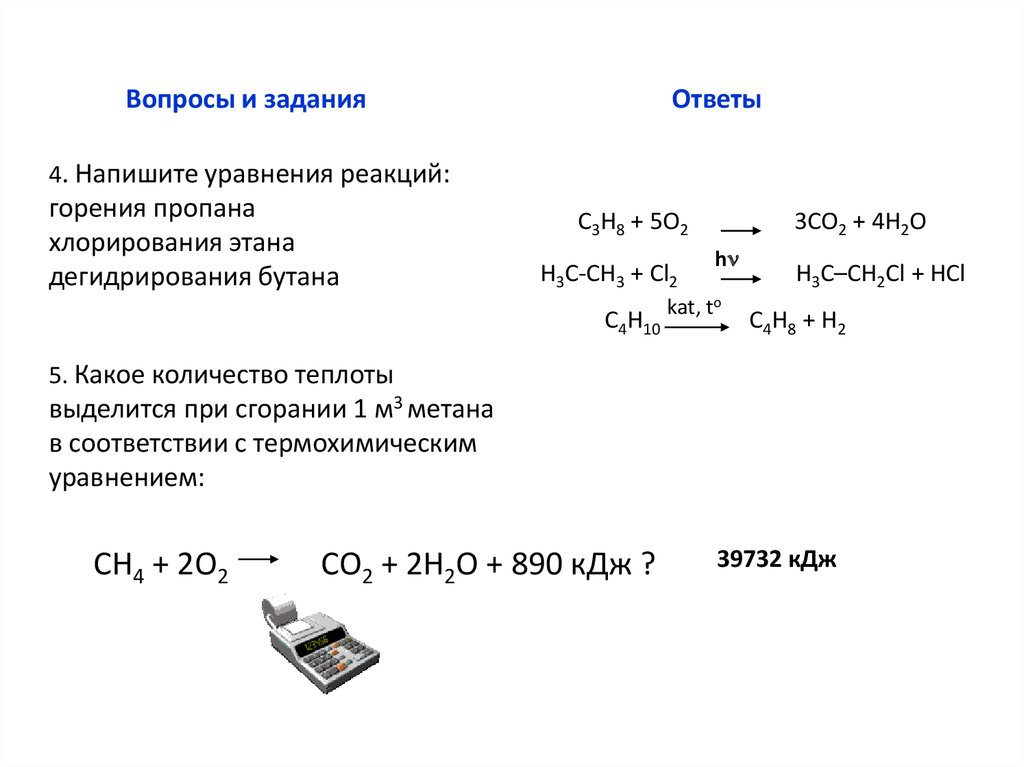
4. Напишите уравнения реакций:
горения пропана
хлорирования этана
дегидрирования бутана
С3Н8 + 5О2
Н3С-СН3 + Cl2
С4Н10
3СО2 + 4Н2О
hn
kat, to
H3С–CH2Cl + НCl
С4H8 + Н2
5. Какое количество теплоты
выделится при сгорании 1 м3 метана
в соответствии с термохимическим
уравнением:
СН4 + 2О2
СО2 + 2Н2О + 890 кДж ?
39732 кДж












 chemistry
chemistry








