Similar presentations:
Предельные углеводороды (алканы)
1. Предельные углеводороды (алканы)
2. Рассматриваемые вопросы:
1. Предельные углеводороды (определение, общаяформула).
2. Изомеры, примеры изомеров, число изомеров в ряду
алканов.
3. Гомологический ряд предельных углеводородов,
гомологи.
4. Сравнительная характеристика гомологов и изомеров.
5. Физические свойства алканов.
6. Строение метана.
7. Нахождение в природе.
8. Химические свойства алканов.
9. Получение алканов.
10. Применение.
3. 1. Определение, общая формула
Предельныеуглеводороды (алканы) -
это органические вещества, которые состоят
только из углерода и водорода и имеют
общую формулу Сn Н2n +2, где n 1
У алканов только простые одинарные связи
между
атомами
углерода,
которые
соединяются с максимально возможным
количеством атомов водорода. Их поэтому
называют предельными или насыщенными.
Алканы еще называют парафинами
4. 2. Изомеры
Изомеры- это вещества, имеющие
одинаковый
качественный
и
количественный состав (одинаковая
молекулярная
формула),
но
различное химическое строение и
различные свойства
Изомерия- это явление
существования изомеров
5. 2. Примеры изомеров
Дляалканов
характерна
изомерия
углеродного скелета (цепи) – структурная
изомерия
Для вещества с общей молекулярной
формулой С4Н10 существуют 2 изомера:
1
2
3
4
СН3-СН2-СН2-СН3 (н - бутан, t кип.=-0,50С)
1
2
3
СН3- СН -СН3 (изобутан, t кип.=-11,70С)
|
СН3
изобутан или 2-метилпропан
6.
7. Гомологический ряд предельных углеводородов
8. Гомологи
Гомологи – вещества, расположенные впорядке
возрастания
относительных
молекулярных масс, сходных по строению и
свойствам, но отличающихся друг от друга по
составу на одну или несколько групп - СН2- СН2- (гомологическая разность), метиленовая
группа
Гомологический
рядряд
веществ,
расположенных в порядке возрастания
относительных молекулярных масс, сходных
по строению и свойствам, но отличающихся
друг от друга по составу на одну или
несколько групп -СН2-
9.
10. Физические свойства предельных углеводородов
Агрегатное состояние: первые четыречлена гомологического ряда (С1-С4) – газы,
С5-С15- жидкости, С16 и более тяжелые –
твердые вещества.
Газообразные и твердые алканы не пахнут,
жидкие алканы обладают характерным
“бензиновым” запахом. Все алканы бесцветны,
легче воды и нерастворимы в ней. Алканы
хорошо растворяются в органических
растворителях, жидкие алканы (пентан, гексан)
сами широко используются как растворители.
11. Физические свойства
СН4… C4Н10
– газы
T кипения:
- 161,6
…
- 0,5 °C
T плавления:
-182,5
… - 138,3 °C
С5Н12 … C15Н32
– жидкости
С16Н34…и далее–
твёрдые вещества
T кипения:
36,1 … 270,5 °C
T плавления:
-129,8 … 10 °C
T кипения:
287,5 °C
T плавления:
20 °C
С увеличением относительных молекулярных масс алканов
закономерно повышаются их температуры кипения и
плавления.
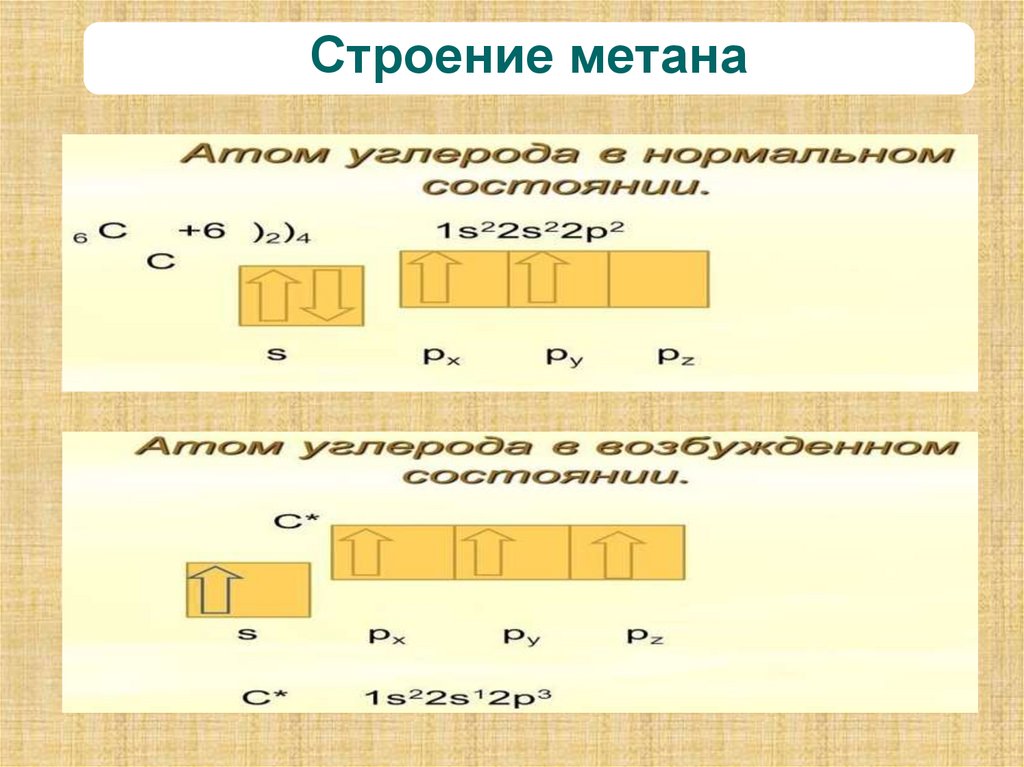
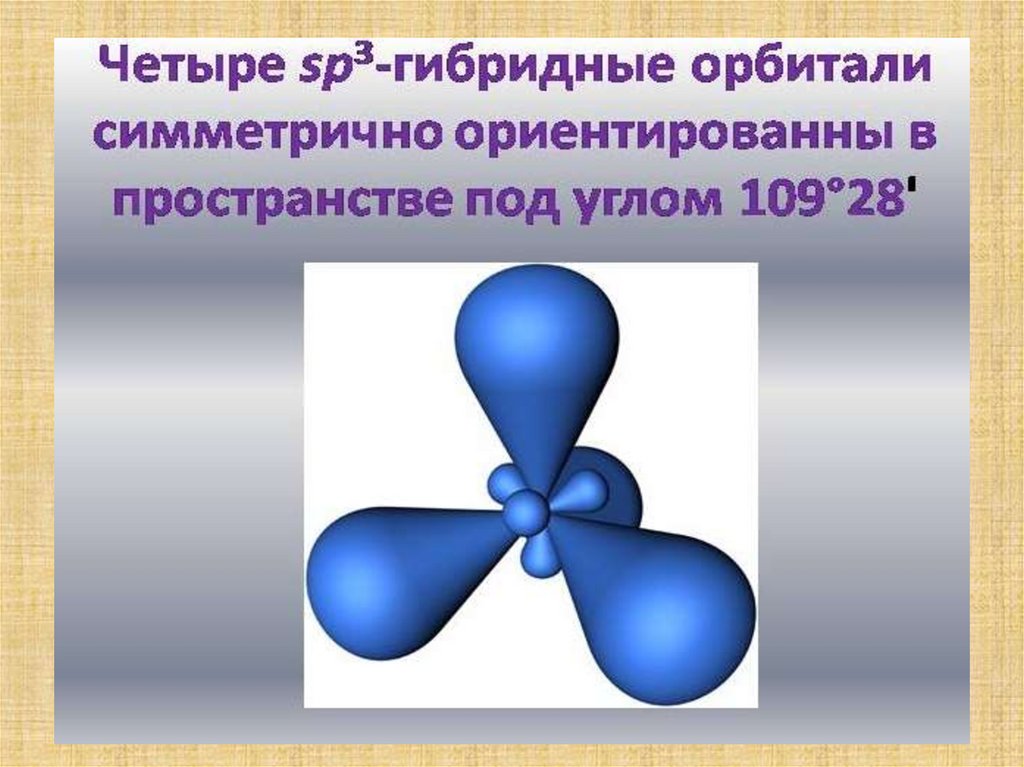
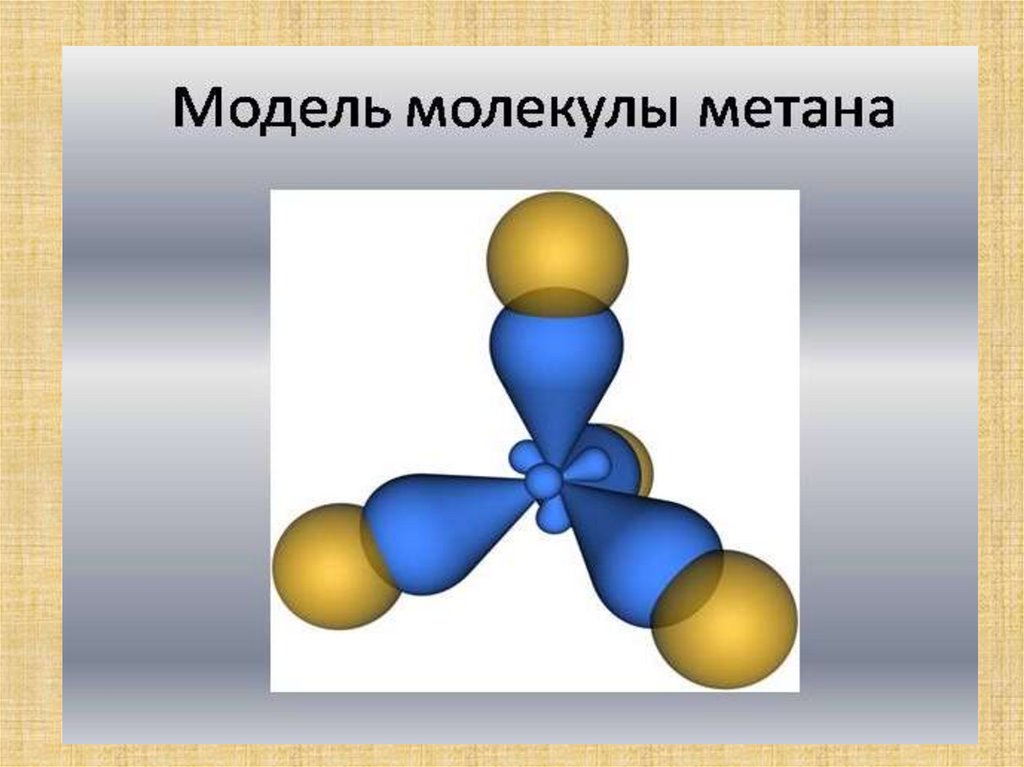
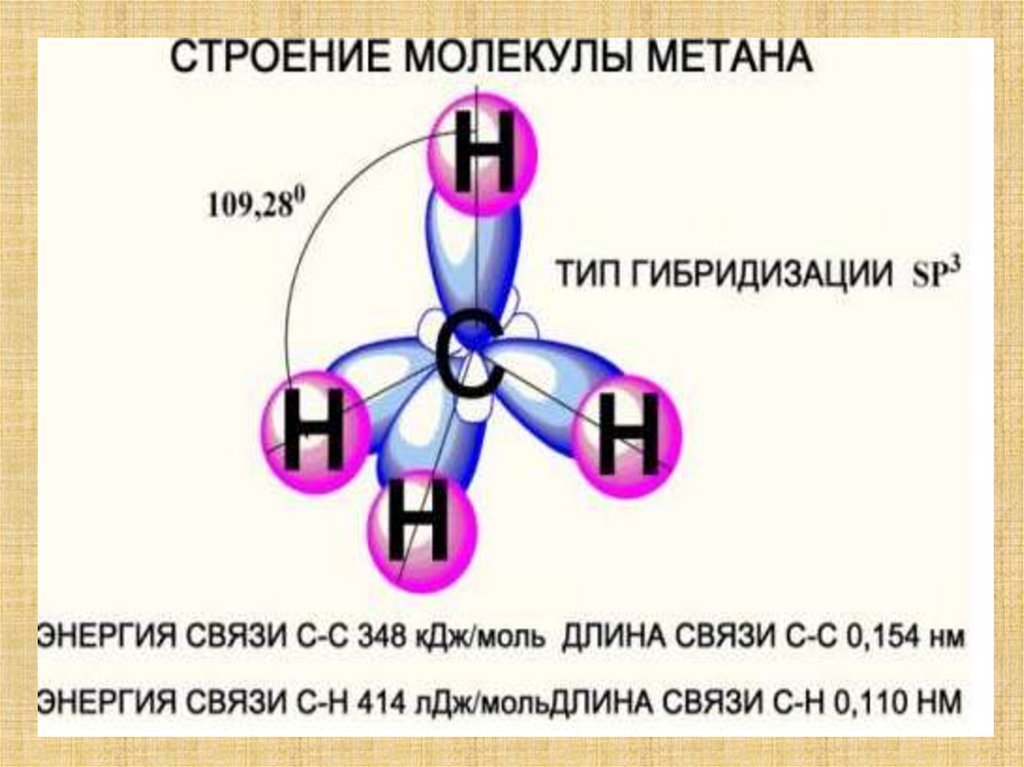
12. Строение метана
13. Строение метана Строение атома углерода
14.
15.
16.
17.
18.
19.
20.
21.
22. Нахождение в природе и получение предельных углеводородов
Предельные углеводороды встречаются:√ в природном газе (98%- метан);
√ в попутном нефтяном газе (С1-С6);
√ в нефти (С5-С50);
√ в каменном угле
Получают их из природного сырья.
23. Химические свойства предельных углеводородов
Для предельных углеводородов характерныследующие химические реакции:
√ замещения (по свободно-радикальному
механизму);
√ окисления (полное, неполное,
каталитическое);
√ разложения (пиролиз, крекинг,
дегидрирование);
√ изомеризация.
Для алканов совсем не характерны реакции
присоединения.
24. Реакции замещения
1. Реакция хлорирования (галогенирования) насвету
1
2
3
4
СН4 →СН3Сl →СН2Сl 2 →СНСl 3 →ССl 4
1. СН4 Сl + Cl2 → СН3 Сl + НCl
хлорметан
2. СН3 Сl + Cl2 → СН2 Сl 2 + НCl
дихлорметан
3. СН2 Сl 2 + Cl2 → СН Сl 3 + НCl
трихлорметан
4. СН Сl 3 + Cl2 → ССl 4 + НCl
тетрахлорметан
(первая стадия)
(вторая стадия)
(третья стадия)
(четвертая стадия)
2. Реакция нитрования (реакция Коновалрва)
t
СН4 + НNO3 (разб.) → СН3 NO2 + H2O
нитрометан
25. Реакции окисления
1. Полное окисление – горениеВсе алканы горят бледно-голубым пламенем
с образованием углекислого газа и воды
СН4 + 2О 2 → СО 2 +2Н2О +Q
2. Неполное окисление (могут образоваться
угарный газ СО или С (сажа, уголь) и второй
продукт – вода
3. Каталитическое окисление
СН4 + [О] → метиловый спирт (СН3ОН);
или метаналь (формальдегид);
или метановая (муравьиная) кислота
26. Реакции разложения
1. Термическое разложение (пиролиз) – разложение допростых веществ или получение ацетилена
0
1000 С
СН4 →
С + 2Н2
0
1500 С
2СН4 →
С2Н2+ 2Н2
метан
ацетилен
(этин)
2. Крекинг (разрыв углеродной цепи посередине)
t
С4Н10 → С2Н4+С2Н6
бутан
этен
этан
3. Дегидрирование (отщепление молекулы водорода)
t, кат.
С2Н6 → С2Н4+Н2
этан
этен
27. Реакции изомеризации
В реакциях изомеризации не меняетсяколичественный и качественный состав
веществ, меняется лишь их пространственное
строение
t, кат.
СН3-СН2-СН2-СН3 → СН3- СН -СН3
|
н - бутан
СН3
изобутан (2-метилпропан)
28. Получение алканов
1) Реакция Вюрца (получение УВ с более длиннойцепью)
2C2H5Cl + 2Na → C4H10 + 2NaCl
хлорэтан
бутан
2) Сплавление ацетата натрия с твердым
гидроксидом натрия (реакция Дюма):
СН3СООNa + NaОН → СН4↑ + Nа2СО3
ацетат натрия
метан
карбонат
натрия
3) Гидролиз карбида алюминия (получение СН4)
Al4C3+12H2O→3CH4↑+4Al(OH)3
4) Синтез метана из простых веществ
t, кат.
С + 2Н2 → CH4↑
29. Применение алканов
1-3 – производствосажи
(1 – картриджи;
2 – резина;
3 – типографическая
краска)
4-7 – получение
органических веществ
(4 – растворителей;
5 – хладогентов,
используемых
в холодильных
установках;
6 – метанол;
7 - ацетилен)
30. Применение алканов
Предельные углеводороды находят своеприменение как:
√ топливо (бензин, керосин, мазут и др.);
√ растворители ;
√ химическое сырье (для получения алкенов
ацетилена, бутадиена и др.);
√ сырье для синтеза ( водорода, сажи,
парафина, сероуглерода и др.)


























 chemistry
chemistry








