Similar presentations:
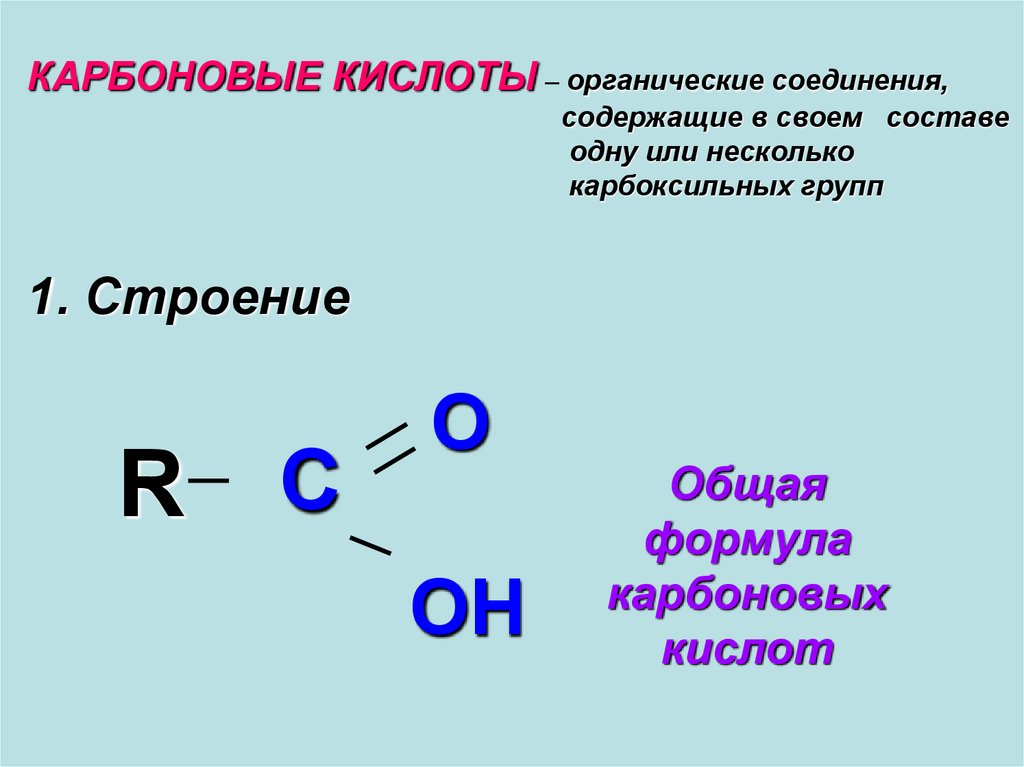
Карбоновые кислоты - органические соединения, содержащие в своем составе одну или несколько карбоксильных групп
1.
2.
КАРБОНОВЫЕ КИСЛОТЫ – органические соединения,содержащие в своем составе
одну или несколько
карбоксильных групп
1. Строение
R C
O
OH
Общая
формула
карбоновых
кислот
3. СnH2nO2 Общая формула карбоновых кислот Атом углерода карбоксильной группы находится в состоянии sp2 – гибридизации, он
СnH2nO2Общая формула карбоновых
кислот
Атом углерода карбоксильной группы находится в
sp2
–
гибридизации,
состоянии
он образует три сигма-связи.
14n +32
Формула для расчета
молекулярной массы
предельных карбоновых
кислот
4.
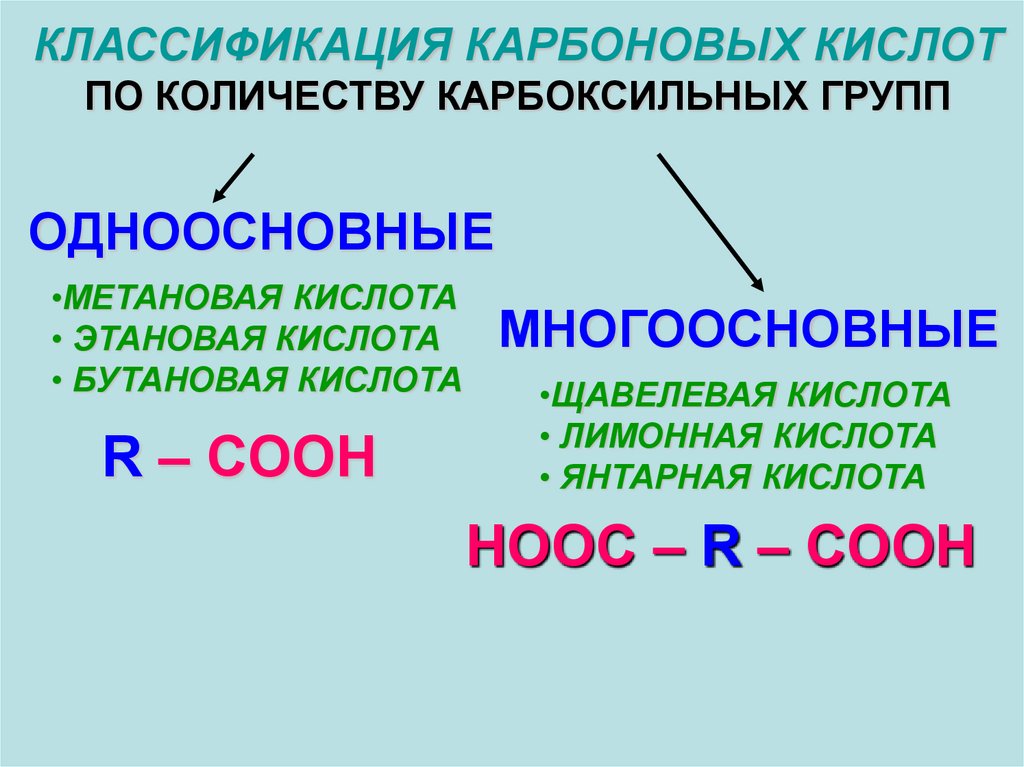
КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТПО КОЛИЧЕСТВУ КАРБОКСИЛЬНЫХ ГРУПП
ОДНООСНОВНЫЕ
•МЕТАНОВАЯ КИСЛОТА
• ЭТАНОВАЯ КИСЛОТА
• БУТАНОВАЯ КИСЛОТА
R – COOH
МНОГООСНОВНЫЕ
•ЩАВЕЛЕВАЯ КИСЛОТА
• ЛИМОННАЯ КИСЛОТА
• ЯНТАРНАЯ КИСЛОТА
HOOC – R – COOH
5.
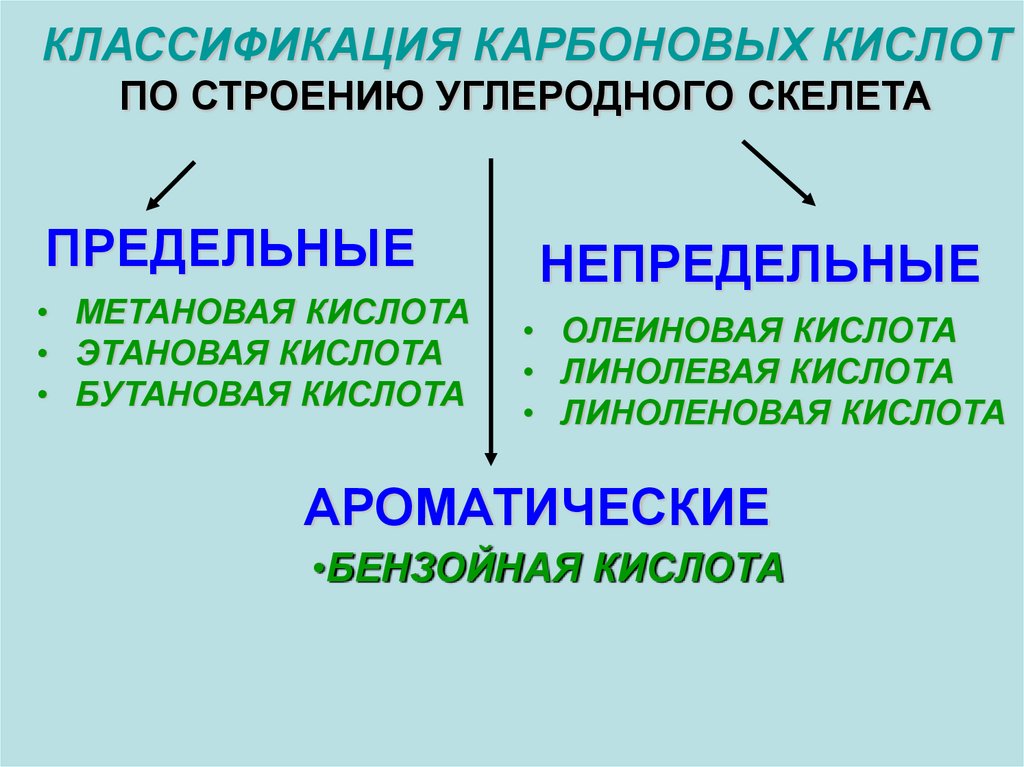
КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТПО СТРОЕНИЮ УГЛЕРОДНОГО СКЕЛЕТА
ПРЕДЕЛЬНЫЕ
• МЕТАНОВАЯ КИСЛОТА
• ЭТАНОВАЯ КИСЛОТА
• БУТАНОВАЯ КИСЛОТА
НЕПРЕДЕЛЬНЫЕ
• ОЛЕИНОВАЯ КИСЛОТА
• ЛИНОЛЕВАЯ КИСЛОТА
• ЛИНОЛЕНОВАЯ КИСЛОТА
АРОМАТИЧЕСКИЕ
•БЕНЗОЙНАЯ КИСЛОТА
6.
2. НОМЕНКЛАТУРА КАРБОНОВЫХКИСЛОТ
Алгоритм составления названий:
1. Найдите главную (самую длинную) цепь
углеводородных атомов (включая атом
карбоксильной группы);
2. Пронумеруйте углеродные атомы главной цепь
начиная с углерода карбоксильной группы;
3. Назовите соединение по алгоритму
углеводородов;
4. В конце названия допишите суффикс «ов» и
окончание «ая» и слово «кислота»
АЛКАН + ОВ + АЯ КИСЛОТА
7.
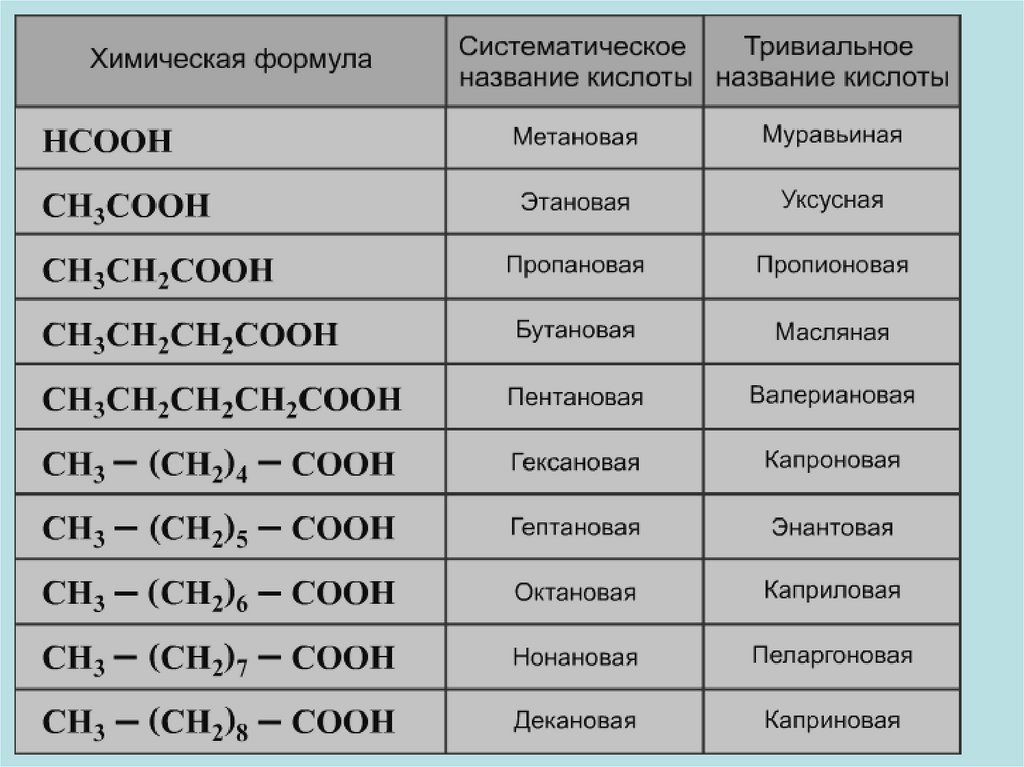
МЕТАНОВАЯ КИСЛОТА(МУРАВЬИНАЯ КИСЛОТА)
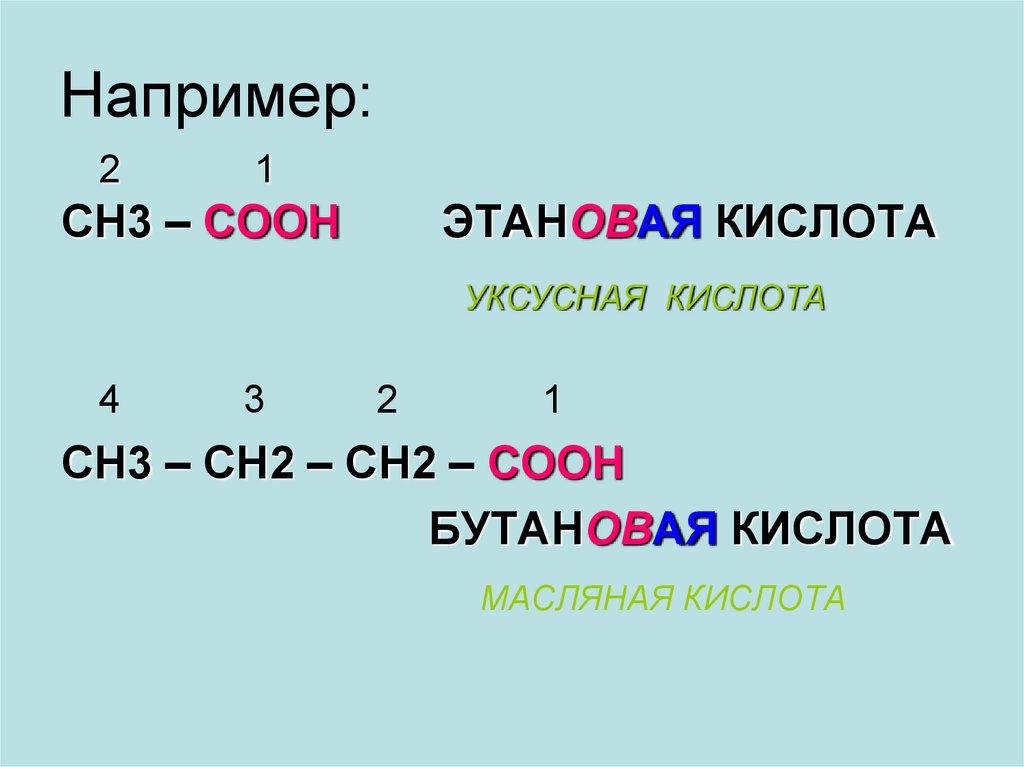
8. Например:
21
СН3 – СООН
ЭТАНОВАЯ КИСЛОТА
УКСУСНАЯ КИСЛОТА
4
3
2
1
СН3 – СН2 – СН2 – СООН
БУТАНОВАЯ КИСЛОТА
МАСЛЯНАЯ КИСЛОТА
9.
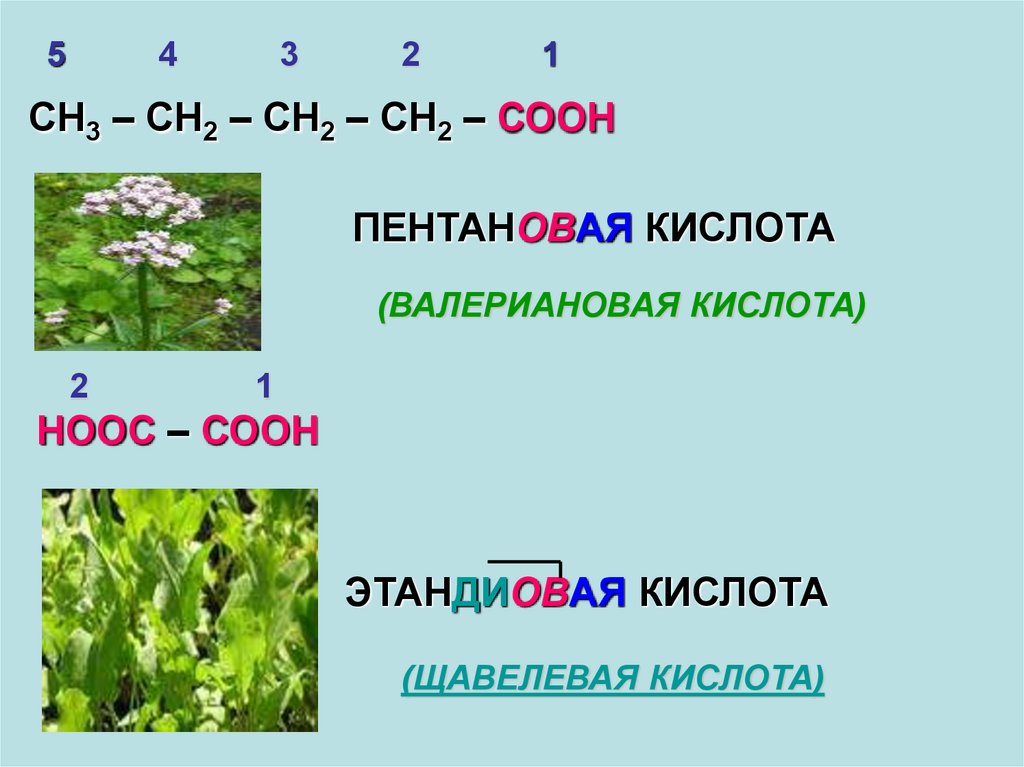
54
3
2
1
СН3 – СН2 – СН2 – СН2 – СООН
ПЕНТАНОВАЯ КИСЛОТА
(ВАЛЕРИАНОВАЯ КИСЛОТА)
2
1
НООС – СООН
ЭТАНДИОВАЯ КИСЛОТА
(ЩАВЕЛЕВАЯ КИСЛОТА)
10.
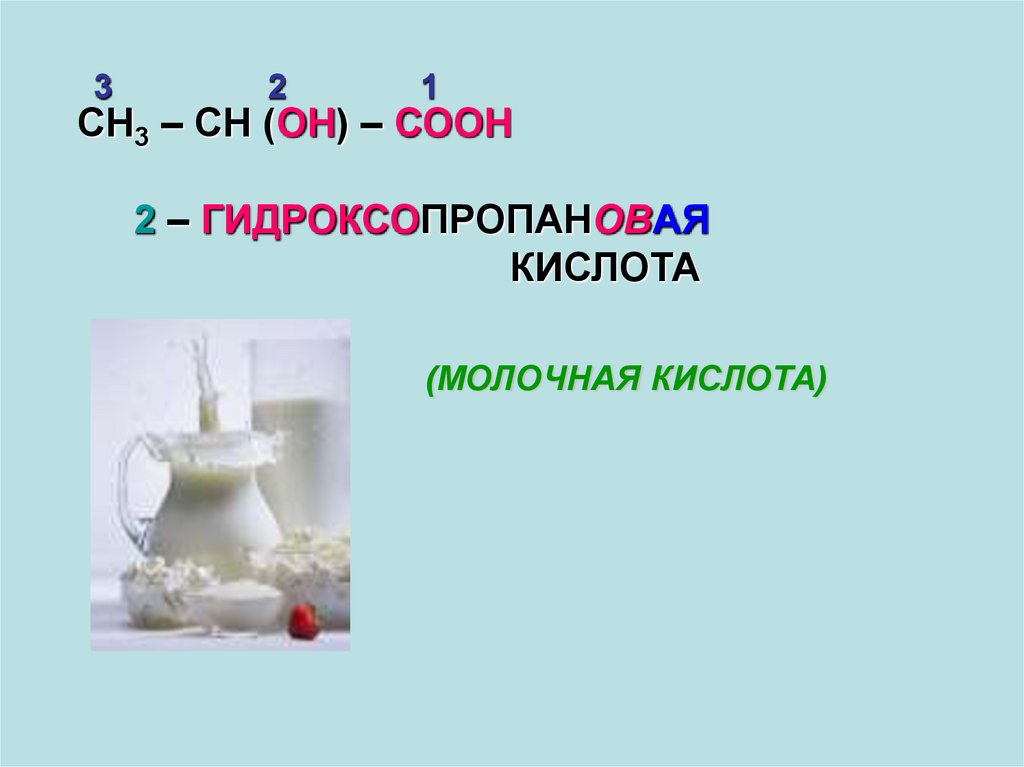
32
1
СН3 – СН (ОН) – СООН
2 – ГИДРОКСОПРОПАНОВАЯ
КИСЛОТА
(МОЛОЧНАЯ КИСЛОТА)
11.
12.
ДАЙТЕ НАЗВАНИЕ ВЕЩЕСТВАМПО МЕЖДУНАРОДНОЙ НОМЕНКЛАТУРЕ
1.СН3 – СН(СН3) – СООН
2.СН3 – СН2 – СН(СН3) – СН(СН3) – СООН
3.СН3 – СН = СН – СН(СН3) – СООН
4.СН3 – СН = СН – СН(ОН) – СООН
5.НООС – СН2 – СН(СН3) – СООН
13.
ОТВЕТЫ1.2 – МЕТИЛПРОПАНОВАЯ КИСЛОТА
2. 2, 3 – ДИМЕТИЛПЕНТАНОВАЯ КИСЛОТА
3. 2 – МЕТИЛПЕНТЕН – 3 – ОВАЯ КИСЛОТА
4. 2 – ГИДРОКСОПЕНТЕН – 3 – ОВАЯ КИСЛОТА
5. 2 – МЕТИЛБУТАНДИОВАЯ КИСЛОТА
14.
ИЗОМЕРИЯ КАРБОНОВЫХ КИСЛОТДля предельных карбоновых кислот:
• УГЛЕРОДНОГО СКЕЛЕТА
• МЕЖКЛАССОВАЯ (СЛОЖНЫЕ ЭФИРЫ)
Для непредельных карбоновых кислот:
• УГЛЕРОДНОГО СКЕЛЕТА
• ПОЛОЖЕНИЯ КРАТНОЙ СВЯЗИ
• МЕЖКЛАССОВАЯ
15.
3. Свойства3.1.Физические
С1 – С3 Жидкости с характерным
резким запахом, хорошо
растворимые
в
воде
Вязкие
маслянистые
с неприятным
С4 – С9 жидкости
запахом, плохо растворимые
в воде
C10 и >
Твердые
вещества,
не имеющие запаха, не
растворимые в воде
16.
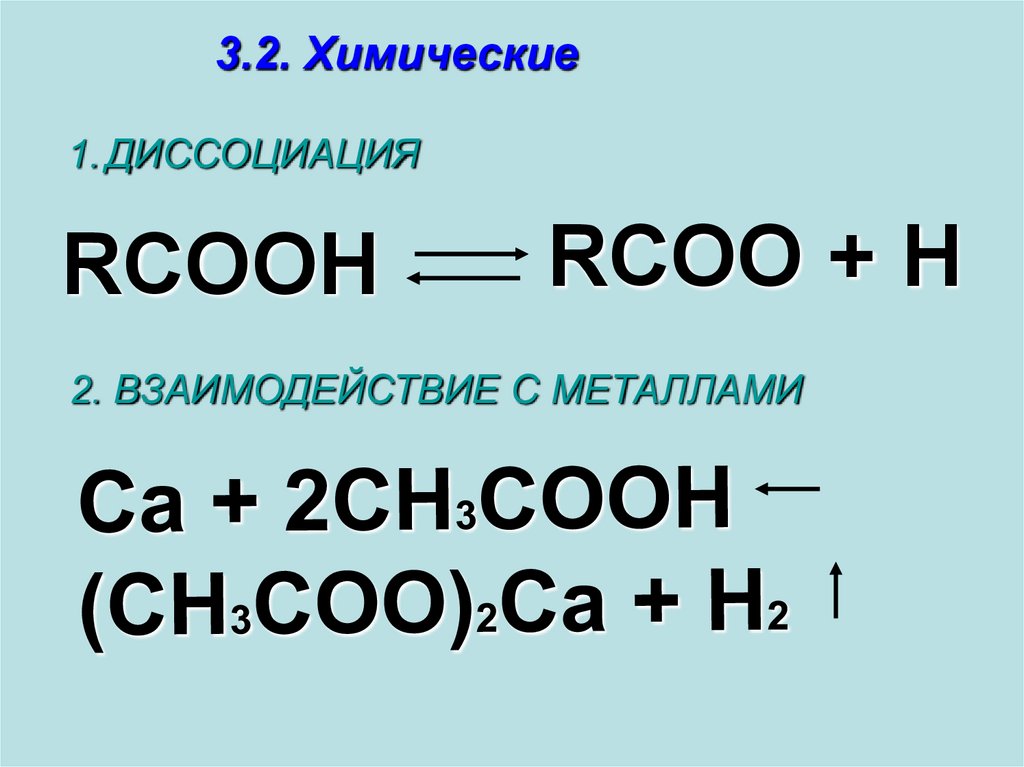
3.2. Химические1. ДИССОЦИАЦИЯ
RCOOH
RCOO + H
2. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ
17.
3.ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ ОКСИДАМИ2 R – COOH + MgO =
(R – COO)2Mg + H2O
4.ВЗАИМОДЕЙСТВИЕ СО ЩЕЛОЧАМИ
R – COOH + NaOH =
R – COONa + H2O
18.
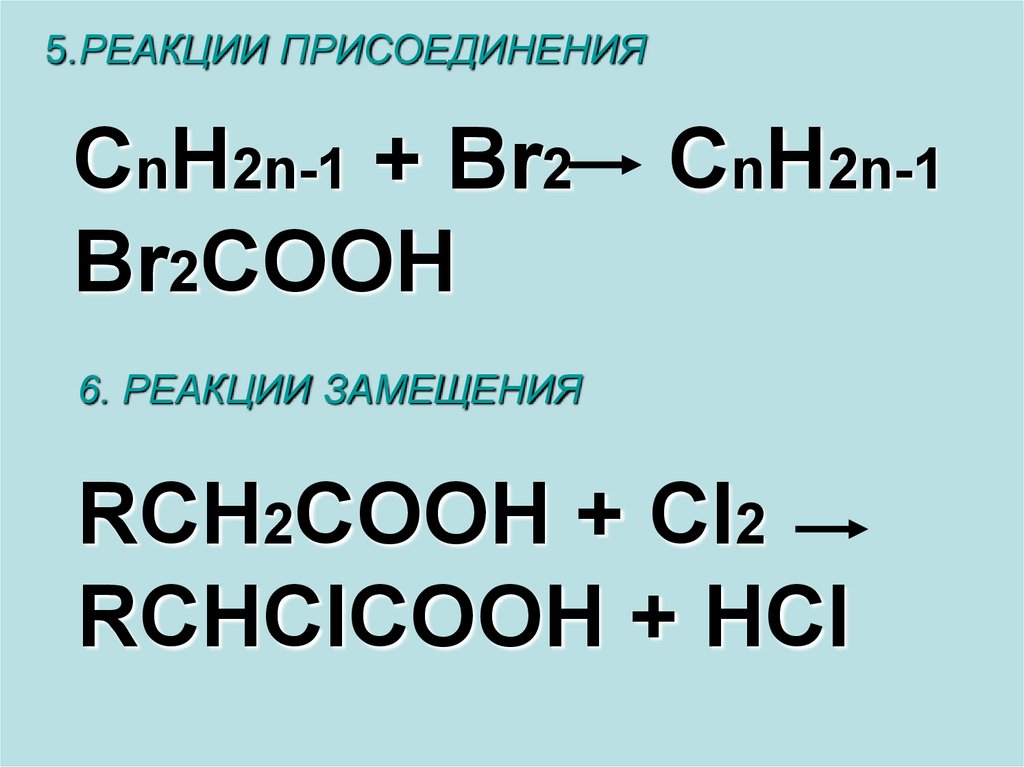
5.РЕАКЦИИ ПРИСОЕДИНЕНИЯCnH2n-1 + Br2
Br2COOH
CnH2n-1
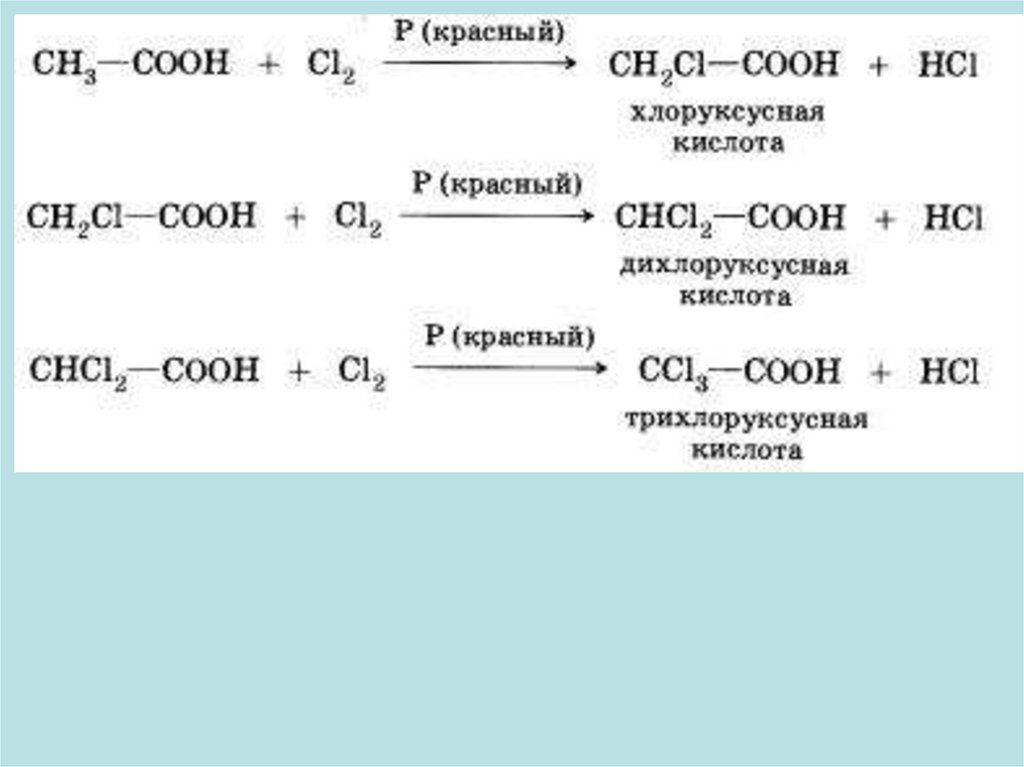
6. РЕАКЦИИ ЗАМЕЩЕНИЯ
RCH2COOH + Cl2
RCHClCOOH + HCl
19.
20.
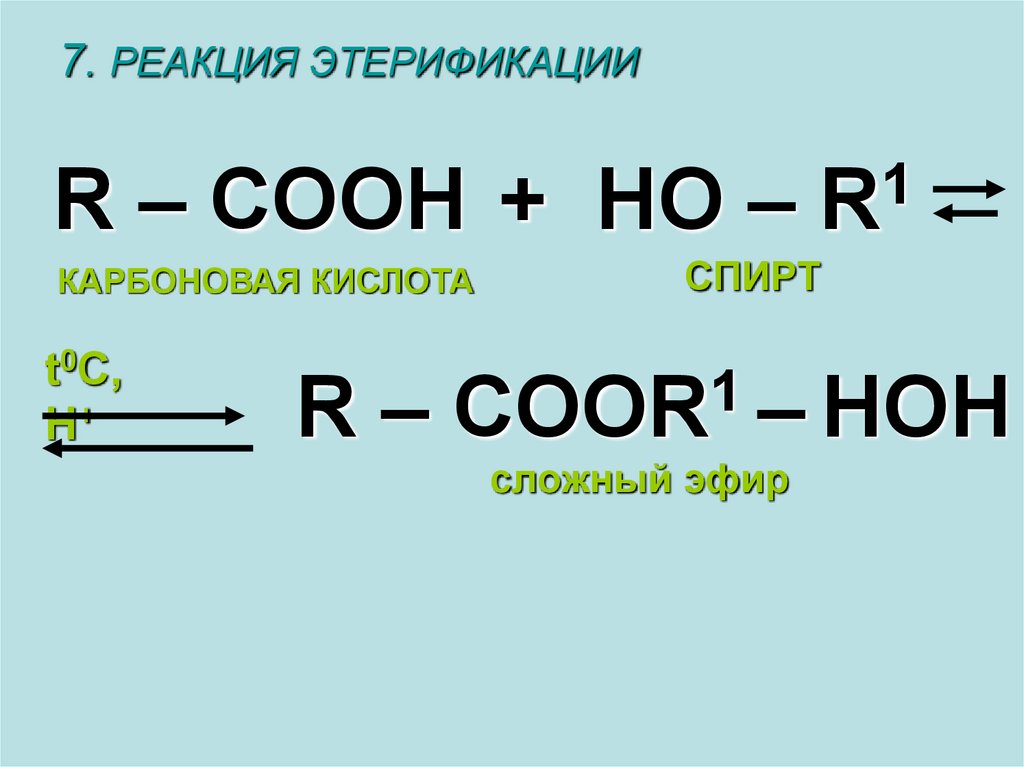
7. РЕАКЦИЯ ЭТЕРИФИКАЦИИR – COOH +
КАРБОНОВАЯ КИСЛОТА
t0C,
H+
1
HO – R
СПИРТ
1
R – COOR – HOH
сложный эфир
21.
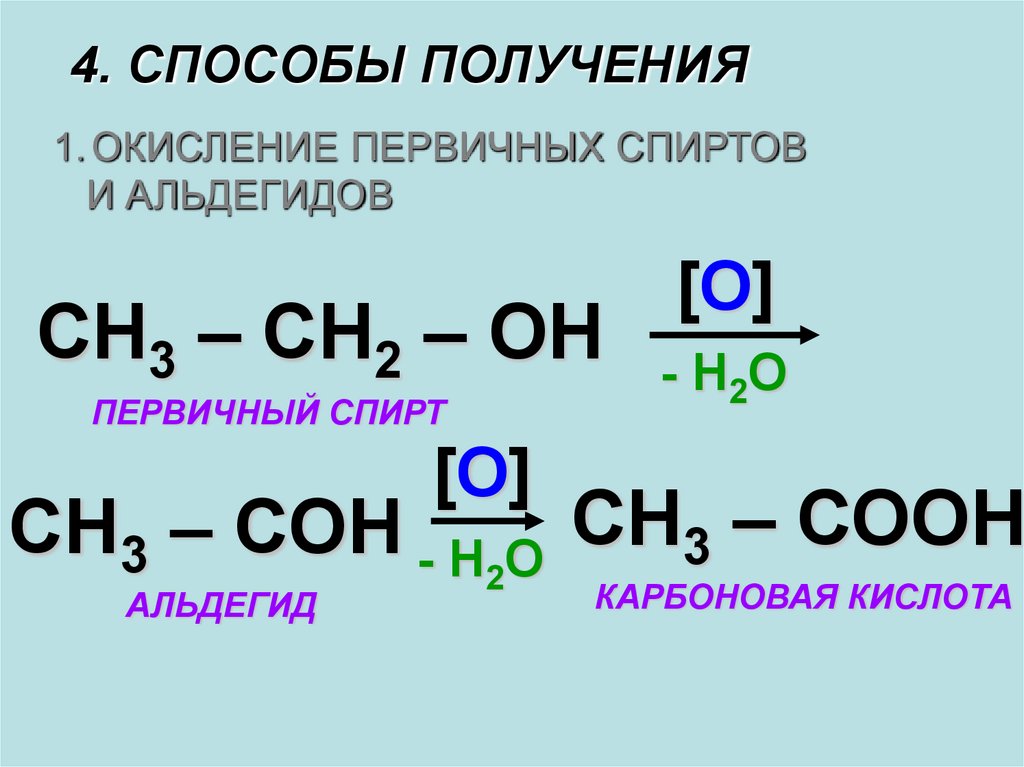
4. СПОСОБЫ ПОЛУЧЕНИЯ1. ОКИСЛЕНИЕ ПЕРВИЧНЫХ СПИРТОВ
И АЛЬДЕГИДОВ
СН3 – СН2 – ОН
ПЕРВИЧНЫЙ СПИРТ
[О]
- Н2О
[О]
СН3 – СОН - Н2О СН3 – СООН
АЛЬДЕГИД
КАРБОНОВАЯ КИСЛОТА
22.
2. ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВСН3 – СООС2Н5 + НОН
Н+
СН3 – СООН + С2Н5ОН
23.
5. ПрименениеОБЛАСТИ ПРИМЕНЕНИЯ
МУРАВЬИНАЯ
КИСЛОТА
ЩАВЕЛЕВАЯ
КИСЛОТА
УКСУСНАЯ
КИСЛОТА
24. Муравьиная кислота:
• в текстильной промышленности (вкачестве протравы при крашении тканей);
• в кожевенной (при дублении кож);
• в пищевой (для консервирования фруктов);
• в медицине;
• в производстве некоторых полимеров
25. Уксусная кислота:
• в пищевой промышленности (дляконсервации);
• для получения полимеров, красителей,
сложных эфиров, ацетатного шелка,
негорючей фото - и кинопленки;
• Широко используются соли уксусной
кислоты:
- ацетаты железа, хрома, алюминия в качестве
протравы при крашении ткани;
- ацетат меди – для борьбы с вредителями с/х;
- ацетат свинца – для изготовления свинцовых
белил
26. Щавелевая кислота:
• для отбеливания тканей;• в производстве красителей;
• в кожевенной и деревообрабатывающей
промышленности;
• для удаления ржавчины и накипи;
• в пищевой промышленности.
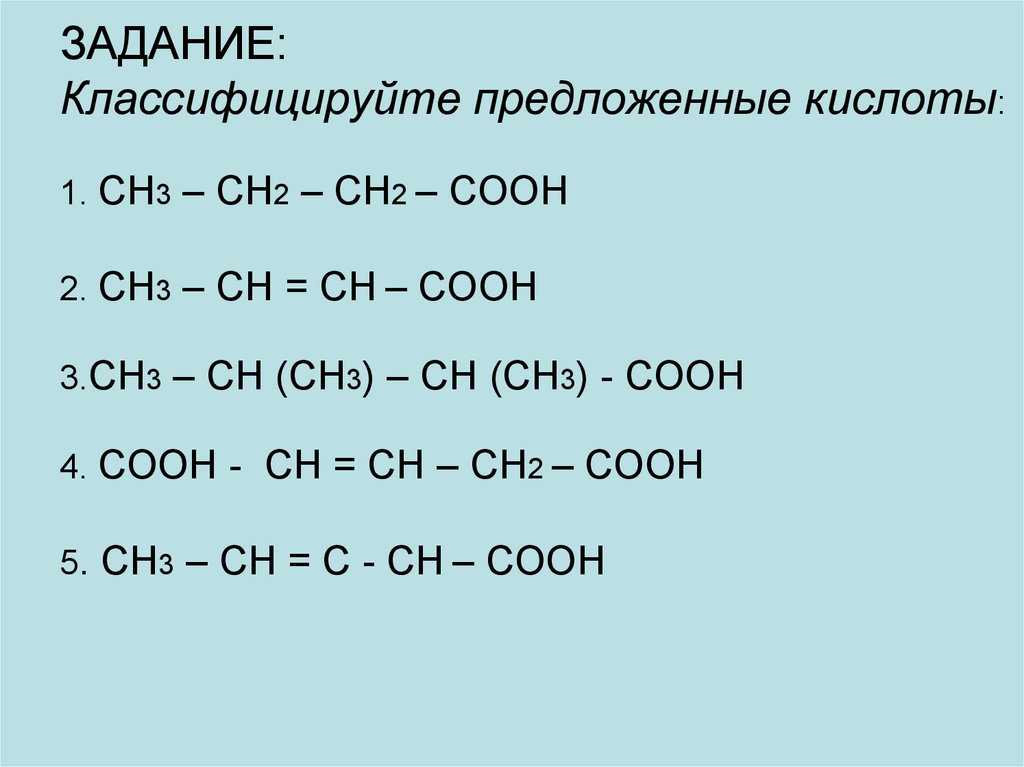
27. ЗАДАНИЕ: Классифицируйте предложенные кислоты: 1. CH3 – CH2 – CH2 – COOH 2. CH3 – CH = CH – COOH 3.CH3 – CH (CH3) – CH (CH3) -
COOH4. COOH - CH = CH – CH2 – COOH
5. CH3 – CH = C - CH – COOH
28. ОТВЕТЫ:
1.одноосновная, предельная2. одноосновная, непредельная
3. одноосновная, предельная
4. двухосновная, непредельная
5. одноосновная, непредельная
29. Ссылки:
• http://engschool18.ru/newteacher/chemistry/page/4/ - рис. (слайд1)
• http://ru.encydia.com/en/Карбоксильная_
кислота - рис. (слайд3)
• http://bankkrasoty.ua/preservatives/&page
=2 – рис.(слайд10)
• http://900igr.net/fotografii/khimija/Karbono
vye-kisloty-2/ - рис. (слайд12,13)
• http://www.itkgroup.ru/?meteg=karbonovie
-kisloti-himiya-10-klass – рис.(слайд23)
30. Список литературы:
1.2.
3.
4.
5.
Габриелян О.С. Химия: учеб. для студ. Учреждений сред.
проф. образования/ О.С. Габриелян, И.Г. Остроумов. – 9-е
изд.,
стер. – М.: изд.
центр «Академия», 2011.
Габриелян О.С., Остроумов И.Г. Химия: Пособие для
поступающих в вузы. – М.: Дрофа, 2005.
Габриелян О.С., Остроумов И.Г., Введенская А.Г. Общая
химия в тестах, задачах и упражнениях. – М. : Дрофа, 2003.
Пичугина Г.В. Химия и повседневная жизнь человека. – М.:
Дрофа, 2004
Химия:
Общая химия:
Учебник для 11 класса
общеобразовательных
учреждений с
углубленным
изучением химии/ О.С. Габриелян, И.Г. Остроумов, С.Н.
Соловьев, Ф.Н. Маскаев. – М.: Просвещение, 2005.








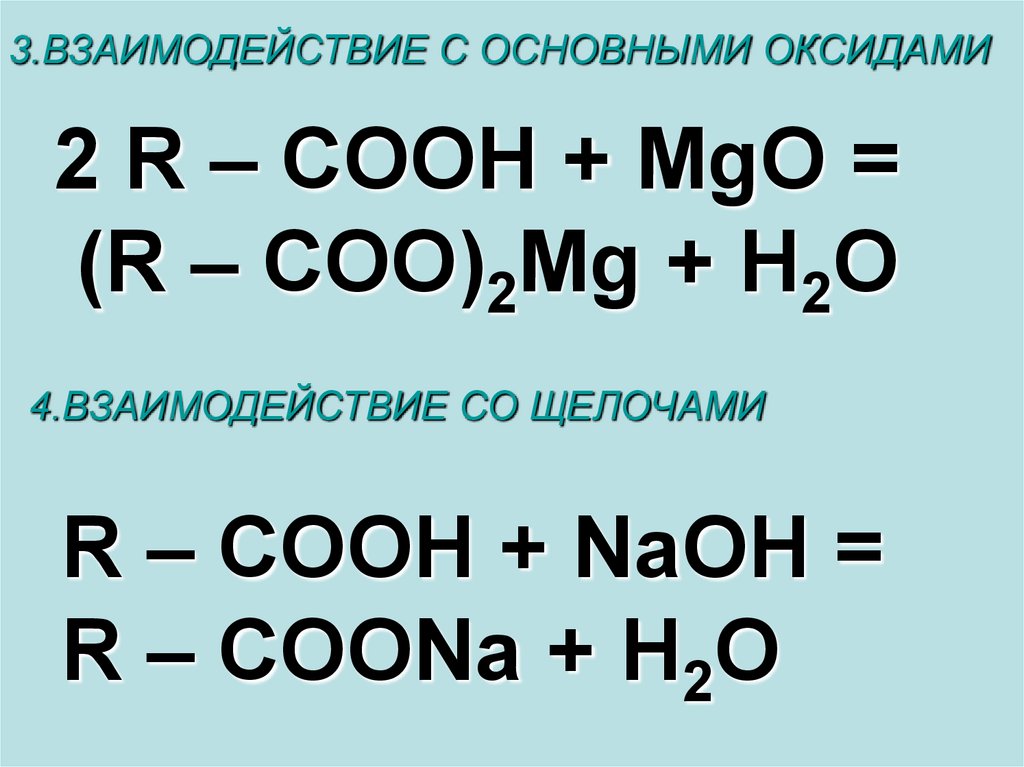








 chemistry
chemistry