Similar presentations:
Биологическое окисление и образование АТФ (лекция)
1.
СЗГМУ им. И. И. МЕЧНИКОВАКафедра клинической лабораторной диагностики,
биологической и общей химии им. В. В. Соколовского
БИОЛОГИЧЕСКАЯ ХИМИЯ-БИОХИМИЯ ПОЛОСТИ РТА
Раздел VII
ЛЕКЦИЯ
Биологическое окисление и образование АТФ
Доцент Антонова Ж.В. , проф. Дадали В.А.,
2023/2024
2.
План лекции1. Малат-аспартатный челночный механизм.
2. Глицеролфосфатный челночный механизм.
3. Биологическое окисление (тканевое дыхание), этапы.
3.1.Общая схема тканевого дыхания (биологического окисления).
4.Механизмы (способы) образования АТФ в организме
(окислительное и субстратное фосфорилирование). 4.1.
Субстратное фосфорилирование. 4.2. Окислительное
фосфорилирование в ЦПЭ. 4.2.1.Строение ЦПЭ. 4.2.2. Механизм
окислительного фосфорилирования.
5. Действие разобщителей на ЦПЭ и синтез АТФ. 5.1.Примеры
разобщителей ЦПЭ. 5.2. Биологическая роль разобщения
дыхания и окислительного фосфорилирования. 5.3.Факторы,
повышающие эффективность работы ЦПЭ.
6. Ингибиторы дыхательной цепи (ЦПЭ)
2
3.
Рис.1. Малат- аспартатный челночный механизмИз 6-й
реакц
ии
глико
лиза
3 АТФ
ЦПЭ
Сердце, печень, почки
3
4.
Рис.2. Глицеролфосфатный челночный механизмИз 6-й
реакц
ии
гликол
иза
2 АТФ
ЦПЭ
В мышечной и мозговой ткани
4
5.
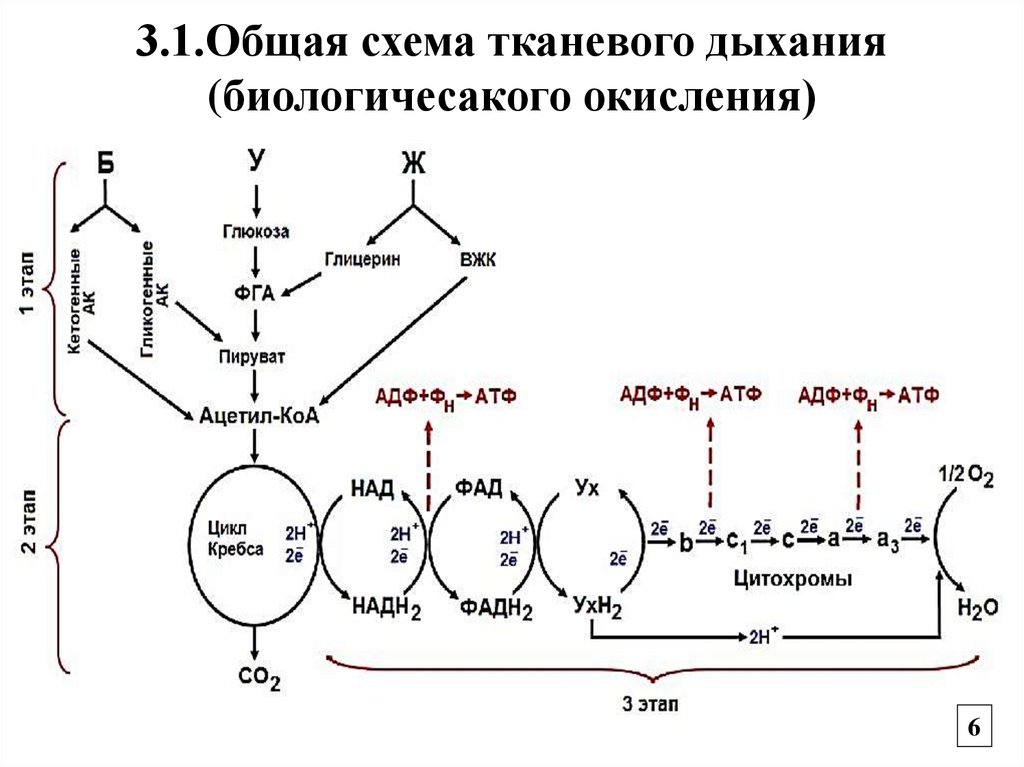
3. Биологическое окисление, или тканевоедыхание
Окисление органических соединений,
сопровождающееся потреблением О2 для
образования АТФ с выделением СО2 и воды.
Этапы
1. Образование ацетил-КоА
2. Окисление ацетил-КоА в цикле Кребса
3. Энергетический этап – передача
восстановительных эквивалентов по ЦПЭ
на кислород с образованием АТФ и воды.
5
6.
3.1.Общая схема тканевого дыхания(биологичесакого окисления)
6
7.
4. Механизмы (способы) образования АТФ ворганизме
Синтез АТФ происходит в реакциях
фосфорилирования, но самостоятельно протекать не
может, а только с использованием свободной энергии
(полезной энергии), т.к. реакция
АДФ + ФН → АТФ термодинамически не разрешена
(∆G>0, т.е. +30,5 кДж/моль)
1. Окислительное фосфорилирование – механизм
образования АТФ, использующий для этого энергию
градиента электрохимического потенциала ( μН+),
возникающего на внутренней мембране митохондрий
в ходе работы ЦПЭ.
7
8.
2. Субстратное фосфорилирование – механизмсинтеза АТФ, использующий энергию гидролиза
макроэргических связей соединений *,
образующихся в процессе метаболизма (1,3дифосфоглицерата, фосфоенолпирувата,
креатинфосфата, сукцинил-КоА)
*Примеч.
Макроэргическое соединение – соединение,
стандартная свободная энергия гидролиза
макроэргической связи которого равна от -30,5
кДж/моль или более «-»
8
9.
Субстратноефосфорилирование
Окислительное
фосфорилирование
Синтез АТФ за счет энергии
гидролиза макроэргической связи
субстрата:
1,3-дифосфоглицерат (∆G - 54
кДж/моль)
фосфоенолпируват (∆G - 62
кДж/моль)
креатинфосфат (∆G - 43 кДж/моль)
Энергетически более
выгодный процесс
Синтез АТФ происходит за
счет энергии переноса ℮
( μН+), в дыхательной цепи
(ЦПЭ) путем сопряжения
процессов окисления и
фосфорилирования
9
10.
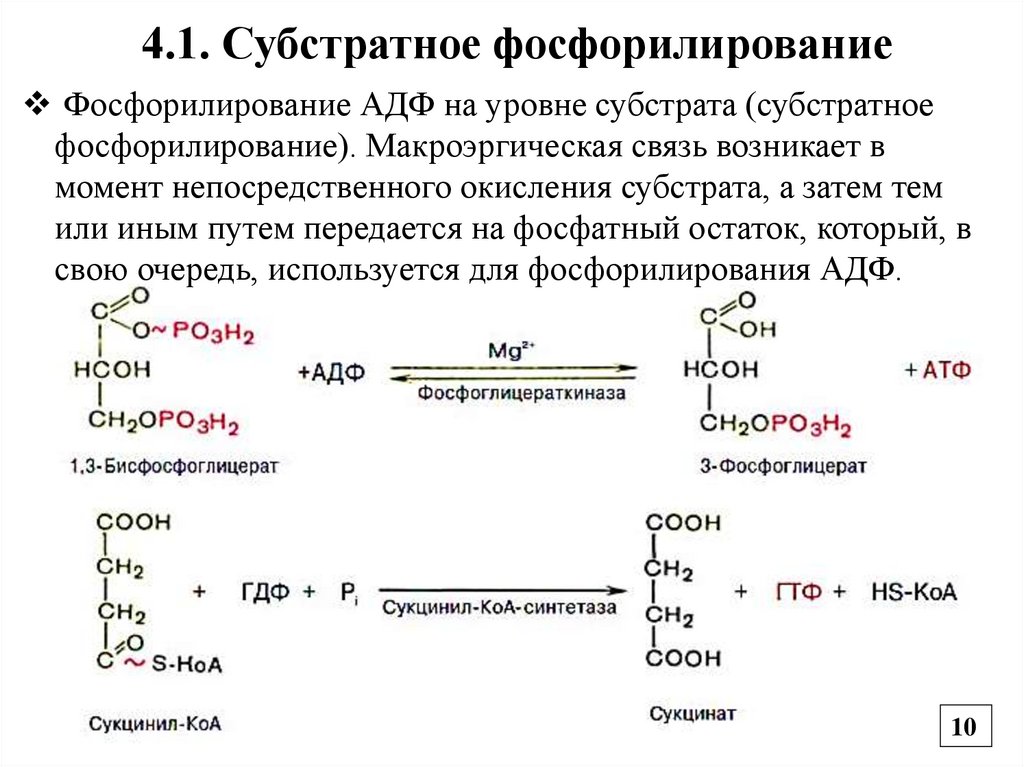
4.1. Субстратное фосфорилированиеФосфорилирование АДФ на уровне субстрата (субстратное
фосфорилирование). Макроэргическая связь возникает в
момент непосредственного окисления субстрата, а затем тем
или иным путем передается на фосфатный остаток, который, в
свою очередь, используется для фосфорилирования АДФ.
10
11.
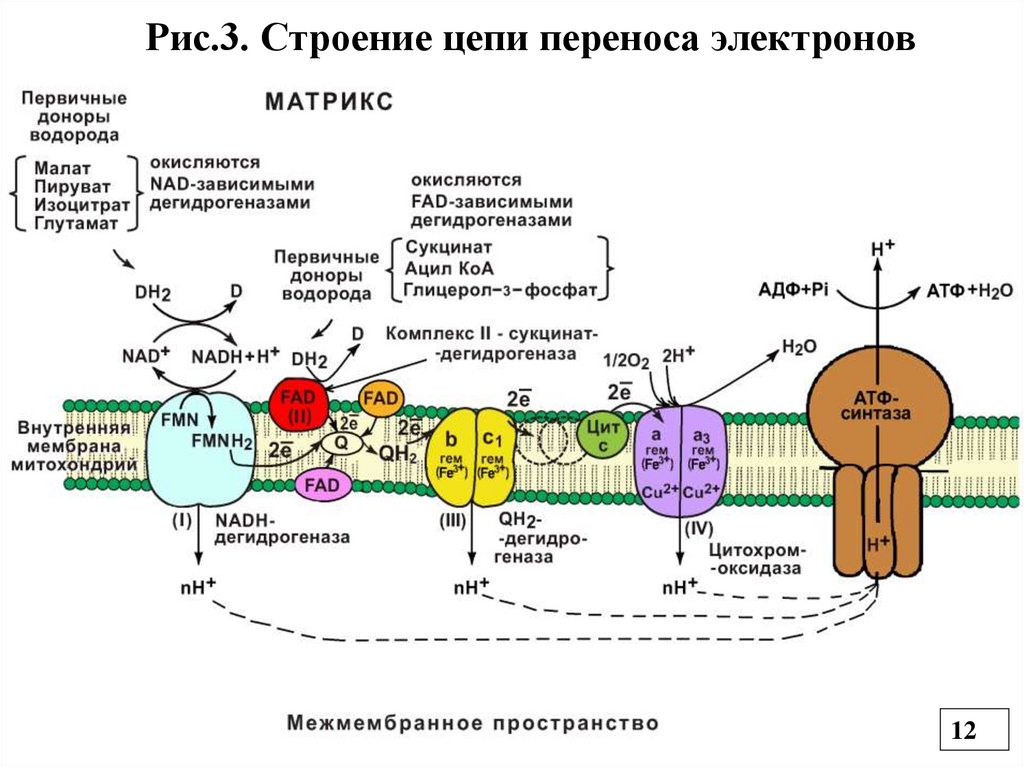
4.2. Окислительное фосфорилирование в ЦПЭ4.2.1.Строение ЦПЭ (ДЦ)
Дыхательная цепь (ДЦ), или цепь переноса
электронов (ЦПЭ) (Рис.3) - это каскад окислительновосстановительных ферментов, расположенных во
внутренней мембране митохондрий, участвующих в
переносе электронов от восстановленных коферментов
на О2 (электронотранспортная цепь).
Все компоненты ДЦ расположены в соответствии со
своим окислительно-восстановительным потенциалом
(это способность принимать и отдавать электроны), т.
е. в соответствии с его возрастанием.
Первым компонентом является НАДН, который принял
2℮ и Н+ (гидрид-ион) от окисляемых субстратов с
помощью НАД-зависимых ДГ. Он выполняет
коллекторную функцию.
11
12.
Рис.3. Строение цепи переноса электронов12
13.
• ФП1 – флавопротеин 1, или НАДН-дегидрогеназа, или(Комплекс I - НАДН-убихинон-оксидоредуктаза). Она
принимает 2℮ и Н +(гидрид-ион) от восстановленных
НАДН и выкачивает еще один Н+ из матрикса, т.е. для
восстановления принимает всего два электрона и два
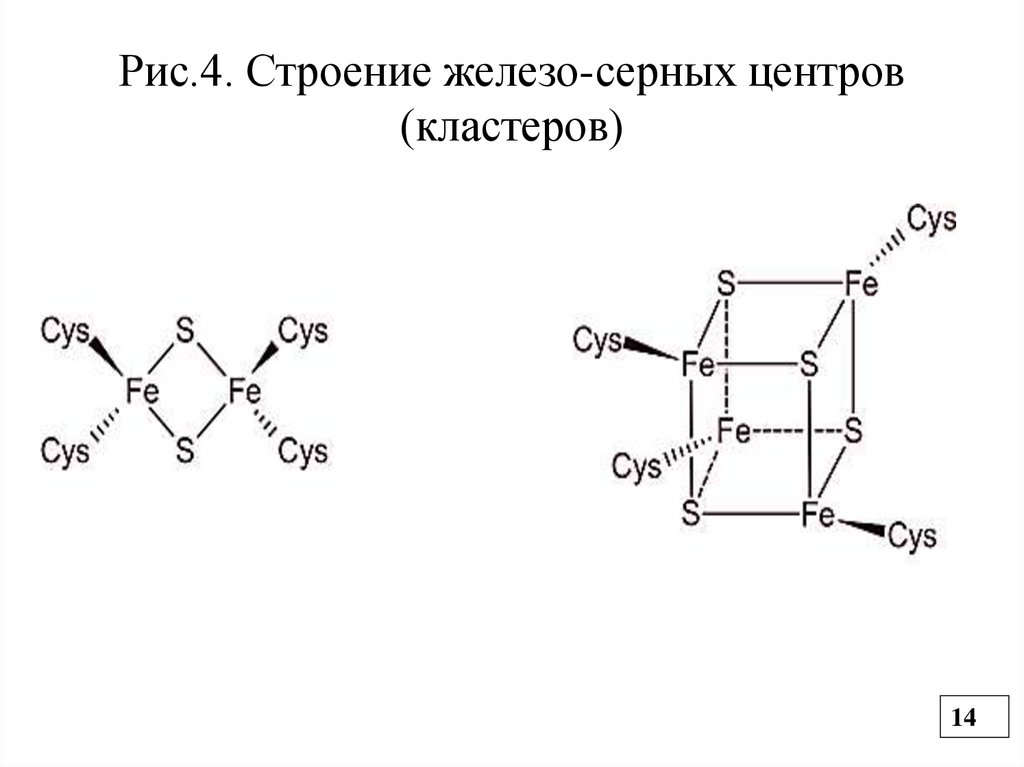
протона. НАДН дегидрогеназа имеет простетическую
группу ФМН и железосерные комплексы (кластеры) , в
которых Fe связано с атомом серы через SH-группы
цистеина (негемовое Fe) (Рис.4).
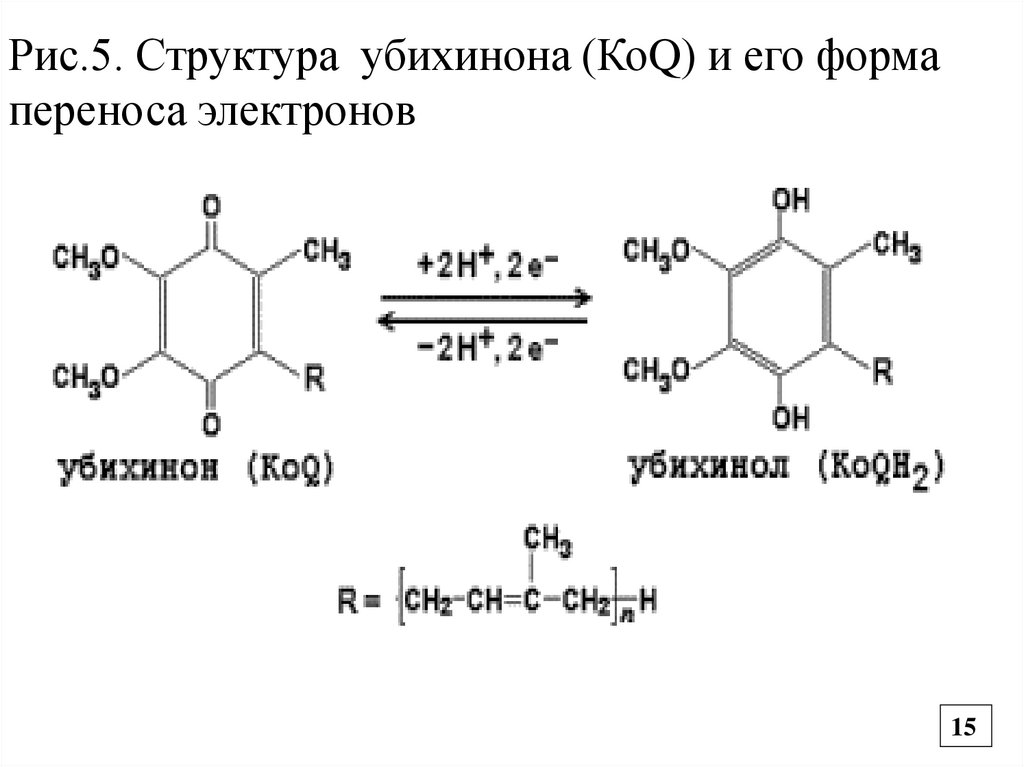
• Следующий переносчик электронов – убихинон или Q10
жирорастворимый хинон содержащий 10 остатков изопрена
(синтезируется в организме, но с возрастом его синтез
снижается). Убихинон тоже выполняет коллекторную
функцию и принимает 2℮ и 2Н+ от ФАД – зависимых ДГ и
превращается в восстановленную форму КоQ2Н –
убихинол (Комплекс III-Q 2Н ДГ и др. названия) (Рис.5).
• Убихинол передает электроны на систему цитохромов, а
2Н+ протона перекачивает из матрикса митохондрий
(перенос каждой пары 2℮ сопровождается выкачиванием
4Н+).
13
14.
Рис.4. Строение железо-серных центров(кластеров)
14
15.
Рис.5. Структура убихинона (КоQ) и его формапереноса электронов
15
16.
• Цитохромы (b,c,c1, аа3)– сложные белки, содержащиепростетическую группу гем, которая принимает и отдает ℮
(гемовое Fe2+). Fe3+гем + ℮ → Fe2+гем
• Цитохромы аа3 называются цитохромоксидазой (Комплекс
IV), которая передает ℮ на О2.
Цит. аа3 содержит 2 молекулы гема и 2 атома Cu+.
℮
℮
Fe3+гем → Fe2+гем
Cu2+ → Cu+
• АТФ-синтаза– трансмембранный ферментативный комплекс
(Комплекс V) (Рис.6)
• Все ферменты ДЦ расположены в соответствии с увеличением
своего окислительно-восстановительного потенциала (Рис.7).
• Электроны движутся в одном направлении от компонентов ДЦ
с электро «-» потенциалом, у которых сродство к электронам
низкое, к компонентам с электро «+» потенциалом, у которых
сродство к электронам высокое, т.е. к О2 (Рис.7).
16
17.
Рис.6. Строение АТФ-синтазы (Комплекс V)17
18.
Рис.7. Направление потока электронов и точкисопряжения окисления и фосфорилирования в ЦПЭ .
18
19.
На участках перепада ок.-восст. потенциала придвижении ℮ выделяется полезная свободная
энергия, которая на 55% рассеивается в виде
тепла, а 45% используется на синтез АТФ. Эти
участки ЦПЭ называются участками сопряжения
окисления и фосфорлирования (Рис.6), а механизм
образования АТФ- окислительное
фосфорилирование.
Энергетический выход
• В полной цепи при окислении НАДН − 3 АТФ
• В короткой цепи при окислении ФАД2Н – 2 АТФ
19
20.
4.2.2.Механизм окислительного фосфорилирования.Хемиосмотическая теория Митчелла. Сопряжение
окисления и фосфорилирования (Нобелевская премия в
1978 г.)
• Мембрана митохондрий должна быть интактной,
целостной и непроницаемой для Н+ и других катионов.
• Первичным событием в окислительном
фосфорилировании является транслокация протонов на
наружную сторону внутренней митохондриальной
мембраны за счет энергии движения электронов по ДЦ,
т.е за счет процессов окисления в ДЦ.
• Выкачивание протонов из матрикса и выброс их на
наружную сторону мембраны связано с формами
переноса электронов компонентов ДЦ.
20
21.
• В результате транслокации протонов на наружнуюсторону мембраны на ней образуется
электрохимический потенциал μН+, необходимый для
работы АТФ-синтазы (Рис.8).
• При движении 2-х восстановительных эквивалентов от
начала ДЦ μН+ примерно = - 200 кДж/моль
(экзергонический процесс).
• Протоны возвращаются обратно в матрикс и отдают
энергию трансмембранного потенциала на синтез АТФ.
• Реакция синтеза АТФ из АДФ и Фн является
эндергонической (+30,5 кДж/моль) и для нее
используется энергия сопряженного процесса
окисления, т.е. μН+.
• В процессе синтеза АТФ имеет место сопряжение двух
процессов: окисления и фосфорилирования (Рис.8) 21
22.
Рис.8. Образование электрохимического потенциала μН+2е
2е
22
23.
• Перенос 2℮ по ДЦ на О2 сопровождается выкачиванием2Н+ протонов из матрикса в межмембранное
пространство, возникает трансмембранный потенциал это разность заряда и рН среды ( μН+) (Рис.8).
• Протоны проходят через АТФ − синтазу (протонный
канал) и одновременно с образованием АТФ
образуется вода 1/2О2+2Н+ → Н2О.
• АТФ − синтаза использует полезную энергию и
катализирует реакцию фосфорилирования
АДФ +Фн → АТФ. Это осуществляется путем
сопряжения окисления и фосфорилирования.
• Если мембрана повреждена и Н+ проходят в матрикс
мх, минуя АТФ-синтазу , то μН+ потенциал падает и
АТФ не образуется. Эффект называется разобщением
окисления и фосфорилирования (Рис.9).
23
24.
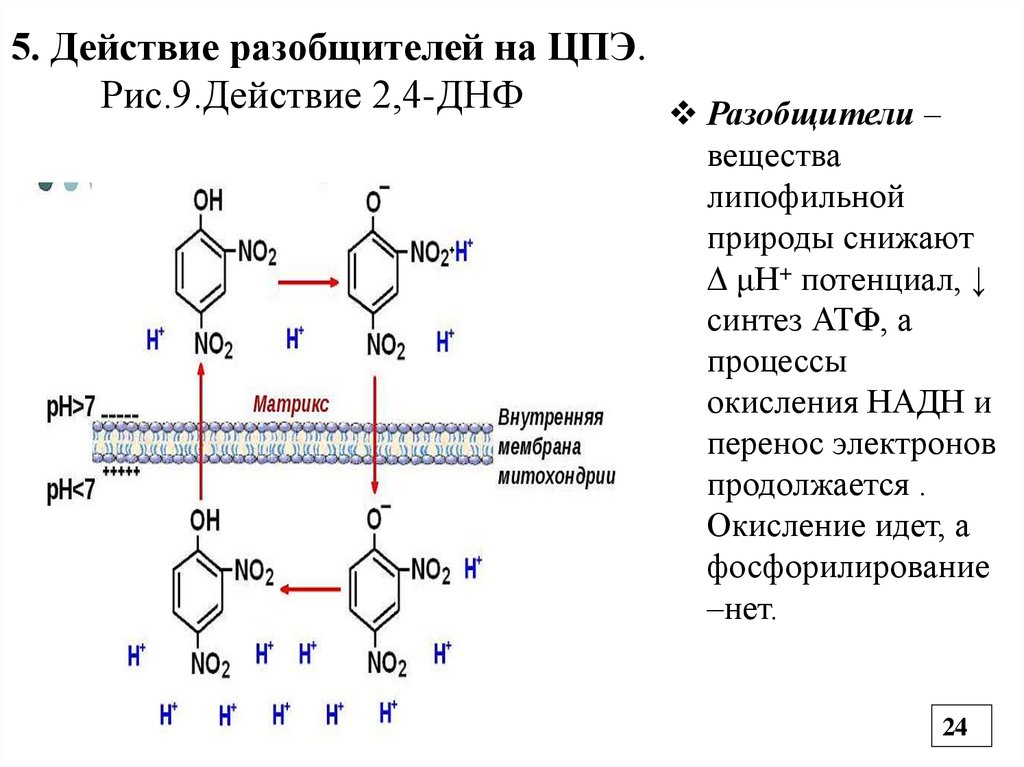
5. Действие разобщителей на ЦПЭ.Рис.9.Действие 2,4-ДНФ
Разобщители –
вещества
липофильной
природы снижают
μН+ потенциал, ↓
синтез АТФ, а
процессы
окисления НАДН и
перенос электронов
продолжается .
Окисление идет, а
фосфорилирование
–нет.
24
25.
5.1.Примеры разобщителей ЦПЭ• 2,4-динитрофенол переносит Н+ из межмембранного
пространства в матрикс митохондрии, минуя АТФ-синтазу.
В результате АТФ не синтезируется, а энергия выделяется
в виде тепла.
• Ионофоры переносят катионы, снижают μН+ и синтез
АТФ.
• Дикумарол (Са2+), гримицидин (Са2+), валиномицин (К+),
нигерицин (К+)
• Активные формы кислорода нарушают проницаемость
мембраны и вызывают эффект разобщения.
℮
℮
• 1/2 О2 → О2•− → Н2О2
25
26.
5.2. Биологическая роль разобщения дыхания иокислительного фосфорилирования
26
27.
5.3.Факторы, повышающиеэффективность работы ЦПЭ
• Глицерофосфолипиды как структурный
компонент клеточной мембраны мх.
• КоQ и препараты убихинола
• Антиоксиданты витамины Е, С, А и др.
27
28.
6. Ингибиторы дыхательной цепи (ЦПЭ)Ингибиторы действуют на точки сопряжения окисления и
фосфорилирования (Рис.10)
● ФМН – [ Fe-S ] — барбитураты (амитал), ротенон (токсичное
в-во некоторых водорослей), ацетальдегид (метаболизм
алкоголя). Блокируют перенос электронов на О2 и синтез АТФ.
В данной ситуации возможно запустить короткую
дыхательную цепь с использованием сукцината.
● цит b → цит с1 — антибиотик антимицин А
●цит аа3 — CN- , СО, Н2S (наиболее опасное действие
ингибиторов), они блокируется перенос ℮ на О2, при этом
снижается выработка АТФ, возникает гипоксия вплоть до
летального исхода.
28
29.
Рис.10. Действие ингибиторов на ЦПЭ29
30.
БЛАГОДАРЮ ЗА ВНИМАНИЕ!Пройдите тестирование.
30
























 biology
biology








