Similar presentations:
Биологическое окисление
1.
2.
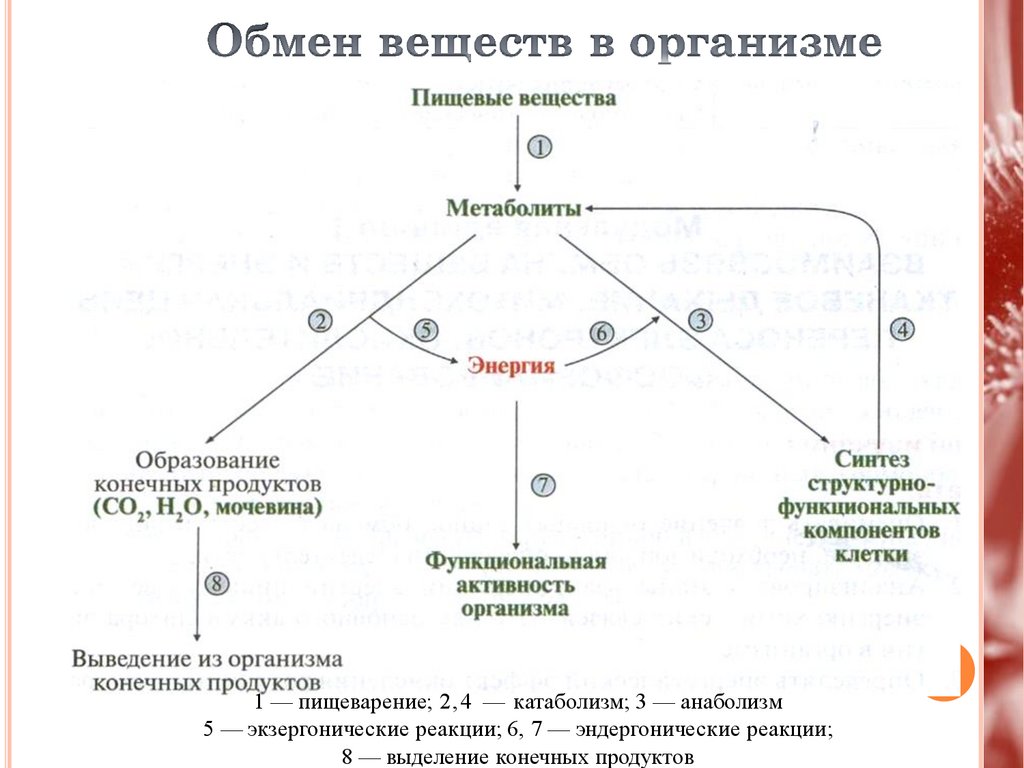
Поступлениевеществ в организм
Метаболизм или промежуточный обмен
Выделение конечных продуктов
3.
1 — пищеварение; 2,4 — катаболизм; 3 — анаболизм5 — экзергонические реакции; 6, 7 — эндергонические реакции;
8 — выделение конечных продуктов
4.
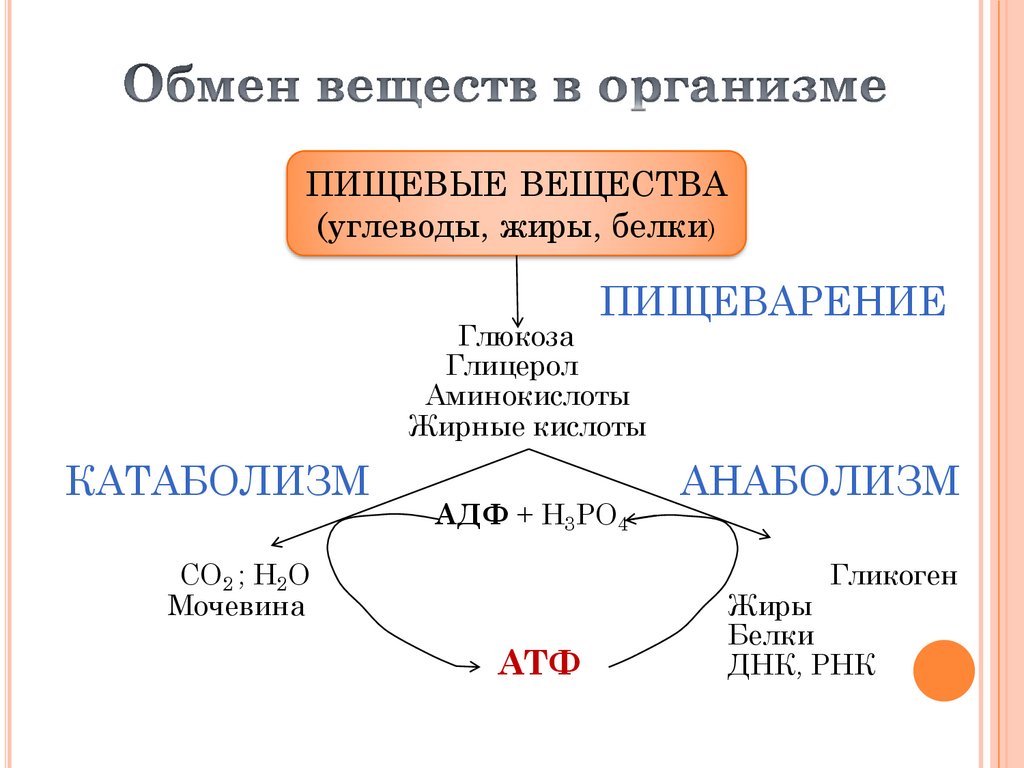
ПИЩЕВЫЕ ВЕЩЕСТВА(углеводы, жиры, белки)
ПИЩЕВАРЕНИЕ
Глюкоза
Глицерол
Аминокислоты
Жирные кислоты
КАТАБОЛИЗМ
АДФ + Н3РО4
СО2 ; Н2О
Мочевина
АНАБОЛИЗМ
Гликоген
АТФ
Жиры
Белки
ДНК, РНК
5.
Метаболизм – представляет собойсовокупность двух разнонаправленных
процессов: катаболизма и
анаболизма
В процессе катаболизма сложные
органические молекулы превращаются в
конечные продукты: СО2 и мочевину.
Анаболизм представляет собой
совокупность реакций синтеза сложных
полимеров
6.
Реакции катаболизмасопровождаются выделением энергии
(экзергонические реакции).
Использование энергии происходит
в реакциях анаболизма и при
выполнении различных видов работы
(эндергонические реакции).
7.
Наиболее важными экзергоничскимиреакциями метаболизма являются
реакции окисления органических
веществ, в которых используется
кислород и образуется вода и СО2
Совокупность этих реакций
называется тканевым дыханием.
8.
Биологическое окисление совокупность окислительновосстановительных реакций,протекающих во всех живых клетках.
Основная функция биологического
окисления – обеспечение организма Е
(энергией) в доступной для
использования форме (прежде всего
АТФ).
9.
❖❖
❖
❖
❖
❖
Протекает постепенно, через многочисленные
промежуточные стадии;
Требует участия ферментов;
Происходит многократная передача протонов
Н+ и электронов ē или только ē от донора к
акцептору;
Освобождение
Е
в
живой
клетке
осуществляется постепенно;
Е может аккумулироваться в виде АТФ;
Основная реакция дегидрирования.
10.
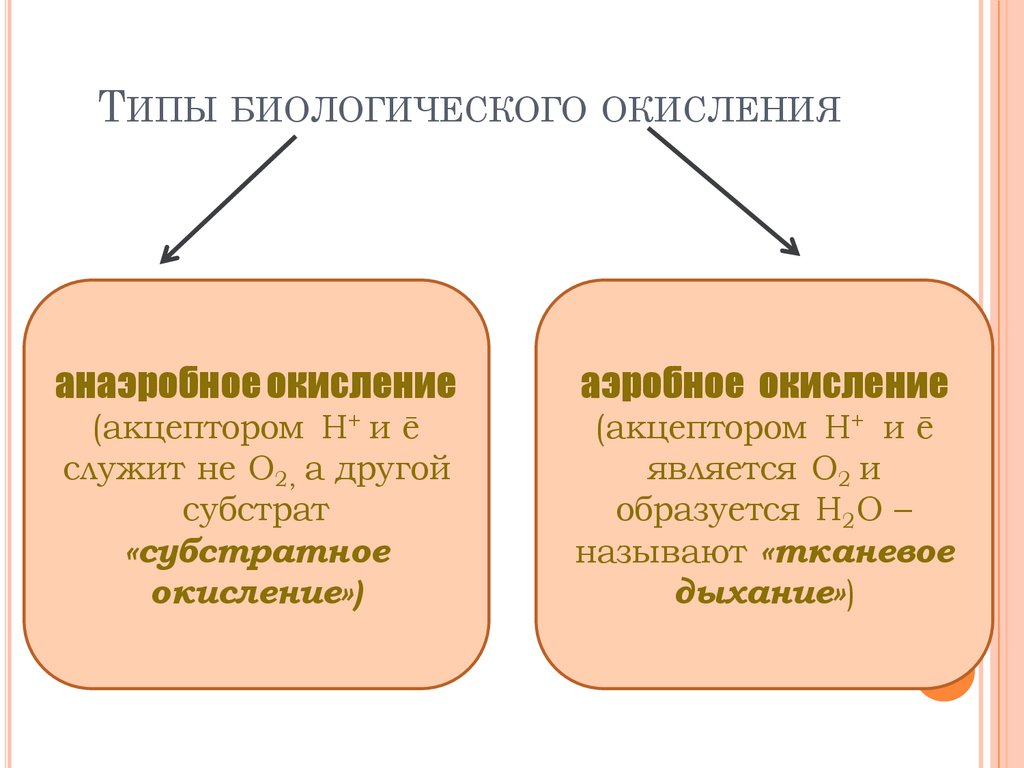
ТИПЫБИОЛОГИЧЕСКОГО ОКИСЛЕНИЯ
анаэробное окисление
аэробное окисление
(акцептором Н+ и ē
служит не О2, а другой
субстрат
«субстратное
окисление»)
(акцептором Н+ и ē
является О2 и
образуется Н2О –
называют «тканевое
дыхание»)
11.
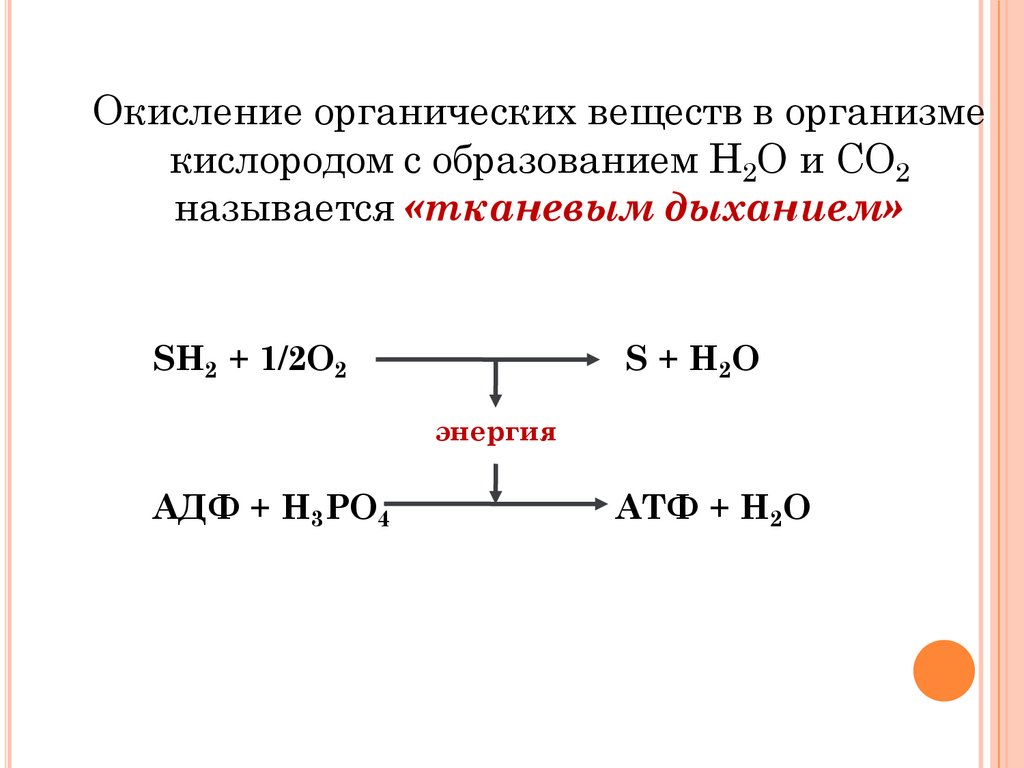
Окисление органических веществ в организмекислородом с образованием Н2О и СО2
называется «тканевым дыханием»
SH2 + 1/2O2
S + H2O
энергия
АДФ + H3PO4
АТФ + H2O
12.
Первыйэтап тканевого дыхания –
дегидрирование различных субстратов,
образующихся в реакциях катаболизма
Ферменты, отщепляющие водород от
субстратов (дегидрогеназы), находятся в
основном в матриксе митохондрий.
13.
В зависимости от строениякоферментов дегидрогеназы делятся на
две группы:
1. NAD – зависимые дегидрогеназы
2. FAD – зависимые дегидрогеназы
14.
В NAD – зависимыхдегидрогеназах NAD непрочно связан
с ферментом: в восстановленной форме
(NADH) он отделяется от апофермента
и служит донором водорода для
другого фермента
15.
В FAD – зависимых дегидрогеназахFAD ковалентно связан с апоферментом,
поэтому в реакциях, катализируемых
FAD – зависимыми дегидрогеназами,
участвует второй субстрат (акцептор
водорода). Для всех флавиновых
ферментов этим субстратом служит
убихинон (коэнзим Q).
16.
Перенос электронов на кислородпроисходит при участии системы
переносчиков локализованных во
внутренней мембране митохондрий и
образующих цепь переноса электронов
(ЦПЭ).
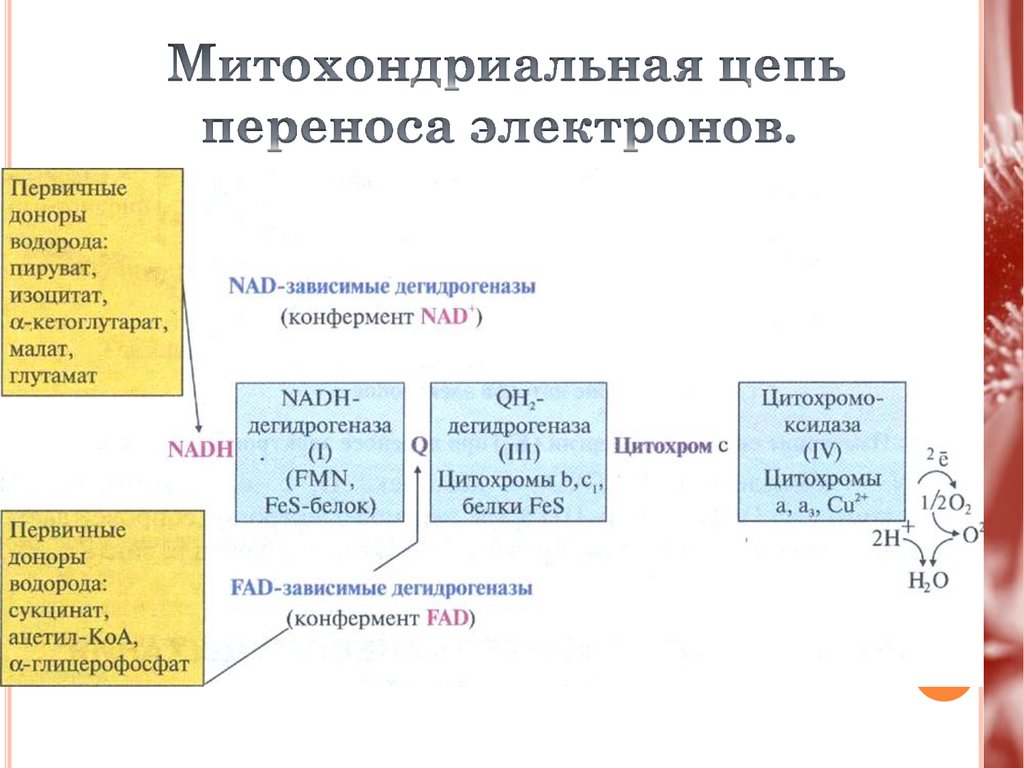
17.
NADH– дегидрогеназа (комплекс I)
сукцинатдегидрогеназа (комплекс II)
QH2 – дегидрогеназа (комплекс III)
цитохромоксидаза (комплекс IV)
низкомолекулярные переносчики
(кофермент Q и цитохром С)
18.
19.
1 комплекс имеет рабочее название НАДН-дегидрогеназа,содержит ФМН, 42 белковых молекулы, из них не менее 6
железосерных белков.
Функция
1.Принимает электроны от НАДН и передает их на коэнзим
Q (убихинон).
2.Переносит 4 иона Н+ на наружную поверхность
внутренней митохондриальной мембраны.
Железосерные белки (FeS-белки) – это белки содержащие
атомы железа, которые соединены с атомами серы и с серой
остатков цистеина. В результате образуется железо-серный
центр.
20.
2 комплекс. ФАД-зависимые дегидрогеназыДанный комплекс как таковой не существует, его
выделение условно. К нему относятся ФАД-зависимые
ферменты, расположенные на внутренней мембране –
например, ацил-SКоА-дегидрогеназа (βокисление жирных кислот), сукцинатдегидрогеназа (цикл
трикарбоновых кислот), митохондриальная глицерол-3фосфат-дегидрогеназа (челночный механизм переноса
атомов водорода).
Функция
Восстановление ФАД в окислительно-восстановительных
реакциях.
Обеспечение передачи электронов от ФАДН2 на
железосерные белки внутренней мембраны митохондрий.
Далее эти электроны попадают на коэнзим Q (убихинон).
21.
3 комплекс. КоQ-цитохром c-оксидоредуктазаПо другому данный комплекс
называется цитохром с редуктаза. В его составе
имеются
молекулы цитохрома b и цитохрома c1, железосерные белки. Комплекс представляет собой 2
мономера, в каждом из которых насчитывается 11
полипептидных цепей.
Функция
Принимает электроны от коэнзима Q и передает их
на цитохром с.
Переносит 2 иона Н+ на наружную поверхность
внутренней митохондриальной мембраны.
22.
4 комплекс. Цитохром с-кислородоксидоредуктазаВ этом комплексе находятся цитохромы а и а3, он
называется также цитохромоксидаза, состоит из 13
субъединиц. В комплексе имеются ионы меди,
соединенные с белками комплекса через HS-группы
цистеина, и формирующие центры, подобные тем,
что имеются в железо-серных белках.
Функция
Принимает электроны от цитохрома с и передает их
на кислород с образованием воды.
Переносит 4 иона Н+ на наружную поверхность
внутренней митохондриальной мембраны.
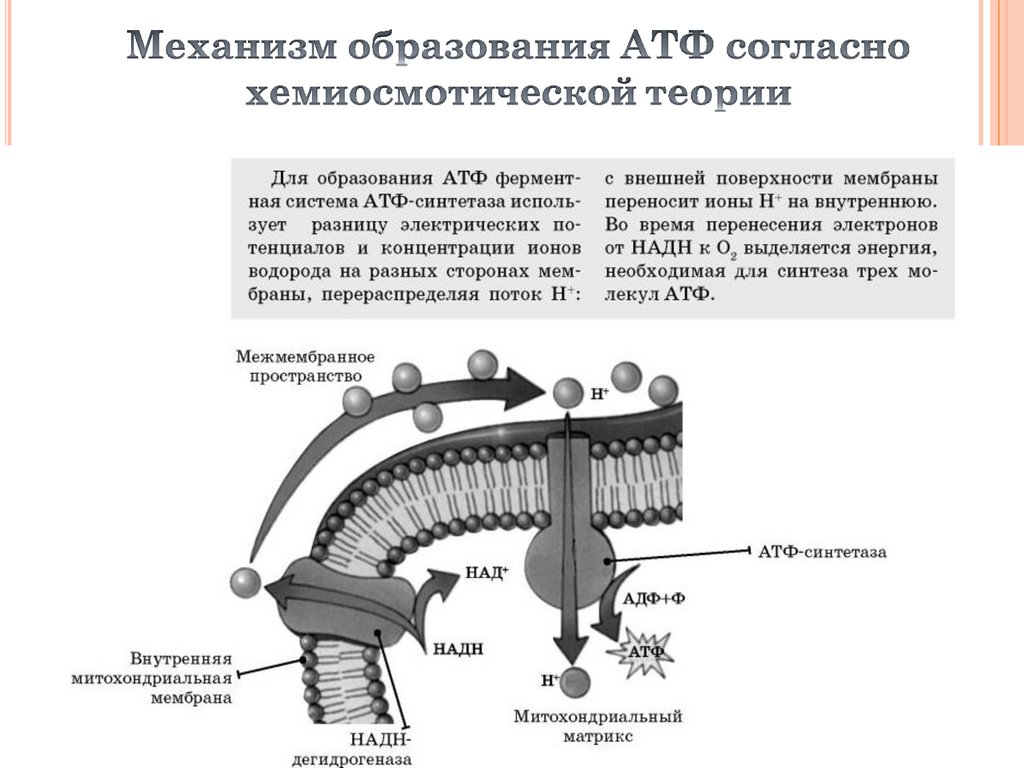
23.
Пятый комплекс – это фермент АТФ-синтаза, состоящийиз множества белковых цепей, подразделенных на две
большие группы:
одна группа формирует субъединицу FО (произносится со
звуком "о", а не "ноль" т.к олигомицин-чувствительная) –
ее функция каналообразующая, по ней выкачанные
наружу протоны водорода устремляются в матрикс.
другая группа образует субъединицу F1 – ее
функция каталитическая, именно она, используя энергию
протонов, синтезирует АТФ.
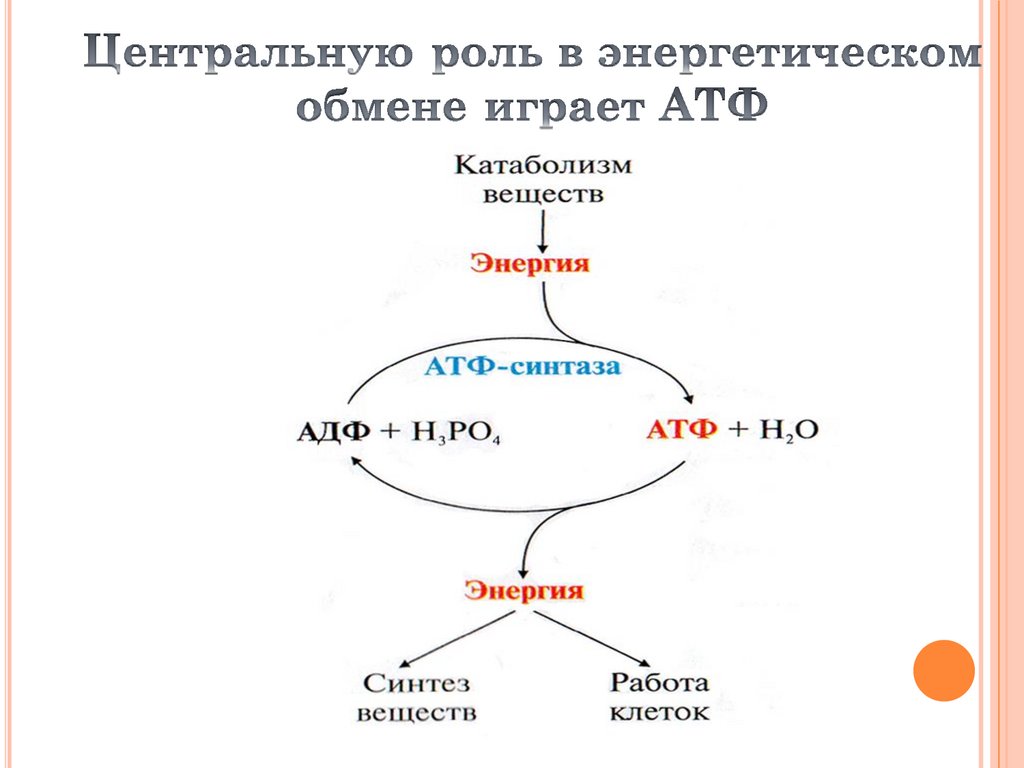
24.
Для синтеза 1 молекулы АТФ необходимопрохождение через АТФ-синтазу приблизительно 3х ионов Н+, и еще один ион H+ используется для
транспорта неорганического фосфата в матрикс
митохондрии и для антипорта АДФ (в
митохондрию) ↔ АТФ (в цитозоль).
Таким образом, для получения одной молекулы
АТФ из АДФ требуется 4 иона Н+.
Поскольку при прохождении одной пары
электронов по всей дыхательной цепи
выкачивается 10 ионов Н+, то окисление одного
моля НАДН+Н+ приведет к образованию 2,5 молей
АТФ.
25.
Все компоненты ЦПЭ расположены вмитохондриальной мембране в порядке
возрастания редокс потенциалов: самый
высокий редокс потенциал у кислорода.
Это обеспечивает последовательное
перемещение электронов от
дегидрируемых субстратов на кислород,
сопровождающееся освобождением части
свободной энергии электронов.
26.
27.
За сутки в организме образуется ираспадается около 60 кг АТФ. Однако в
клетке АТФ не накапливается, а
расходуется в течении 1 минуты, после
образования, что требует ее
непрерывно пополнения (АТФ – АДФ
цикл)
28.
В зависимости от источника Е(энергии), обеспечивающего
присоединение Фн выделяют
два типа фосфорилирования АДФ
29.
Субстратное фосфорилирование АДФS-O~PO3H2
киназа
АДФ
S-OH
АТФ
происходит за счет энергии
макроэргических связей некоторых
соединений (1,3-бисфосфоглицерат, ФЕП,
сукцинил-КоА, креатинфосфат)
30.
Особенности субстратногофосфорилирования
процесс может идти в матриксе митохондрий и в
цитоплазме;
✓ не зависит от присутствия О2;
✓ используется
реже,
чем
окислительное
фосфорилирование.
✓
31.
Синтез АТФ из АДФ и Н3РО4 за счетэнергии выделяющейся при тканевом
дыхании, называется окислительным
фосфорилированием.
32.
Окислительное фосфорилирование АДФПревращение АДФ в АТФ происходит с
использованием энергии переноса
электронов от органических веществ к О2
Особенности:
энергию дают ОВ реакции;
происходит в аэробных условиях;
участвуют ферменты ЦПЭ и АТФ-синтетаза;
протекает в митохондриях;
основной механизм синтеза АТФ в организме
33.
34.
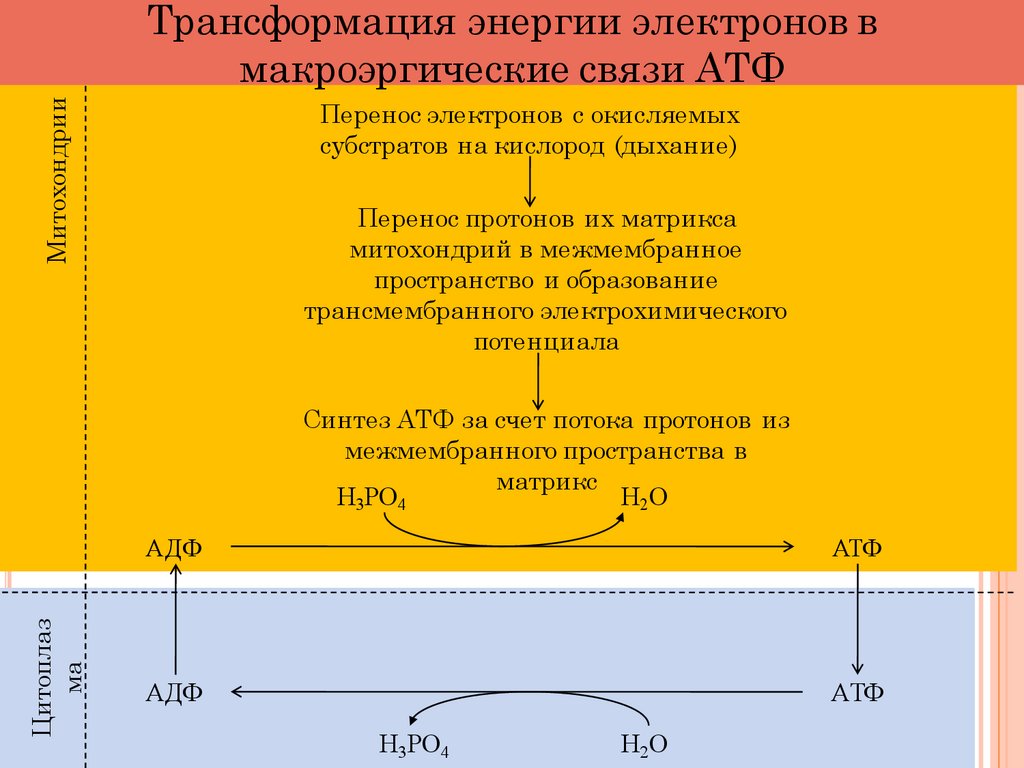
МитохондрииТрансформация энергии электронов в
макроэргические связи АТФ
Перенос электронов с окисляемых
субстратов на кислород (дыхание)
Перенос протонов их матрикса
митохондрий в межмембранное
пространство и образование
трансмембранного электрохимического
потенциала
Цитоплаз
ма
Синтез АТФ за счет потока протонов из
межмембранного пространства в
матрикс
Н3РО4
Н2О
AДФ
ATФ
AДФ
AТФ
Н3РО4
Н2О
35.
Энергия химических связей субстратовЭнергия электронов в составе коферментов NADH и FADH
Энергия электронов, переносимых по ЦПЭ на кислород
Энергия трансмембранного электрохимического потенциала
Энергия химических связей АТФ
36.
Показывает, какое количествонеорганического фосфата затрачивается для
фосфорилирования АДФ при использовании 1
атома кислорода на образование 1 молекулы
воды. Коэффициент окислительного
фосфорилирования численно равен
количеству молей АТФ, синтезированных в
результате окислительной реакции.
37.
НАД-Н+ + ½О23АДФ + 3Н3РО4
ФАДН2 + ½О2
2АДФ + Н3РО4
НАД+ + Н2О
3АТФ + Н2О
ФАД + Н2О
2АТФ + 2Н2О
Р/О = 3
Р/О = 2
38.
В норме скорость окисления первичных доноровпротонов (Н+) и электронов (ē) регулируется
содержанием АДФ. Выполнение клеткой работы с
затратой АТФ приводит к накоплению АДФ, это
активирует окисление субстратов (SH2) и
поглощение кислорода митохондриями клетки.
Таким образом клетки реагируют на интенсивность
метаболизма поддерживают соотношение АТФ/АДФ
на необходимом уровне. Зависимость интенсивности
поглощения кислорода от концентрации АДФ
называется дыхательным контролем.
39.
1.2.
3.
4.
Недостаток субстрата (голодание,
пищеварение, межуточное нарушение
обменов белков, углеводов, липидов)
Недостаток О2 (сердечно-сосудистые
заболевания, кровь, легкие)
Недостаточная активность ферментов
дыхательной цепи (генетические дефекты
апоферментов, синтеза кофакторов,
недостаток железа, гиповитаминоз)
Ингибиторы дыхания
40.
Ингибиторы ферментов ЦПЭ подавляютактивность ферментных комплексов I, III, и IV.
Скорость восстановления коферментов NAD+ и FAD+
при этом снижается, что уменьшает скорость
окислительных процессов, потребления кислорода и
коэффициент Р/О:
➢ ингибиторы NADH-дегидрогеназы – лекарственные
препараты со снотворным действием – барбитураты
(веронал, гексенал, нембутал, амитал); ротенон;
➢ ингибиторы QH2-дегидрогеназы – антимицин А;
➢ ингибиторы цитохром-с-оксидазы – цианиды (СN-),
угарный газ (СО), сероводород (Н2S)
Ингибиторы АТФ-синтазы снижают активность
фермента, скорость фосфорилирования АДФ и
коэффициент Р/О – олигомицин.
41.
Разобщители окисления и фосфорилирования– липофильные протонофоры способны легко проникать
через липидный бислой и переносить протоны через
внутреннюю мембрану митохондрии в матрикс, минуя
АТФ-синтазу. Скорость образования метаболической
воды и дыхания не изменяется или даже возрастает, но
сопряжение окисления и фосфорилирования АДФ при
этом ослабевает, Р/О снижается. Энергия окисления
рассеивается в виде тепла, что приводит к повышению
температуры тела человека (пирогенное действие).
Экзогенные разобщители – 2,4-динитрофенол,
дикумарол, стрептомицин;
Эндогенные разобщители – жирные кислоты, гормоны
щитовидной железы (тироксин), желчный пигмент
билирубин, белок термогенин.
42.
НАДФАД
барбамил
ротенон
Q
в
с
а/а1
цианиды
Актиномицин А
Пирицидил
в жкт НСl + KCN
О2
H+
KCl + HCN
CN-
связывает Fe2+
Актиномицин А – противонрибковый антибиотик
Пирицидин – антибиотик
Барбамил – (снотворное, успокаивающее,
противосудорожное)
43.
При этом тканевое дыхание усиливается, ноидет рассеивание энергии в виде тепа – свободное
окисление.
Набухание митохондрий
Тиреотоксикоз
Жирные кислоты с длинной углеродной цепью
Нитрофенол
Антикоагулянты производные дикумарина
Ионофоры (некоторые антибиотики)
Ингибиторы
44.
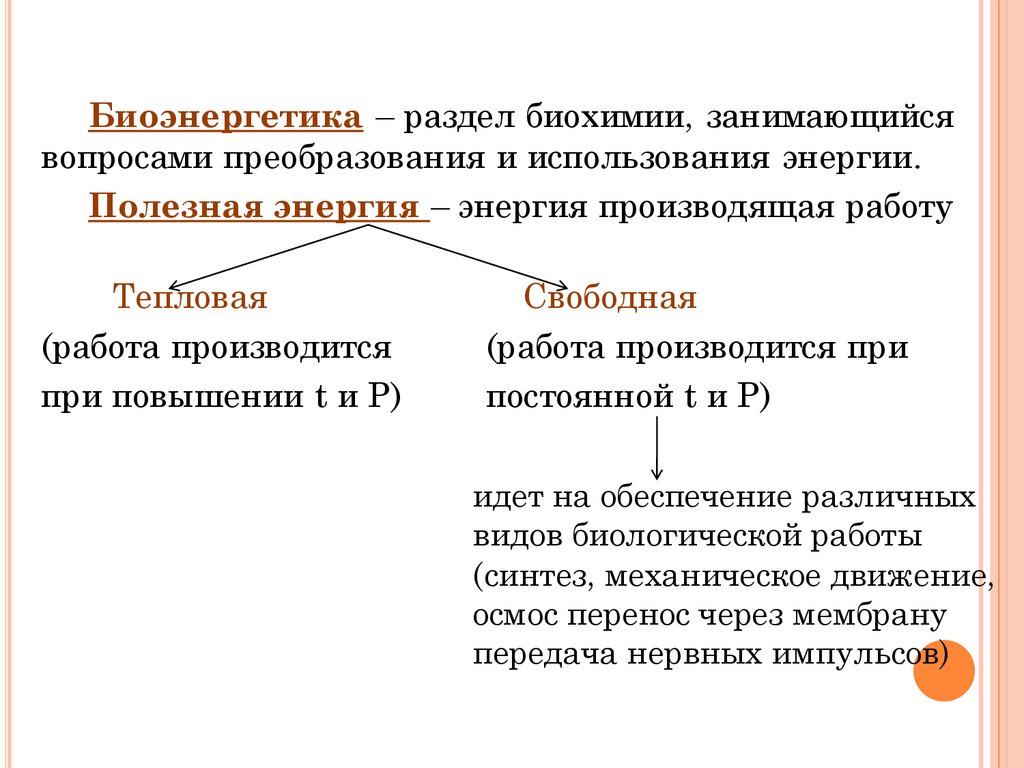
Биоэнергетика – раздел биохимии, занимающийсявопросами преобразования и использования энергии.
Полезная энергия – энергия производящая работу
Тепловая
(работа производится
при повышении t и Р)
Свободная
(работа производится при
постоянной t и Р)
идет на обеспечение различных
видов биологической работы
(синтез, механическое движение,
осмос перенос через мембрану
передача нервных импульсов)




































 biology
biology








