Similar presentations:
Водородная и ковалентные связи
1.
ВОДОРОДНАЯ И КОВАЛЕНТНЫЕСВЯЗИ
2.
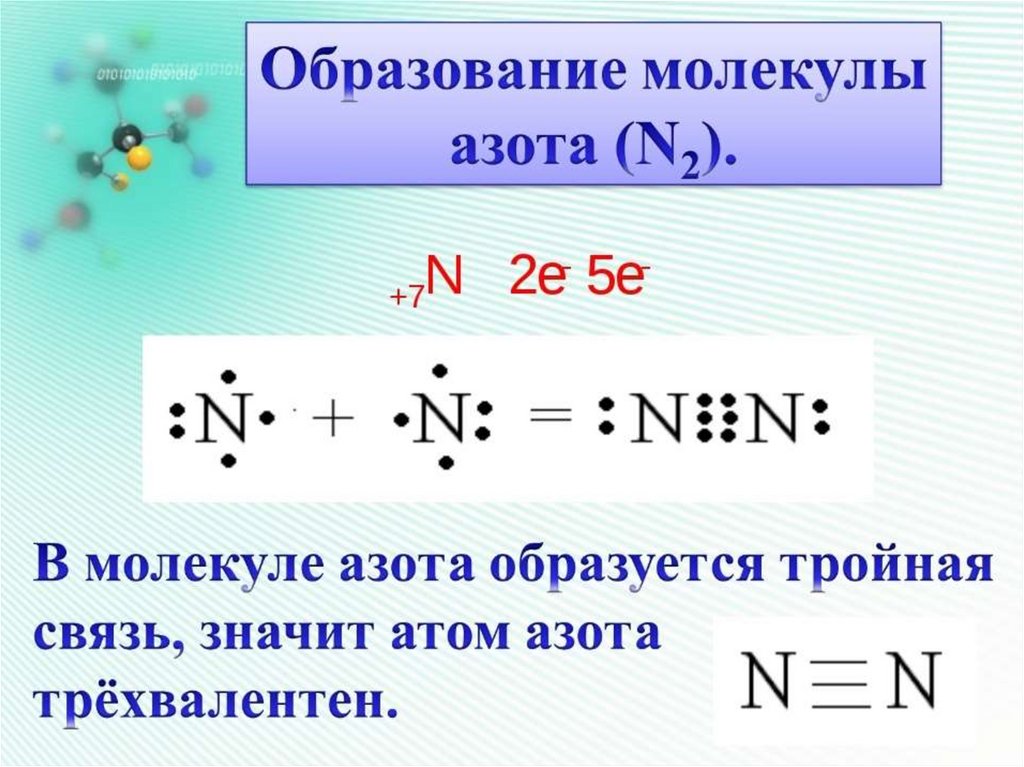
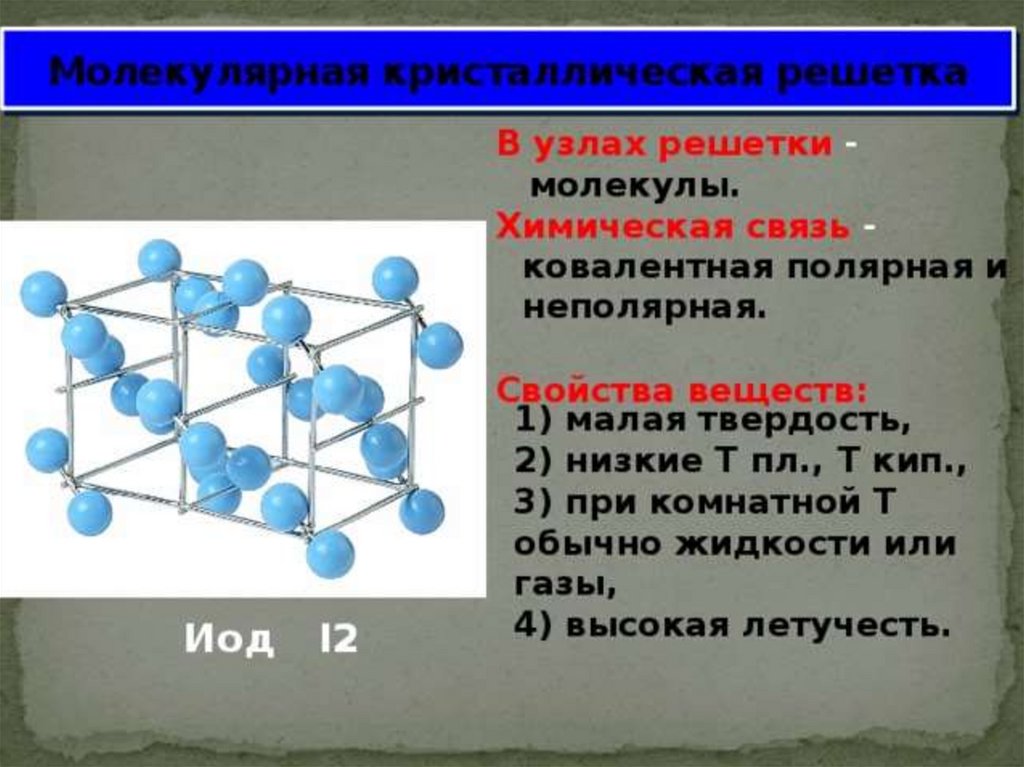
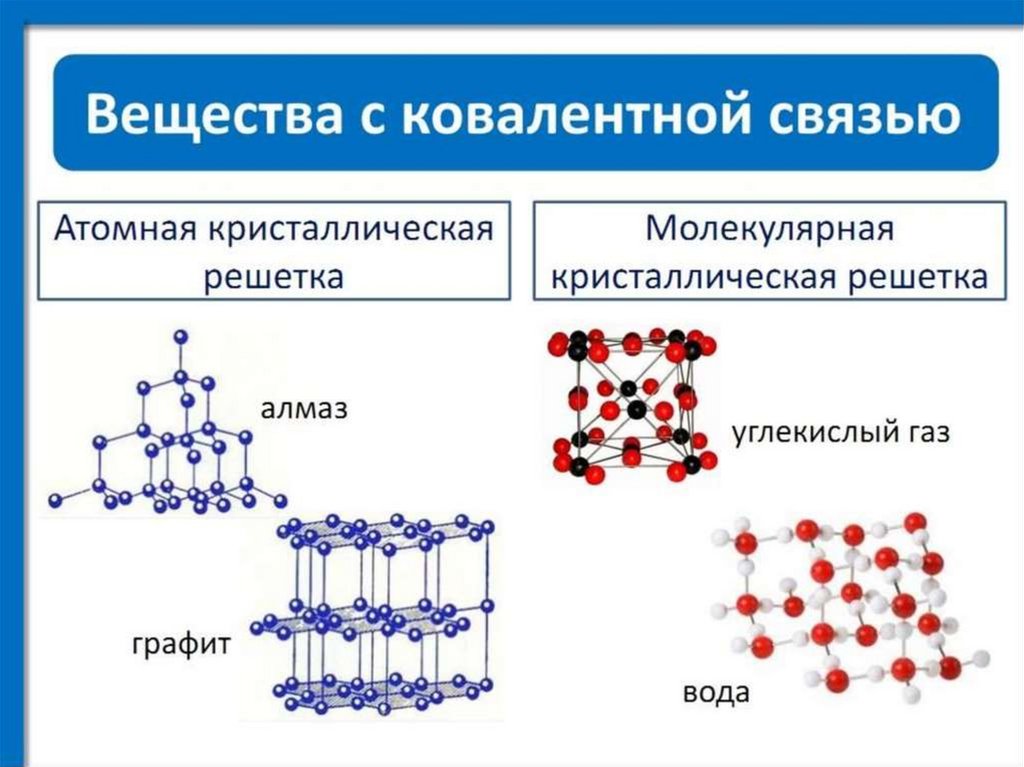
Ковалентная связьСвязь между атомами за счет образования
общих электронных пар.
Теорию ковалентной связи в 1916 г.
предложил американский химик Гилберт
Льюис. Он объяснил, как возникает
химическая связь в двухатомных
молекулах водорода Н2, азота N2,
кислорода O2, галогенов (F2, Сl2, Вг2, I2).
3.
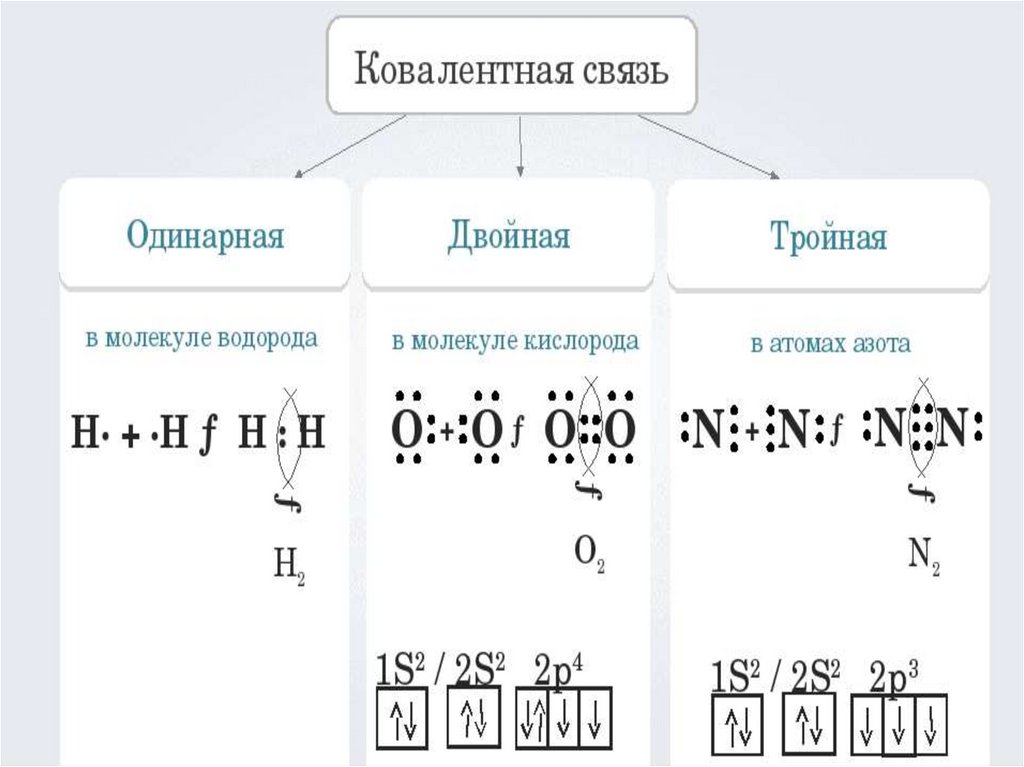
Образование s-связиАтом водорода на единственной s-
орбитали содержит один электрон. Два
атома объединяют непарные электроны в
общую пару. Следовательно, у атомов
водорода в распоряжении уже два
электрона, т. е. их электронная оболочка
завершена до устойчивой
двухэлектронной оболочки благородного
газа гелия.
4.
Место взаимопроникновения орбиталей называетсяэлектронной плотностью. Это область пространства,
где сосредоточен повышенный отрицательный заряд.
В структурных формулах общая электронная пара
обозначается чёрточкой.
5.
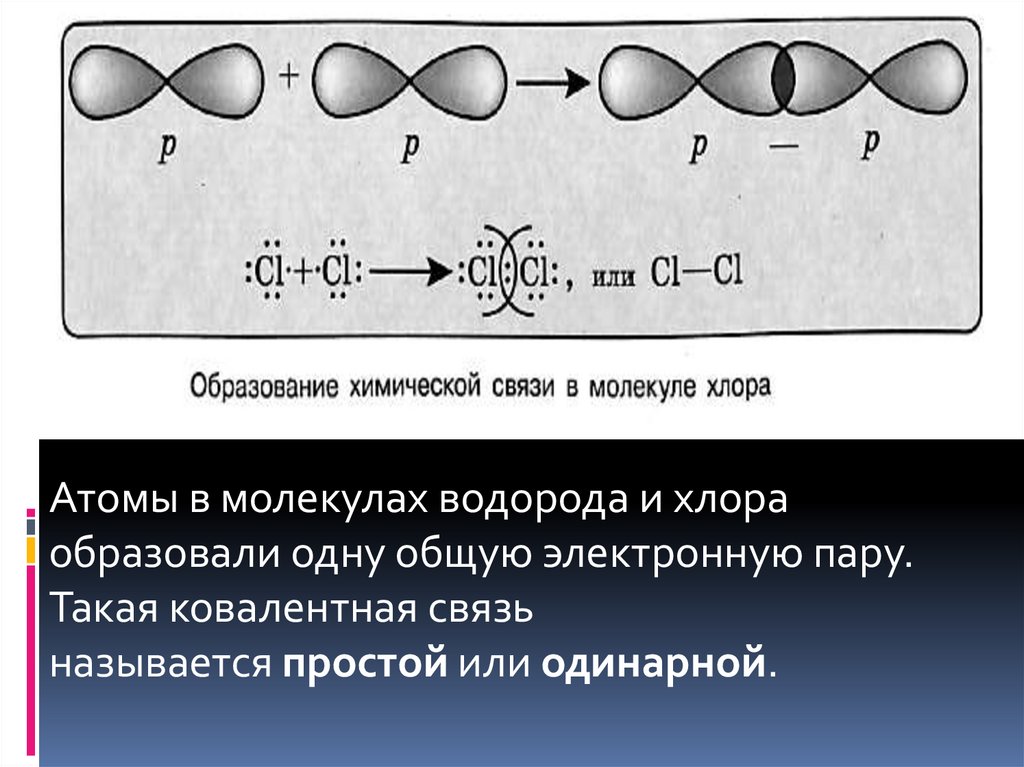
Образование р-связиАтомы хлора в основном состоянии
содержат неспаренный электрон не на s-, а
на р-орбитали. В молекуле хлора
Сl2 образование химической связи, т. е.
общей электронной пары, происходит за
счёт перекрывания р-орбиталей.
6.
Атомы в молекулах водорода и хлораобразовали одну общую электронную пару.
Такая ковалентная связь
называется простой или одинарной.
7.
8.
9.
10.
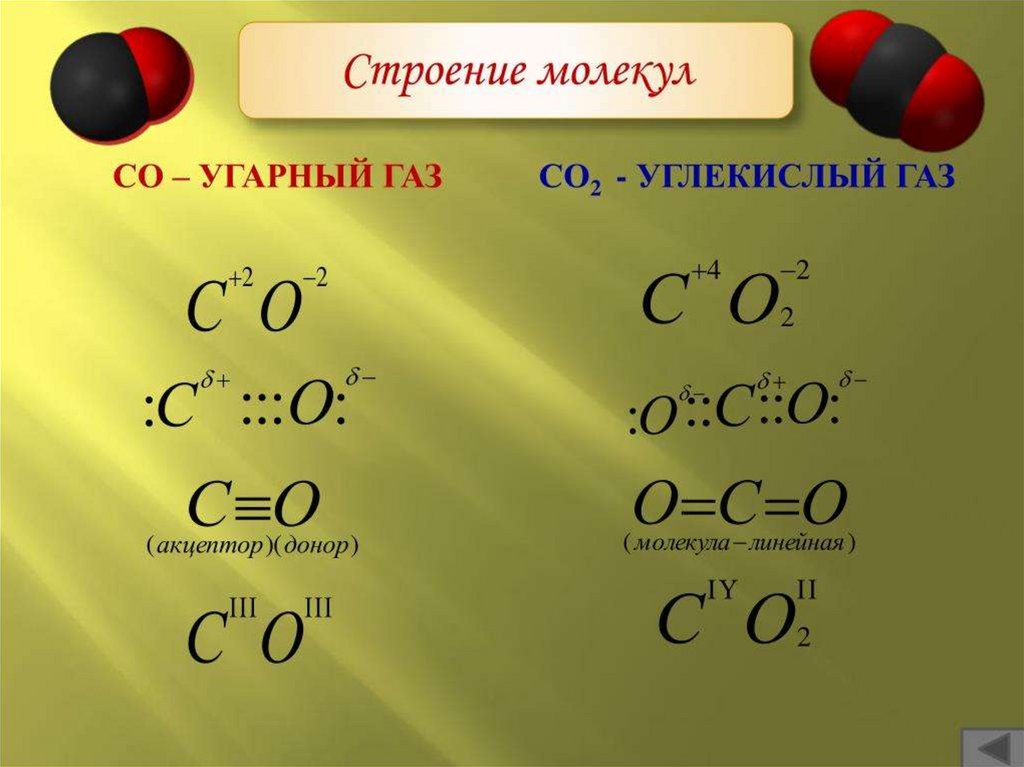
Ковалентная неполярная связьЭто связь между атомами одного элемента
(характерна для элементов неметаллов)
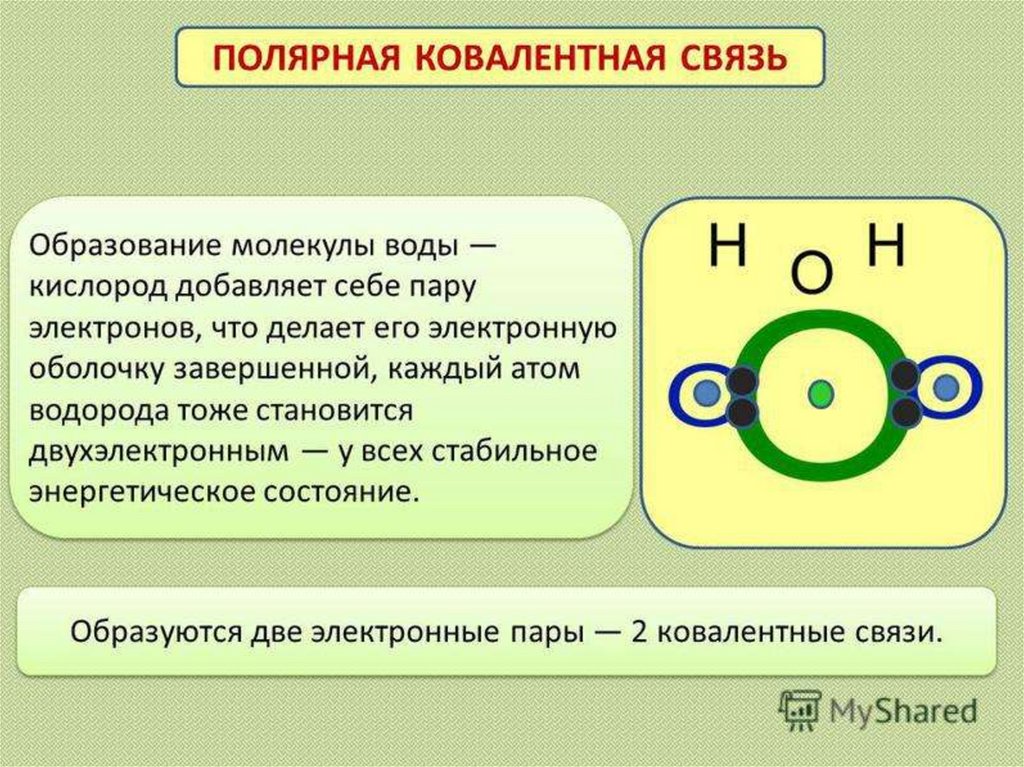
Ковалентная полярная связь
Это связь образованная атомами с разной
электроотрицательностью
11.
Способность атомов оттягивать к себеобщие электронные пары называется
электроотрицательностью
12.
13.
14.
15.
16.
17.
18.
19.
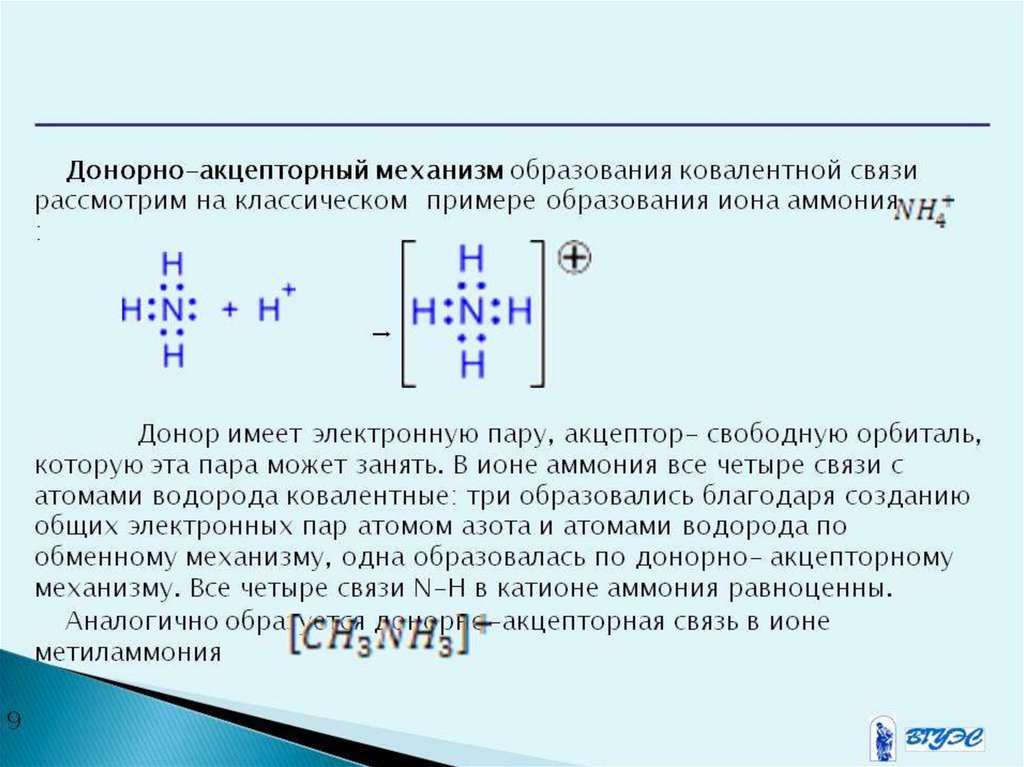
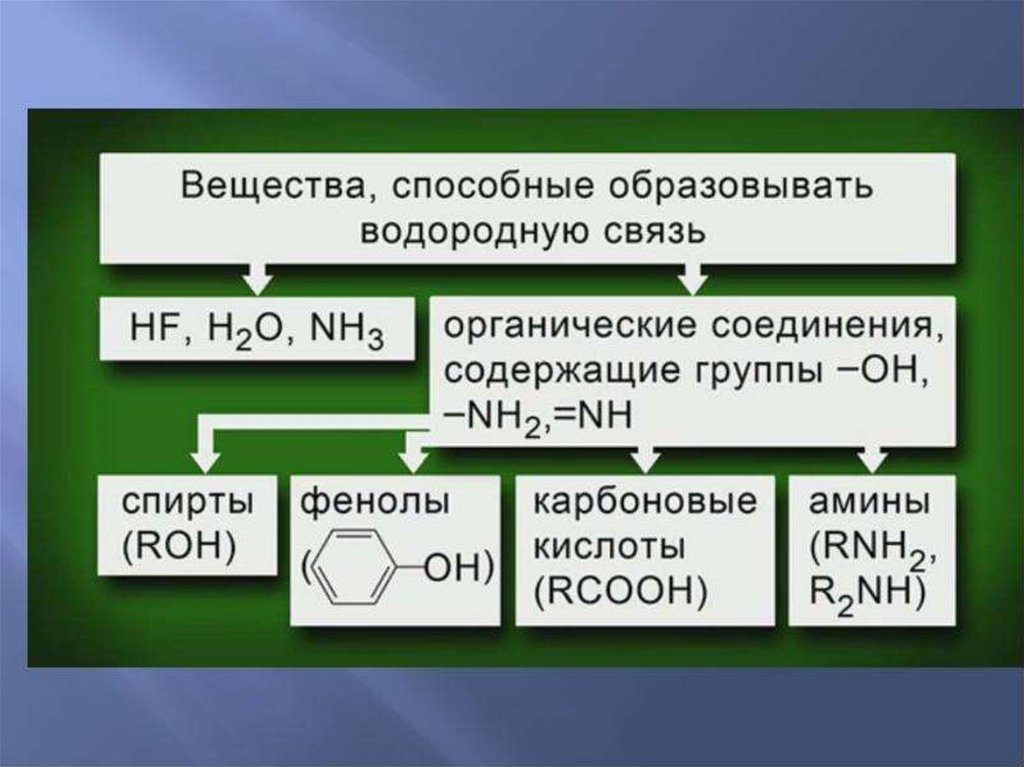
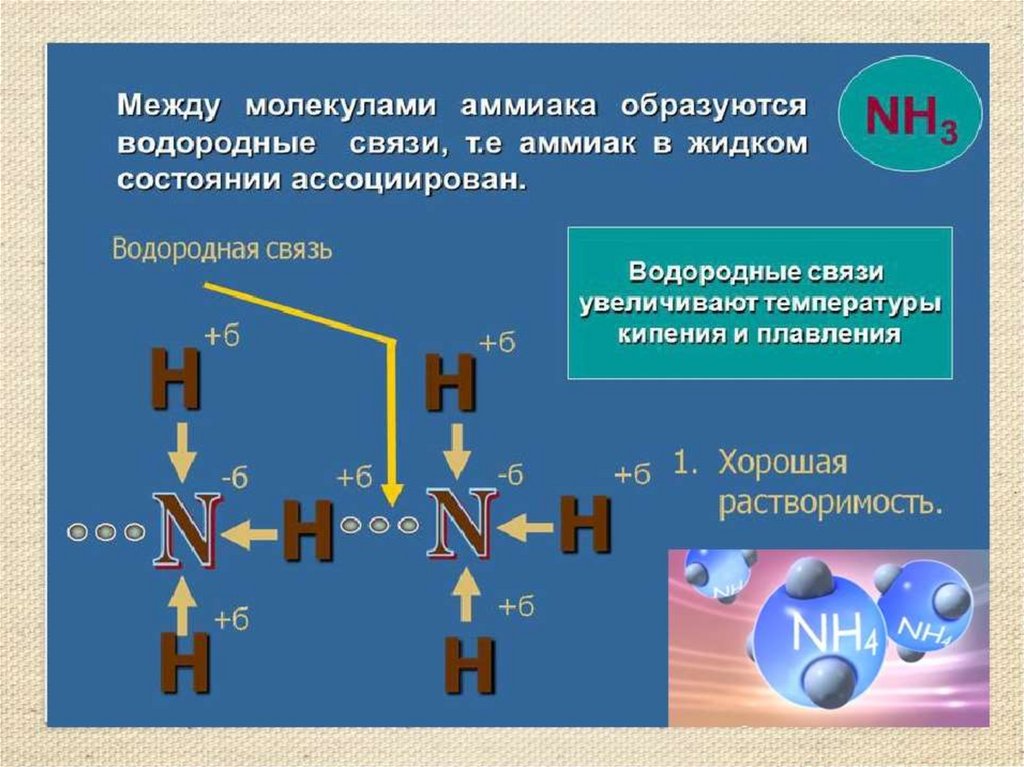
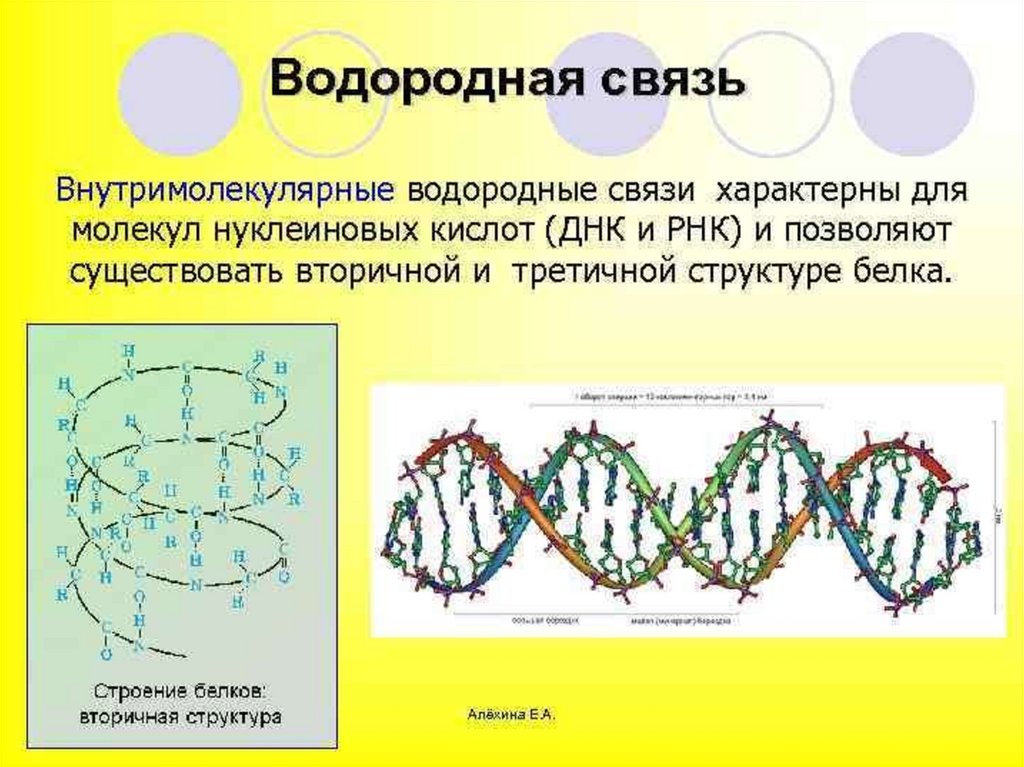
Водородная связьОбразуется между атомами водорода
связанными ковалентной связью с
электроотрицательным атомом одной
молекулы и атомами фтора, кислорода,
азота другой молекулы имеющими
неподеленные электронные пары















 chemistry
chemistry








