Similar presentations:
Химическое равновесие и способы его смещения. Необратимые реакции. Часть 1
1.
ХИМИЧЕСКОЕРАВНОВЕСИЕ
и способы его смещения
Часть 1.
Соболева Нина Олеговна
учитель химии ГБОУ школы № 242
Санкт-Петербурга
2.
Химическое равновесие• Состояние равновесия характерно для
обратимых химических реакций.
• Обратимая реакция - химическая
реакция, которая при одних и тех же
условиях может идти в двух
противоположных направлениях.
• Необратимой называется реакция,
которая идет практически до конца в
одном направлении.
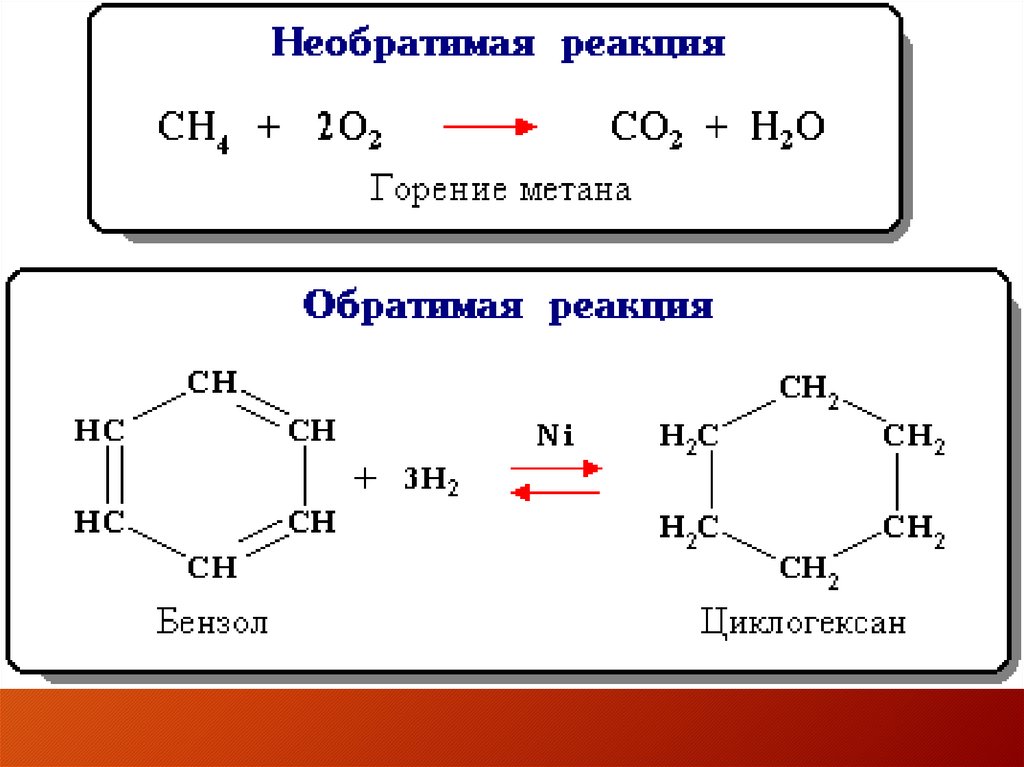
3.
Необратимые реакции• Рекции обмена идут до конца если:
• 1.образуется газ
• 2. выпадает осадок
• 3. образуются соль и вода
4.
5.
• Во всех обратимых реакциях скорость прямойреакции уменьшается, скорость обратной
реакции возрастает до тех пор, пока обе
скорости не станут равными и не установится
состояние равновесия.
6.
Химическое равновесие - состояниесистемы, в котором скорость прямой
реакции равна скорости обратной реакции.
7.
• Концентрации всех веществ в состоянииравновесия (равновесные концентрации)
постоянны.
• Химическое равновесие имеет динамический
характер. Это значит, что и прямая и обратная
реакции в состоянии химического равновесия
не прекращаются.
8.
• Смещение равновесия в нужном направлениидостигается изменением условий реакции
• Принцип Ле-Шателье -Если на систему,находящуюся в
состоянии равновесия, оказать внешнее воздействие, то
в системе будет протекать преимущественно тот
процесс, который данное воздействие уменьшает.







 chemistry
chemistry








