Similar presentations:
Химическое равновесие и способы его смещения
1. Практическая работа № 7 Химическое равновесие и способы его смещения Раздел 1. неорганическая химия
ПРАКТИЧЕСКАЯ РАБОТА № 7ХИМИЧЕСКОЕ РАВНОВЕСИЕ И
СПОСОБЫ ЕГО СМЕЩЕНИЯ
РАЗДЕЛ 1. НЕОРГАНИЧЕСКАЯ ХИМИЯ
2. Цель: Цель: Рассмотреть реакцию химического равновесия и исследовать влияние влияния концентрации(С) веществ на смещение
ЦЕЛЬ:Цель: Рассмотреть реакцию химического равновесия и
исследовать влияние влияния концентрации(С)
веществ на смещение химического равновесия,
Задача:
Закрепить знания по теме «Химическое равновесие». .
Реактивы и оборудование:
Растворы солей: FeCl3(p-р.) , NH4NCS(p-р.) Fe(NCS)3(p-р.),
NH4Cl(p-р.) штатив с пробирками
5/17/2016
adasdfsdzfvzx
2
3. Техника безопасности на уроках
ТЕХНИКА БЕЗОПАСНОСТИНА УРОКАХ
4. Общие положения. Организация рабочего места 1. Прочитайте внимательно задание по практической работе. 2. Строго выполняйте
ОБЩИЕ ПОЛОЖЕНИЯ. ОРГАНИЗАЦИЯ РАБОЧЕГО МЕСТА1. Прочитайте внимательно задание по практической
работе.
2. Строго выполняйте указанные учителем меры
предосторожности, иначе может произойти несчастный
случай.
3. Не загромождайте своё рабочее место предметами,
которые не потребуются для выполнения практической
работы.
5. Закончив работу, приведите рабочее место в порядок и
вымойте руки.
5. Основные теоретические сведения
ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ• Все самопроизвольно протекающие реакции можно разделить на две
группы: обратимые и необратимые.
• Необратимые реакции проходят только в одном направлении - до конца, т.е.
до полного превращения одного или всех исходных веществ в продукты
реакции. Пример:
• 2KClO3 = 2KCl + 3O2.
Обратимые реакции идут в противоположных направлениях, не
проходят до конца, исходные вещества полностью не расходуются. Пример:
• H2 + I2 = 2HI.
В ходе обратимых реакций наступает состояние химического
равновесия.
5/17/2016
adasdfsdzfvzx
5
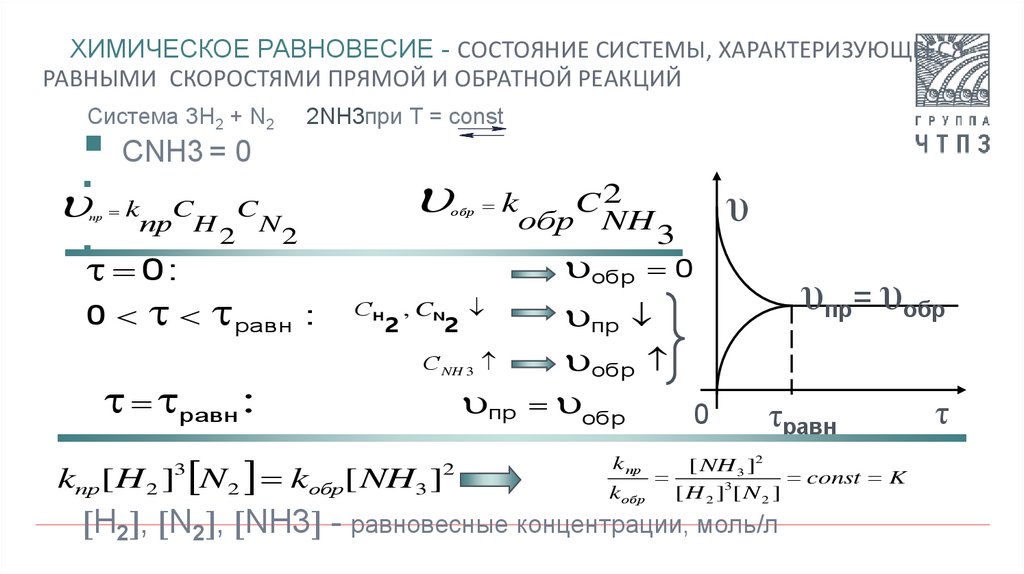
6. Химическое равновесие - состояние системы, характеризующееся равными скоростями прямой и обратной реакций
ХИМИЧЕСКОЕ РАВНОВЕСИЕ - СОСТОЯНИЕ СИСТЕМЫ, ХАРАКТЕРИЗУЮЩЕЕСЯРАВНЫМИ СКОРОСТЯМИ ПРЯМОЙ И ОБРАТНОЙ РЕАКЦИЙ
Система 3H2 + N2
2NH3при Т = const
СNH3 = 0
пр
k
C
C
пр H
N
2
2
обр
k
C2
обр NH
0:
0
равн :
равн :
СH , CN
2
2
С NH 3
пр
kпр [ H 2 ] N 2 kобр[ NH3 ]
3
2
3
обр 0
пр
обр
обр
0
k пр
k обр
υ
υпр= υобр
τравн
[ NH 3 ]2
const K
[ H 2 ]3 [ N 2 ]
H2 , N2 , NH3 - равновесные концентрации, моль/л
τ
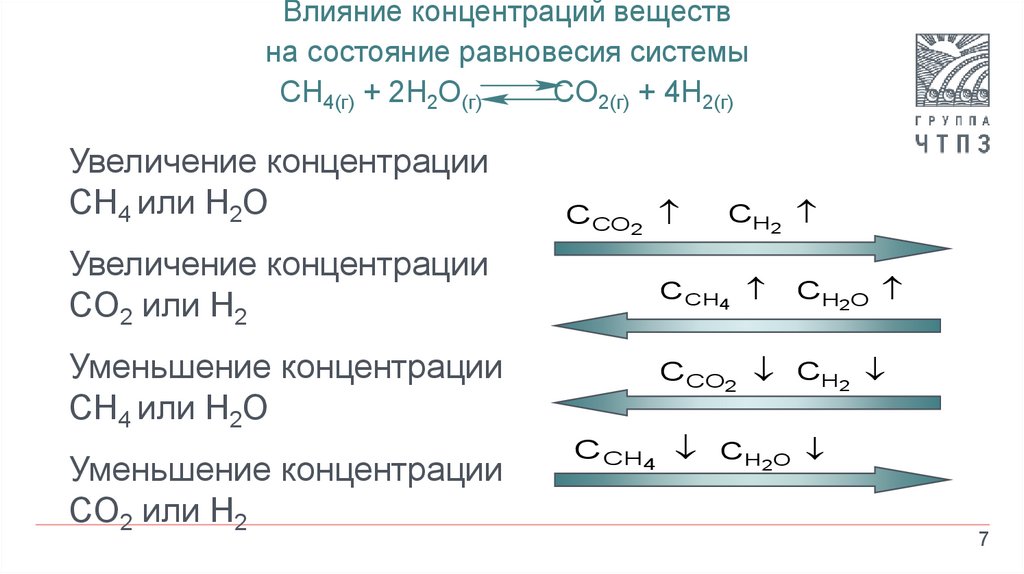
7.
Влияние концентраций веществна состояние равновесия системы
CH4(г) + 2H2O(г)
CO2(г) + 4H2(г)
Увеличение концентрации
CH4 или H2O
Увеличение концентрации
CO2 или H2
Уменьшение концентрации
CH4 или H2O
Уменьшение концентрации
CO2 или H2
C CO2
CH2
C CH4
C H2 O
C CO2 CH2
C CH4 CH2O
7
8. Влияние общего давления в системе
ВЛИЯНИЕ ОБЩЕГО ДАВЛЕНИЯ В СИСТЕМЕДавление оказывает влияние на равновесие реакций,
сопровождающихся изменением количеств газообразных веществ
увеличение общего
давления
смещение равновесия в
сторону уменьшения
количества газообразных
веществ
CH4(г) + 2H2O(г)
p :
3 моль
понижение общего
давления
смещение равновесия в
сторону увеличения
количества газообразных
веществ
CO2(г ) + 4H2(г)
p :
5 моль
8
9. Влияние температуры на состояние равновесия
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СОСТОЯНИЕРАВНОВЕСИЯ
Нагревание
смещение равновесия в сторону
эндотермических реакций
CH4(г) + 2H2O(г)
Охлаждение
смещение равновесия в
сторону экзотермических
реакций
CO2(г) + 4H2(г), H>0
прямая реакция эндотермическая
обратная реакция экзотермическая
нагревание
охлаждение
9
10. Выполнение практической работы
ВЫПОЛНЕНИЕ ПРАКТИЧЕСКОЙ РАБОТЫЗАДАНИЕ
Для обратимой реакции определить направление смещения равновесия
при изменении концентрации веществ и проверить согласование с принципом
Ле Шателье.
Реакция
FeCl3(p.) + 3NH4NCS(p.)
желтый бесцветный
Fe(NCS)3(p.) + 3NH4Cl(p.)
красный
бесцветный
является обратимой. Наиболее интенсивно окрашенное соединение в системе –
Fe(NCS)3 – тиоцианат железа (III). По изменению интенсивности окраски
раствора вследствие внешних воздействий можно судить об увеличении или
уменьшении концентрации Fe(NCS)3 и, следовательно, о направлении
смещения равновесия.
10
11.
ХОД ОПЫТАСтакан вместимостью 100 мл наполовину заполните дистиллированной
водой, добавьте по 1–2 капли растворов FeCl3 и NH4NCS, полученный
раствор перемешайте до однородной окраски и разлейте в четыре пробирки.
Прибавьте:
в первую пробирку 1–2 капли раствора FeCl3;
во вторую пробирку 1–2 капли раствора NH4NCS;
в третью пробирку – микрошпатель кристаллического NH4Cl.
Четвертую пробирку оставьте в качестве эталона окраски раствора в состоянии начального
равновесия.
11
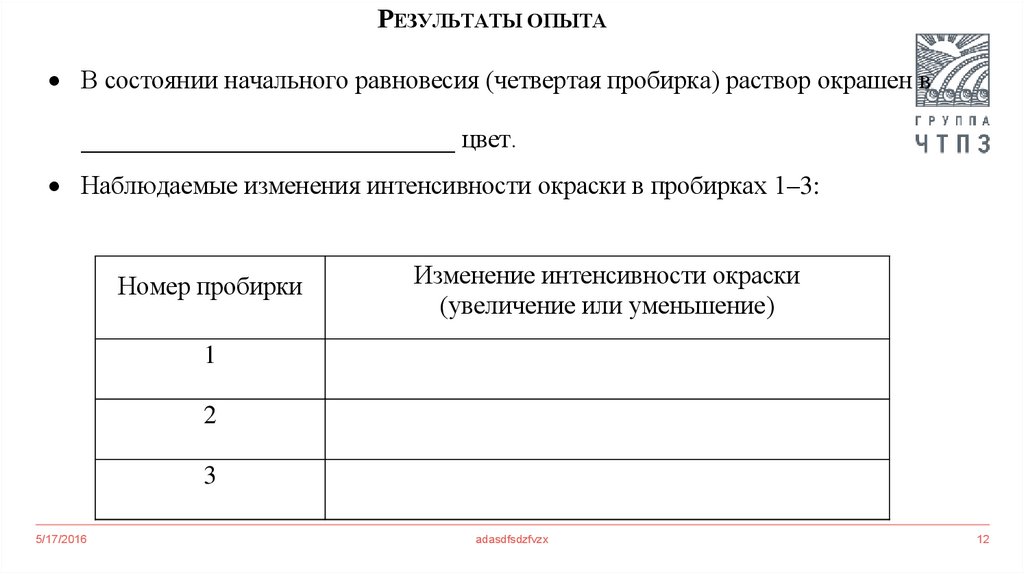
12.
РЕЗУЛЬТАТЫ ОПЫТАВ состоянии начального равновесия (четвертая пробирка) раствор окрашен в
_____________________________ цвет.
Наблюдаемые изменения интенсивности окраски в пробирках 1–3:
Номер пробирки
Изменение интенсивности окраски
(увеличение или уменьшение)
1
2
3
5/17/2016
adasdfsdzfvzx
12
13.
ОБРАБОТКА РЕЗУЛЬТАТОВВ изучаемой реакции
____________________________________________________________________
(уравнение)
в равновесии находятся:
____________________________________________________________________
(формулы и названия веществ)
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Выражение константы равновесия:
____________________________________________________________________,
где [FeCl3], [NH4NCS], [Fe(NCS)3], [NH4Cl] – ______________________________
5/17/2016
adasdfsdzfvzx
____________________________________________________________________
13
14.
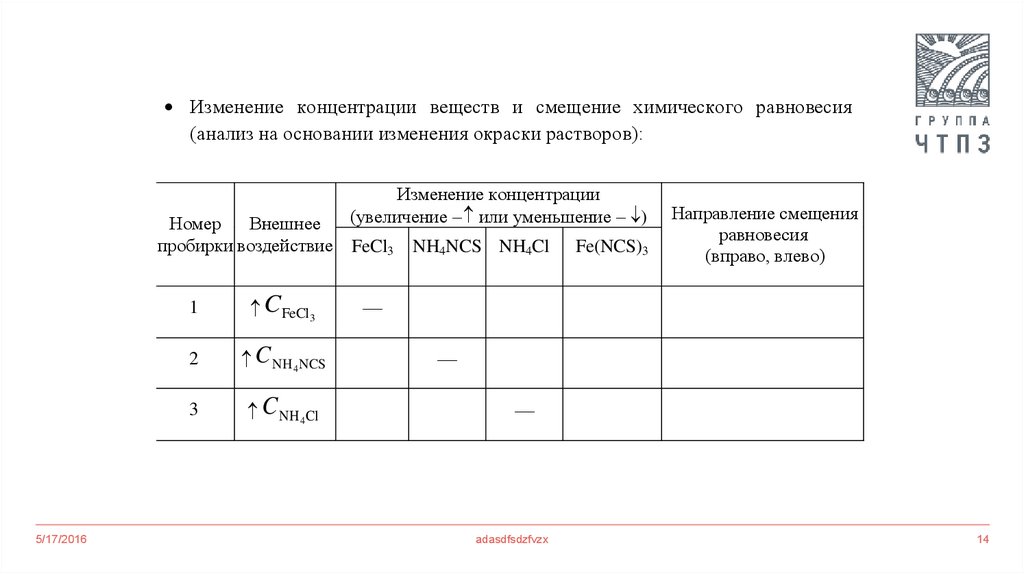
Изменение концентрации веществ и смещение химического равновесия(анализ на основании изменения окраски растворов):
Изменение концентрации
(увеличение – или уменьшение – )
Номер
Внешнее
пробирки воздействие FeCl3
5/17/2016
1
CFeCl3
2
C NH4 NCS
3
C NH 4Cl
NH4NCS NH4Cl
Fe(NCS)3
Направление смещения
равновесия
(вправо, влево)
adasdfsdzfvzx
14
15.
ВЫВОДПри увеличении концентрации исходных веществ равновесие системы
смещается в сторону ____________________________ реакции, при увеличении
(прямой, обратной)
концентрации продукта реакции – в сторону ______________________ реакции,
(прямой, обратной)
что
с принципом Ле Шателье.
(согласуется, не согласуется)
5/17/2016
adasdfsdzfvzx
15
16. В отчёте по практической работе должно быть записано:
В ОТЧЁТЕ ПО ПРАКТИЧЕСКОЙРАБОТЕ ДОЛЖНО БЫТЬ ЗАПИСАНО:
• 1.Название работы
• 2.Цель работы
• 3.Оборудование
• 4. Выполнение практической работы (оформление таблицы)
• 5.Вывод по практической работе
5/17/2016
adasdfsdzfvzx
16
17. Благодарим за внимание!
БЛАГОДАРИМ ЗАВНИМАНИЕ!













 chemistry
chemistry








