Similar presentations:
Обратимость химических реакций. Химическое равновесие и способы его смещения
1.
Обратимость химическихреакций
Химическое равновесие и способы его
смещения
2.
Обратимые инеобратимые реакции
Необратимыми называют химические реакции,
в результате которых исходные вещества
практически полностью превращаются в
конечные продукты
AlCl3 3NaOH Al (OH ) 3 3 NaCl
Обратимыми называют химические реакции,
протекающие одновременно при одних и тех
условиях в двух противоположных
направлениях - прямом и в обратном
N 2 3H 2 2 NH 3
3.
Обратимые инеобратимые реакции
При каких условиях данная реакция будет
обратимой? Необратимой?
СаСO3 CaO CO2
СаСO3 CaO CO2
СаСO3 CaO CO2
4.
Химическое равновесиеСостояние химически обратимого
процесса, при котором скорость прямой
реакции равна скорости обратной
реакции, называется химическим
равновесием.
V1 V2
5.
Смещение химическогоравновесия
Принцип Ле Шателье
(1884г.):
если изменить одно из условий
- температуру, давление или
концентрацию веществ, - при
которых данная система,
находится в состоянии
химического равновесия, то
равновесие сместится в
направлении, которое
ослабляет это изменение
6.
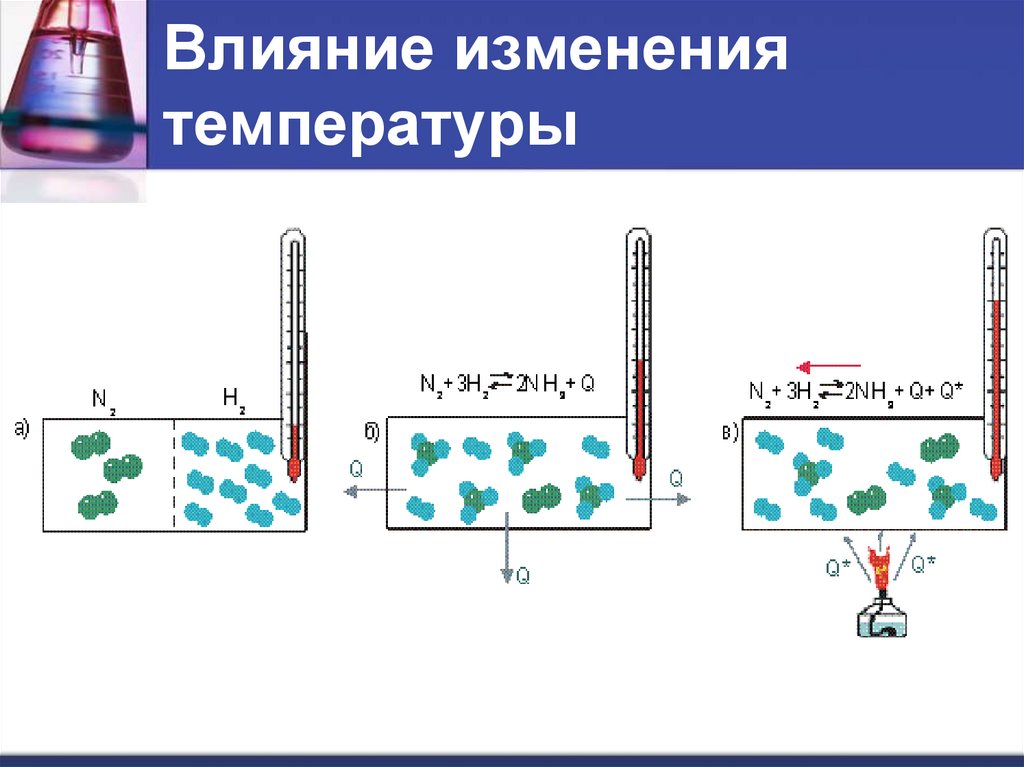
Влияние изменениятемпературы
7.
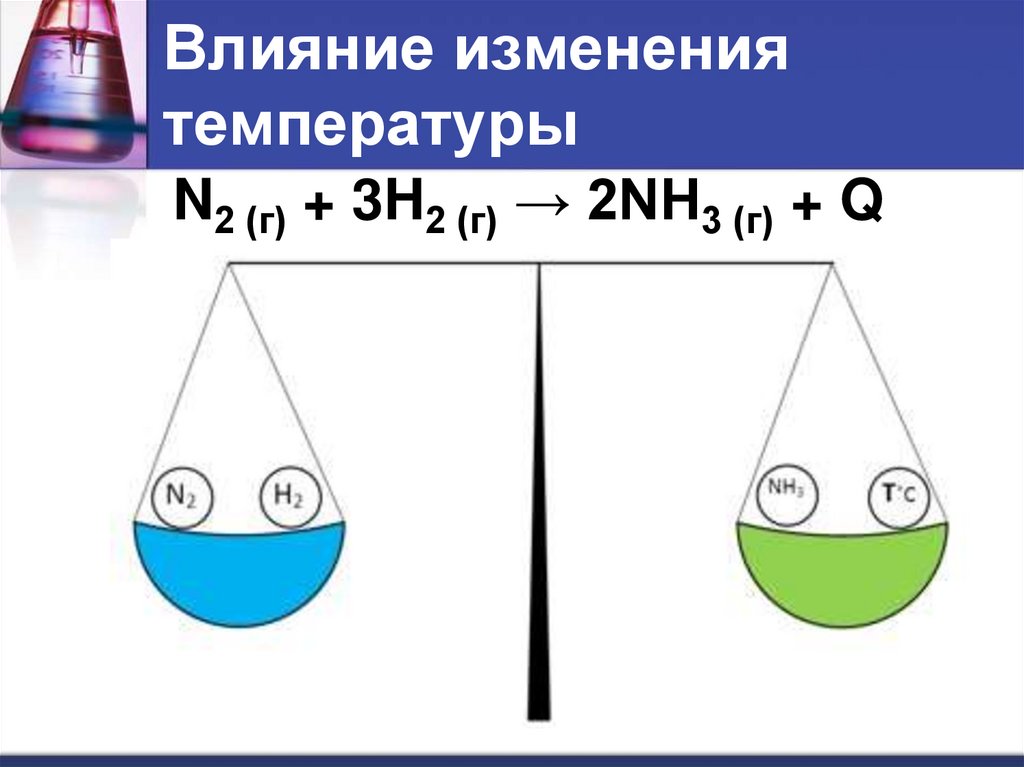
Влияние изменениятемпературы
N2 (г) + 3H2 (г) → 2NH3 (г) + Q
8.
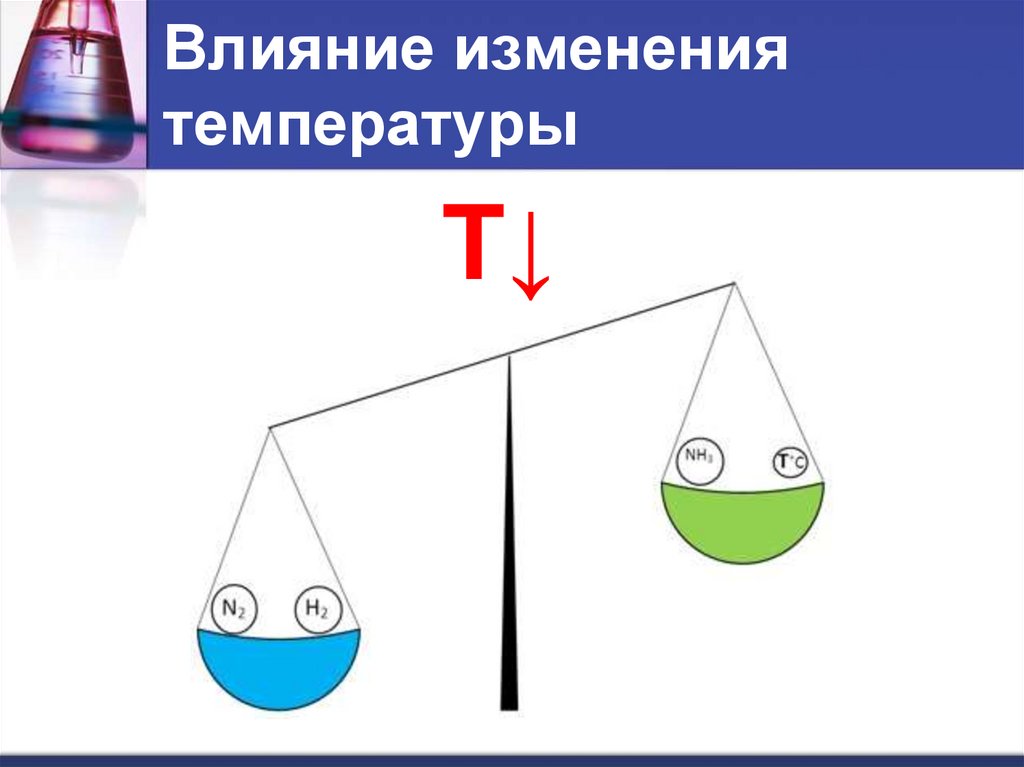
Влияние изменениятемпературы
T↓
9.
Влияние изменениятемпературы
При повышении температуры равновесие
смещается в сторону эндотермической
реакции.
N 2 3H 2 2 NH 3 Q
При понижении температуры – в сторону
экзотермической реакции.
N 2 3H 2 2 NH 3 Q
10.
Влияние измененияконцентрации веществ
СN ↑
2
11.
Влияние измененияконцентрации веществ
При увеличении концентрации одного из
веществ равновесие смещается в сторону
его расходования.
При уменьшении концентрации – в
сторону его образования.
12.
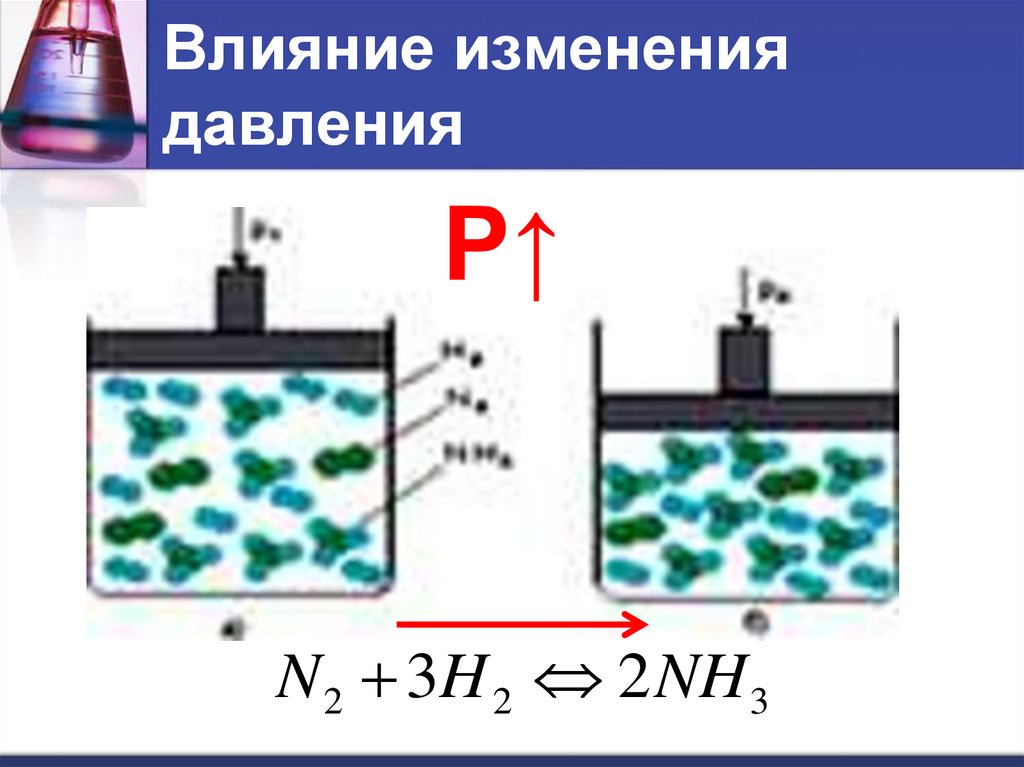
Влияние изменениядавления
Р↑
N 2 3H 2 2 NH 3
13.
Влияние изменениядавления
При увеличении давления
равновесие смещается в сторону той
реакции, при которой объем
образующихся газов меньше.
14.
Катализатор:не влияет на смещение
химического равновесия
(он лишь ускоряет процесс его
достижения)
15.
Принцип Ле Шателье:применим к любым равновесным
системам: термодинамическим
биологическим
психическим
педагогическим
социальным
экономическим











 chemistry
chemistry








