Similar presentations:
Предмет органической химии. Теория строения органических веществ
1.
ОРГАНИЧЕСКАЯ ХИМИЯЛЕКЦИЯ №1
ПРЕДМЕТ ОРГАНИЧЕСКОЙ ХИМИИ
2.
План лекции:• Что такое органическая химия?
• Теория строения органических веществ
• Классификация органических веществ
3.
ОРГАНИЧЕСКАЯ ХИМИЯВ 1807 году шведский химик
Якоб Берцелиус предложил назвать
вещества, получаемые из организмов,
органическими, а науку, изучающую
их — органической химией.
Органическая химия – химия веществ
полученных из живых организмов.
Неорганическая химия – химия
минеральных веществ.
4.
Органическая химия — раздел химической науки, в которомизучаются соединения углерода – их строение, свойства, способы
получения и практического использования.
Органическая химия — это химия углеводородов и их
производных.
Основой органической химии является структурная теория, или
теория химического строения органических соединений
Бутлерова.
5.
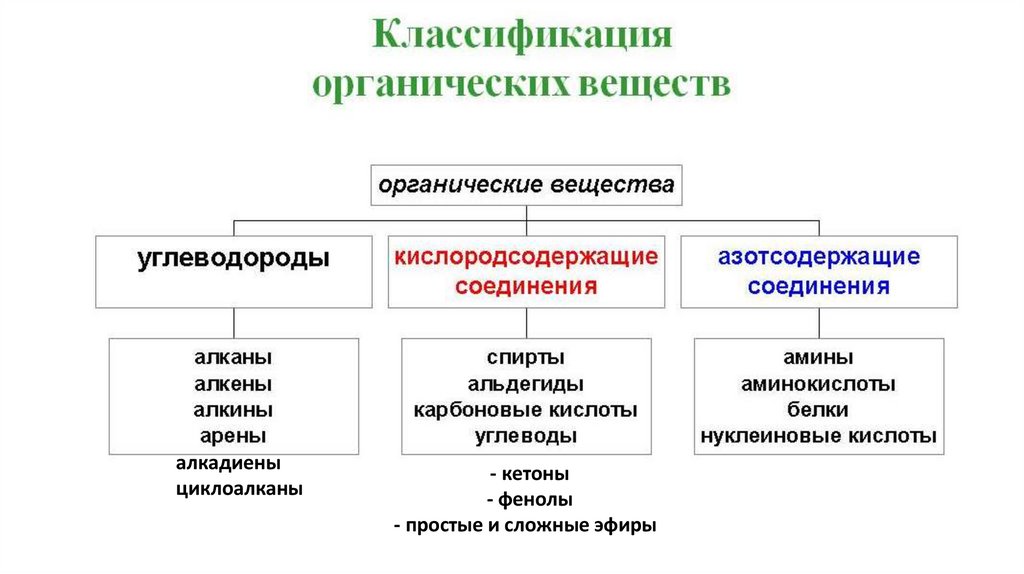
Классификация веществВещества
ОРГАНИЧЕСКИЕ
НЕОРГАНИЧЕСКИЕ
Все соединения содержат углерод
Нет такого химического элемента,
который присутствовал бы
во всех веществах
Исключения:
CO, CO2, CaC2, H2CO3
6.
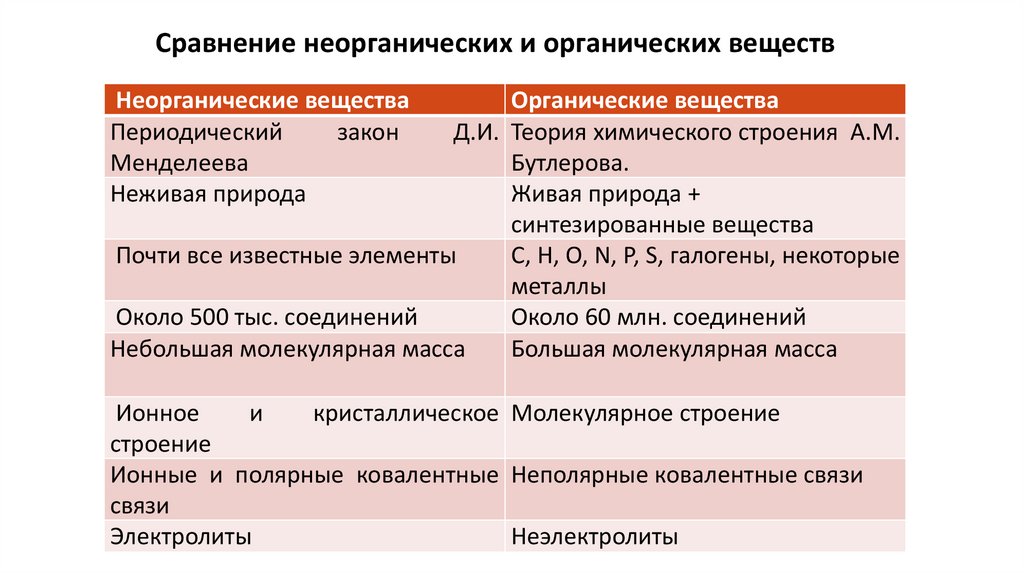
Сравнение неорганических и органических веществНеорганические вещества
Периодический
закон
Менделеева
Неживая природа
Органические вещества
Д.И. Теория химического строения А.М.
Бутлерова.
Живая природа +
синтезированные вещества
Почти все известные элементы
С, Н, О, N, P, S, галогены, некоторые
металлы
Около 500 тыс. соединений
Около 60 млн. соединений
Небольшая молекулярная масса
Большая молекулярная масса
Ионное
и
кристаллическое Молекулярное строение
строение
Ионные и полярные ковалентные Неполярные ковалентные связи
связи
Электролиты
Неэлектролиты
7.
8.
9.
10.
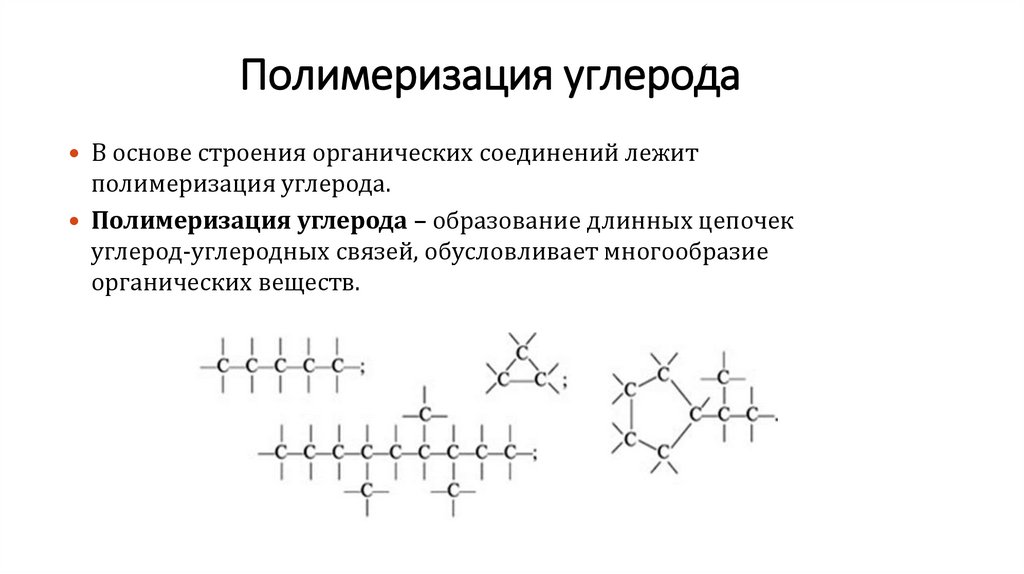
Полимеризация углеродаВ основе строения органических соединений лежит
полимеризация углерода.
Полимеризация углерода – образование длинных цепочек
углерод-углеродных связей, обусловливает многообразие
органических веществ.
11.
12.
13.
14.
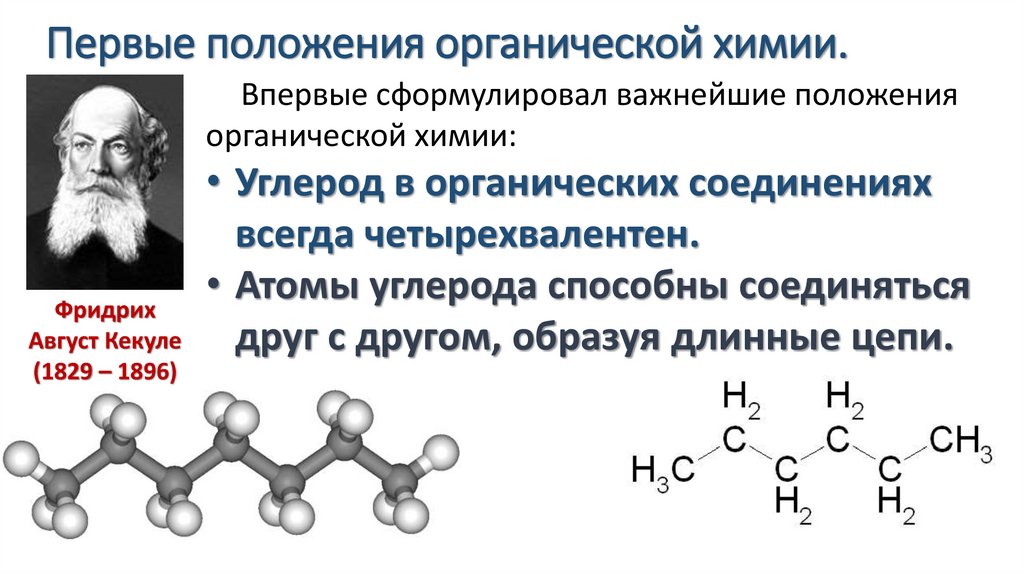
Первые положения органической химии.Впервые сформулировал важнейшие положения
органической химии:
• Углерод в органических соединениях
всегда четырехвалентен.
Атомы
углерода
способны
соединяться
Фридрих
Август Кекуле
друг с другом, образуя длинные цепи.
(1829 – 1896)
15.
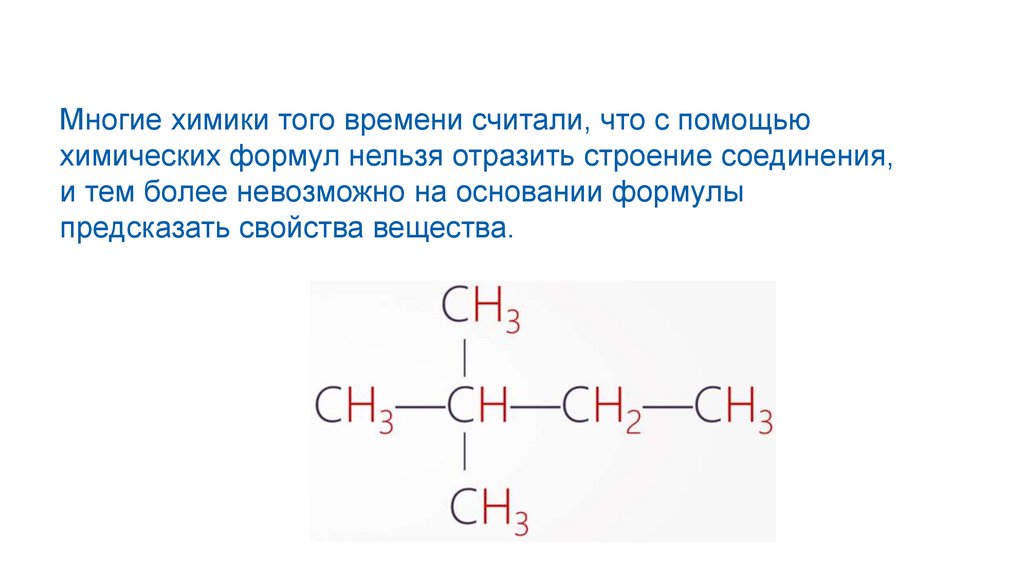
Многие химики того времени считали, что с помощьюхимических формул нельзя отразить строение соединения,
и тем более невозможно на основании формулы
предсказать свойства вещества.
16.
Молодой российский учёныйАлександр Михайлович Бутлеров
выступил на конгрессе с основными
положениями теории строения
органических соединений.
А.М. Бутлеров
1828–1886гг.
17.
Теория строения органическихвеществ А. М. Бутлерова
Атомы в молекулах соединены между собой в
определенном порядке согласно их валентности.
2. Свойства вещества определяются не только
качественным составом, но и строением, и взаимным
влиянием атомов.
3. По свойствам вещества можно определить его
строение, а по строению – свойства.
1.
18.
Общие и структурные формулыОбщая формула – отражает качественный и
количественный состав вещества.
СН4 – метан, С2Н6 – этан, С3Н8 – пропан
Структурная формула – отражает
последовательность соединения атомов в молекуле.
19.
алкадиеныциклоалканы
- кетоны
- фенолы
- простые и сложные эфиры
20.
С=СС-С
С=С=С
С≡С
21.
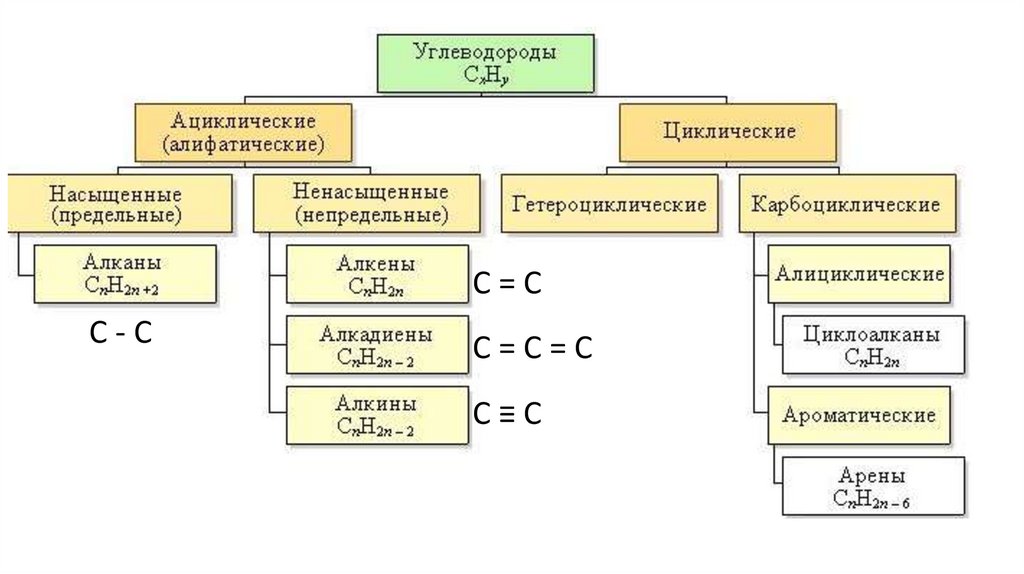
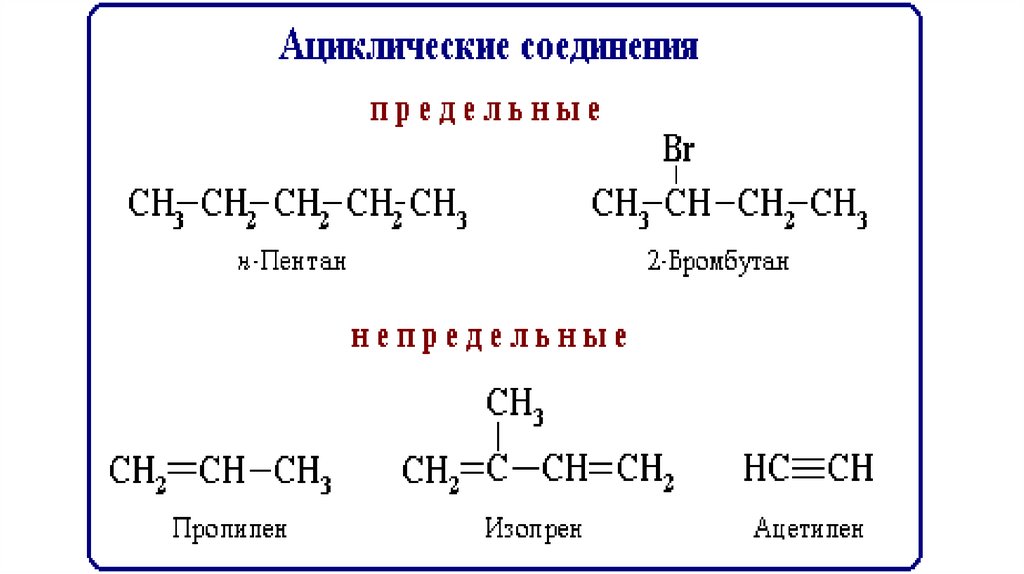
Ациклические соединения• Ациклические соединения (алифатические) соединения с открытой (незамкнутой)
углеродной цепью.
• Среди ациклических соединений различают
предельные (насыщенные), содержащие в
скелете только одинарные связи C-C и
непредельные (ненасыщенные), включающие
кратные связи C=C и C ≡C.
22.
23.
Циклические соединения Карбоциклические соединения содержат вцикле только атомы углерода.
Они делятся на две существенно
различающихся по химическим свойствам
группы: алициклические - и ароматические
(арены).
24.
25.
•Радикал – это углеводоро́дный оста́ток.•Функциональная группа – атом или
группа атомов, которые определяют
принадлежность соединения к
определенному классу и его химические
свойства.
функциональная группа
26.
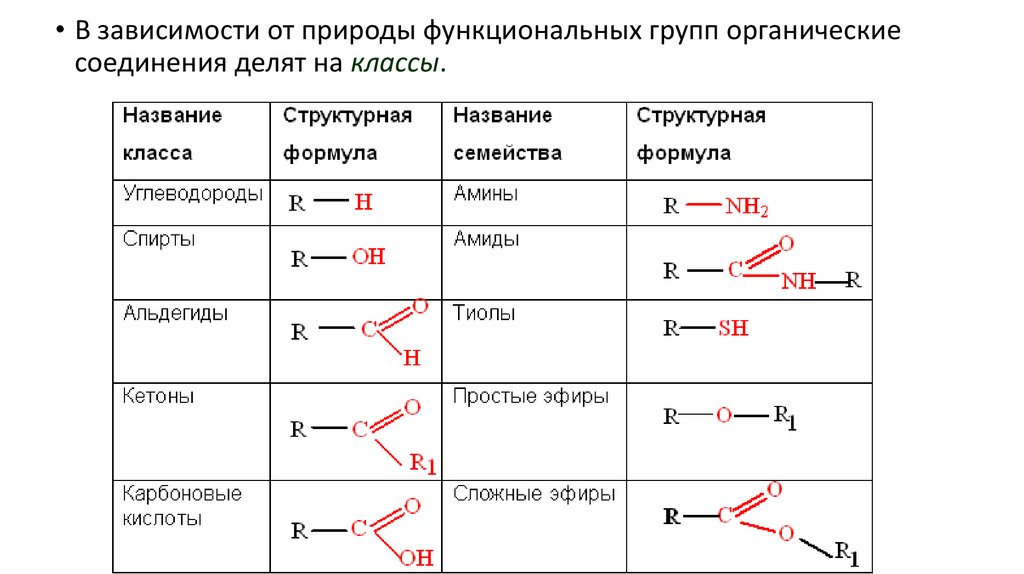
• В зависимости от природы функциональных групп органическиесоединения делят на классы.
27.
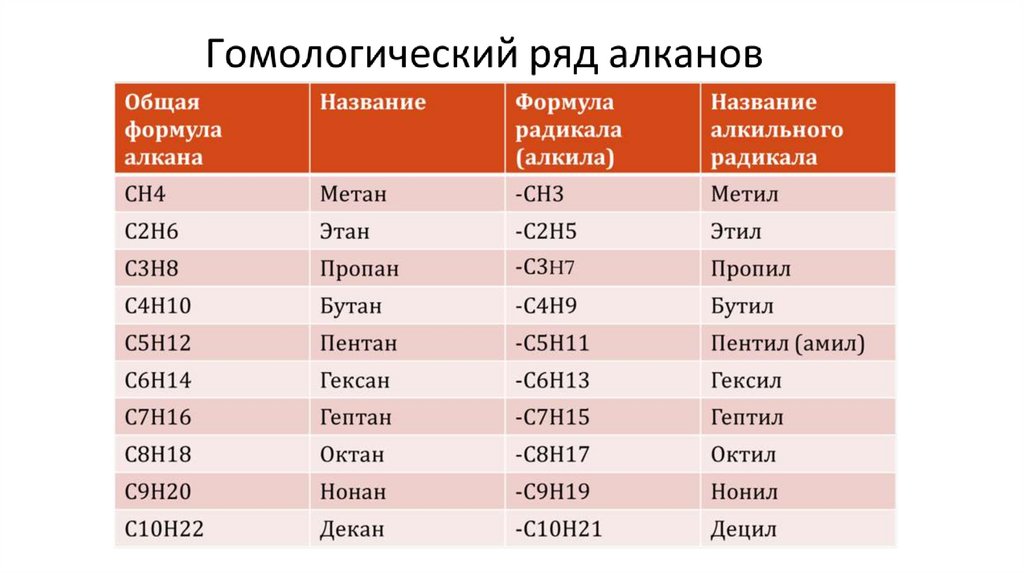
Гомологический рядВсе классы органических соединений
взаимосвязаны. Переход от одних классов
соединений к другим осуществляется в
основном за счет превращения функциональных
групп без изменения углеродного скелета.
Соединения каждого класса составляют
гомологический ряд.
28.
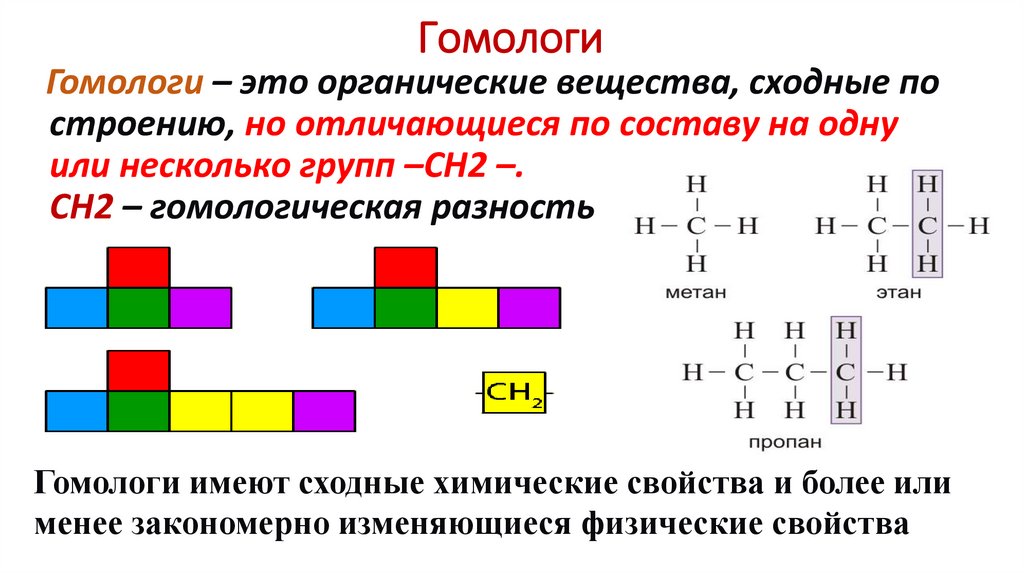
ГомологиГомологи – это органические вещества, сходные по
строению, но отличающиеся по составу на одну
или несколько групп –СН2 –.
СН2 – гомологическая разность
Гомологи имеют сходные химические свойства и более или
менее закономерно изменяющиеся физические свойства
29.
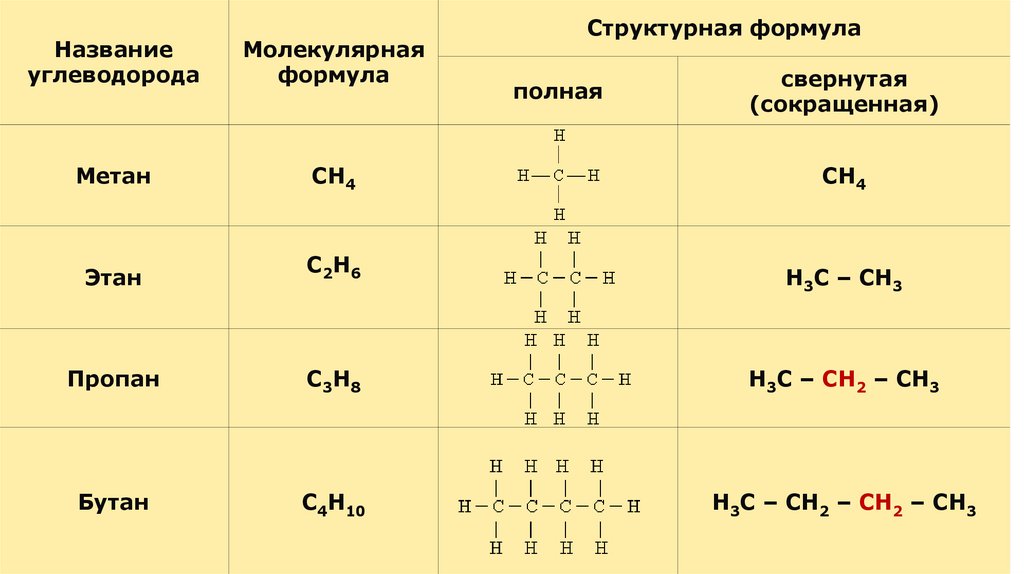
Структурная формулаНазвание
углеводорода
Молекулярная
формула
Метан
СН4
Этан
С 2Н 6
Пропан
С 3Н 8
Н3С – СН2 – СН3
Бутан
С4Н10
Н3С – СН2 – СН2 – СН3
полная
свернутая
(сокращенная)
СН4
Н3С – СН3
30.
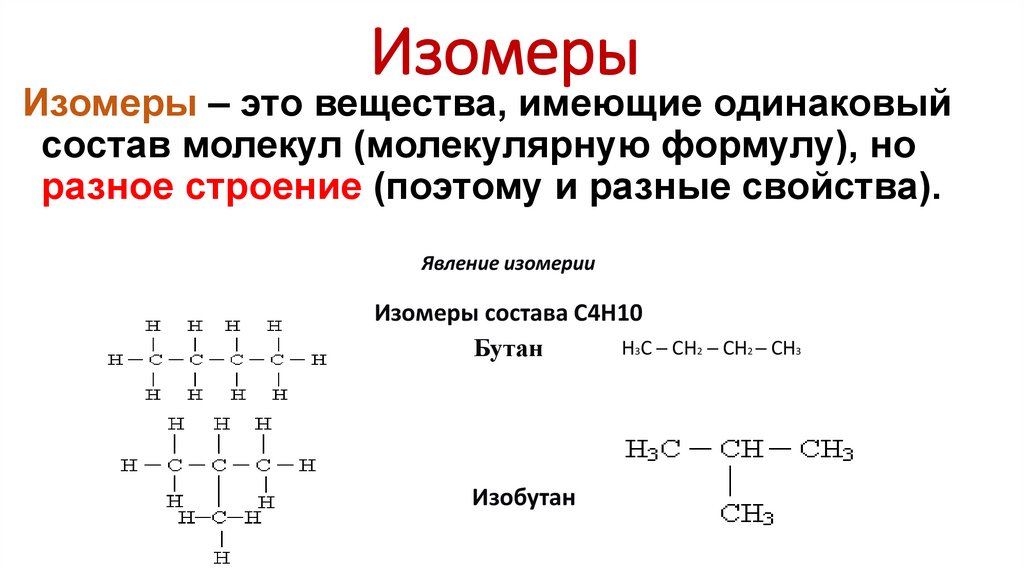
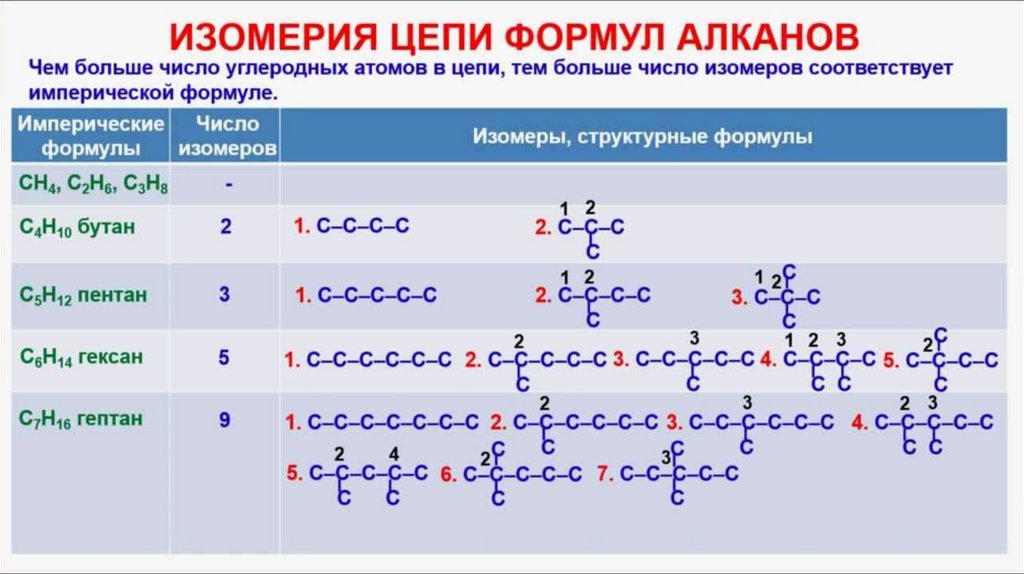
ИзомерыИзомеры – это вещества, имеющие одинаковый
состав молекул (молекулярную формулу), но
разное строение (поэтому и разные свойства).
Явление изомерии
Изомеры состава С4Н10
Н3С ─ СН2 ─ СН2 ─ СН3
Бутан
Изобутан
31.
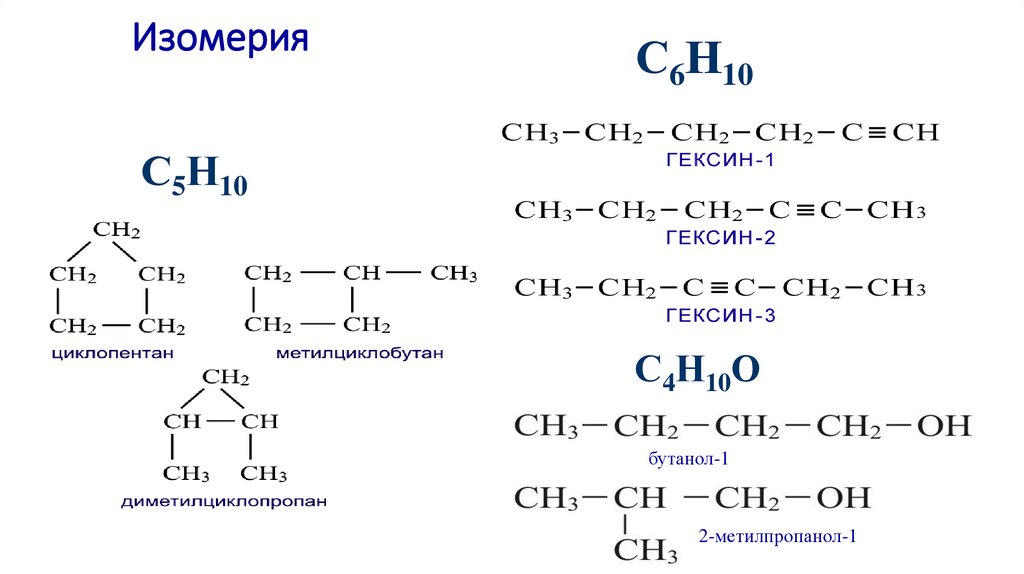
ИзомерияС6Н10
С5Н10
С4Н10О
бутанол-1
2-метилпропанол-1
32.
33.
(историческое)первая номенклатура, возникшая
в начале развития органической
химии, когда не существовало
классификации и теории строения
органических соединений
Пример: винный спирт,
щавелевая кислота, яблочная
кислота, уксусная кислота,
ванилин, мочевина. Многие
такие названия часто
применяются до сих пор.
за основу названия органического
соединения берется название
простейшего члена гомологического
ряда. Все остальные соединения
рассматриваются как производные
этого соединения
Пример:
триметилметан,
этилпропилацетилен
международная
номенклатура ИЮПАК
является научной и отражает
состав, химическое и
пространственное строение
соединения
Основой названия служит один
углеводородный фрагмент, а другие
рассматриваются как заместители
водорода.
Пример: 2,3 – диметилгексан
34.
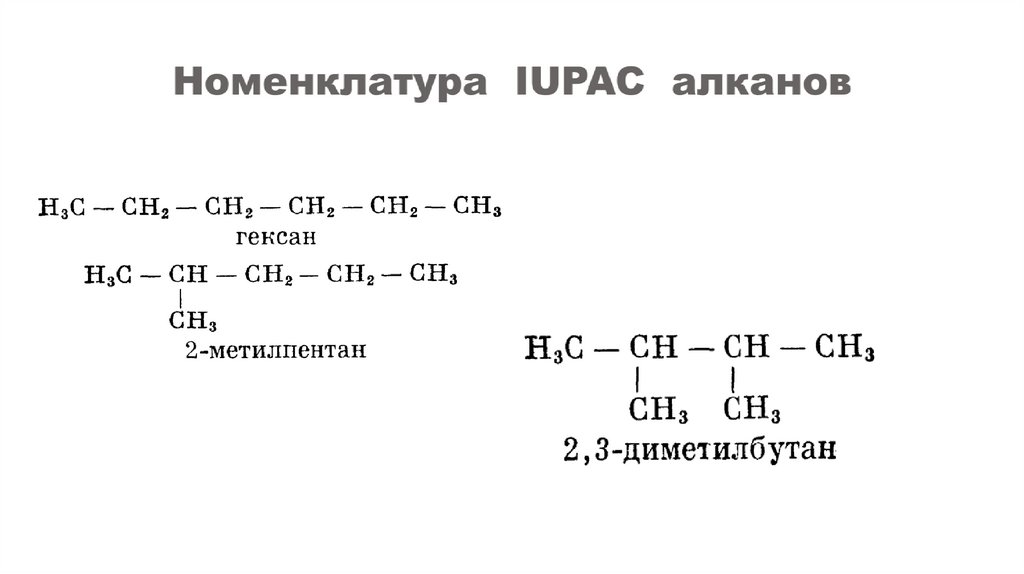
Номенклатура – совокупность правил составления химических названий веществ, классов, групп и др.1. Выбрать самую длинную цепь атомов углерода.
2. Пронумеровать углеродную цепь с конца, к которому ближе разветвление или
радикал.
3. Указываем положение радикала (ответвления) цифрой и называем сам
радикал, например: 3-метил, 2-хлор. Если в молекуле имеется несколько
одинаковых радикалов, то перед названием этой группы словом указывается
их количество (например, диметил- , трихлор- , тетраметил- и т.д.).
4. Все цифры отделяют друг от друга запятой, буквы от цифр – дефисом.
5. Если при одном атоме углерода имеется не один, а два заместителя, его
номер повторяют в названии дважды, первым записывается радикал с
меньшим числом атомов углерода.
6. Основу названия соединения составляет корень слова, обозначающий
предельный углеводород с тем же числом атомов, что и главная цепь (мет- ,
эт- , проп- , бут- и т.д.).





















 chemistry
chemistry








