Similar presentations:
Молекулярно-кінетичні явища в дисперсних системах
1.
4. Молекулярно-кінетичні явищав дисперсних системах
явища, обумовлені тепловим рухом атомів,
молекул, іонів:
1) броунівський рух
2) дифузія
3) осмос
4) седиментація
5) в’язкість
2.
Кінетична енергія молекули(теплового руху)
m V
3
E
kT
2
2
2
k = 1,38 10 23 Дж/град – константа Больцмана –
змінювання енергії однієї молекули при
змінюванні температури Т на 1 градус
3.
Кінетична енергія моля речовини3
E kT N A
2
NА = 6,02 1023 1/моль – число Авогадро –
кількість молекул у молі речовини;
4.
k NA = R = 1,38 10 23 6,02 1023 = 8,31[(Дж/град) (1/моль) = Дж/(моль град)]
універсальна газова стала – змінювання
енергії моля речовини при змінюванні
температури Т на 1 градус
Кінетична енергія моля речовини
3
3
E kN AT RT
2
2
5.
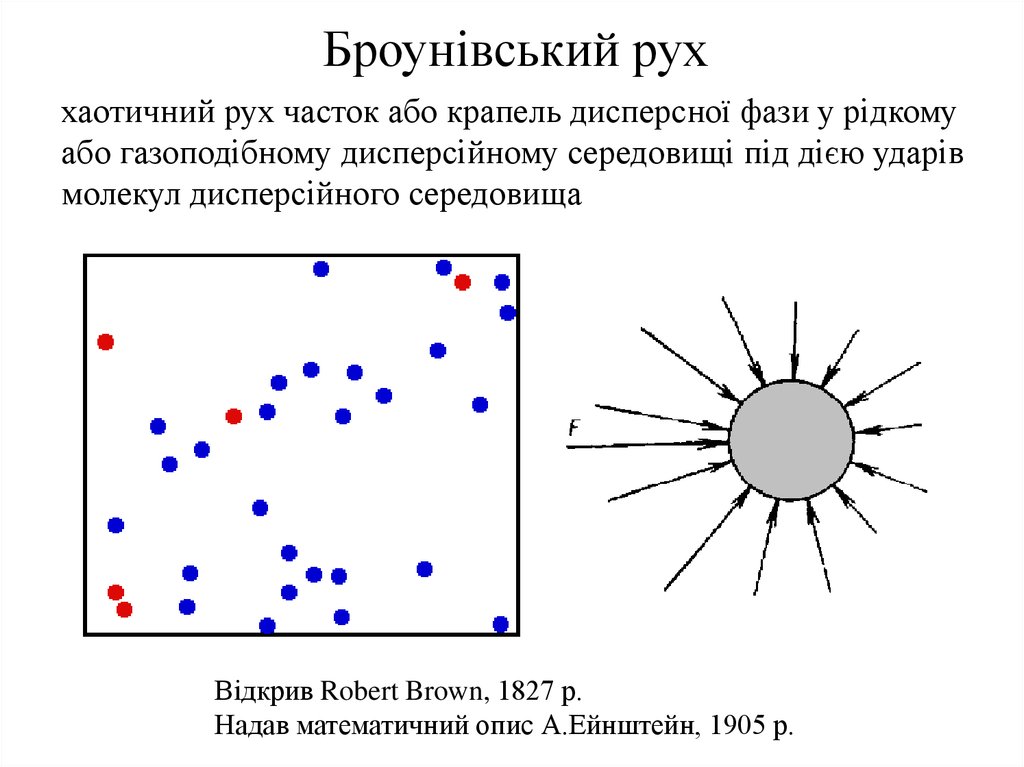
Броунівський руххаотичний рух часток або крапель дисперсної фази у рідкому
або газоподібному дисперсійному середовищі під дією ударів
молекул дисперсійного середовища
Відкрив Robert Brown, 1827 р.
Надав математичний опис А.Ейнштейн, 1905 р.
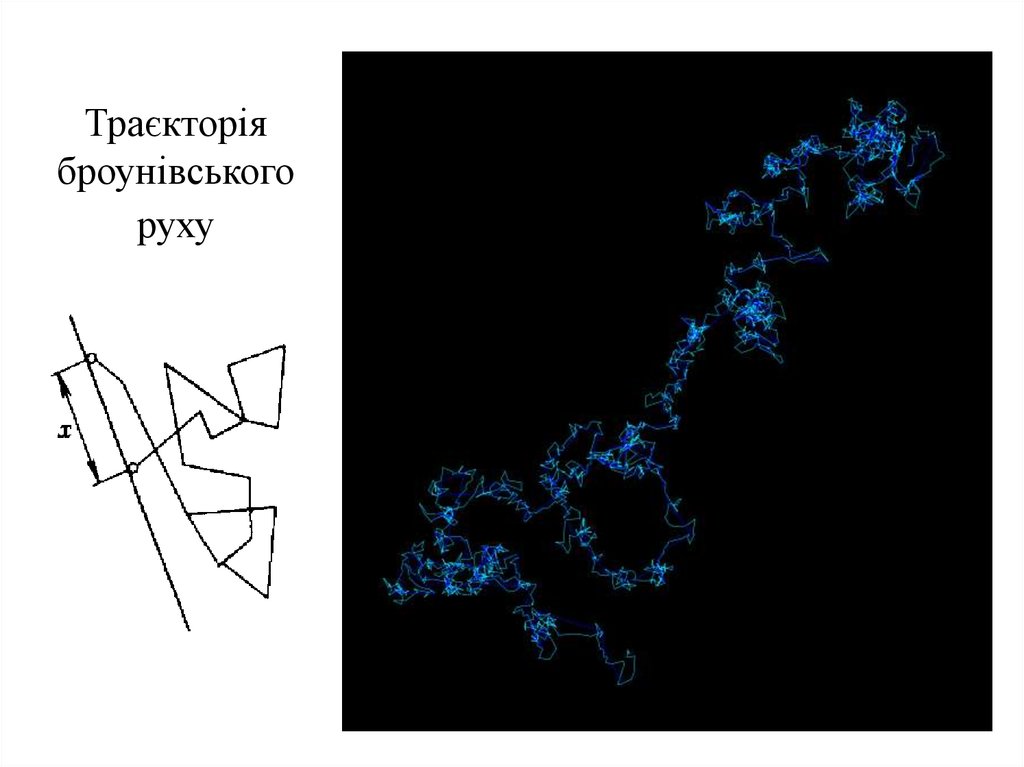
6.
Траєкторіяброунівського
руху
7.
Дифузіядовільне перенесення речовини з області з
більшою концентрацією в область з меншою
концентрацією до їх вирівнювання
8.
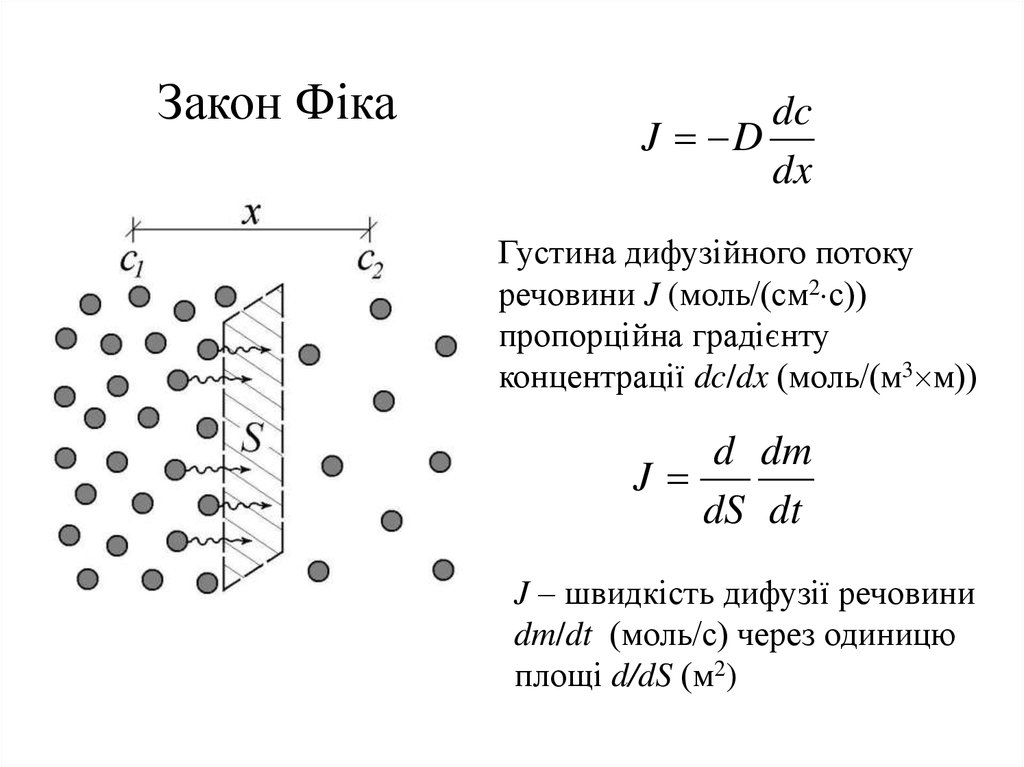
Закон Фікаdc
J D
dx
Густина дифузійного потоку
речовини J (моль/(см2 с))
пропорційна градієнту
концентрації dc/dx (моль/(м3 м))
d dm
J
dS dt
J – швидкість дифузії речовини
dm/dt (моль/с) через одиницю
площі d/dS (м2)
9.
mc
D
St
x
D – коефіцієнт дифузії – кількість речовини, яка
дифундує за одиницю часу через одиницю площі при
одиничному градієнті концентрації:
mx моль м
м4
м2
D
2
моль
cSt м 2
м с
с
с
3
м
10.
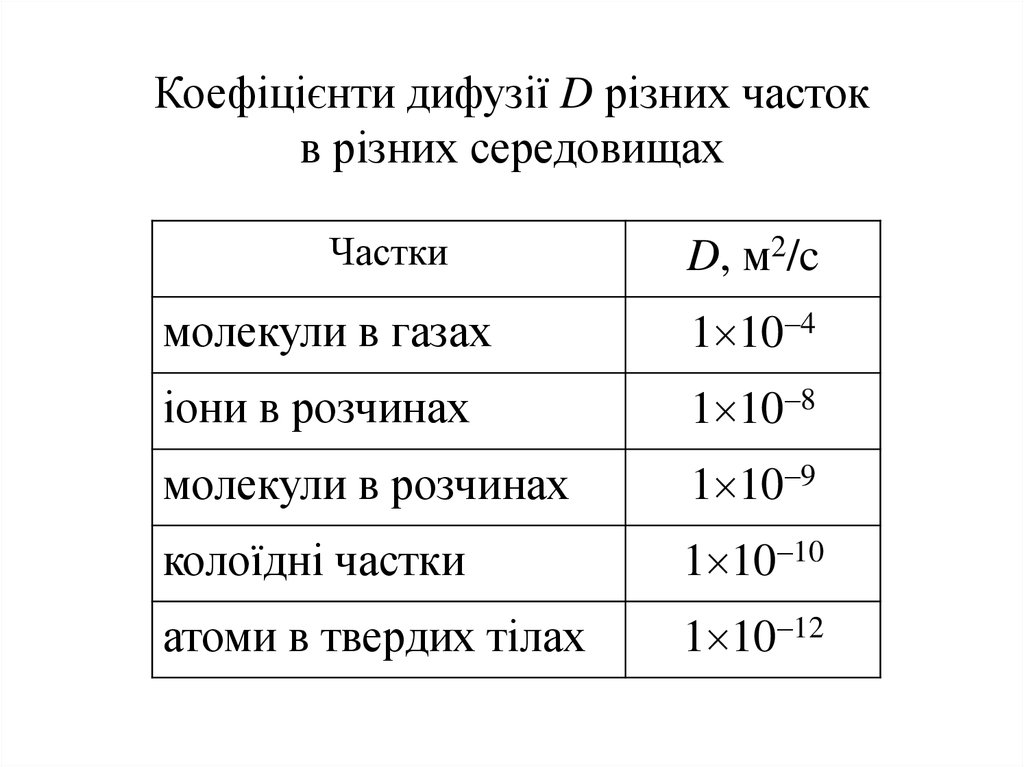
Коефіцієнти дифузії D різних частокв різних середовищах
Частки
D, м2/c
молекули в газах
1 10 4
іони в розчинах
1 10 8
молекули в розчинах
1 10 9
колоїдні частки
1 10 10
атоми в твердих тілах
1 10 12
11.
Дифузія в пористих середовищахdc
J D *
dx
D* – ефективний коефіцієнт дифузії:
D* = a1a2a3D
a1, а2, а3 – параметри, що враховують:
a1 – хвилястість капілярів;
а2 – вплив стінок капілярів;
а3 – зменшення дифузійного потоку (площі перерізу)
твердою фазою системи
12.
Прояви дифузії при виготовленні та експлуатаціїбудівельних матеріалів і конструкцій:
- спікання кераміки;
- проникнення агресивних речовин в матеріал і винос
продуктів корозії:
- проникнення вуглекислого газу при карбонізації
бетону;
- проникнення хлоридів при хлоридній корозії
арматури;
- проникнення сульфатів при сульфатній корозії бетону
і т.п.
13.
Карбонізація бетонуCa(OH)2 + CO2 = CaCO3 + H2O
- призводить до втрати бетоном захисних властивостей;
- СО2 проникає у бетон за механізмом дифузії;
- карбонізація розповсюджується фронтом;
- при досягненні фронтом арматури починається її корозія
14.
Корозія арматури після нейтралізаціїбетону захисного шару
15.
Корозія арматури після нейтралізаціїбетону захисного шару
16.
Довговічність залізобетонної конструкції –тривалість карбонізації захисного шару t
m
c
D*
St
x
mx
t
D * cS
17.
m – кількість СО2, що поглинається захисним шаром:m m0 xS
m0 – реакційна здатність бетону – максимальна
кількість СО2, що поглинається одиницею об’єму
бетону:
m0 0,4 Цpf 0,4 Ц 0,6 0,6 0,144 Ц
Ц – вміст цементу в 1 см3 бетону, г/см3;
р – вміст СаО у цементі, відн.од., 0,6;
f – доля СаО, що бере участь у карбонізації, 0,6
2
m0 xSx m0 x
t
D * cS D * c
18.
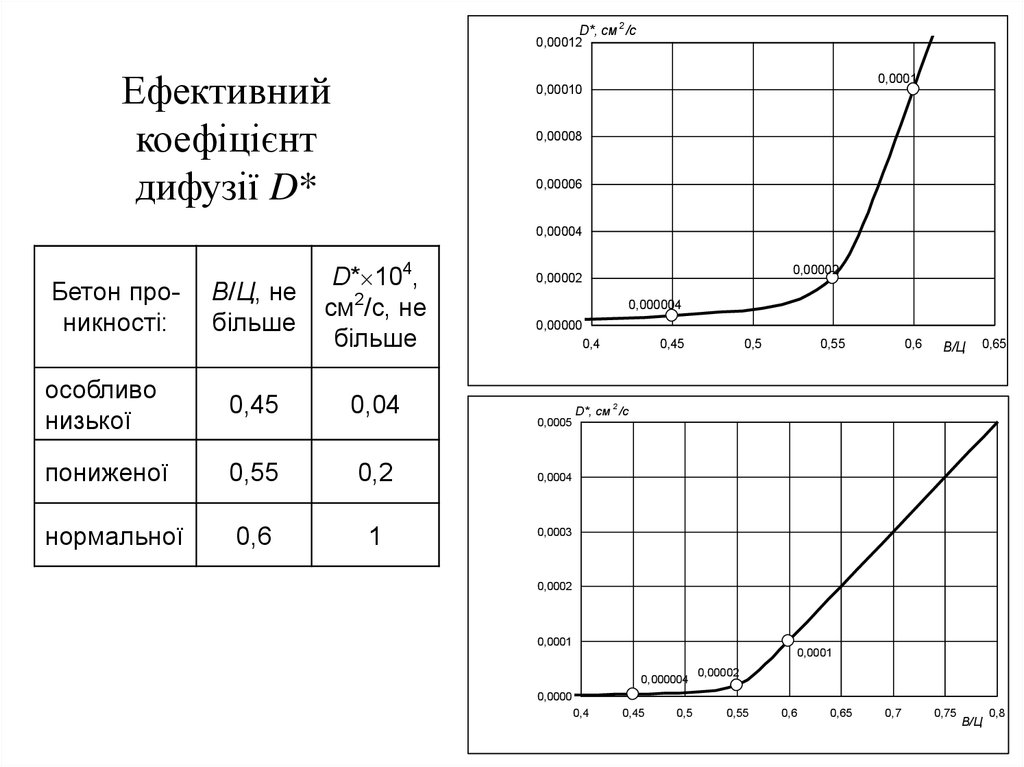
D*, cм 2 /c0,00012
Ефективний
коефіцієнт
дифузії D*
0,0001
0,00010
0,00008
0,00006
0,00004
Бетон проникності:
В/Ц, не
більше
D* 104,
cм2/с, не
більше
особливо
низької
0,45
0,04
пониженої
0,55
0,2
нормальної
0,6
1
0,00002
0,00002
0,000004
0,00000
0,4
0,45
0,5
0,55
0,6
В/Ц
0,65
2
0,0005
D*, cм /c
0,0004
0,0003
0,0002
0,0001
0,0001
0,000004
0,00002
0,0000
0,4
0,45
0,5
0,55
0,6
0,65
0,7
0,75
В/Ц
0,8
19.
Задача:Визначити тривалість t карбонізації захисного шару
товщиною х = 1 см (довговічність конструкції):
1) бетону низької міцності з витратою цементу
Ц = 200 кг/м3, В/Ц = 0,7;
2) бетону плит БМП з витратою цементу
Ц = 493 кг/м3, В/Ц = 0,36.
Концентрація СО2 в атмосферному повітрі
с = 600 мг/м3
20.
21.
ОсмосОсмос – одностороння
дифузія розчинника в
розчин крізь
напівпроникну
перегородку від
меншої до більшої
концентрації
розчиненої речовини
22.
ОсмосОсмотичний
тиск
pосм= cRT
23.
Осмометрросм = ρgh
ρgh = cRT
c
gh
RT
24.
ЗадачаКапіляри бетону і цементного каменю заповнені:
1) розчином Са(ОН)2 концентрацією 0,02 Моль/л
(природний стан бетону);
2)розчином NaCl концентрацією 359 г/л
(після посипання сіллю як антиобморожувачем)
Визначити осмотичний тиск в капілярах бетону
при його контакті з чистою водою при температурі 20ºС.
Порівняти величину осмотичного тиску з міцністю
на розтяг бетону класу В15
25.
СедиментаціяСедиментація – порушення рівномірного
розподілу часток дисперсної фази в об'ємі,
наприклад, їх осідання в суспензії
26.
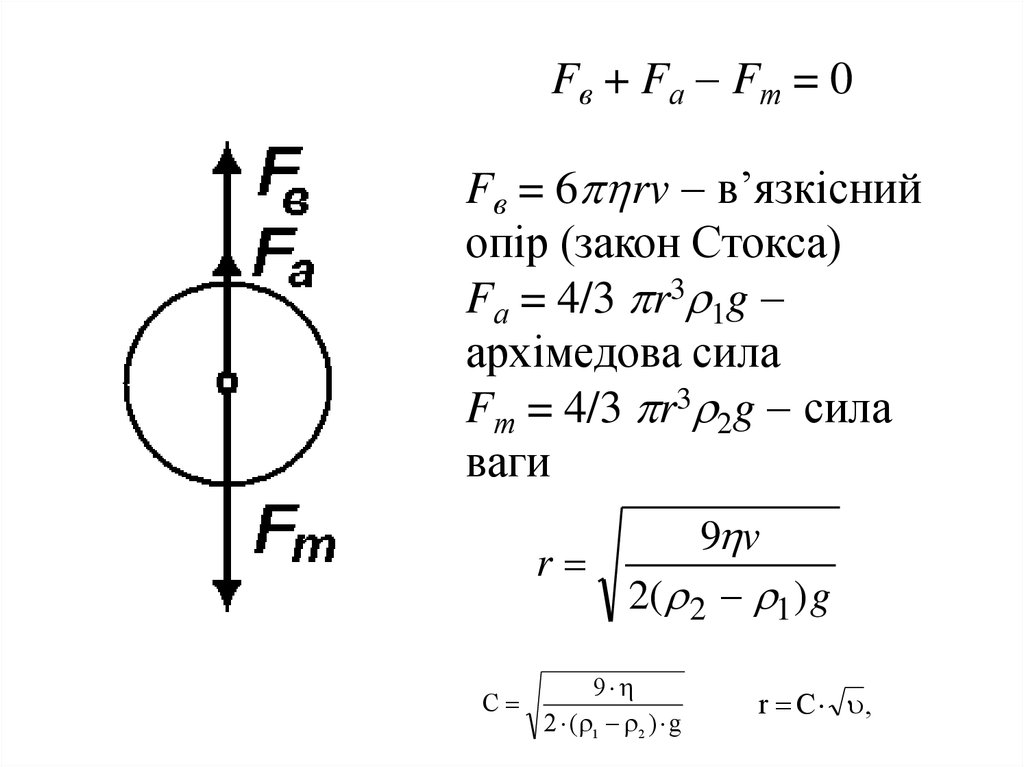
Fв + Fа Fт = 0Fв = 6 rv в’язкісний
опір (закон Стокса)
Fа = 4/3 r3 1g
архімедова сила
Fт = 4/3 r3 2g сила
ваги
r
C
9 v
2( 2 1 ) g
9
2 ( 1 2 ) g
r C ,
27.
Седиментаційний аналізГравітаційний
Відцентровий
r
9
,
2 ( 1 2 ) j
j відцентрове прискорення, м/с2
28.
В’язкістьВ’язкість – здатність рідини опиратись течії –
взаємному переміщенню шарів
Закон Ньютона
F
dv
S
dx
Сила тертя між шарами рідини, що рухаються,
яка припадає на 1 м2 поверхні, пропорційна
градієнту швидкості.
29.
В’язкість (коефіцієнт в’язкості) – сила тертя між шарамирідини, що рухаються, яка припадає на 1 м2 поверхні, та при
градієнті швидкості, який дорівнює одиниці:
F dx Н м
Н
2
2 с Па с
S dv м м / с м
В’язкісний опір руху кулі в рідині (закон Стокса):
F = 6 rv
В’язкісний опір руху рідини трубопроводом:
F
dv
2 r
l
dx






















 chemistry
chemistry








