Similar presentations:
Класифікація, методи отримання та властивості дисперсних систем
1.
1. Класифікація, методи отримання та властивості дисперсних систем2. Будова колоїдних частинок
3. Способи очищення колоїдних розчинів
4. Стійкість і коагуляція дисперсних систем
Аерозолі: методи отримання, властивості, руйнування (СРС)
2.
Дисперсною називають систему, в якій дрібні частинки однієї або кількох речовин- диспесноїфази рівномірно розподілені між частинками іншої -дисперсійного середовища.
Подрібнення речовини називається диспергуванням.
Залежно від розмірів частинок дисперсної фази системи поділяють на гомогенні та гетерогенні.
Ознаки дисперсної системи:
1. Гетерогенність(багатофазовість)
2. Ступінь подрібнення частинок дисперсної фази, або ступінь дисперсності.
Дисперсність D – величина, обернена розміру частинки диспергованої речовини(d або l):
D = 1/ d,
D = 1/ l ,
де d-діаметр частинки кулястої форми; l –довжина ребра частинки кубічної форми .
Чим менший розмір частинок, то більша дисперсність системи та їхня питома поверхня. Питома
поверхня(Sпит )- це міжфазова поверхня (Sсум ) одиниці об’єму(V) або маса(m) дисперсної фази:
Дисперсні системи класифікують за різними ознаками:
за агрегатним станом фаз – Т/Р;
за ступенем дисперсності;
за формою частинок;
за ступенем структурованості;
за енергією взаємодії фаз
3.
Класифікація дисперсних систем за ступенем дисперсностіРозмір частинокм, нм
Тип системи
грубодисперсні
(d = 10-3 -10-5,
понад 100 нм
Суспензії,
емульсії, порошки
середньої
дисперсності
d = 10-5 -10-7
тонкі зависі, дим,
поруваті тіла
високодисперсні
d = 10-7 -10-9 м,
1-100 нм
колоїдні системи золі, гелі
істинні розчини
10-9 м,
менше 1 нм
Молекулярні,
йонні
В колоїдній хімії прийнято всі системи, що мають колоїдні частинки
дисперсності від 1 до 100 нм називати золями.
Дисперсні системи ділять на монодисперсні(частинки дисперсної фази мають
однаковий розмір) і полідисперсні(частинки мають різні розміри).
4.
Золі з газоподібним дисперсійним середовищем називають аерозолями, з рідкимліозолями або золями; з твердим – солідозолямиДисперсні системи з рідким або газоподібним дисперсійним середовищем,
у якому частинки дисперсної фази можуть вільно переміщуватись, називають
вільнодисперсними (емульсії, суспензії, ліозолі, аерозолі).
Системи з твердим дисперсійним середовищем, у якому частинки
дисперсної фази не можуть вільно переміщуватись, називають
зв’язанодисперсними (капілярно-поруваті тіла, полімерні плівки, гелі й драглі,
тверді розчини).
5.
Методи отримання колоїдно-дисперсних системУмовами утворення колоїдних розчинів є:
а) мала розчинність речовини дисперсної фази у дисперсійному середовищі;
б) відповідний ступінь дисперсності речовини (d = 10–7 –10–9 м = 1–100 нм);
в) наявність стабілізатора, який надає частинкам дисперсної фази однойменного заряду,
що перешкоджає їх об'єднанню (агрегації).
Методи отримання колоїдно-дисперсних систем поділяють на
диспергаційні та конденсаційні.
При диспергаційному способі отримують частинки дисперсної фази з розмірами не
менше -100 нм.
Конденсаційні методи - укрупнення мікрочастинок шляхом об’єднання атомів чи
молекул під дією сил міжмолекулярної взаємодії(ван-дер-вальсових сил), відбувається
без витрати енергії ззовні. В основі конденсаційних методів лежить утворення
частинок дисперсної фази з пересиченого розчину або пари за певних фізичних і
хімічних умов.
Особливе значення мають способи отримання дисперсних систем, засновані на
пептизації. При цьому заздалегідь скоагульовані частинки дисперсної фази знову
переходять у розчин, утворюючи золь.
Метод пептизації –це процес переходу речовини із гелю в золь під дією пептизаторів,
речовин, що забезпечують видалення з розчину коагулюючих йонів, які укрупнюють ці
частинки.
6.
Диспергаційні та конденсаційні методи отримання колоїднихрозчинів:1-речовина; 2-частинки грубої зависі(суспензія); 3міцели(колоїдний розчин); 4-молекули та йони(істинний розчин)
7.
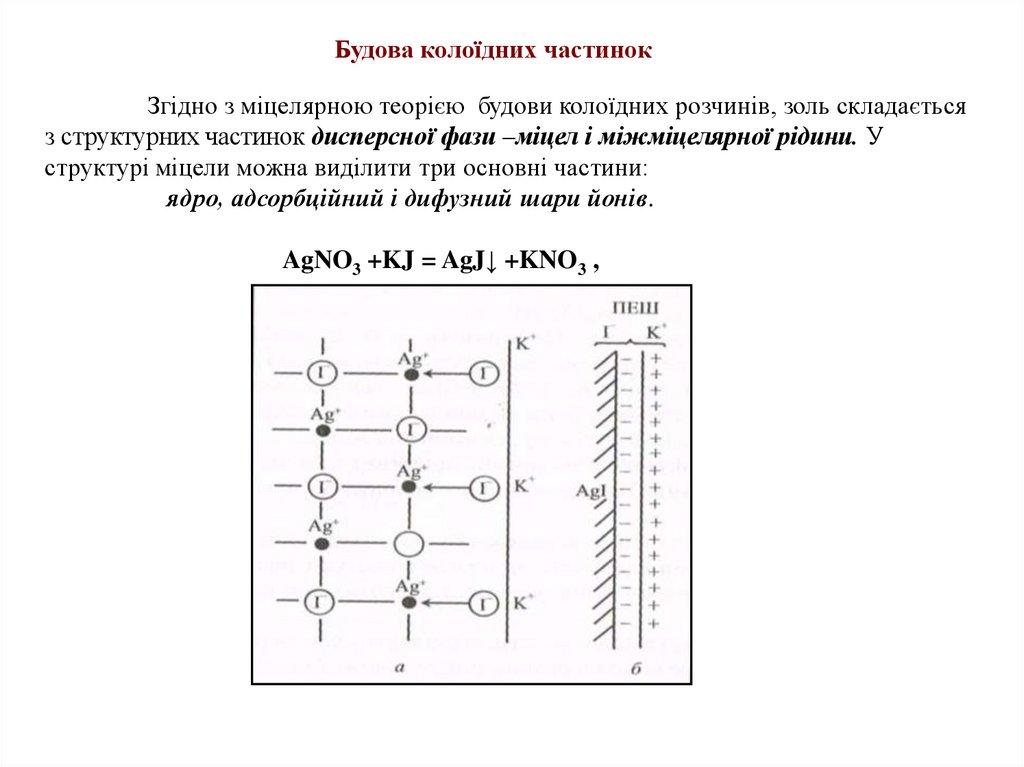
Будова колоїдних частинокЗгідно з міцелярною теорією будови колоїдних розчинів, золь складається
з структурних частинок дисперсної фази –міцел і міжміцелярної рідини. У
структурі міцели можна виділити три основні частини:
ядро, адсорбційний і дифузний шари йонів.
AgNO3 +KJ = AgJ↓ +KNO3 ,
8.
AgNO3 +KJ = AgJ↓ +KNO3 ,Основу колоїдних частинок золю аргентум йодиду становлять молекули
малорозчинного AgJ, сукупність яких(m молекул) утворює агрегат: (mAgJ) –агрегат.
При надлишку AgNO3 (стабілізатор), на поверхні агрегату(mAgJ) виникає позитивно заряджений
шар з n йонів Ag+ (потенціаловизначальні йони). Агрегат з ПВЙ, які увійшли до його складу,
називають ядром:
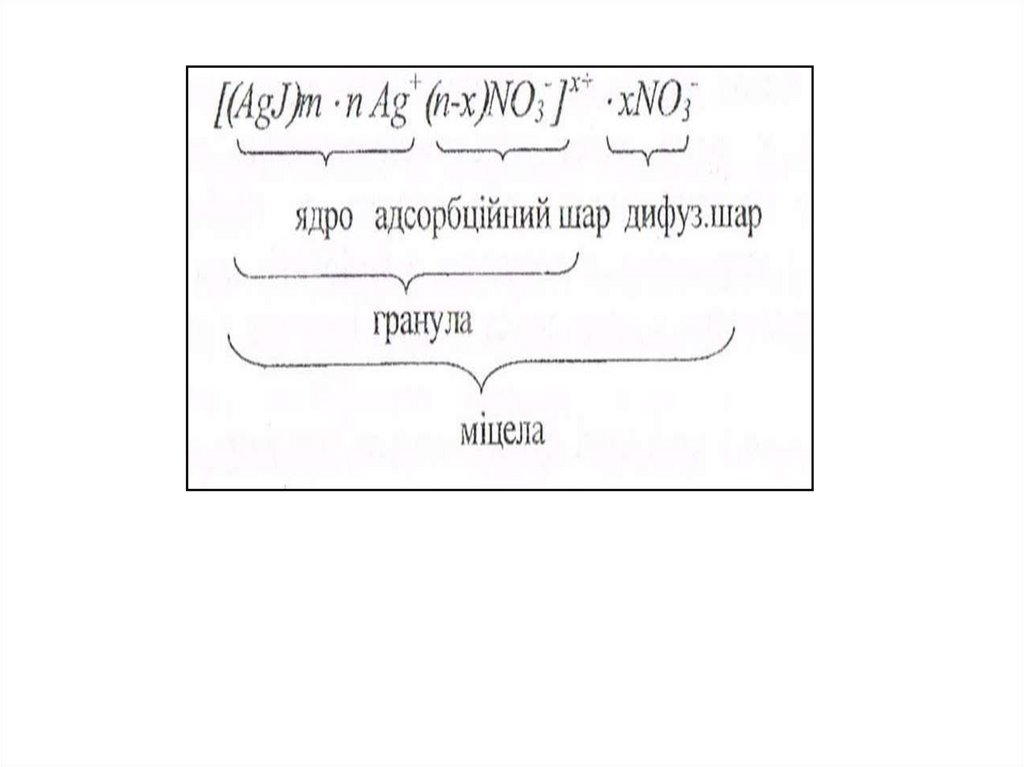
[(mAgJ)۰ n Ag+ ]n+ - ядро.
До поверхні ядра притягуються йони стабілізатора протилежного знака NO3-, які
називають протиіонами. Частина протиіонів (n-x) NO3-, утримується на досить близькій відстані
від ядра і утворює адсорбційний шар протиіонів. Ядро разом з адсорбційним шаром протиіонів
утворює колоїдну частинку – гранулу, знак заряду якої визначається знаком заряду
потенціаловизначальних йонів:
Гранула
9.
Решта х протиіонів NO3-, поступово дифундує в напрямку розчину і утворює дифузний шар.Гранула, разом із дифузним шаром утворюють електронейтральну міцелу. Якщо стабілізатором є
AgNO3 , гранула має позитивний заряд, і формула міцели така:
Міцела
Будова міцели гідрозолю йодиду
срібла з позитивним зарядом
гранул
10.
Якщо стабілізатором цього золю є KJ, то отримаємо золь AgJ з негативним зарядом гранули:Будова міцели гідрозолю
йодиду срібла з негативним
зарядом гранул
Отже, змінюючи співвідношення між кількостями реагуючих речовин, можна
отримати золь з позитивним або негативним зарядом гранули.
11.
12.
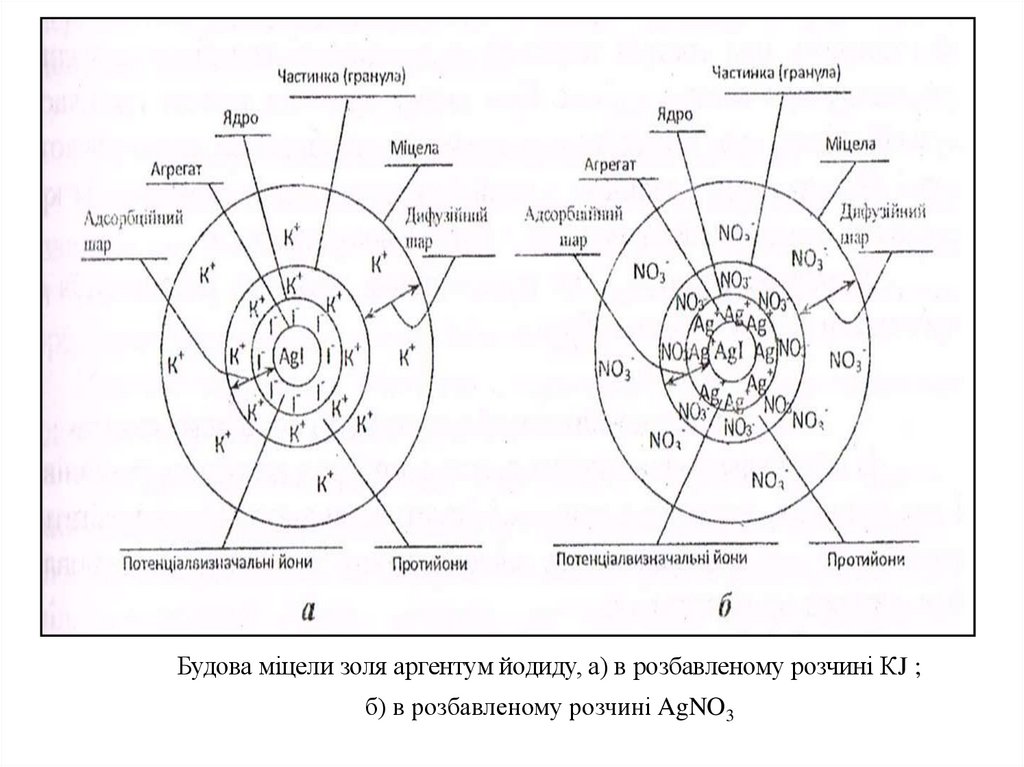
Будова міцели золя аргентум йодиду, а) в розбавленому розчині КJ ;б) в розбавленому розчині AgNO3
13.
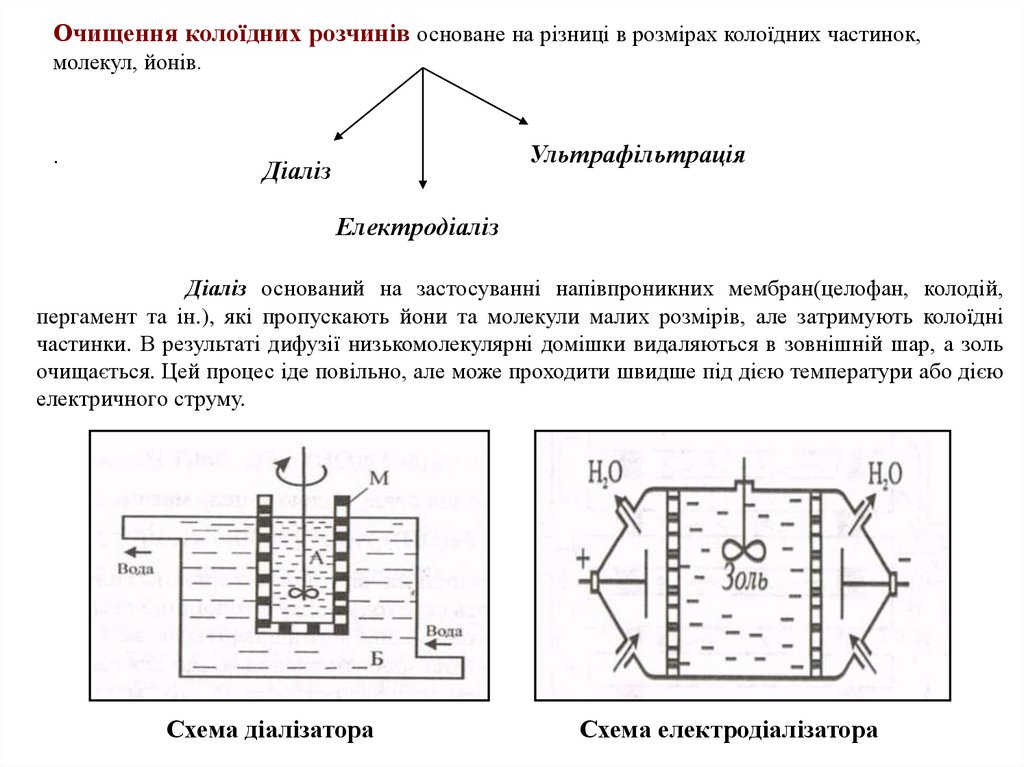
Очищення колоїдних розчинів основане на різниці в розмірах колоїдних частинок,молекул, йонів.
.
Ультрафільтрація
Діаліз
Електродіаліз
Діаліз оснований на застосуванні напівпроникних мембран(целофан, колодій,
пергамент та ін.), які пропускають йони та молекули малих розмірів, але затримують колоїдні
частинки. В результаті дифузії низькомолекулярні домішки видаляються в зовнішній шар, а золь
очищається. Цей процес іде повільно, але може проходити швидше під дією температури або дією
електричного струму.
Схема діалізатора
Схема електродіалізатора
14.
Ультрафільтрація –метод очищення колоїдних розчинів фільтруванням їх підтиском або у вакуумі крізь ультрафільтри, які пропускають дисперсійне середовище разом із
низькомолекулярними домішками, але затримують частинки колоїдних розмірів. Як мембранні
фільтри використовують полімерні плівки з розміром пор 10-8 -10-7 м, які виготовлені з
нітроцелюлози, ацетату целюлози, скловолокна. Метод використовують для фракціонування
дисперсних систем, а також визначають розміри частинок. Так було визначено розміри деяких
вірусів і бактеріофагів.
Схема приладу для ультрафільтрації
15.
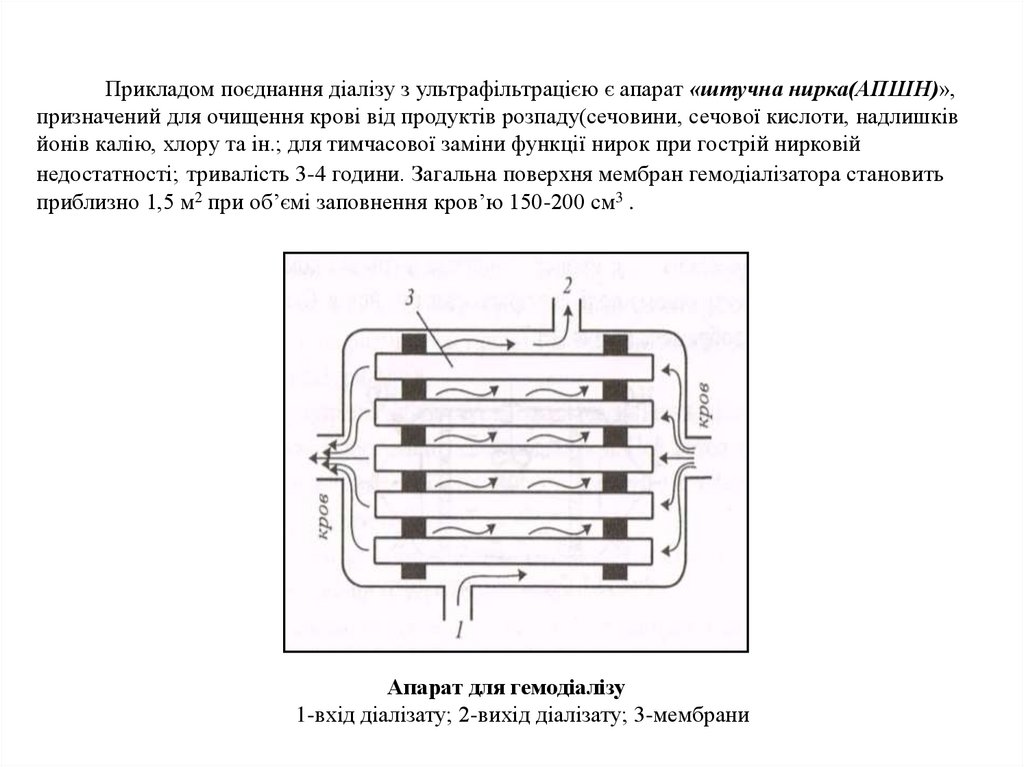
Прикладом поєднання діалізу з ультрафільтрацією є апарат «штучна нирка(АПШН)»,призначений для очищення крові від продуктів розпаду(сечовини, сечової кислоти, надлишків
йонів калію, хлору та ін.; для тимчасової заміни функції нирок при гострій нирковій
недостатності; тривалість 3-4 години. Загальна поверхня мембран гемодіалізатора становить
приблизно 1,5 м2 при об’ємі заповнення кров’ю 150-200 см3 .
Апарат для гемодіалізу
1-вхід діалізату; 2-вихід діалізату; 3-мембрани
16.
Оптичні властивості колоїдних системКолоїдно-дисперсні системи характеризуються оптичною неоднорідністю.
Їхні оптичні властивості визначаються взаємодією світла з частинками дисперсної
фази.
При проходженні світла через дисперсну систему воно може поглинатися,
відбиватися або розсіюватися частинками.
Поглинання світла властиво будь-яким дисперсним системам.
Відбивання світла поверхиею частинок можливе тільки в
грубодисперсних системах (суспензіях, емульсіях). Відбивання світла проявляється в
помутнінні дисперсних систем.
Характерною оптичною властивістю для типових колоїдних систем
є розсіювання світла в усіх напрямках - явище дифракції.
При спостереженні
за колоїдним розчином при боковому освітленні спостерігається голубувате світіння.
Це світіння називається опалесценцією.
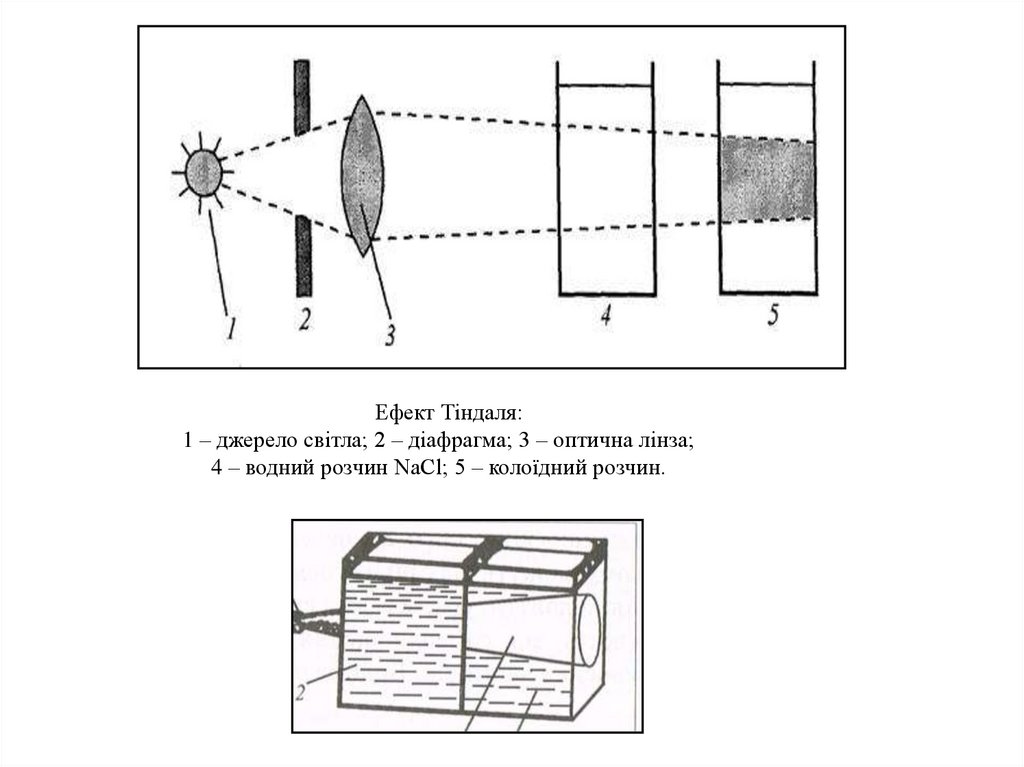
Опалесценція – дифракційне розсіювання світла в колоїдних системах,
яке супроводжується зміною кольору. З опалесценцією пов’язане специфічне для
колоїдно-дисперсних систем явище – утворення конуса Тіндаля. Ефект Тіндаля
властивий і розчинам білків, які є каламутними.
17.
Ефект Тіндаля:1 – джерело світла; 2 – діафрагма; 3 – оптична лінза;
4 – водний розчин NaCl; 5 – колоїдний розчин.
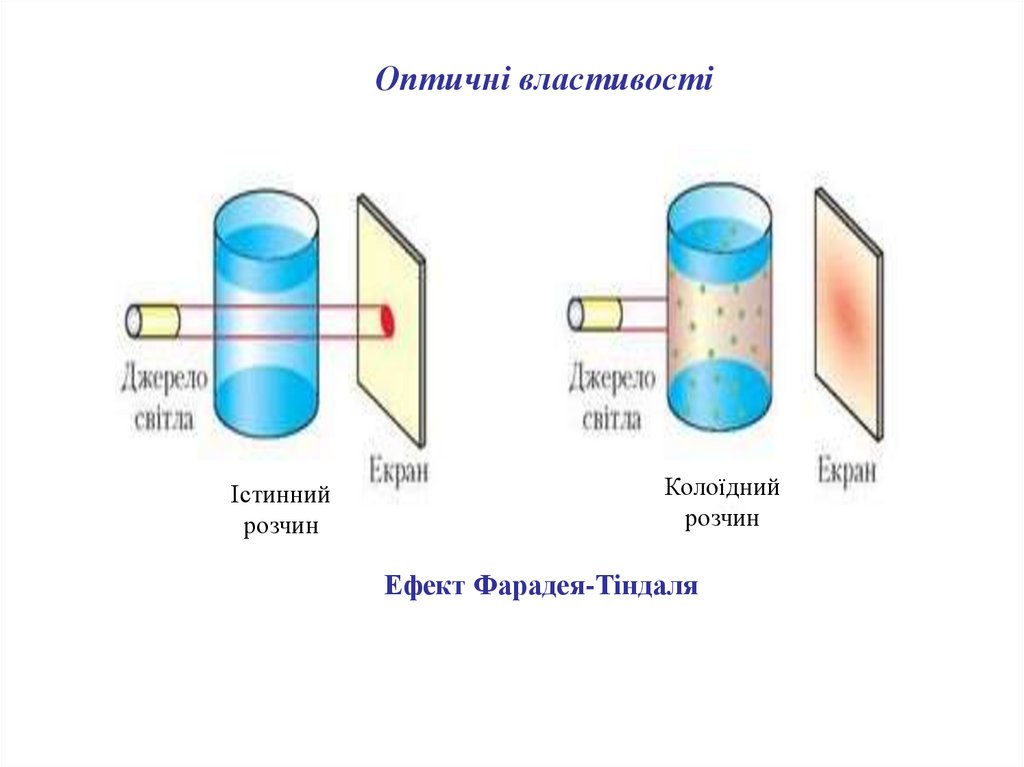
18.
Оптичні властивостіІстинний
розчин
Колоїдний
розчин
Ефект Фарадея-Тіндаля
19.
Електрокінетичні явища. ЕлектрофорезЕлектрокінетичними називають явища, які грунтуються на взаємозв’язку
між електричними та кінетичними властивостями дисперсних систем.
Усі електрокінетичні явища пов’язані з існуванням на межі поділу фаз ПЕШ.
На межі поділу твердої та рідкої фаз виникають певні електричні потенціали.
Потенціалвизначальні йони(ПВЙ), фіксовані на твердій поверхні, створюють
поверхневий φs -потенціал. Частиною поверхневого,
φs
-потенціалу, є
електрокінетичний, або дзета-потенціал (ζ-потенціал).
Під час руху твердої і рідкої фаз одна відносно одної ковзання відбувається не
по поверхні твердої фази, а за межами адсорбційного шару, тобто між гранулою з
частиною протиіонів та дифузним шаром, відбувається розрив ПЕШ. Цю межу наз.
повехнею «ковзання». Саме тут виникає ζ-потенціал. Значення ζ-потенціалу може
досягати 100 мВ.
Кожний тип клітин характеризується певним, досить стабільним значенням ζпотенціалу. Жива протоплазматична поверхня та всі біологічні поверхні, лейкоцити,
еритроцити мають негативний заряд.
У людини величина ζ-потенціалу дорівнює 16,3 мВ при рН=7,4.
20.
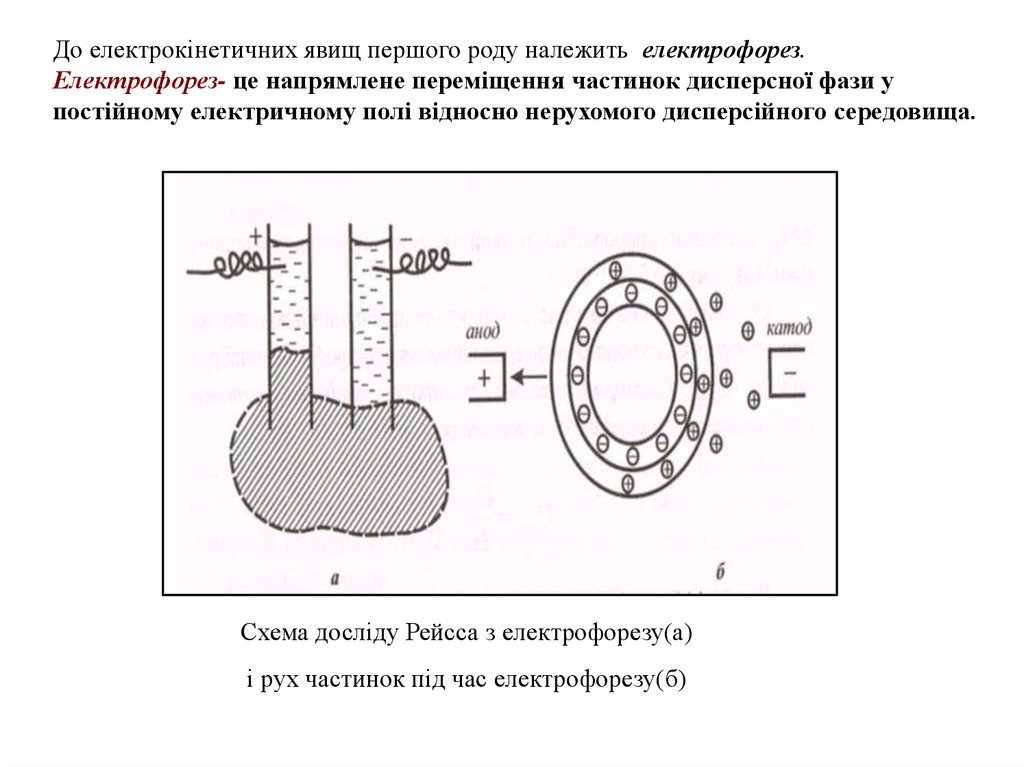
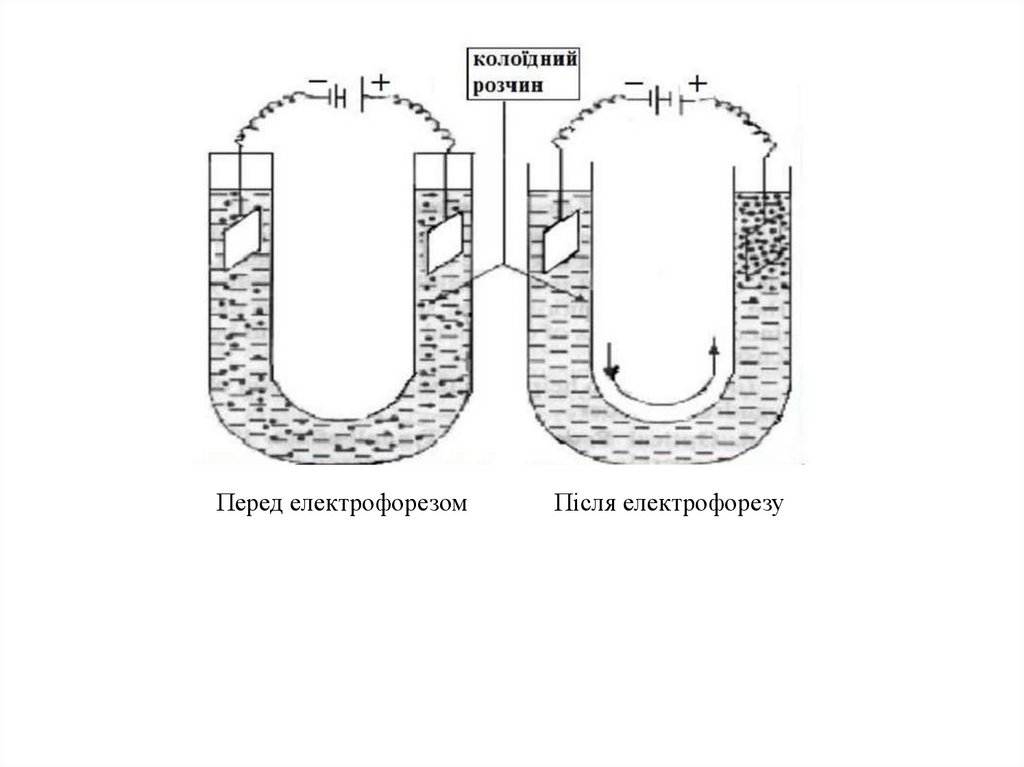
До електрокінетичних явищ першого роду належить електрофорез.Електрофорез- це напрямлене переміщення частинок дисперсної фази у
постійному електричному полі відносно нерухомого дисперсійного середовища.
Схема досліду Рейсса з електрофорезу(а)
і рух частинок під час електрофорезу(б)
21.
Перед електрофорезомПісля електрофорезу
22.
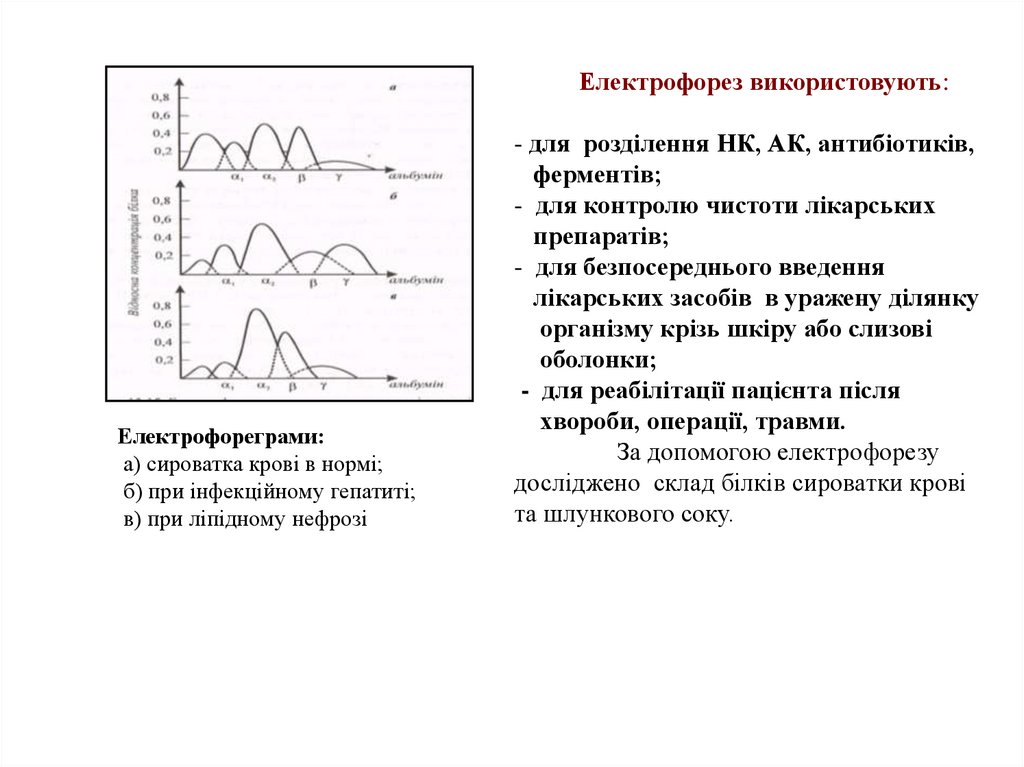
Електрофорез використовують:Електрофореграми:
а) сироватка крові в нормі;
б) при інфекційному гепатиті;
в) при ліпідному нефрозі
- для розділення НК, АК, антибіотиків,
ферментів;
- для контролю чистоти лікарських
препаратів;
- для безпосереднього введення
лікарських засобів в уражену ділянку
організму крізь шкіру або слизові
оболонки;
- для реабілітації пацієнта після
хвороби, операції, травми.
За допомогою електрофорезу
досліджено склад білків сироватки крові
та шлункового соку.
23.
Стійкість дисперсних системСтійкість дисперсної системи - це здатність її впродовж певного часу
зберігати незмінними склад та основні властивості: дисперсність,
концентрацію, рівномірний розподіл частинок диспесної фази в дисперсійному
середовищі та характер взаємодії між частинками.
Колоїдні частинки зазанають дії двох взаємнопротилежних сил взаємодії притягання та відштовхування. Залежно від того, які сили переважають у певній
системі, відбувається або коагуляція, або збільшення стійкості.
Види стійкості дисперсних систем - кінетична та агрегативна.
Кінетична(седиментаційна) стійкість дисперсних систем виявляється
у збереженні рівномірного розподілу частинок у всьому об’ємі системи.
Агрегативна стійкість дисперсних систем –це здатність системи
протидіяти злипанню(агрегації) частинок і тим самим утримувати певний
ступінь дисперсності.
Підвищення температури, з одного боку, збільшує кінетичну стійкість, а з
іншого – сприяє частішим і ефективнішим зіткненням частинок, їх злипанню, тобто
порушенню агрегативної стійкості.
24.
Коагуляція –це процес зменшення дисперсності системи внаслідок укрупненнячастинок дисперсної фази.
Найважливішим чинником коагуляції золів є дія електролітів. Вони дуже швидко і різко
впливають на ПЕШ та величину ζ-потенціалу –один із головних чинників стійкості дисперсних
систем. Мінімальне значення ζ-потенціалу, за якого золь стійкий, називають критичним
(ζкр = 30мВ).
Основні правила електролітної коагуляції:
1. З помітною швидкістю коагуляція відбувається лише за певної кількості введеного електроліту.
Мінімальну концентрацію електроліту в мілімолях, яка здатна спричинити
коагуляцію 1 дм3 золю, наз. порогом коагуляції(Спор), або критичною концентрацією(Ск ).
Початок явної коагуляції визначають за такими ознаками: зміною забарвлення
системи, виникненням каламуті. Поріг коагуляції обчислюють за формулою:
де Vел – об’єм електроліту, см3 , що спричинив коагуляцію; Сел -концентрація електроліту,
ммоль/дм3 ; Vзолю -об’єм золю, в см3 . Величину, обернену порогу коагуляції, називають
коагуляційною здатністю(Vк )
1
Vк = ------.
Спор
25.
2. Коагулювальну дію виявляє не вся молекула електроліту, а лише той з її йонів, знакякого протилежний знаку заряду гранули. Ці йони електроліту наз. коагуляційними,
або йонами коагуляторами (М.Гарді 1900р).
3. За правилом Шульце, коагуляційна здатність йона тим більша, чим більший його
заряд Тому найменший поріг коагуляції
мають електроліти, що містять
багатовалентний йон-коагулятор.
Поріг коагуляції є оберненим до заряду йона(z) у шостому степені:
1
Спор = ------ .
z6
26.
Коагуляція в біологічних системахКров є системою, в якій дисперсною фазою є формені елементи(еритроцити,
лейкоцити, тромбоцити), а дисперсійним середовищем – плазма. Плазма високодисперсна система, що містить розчинені в воді білки, ферменти, гормони.
Обстеження хворих із різною патологією включає загальний аналіз крові:
- вивчення кількісного та якісного складу формених елементів ,
- швидкості осідання еритроцитів(ШОЕ),
- часу згортання крові.
Ці показники крові здорової людини є стабільними, тому різні їх коливання
мають діагностичне значення. Зміна ШОЕ свідчить про наявність патологічних,
запальних процесів в організмі людини.
В організмі людини кров перебуває в рідкому стані завдяки підтриманню
фізичної рівноваги між системами згортання і протизгортання. Згортання є складним
ферментативним процесом, в якому беруть участь 13 плазмових і 12 тромбоцитарних
факторів. Коагулювальною фазою цього процесу є утворення кров’яного згустка –
коротких ниток фібрину із фібриногену крові під впливом тромбіну. Отже, спинення
кровотечі(гемостаз) здійснюється через послідовно діючі механізми , що захищають
організм від крововтрат.
До плазмових факторів процесу згортання крові належать йони Кальцію,
тому при консервуванні крові їх усувають добавлянням натрій цитрату або
катіонітним методом.
Основними антикоагулянтами крові є гепарин і дикумарин.
27.
Колоїдний захистКолоїдний захист проводять при додаванні речовин-стабілізаторів, якими
можуть бути ПАР або ВМС.
Явище збільшення стійкості колоїдних золів добавлянням невеликих
кількостей ВМС називають колоїдним захистом, а речовину, що його зумовлює, захисною речовиною.
Як захисні
полісахариди.
речовини
в
живих
організмах
виступають
різні
білки,
Кров, сеча є захищеними колоїдами.
Вміст захисних речовин у біологічних рідинах є сталим.
Однак при деяких захворюваннях, а також за умови старіння організму вміст захисних
білків у крові зменшується, що приводить до порушення лецитино-холестеринової
рівноваги, відкладання холестерину на стінках судин, утворення нерозчинних солей і
каменів у нирках, печінці, протоках травних залоз.
28.
Мікрогетерогенні системиДо мікрогетерогенних відносять дисперсні системи, в яких розмір частинок
становить 10-6 -10-4 м.
Залежно від агрегатного стану речовини дисперсійного середовища
мікрогетерогенні системи поділяють на:
1. Аерозолі та порошки – дисперсійним середовищем є газ.
2. Суспензії, емульсії, піни – системи з рідким дисперсійним середовищем.
Суспензії –це мікрогетерогенні грубодисперсні системи, в яких трерді частинки
дисперсної фази знаходяться в рідкому дисперсійному середовищі.
Найбільш грубодисперсні системи називають зависями.
Висококонцентровані суспензії називають пастами.
Масова частка дисперсної фази в пастах становить 25-75%.
Багато лікарських препаратів, наприклад, синтоміцин, стрептоцид,
камфору, метилсаліцилат, ментол, сірку, цинку оксид використовують у медичній
практиці у вигляді суспензій і паст, переважно для зовнішнього застосування.
29.
Емульсії –це мікрогетерогенні грубодисперсні системи, які складаються з двох рідин, що не
змішуються між собою внаслідок різної полярності. Полярною рідиною в емульсіях
найчастіше буває вода ( *В*), а неполярною - будь-яка органічна рідина(бензен, толуен,
етер, бензин, олія ), *О*(*олія*).
Залежно від того, яка рідина є дисперсною фазою, емульсії поділяють на два типи:
1. Прямі(емульсії першого роду), позначають О/В.
2. Зворотні(емульсії другого роду), їх називають емульсіями води в олії В/О.
До емульсій належить молоко, вершки, майонез, маргарин, яєчний жовток,
латекси, бітумні емульсії препарати для жирування шкір.
В організмі ліпіди переносяться кров’ю у вигляді емульсій.
У медицині багато лікарських речовин застосовують у вигляді емульсій,
причому емульсії О/В використовують для внутрішнього вживання та ін’єкцій,
а емульсії В/О-переважно як зовнішні засоби.
30.
За концентрацією дисперсної фази(об’ємна частка в %) емульсіїподіляють на:
розбавлені, концентровані, висококонцентровані.
Види емульсій
а-розбавлена; б-концентрована;
в -висококонцентрована
31.
Музиченко В.П. та ін. Медична хімія. с.264-31232.
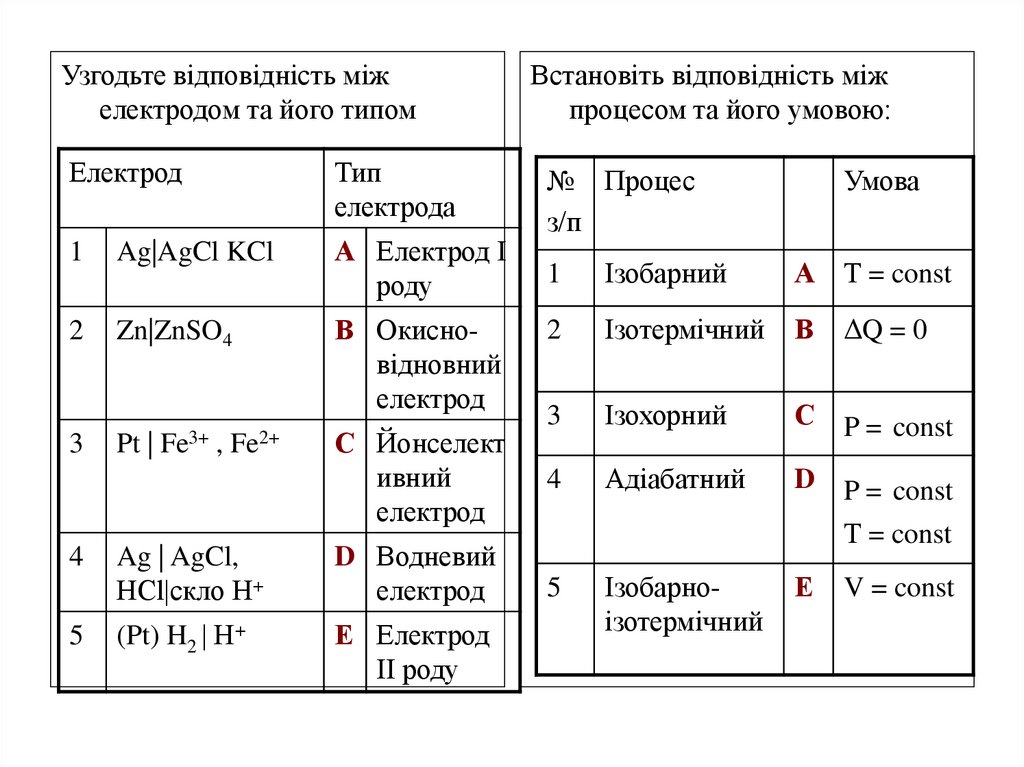
Узгодьте відповідність міжелектродом та його типом
Встановіть відповідність між
процесом та його умовою:
Електрод
Тип
електрода
1
Ag|AgCl KCl
А Електрод І
роду
№ Процес
з/п
2
Zn|ZnSO4
В Окисновідновний
електрод
3
4
5
Pt | Fe3+ , Fe2+
С Йонселект
ивний
електрод
Ag | AgCl,
HCl|скло Н+
D Водневий
електрод
(Pt) H2 | Н+
Е Електрод
ІІ роду
Умова
1
Ізобарний
А
Т = const
2
Ізотермічний
В
ΔQ = 0
3
Ізохорний
С
P = const
4
Адіабатний
D
P = const
Т = const
5
Ізобарноізотермічний
Е
V = const





















 chemistry
chemistry








