Similar presentations:
Поверхневі явища. Адсорбція
1. 2020 Поверхневі явища. Адсорбція
2.
1. Поверхневий натяг рідин та розчинів.Правило Дюкло-Траубе
2. Адсорбція на межі поділу рідина-газ та рідина-рідина.
Рівняння Гіббса
3. Адсорбція на межі поділу тверде тіло-газ. Рівняння Ленгмюра
4. Адсорбція електролітів. Правило Панета-Фаянса
Фізико-хімічні основи адсорбційної терапії (СРС)
3.
Поверхневі явища – це процеси, які відбуваються на межі поділу фаз у гетерогеннихсистемах.
На поверхні поділу фаз відбуваються процеси обміну, синтезу, адсорбції, десорбції,
ферментативні реакції, які забезпечують життєдіяльність організмів.
За агрегатним станом контактуючих фаз поверхні поділу класифікують:
- рухомі межі поділу: рідина-газ(Р-Г);
Р-Р;
- нерухомі межі поділу: тверде тіло-газ (Т-Г); Т-Р; Т-Т.
Будь-яка гетерогенна с-ма на межі поділу фаз має певний надлишок
вільної поверхневої енергії- Gs .
.
Який механізм її виникнення?
4.
Відношення надлишку вільної поверхневої енергії Гіббса до площі поверхні поділуфаз називають поверхневим натягом:
Gs
σ = -------,
S
де Gs-вільна поверхнева енергія; S –площа поверхні поділу фаз; σ-поверхневий
натяг. Розмірність –Н/м або Дж/м2 .
Отже, поверхнева енергія системи залежить від поверхневого натягу та
площі поверхні поділу фаз.
Зменшення поверхневого натягу відбувається під час адсорбції.
5.
Сорбція –поглинання; сорбент- речовина, яка поглинає; сорбтив -речовина,що поглинається.
Речовина, на поверхні якої проходить адсорбція- адсорбент; речовина, що
адсорбується –адсорбтив (адсорбат).
Адсорбція – це самочинний процес зміни концентрації компонентів у
поверхневому шарі Сs порівняно з їх концентрацією в об’ємі фази Сv , тобто на
межі поділу фаз рзчин-газ , або розчин-розчин, який залежить від величини
поверхневого натягу цих речовин.
Адсорбція - перехід речовини з зони меншої концентрації у зону більшої
концентрації, що відбувається на межі поділу фаз; накопичення однієї речовини
на поверхні іншої.
Концентрування однієї речовини в об’ємі іншої - абсорбція.
Десорбція –видалення адсорбованих молекул з поверхні адсорбенту.
Швидкість адсорбції з часом зменшується, а швидкість десорбції збільшується.
В залежності від того, що адсорбується – молекули чи йони, розрізняють
молекулярну та йонну адсорбцію.
За природою сил взаємодії розрізняють хімічну адсорбцію (хемосорбцію) та фізичну
адсорбцію.
6.
СорбціяАдсорбція
Сорбент
Адсорбент
Сорбтив
Адсорбтив-Адсорбат
Абсорбція
Десорбція –видалення адсорбованих
молекул з поверхні адсорбенту.
7.
Найпоширенішим розчинником у неживій і живій природі є вода. Стосовно води усіречовини поділяють на:
- поверхнево-активні,
- поверхнево-неактивні(поверхнево-інактивні),
- поверхнево-індиферентні.
Поверхнево-активні речовини (ПАР) - це сполуки, що адсорбуються на
поверхні поділу фаз(Сs > Сv ) і зменшують поверхневий натяг води (σр-ну < σводи).
ПАР поділяють на аніонактивні, катіонактивні, неіоногенні та
амфолітні (амфотерні).
У молекулі ПАР розрізняють дві частини: неполярну(вуглеводневий
ланцюг) та полярну(функціональна група -ОН, -СООН, -NH2 , -SO3H.
8.
До ПАР належать спирти, жирні к-ти та їх солі(мила), сульфок-ти таінші класи органічних сполук.
Вуглеводнева частина молекули гідрофобна(відштовхує воду);
полярна група, взаємодіє з водою, є гідрофільною( тобто притягує воду).
Молекули, що мають таку будову називаються дифільними. У
дифільних молекул з короткою гідрофобною частиною(нижчі представники
гомологічних рядів) переважають гідрофільні властивості, тому вони легко
розчиняються в воді. Зі збільшенням довжини вуглеводневого радикалу
посилюються гідрофобні властивості речовин, знижується їх розчинність у
воді і зменшується власний поверхневий натяг.
Поверхнево-неактивні(ПНР) - речовини, які збільшують
поверхневий натяг води (σр-ну > σводи), концентрація (Сs < Сv ). До ПНР
належать неорганічні кислоти, основи, солі та деякі дуже полярні органічні
сполуки(гліцерол, АК тощо).
Поверхнево-індиферентні(ПІР) - речовини, що не змінюють
поверхневий натяг розчинника((σр-ну = σводи), так як їх поверхнева і об’ємна
концентрації однакові(Сs = Сv ). Прикладом є сахароза та інші вуглеводи ,
форміатна кислота НСООН.
9.
Як орієнтуються молекули ПАР у поверхневому шарі і якзмінюєтьсяються при цьому
поверхневий натяг?
Г-газоподібна плівка; Р+Г-часткова конденсація;
Р-повністю конденсована плівка
Поверхневу плівку з одного шару молекул ПАР, що утворюється на межі поділу
називають моношаром.
10.
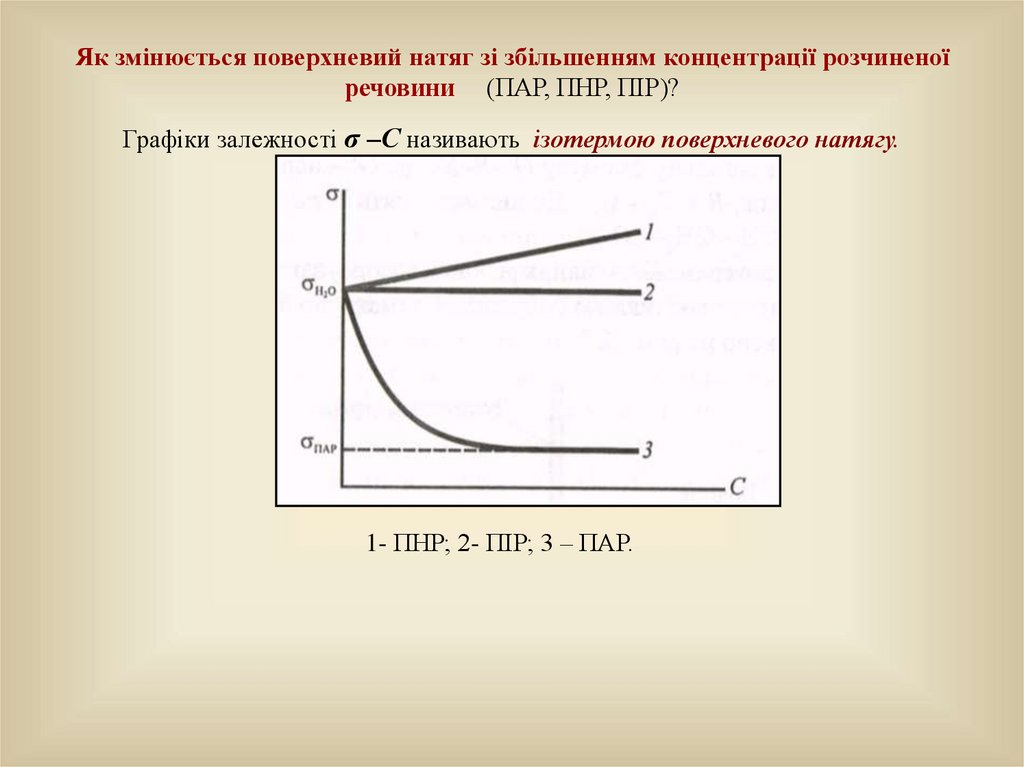
Як змінюється поверхневий натяг зі збільшенням концентрації розчиненоїречовини (ПАР, ПНР, ПІР)?
Графіки залежності σ –С називають ізотермою поверхневого натягу.
1- ПНР; 2- ПІР; 3 – ПАР.
11.
Здатність ПАР знижувати поверхневий натяг кількісно виражаютьповерхневою активністю. Поверхневу активність визначають як відношення зміни
поверхневого натягу до зміни концентрації ПАР.
dσ
G = ± -------.
dc
dσ
Концентрація ПАР збільшується, поверхневий натяг зменшується, то ------ < 0.
адсорбція є додатньою величиною (Г> 0);
dc
Для ПНР зі зростанням концентрації, поверхневий натяг збільшується, поверхнева
активність є додатньою величиною
dσ
------ > 0. адсорбція є від’ємною,
негативною (Г<0),
dc
тобто ПНР не адсорбуються на межі поділу, а розподіляються в усьому об’ємі розчину
Графік залежності величини адсорбції від концентрації Г=ƒ(С) називають
ізотермою адсорбції.
12.
Кількісну залежність величини адсорбції на поверхні розчин-повітря відконцентрації ПАР і поверхневого натягу описує рівняння Гіббса (1878) :
С
dσ
Г= - ------ ۰ --------- ,
RT
dc
де Г –величина адсорбції розчиненої речовини, моль/м2 ; С –загальна
концентрація розчину, моль/м3 ; R-газова стала; Т-абсолютна температура, К;
dσ
± -------. – поверхнева активність G .
dc
Рівняння Гіббса є математичним обгрунтуванням загального правила:
речовина, що зменшує поверхневий натяг, концентрується в поверхневому
шарі.
13.
Від чого залежить поверхнева активність ПАР?Поверхнева активність дифільних молекул залежить від довжини
вуглеводневого радикалу.
У певному гомологічному ряду(жирних кислот, спиртів та інших
дифільних сполук) у водних розчинах однакової концентрації зі
збільшенням довжини вуглеводневого радикалу на одну групу –СН2 –
поверхнева активність збільшується у 3-3,5 раза – правило П.Дюкло,
І.Траубе(1831)
де G –поверхнева активність; n –число груп–СН2 –; β –коефіцієнт Траубе.
Правило Дюкло-Траубе найточніше виконується за низьких концентрацій
розчинених речовин.
14.
Уявлення про структуру біологічних мембранМембрана має будову рідкого кристала. При переході мембрани з
рідкокристалічного стану в упорядкований її робота гальмується. У такому
стані спостерігається розвиток патологічних процесів в організмі –
атеросклероз, утворення жовчних каменів тощо.
Схематичне зображення
дволанцюгової
амфіфільної
молекули(а) та
плоского подвійного
шару фосфоліпідів(б)
15.
Адсорбція на межі поділу тверде тіло – газМежі поділу між твердим тілом і газом та твердим тілом і розчином
належать до нерухомих меж поділу фаз.
Для характеристики цього виду адсорбції американський учений
І.Ленгмюр запропонував теорію мономолекулярної адсорбції.
Основні положення:
1. Адсорбція має локалізований характер, молекули адсорбату не можуть
переміщуватися по поверхні адсорбенту, між адсорбованими молекулами
й поверхневим шаром відсутня будь-яка взаємодія.
2. Адсорбція молекул адсорбтиву відбувається на активних(адсорбційних)
центрах твердої поверхні. Кожен такий центр адсорбує лише одну
молекулу адсорбтиву, тому на поверхні адсорбенту утворюється лише
мономолекулярний шар адсорбату.
3.
Адсорбовані молекули постійно десорбуються й перебувають в
адсорбованому стані мільйонні частки секунди. Між процесом адсорбції
та десорбції встановлюється адсорбційна рівновага, унаслідок якої
розподіл молекул газу між поверхнею та об’ємом залишається сталим.
16.
Тверді адсорбенти-це природні і штучні матеріали з великою зовнішньоюі внутрішньою поверхнями, на яких відбувається процес адсорбції.
Непоруваті адсорбенти(порошкоподібні речовини) мають значну зовнішню
поверхню, а поруваті(силікагель, активоване вугілля, алюмогелі тощо) –
внутрішню за рахунок великої кількості мікропор.
Площа поверхні однієї таблетки
активованого вугілля(0,25 г) досягає
125 м2 , тому його використовують у
медичній практиці як ефективний
дезінтоксикаційний засіб.
“карболен”
17.
Залежно від природи адсорбційних сил розрізняють два видиадсорбції: фізичну та хімічну(хемосорбцію).
Фізична адсорбція
- зумовлена дією силових полів поверхневих молекул адсорбенту, слабких
сил міжмолекулярної взаємодії;
- молекули адсорбату не втрачають своєї індивідуальності;
- поверхня адсорбента неоднорідна і адсорбція відбувається лише на окремих
«активних центрах», які мають надлишкову поверхневу енергію;
- вона оборотна й зменшується при підвищенні температури.
Приклад: вбирання благородних газів активованим вугіллям.
Хімічна адсорбція
- зумовлена силами хімічної взаємодії між поверхневими молекулами
адсорбенту та адсорбату;
- на поверхні адсорбенту утворюються хімічні сполуки, і окремі молекули
втрачають свою індивідуальність;
- вона необоротна й збільшується з підвищенням температури.
Прикладом хемосорбції є реакція у протигазах з використанням
адсорбенту-активованого вугілля:
СОCl2 +Н2О→СО2 + 2НCl.
18.
На основі експериментальних даних Ленгмюр запропонував рівнянняізотерми адсорбції, яке встановлює залежність адсорбції від тиску за сталої
температури
Його можна застосовувати і до мономолекулярної адсорбції з розчинів.
Якщо молекули розчиненої речовини адсорбуються на поверхні
адсорбенту, а їх концентрація дорівнює С, то
де К-константа адсорбційної
рівноваги; Гmax -гранична
максимальна адсорбція; С і р –
концентрація і тиск адсорбтиву; хкількість молів адсорбтиву; m-маса
адсорбента,
19.
Загальний виглядізотерми адсорбції
Ленгмюра
Адсорбційний молекулярний шар на поверхні поділу рідина-газ, як і
нерозчинний мономолекулярний шар на поверхні поділу тверде тіло-газ,
називають частоколом Ленгмюра:
20.
Адсорбція з розчину на поверхні твердого тілаАдсорбція з розчинів залежить від природи розчиненої речовини та її
концентрації, природи розчинника та адсорбенту.
Її особливості:
1. Розчин складається принаймні з двох компонентів, розчинника і
розчиненої речовини, то адсорбція з розчину – це адсорбція із суміші.
2. На поверхні адсорбенту, поряд з адсорбцією розчиненої речовини,
відбувається адсорбція розчинника.
3. Молекули розчинника конкурують з молекулами розчиненої речовини за
адсорбційні центри на поверхні твердого тіла.
Тому можливі два види адсорбції з розчинів: позитивна(додатна), коли
молекули розчиненої речовини адсорбуються краще за молекули
розчинника, і негативна(від’ємна), коли молекули розчинника
адсорбуються краще за молекули розчиненої речовини.
Залежніцсть адсорбції речовин(газуватих або твердих) від їх концентрації у
розчині описують емпіричним рівнянням Фрейндліха:
21.
де х-кількість речовини адсорбтиву, моль; m -маса адсорбенту; р –рівноважний тиск; С –рівноважна концентрація; k і 1/n –емпіричні
константи. Константа k залежить від властивостей адсорбенту, адсорбату,
температури й має назву питомої адсорбції,
Чим вищий тиск або концентрація розчиненої речовини, то більша
кількість речовини адсорбується на поверхні адсорбенту
Її застосовують:
- для очищення організму від чужорідних речовин(отрут, токсинів, великих
доз сильнодіючих лікарських препаратів;
- очищення питної та стічних вод;
- очищення цукру від забруднень;
- у промисловості для очищення газів.
22.
Молекулярна адсорбціяДля молекулярної адсорбції характерні такі закономірності:
Адсорбція –вибірковий процес, який залежить від:
1. полярності адсорбента;
2. полярності розчинника.
Акад.П.Ребіндер сформулював правило вирівнювання полярностей:
на полярних адсорбентах краще адсорбуються полярні речовини із
неполярних або малополярних розчинників, а на неполярних
адсорбентах –неполярні речовини із полярних розчинників.
Отже, процес адсорбції відбувається у бік вирівнювання полярностей фаз,
причому чим більша різниця полярностей, тим швидше відбувається цей
процес.
23.
Адсорбція електролітів з розчинівАдсорбцію на твердій поверхні з розчинів електролітів називають йонною.
При цьому йони , зазвичай, адсорбуються на полярних адсорбентах.
Йонна адсорбція – це хімічна взаємодія між йонами розчиненої речовини
і твердою поверхнею адсорбента. Особливістю такої адсорбції є те, що
на межі поділу тверде тіло-рідина виникає подвійний електричний шар.
Тому поверхня адсорбенту набуває певного заряду, наявність якого
спричиняє притягання з розчину йонів протилежного знака.
Залежно від механізму процесу розрізняють вибіркову та йонообмінну
адсорбцію сильних електролітів.
Вибіркова(селективна) адсорбція визначається процесом адсорбції катіонів
або аніонів і підпорядковується правилам вибіркової адсорбції, які
сформульовані Панетом і Фаянсом.
1. Кристалічну гратку адсорбенту добудовують ті йони електроліту, що
входять до її складу, ізоморфні з її йонами або ті, що утворюють з ними
важкорозчинні сполуки.
2. На твердій поверхні адсорбенту адсорбуються тільки ті йони, знак заряду
яких протилежний знаку заряду поверхні адсорбенту.
24.
AgNO3 +KJ = AgJ↓ +KNO3 ,Схема адсорбції йодид-іонів на
поверхні кристала аргентум
йодиду(а) та виникнення ПЕШ(б)
25.
Йонообмінна адсорбція –це процес еквівалентного обміну однойменнозарядженими йонами між
адсорбентом і розчином.
Адсорбенти, на поверхні яких відбувається процес еквівалентного
обміну, називають йонообмінниками.
Йонообмінники не розчинні ні у воді, ні у кислотах, ні у лугах.
Йонообмінники бувають неорганічні і органічні, природні(глина, грунт та
інші мінерали) та синтетичні(йоніти), йонообмінні смоли- високомолекулярні
сполуки. За природою йоногенних груп їх поділяють на катіоніти (кислотні
йоніти), аніоніти( основні йоніти), амфоліти.
Ця адсорбція використовується:
- для декальцинування крові і коров’ячого молока;
- пом’якшення і обезсолювання води;
- для очистки ліків та біологічно активних речовин-вітамінів, антибіотиків,
білків;
- визначають кислотність шлункового соку, регулюють склад йонного
середовища у ШКТ.
Йонний обмін відбувається за схемою:
2Н-катіоніт+СаCl2 →Са(катіоніт)2 + 2НCl
Аніоніт –ОН + НCl→Аніоніт-Cl +Н2О
26.
Хроматографія-це фізико-хімічний метод розділення і аналізу суміші газів, випарів, рідин
або розчинених речовин за допомогою сорбційних процесів.
Метод грунтується на різному розподілі компонентів суміші між двома
фазами – рухомою(РФ) та нерухомою(НФ) Метод відкритий в 1903р
М.Цвєтом, який вперше застосував його для розділення рослинних пігментів.
Речовини, що складають нерухому фазу, називають сорбентами,
переважно це тверді речовини. Як сорбенти використовують силікагель,
алюміній оксид тощо.
Рухома фаза –це потік рідини або газу, що фільтрується крізь шар
сорбенту. Вона виконує функції розчинника і носія суміші речовин, які
аналізують, і її називають сорбатом.
Хроматографію широко використовують у наукових дослідженнях та у
практиці лабораторій з контролю якості лікарських препаратів, клінічних та
хіміко-токсикологічних лабораторій.
27.
Музиченко В.П. та ін. Медична хімія. с.240-259Фізикохімія дисперсних систем
28.
Дайте відповіді на питання1. Встановіть відповідність між наведеними величинами:
Речовини
Приклади
Властивості
1. Поверхневоактивні
А. НСООН,
С12Н22О11
а) збільшують
поверхневий
натяг води
2. Поверхневонеактивні
В. СаCl2, H2SO4, б) зменшують
NaOH
поверхневий
натяг води
3. Поверхневоіндиферентні
С. С15Н31СООК,
С8Н17ОН
в) не змінюють
поверхневого
натягу води
29.
2. Який принцип дії біологічних мембран?А. Пропускають тільки молекули води;
В. Не пропускають молекули води;
С. Вибірково пропускають певні йони або молекули;
D. Проникні для будь-яких йонів або молекул.
3. Вкажіть правильні твердження щодо адсорбції та адсорбентів:
1. Адсорбція є різновидом сорбції;
2. Абсорбція – це процес, зворотний адсорбції;
3. Добрими адсорбентами є: активоване вугілля, силікагель, глини;
4. Адсорбенти мають велику внутрішню поверхню;
5. Процесом, зворотним адсорбції, є десорбція.




























 chemistry
chemistry








