Similar presentations:
Кислотно-щелочное равновесие
1.
Кислотнощелочноеравновесие
Врач
анестезиолог-реаниматолог
отделения АРИТ новорожденных
Перинатального центра
ГБУ РС(Я) «ЯРКБ»
Попов Сергей Владимирович
2.
Кислотно-щелочное равновесие– соотношение концентрации
водородных и гидроксильных
ионов в жидкостях организма
рН артериальной крови 7,35 – 7,45
pH венозной крови 7,26-7,36
pH клеток тканей 6,9-7,2
pH спино-мозговой жидкости 7,4-7,6
pH лимфы 7,35-7,4
рН желудочного сока 1,0-2,0
рН желчи 7,5-8,0
рН кишечного сока 7,8 – 8,0
рН мочи 5,3 -6,5
3.
Синонимы кислотнощелочногоравновесия:
кислотно-основное равновесие,
кислотно-щелочной баланс,
кислотно-щелочное состояние,
кислотно-основное состояние.
4.
Кислотно-щелочноеравновесие отражает
клеточный метаболизм,
газотранспортную функцию крови,
внешнее дыхание,
водно-солевой обмен.
Изменение показателей кислотно-щелочного
равновесия наступает при нарушениях
газового обмена, метаболизма в тканях и
отражает степень тяжести этих нарушений.
5.
Образование ионов водородаОбмен веществ в
клетке
Углеводы
Белки
Жиры
H+
Жизнедеятельность клетки
возможна при
концентрации
иона водорода в строгих
пределах:
20 - 160 нмоль/л в
артериальной крови
(рН от 6,8 до 7,8)
pH Мирового океана
варьируется в пределах
7,2-8,4
6.
Кислотно-основной балансpH = - log aH+
Шкала pH ранжируется от 0 до 14
КИСЛАЯ
pH
НЕЙТР.
ЩЕЛОЧНАЯ
0
7
14
[H+] 1 mol/L
10-7 mol/L
10-14 mol/L
7.
Изогидрия – постоянство рН,обусловленное действием
буферных систем и
физиологическим контролем.
В норме кислотно-основной баланс
поддерживается тремя механизмами:
Буферные системы
Респираторный контроль CO2
Почечная компенсация
8.
Буферные системыорганизма, которые
устраняют сдвиги рН
1 бикарбонатная,
2 фосфатная,
3 белковая,
4 гемоглобиновая.
9.
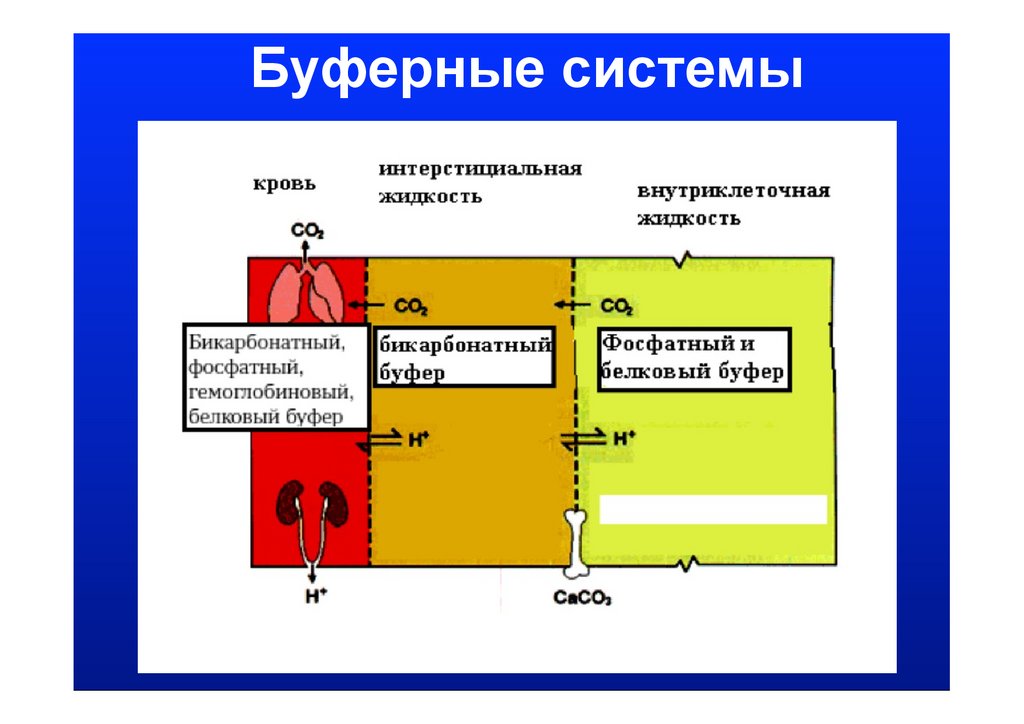
Буферные системы10.
Буфер - это вещество, способное связывать ивысвобождать ионы водорода (Н+) в растворе,
тем самым поддерживая рН раствора
относительно постоянным.
Основные буферные системы крови:
• Белки:
Н-белок
• Бикарбонат:
H2CO3
H+ + Белок-
H+ + HCO3Буферные основания (BB)
Избыток оснований (ВЕ) = Истинные ВВ- Нормальные ВВ
BE — base excess, BB — buffer base
11.
Углекислота – системабикарбоната
Фермент
карбоангидраза
Быстро и
самопроизвольно
12.
Время, необходимое дляустранения сдвига рН
Буферные системы - 30 секунд
Дыхательный контроль - 1-3 минуты.
Выделительная функция почек - 10-20 часов.
pН в первую очередь регулируется
уравнением Henderson-Hasselbalch
[HCO3- ]
pH = 6,1 + log
0,03 * pCO2
13.
pСО2 (парциальноеАльвеолы
давление
углекислоты)
35-45 мм.рт.ст. CO2
дыхательный
компонент КЩС.
pCO =
- повышается при
дыхательном ацидозе,
- снижается при
дыхательном алкалозе.
2
40 мм.рт.ст.
Капилляры
CO2
pCO2 =
45 мм.рт.ст.
14.
HCO3- (стандартные бикарбонаты)21-25 ммоль/л – метаболический
компонент кислотно-щелочного
равновесия
- повышается при метаболическом алкалозе,
- снижается при метаболическом ацидозе.
Кровь
Клетки почек
Моч
а
15.
ВВ (buffer base) – буферные основания –сумма оснований всех буферных систем
крови: 40 – 60 ммоль/л,
ВЕ (base excess) – избыток или дефицит
оснований, то есть разница между реальной
и нормальной концентрациями буферных
оснований.
Пределы нормы ± 2,3 ммоль/л.
Изменяется при метаболическом характере
нарушений:
избыток - при алкалозе,
дефицит - при ацидозе.
16.
Кислотно-основные нарушенияНормальный уровень pH крови 7.35 - 7.45
Ацидоз
Алкалоз
pH крови
pH снижение 7.35 - 7.45
повышение
Ацидоз или алкалоз вызываются
дыхательными или метаболическими
нарушениями
17.
Респираторныйацидоз
pH
pCO2
- передозировка
седативных препаратов,
- мышечная слабость,
- неадекватная ИВЛ,
- дыхательная
недостаточность
различной этиологии (отек
легких, РДСН,
пневмоторакс, обструкция
дыхательных путей и т.д.)
- злокачественная
гипертермия.
Респираторный
алкалоз
pH
pCO2
- лихорадка,
- застойная
сердечная
недостаточность,
- сепсис,
- неадекватная ИВЛ,
- психогенная
гипервентиляция,
- врожденные пороки
сердца,
- поражение ЦНС
различной этиологии.
18.
Метаболическийацидоз
pH
HCO3-
- почечная
недостаточность,
- диабет (продукция
кетокислот),
- анаэробный метаболизм
(продукция молочной
кислоты),
- избыточное поступление
белков,
- диарея (потеря HCO3- ),
- сепсис,
- шок различной этиологии.
Метаболический
алкалоз
pH
HCO3-
- рвота (потеря H+ ),
- внутривенное введение
бикарбоната,
- поступление щелочных
субстанций,
+
- дефицит K (повышенная
+
экскреция почками H ),
- врожденная хлоридорея,
- гиперальдостеронизм,
- синдром Кушинга,
- массивное переливание
крови
- врожденная желудочнотолстокишечная фистула.
19.
20.
21.
У новорожденногопервые 2 суток жизни наблюдается
физиологический ацидоз.
Это смешанная форма:
компонент газового ацидоза – гиперкапния,
компонент метаболического – увеличение
концентрации лактата.
Некомпенсированный ацидоз у
новорожденного – это ацидоз, чаще всего
связанный с:
развитием гипоксии у плода во время родов,
незрелостью дыхательного центра,
незрелостью почек.
22.
60HCO3
50
40
35
30
25
20
15
10
9
8
7
6
4
3
10
pH
8.0
7.9
7.8
7.7
7.6
7.5
7.4
7.3
7.2
7.1
7.0
6.9
6.8
6.7
6.6
PCO2
15
20
25
30
35
40
50
60
70
80
90
100
110
120
130
140
150
23.
60М
50
HCO
3
Е
40
Т
35
А
30
Б
25
О
Л
20
И
Ч
15
Е
С
К
10
И
9
Й
8
7
6
10
pH
PCO2 Р
8.0
7.9
7.8
7.7
7.6
7.5
7.4
7.3
7.2
7.1
7.0
6.9
6.8
6.7
15
6.6
80
90
20
25
30
35
40
50
60
70
Е
С
П
И
Р
А
Т
О
Р
Н
Ы
Й
HCO3, pH и PCO2 в пределах заштрихованных
110
областей — нормальные газы крови
130
140
3
24.
Лабораторная диагностика нарушенийкислотно-щелочного состояния
Тип нарушения
рСО2
ВЕ
HCO3-
Респираторный
ацидоз
Повышение
Без изменения
Без
изменения
Метаболический
ацидоз
Без изменения Снижение
Снижение
Респираторный
алкалоз
Снижение
Без
изменения
Метаболический
алкалоз
Без изменения Повышение
Без изменения
Повышение
25.
60HCO50
3
40
35
30
25
20
15
10
9
8
10
pH
8.0
7.9
7.8
7.7
7.6
7.5
7.4
7.3
7.2
7.1
7.0
6.9
6.8
6.7
PCO2
15
20
25
30
35
40
50
60
70
7
80
1. Участок
pH и PCO2 6.6
90
2. Расчет HCO3 при соединении точек рН
и РСО2 получаем
точку на шкале НСО
3
120
4
130
3. Всегда будут линейные соотношения
3
26.
60HCO50
3
40
М
Е
Т
А
Б
О
Л
И
Ч
Е
С
К
И
Й
35
30
25
20
15
10
9
8
7
6
4
3
10
pH
8.0
7.9
7.8
7.7
7.6
7.5
7.4
7.3
7.2
7.1
7.0
6.9
6.8
6.7
6.6
PCO2
15
20
25
30
35
40
50
60
70
80
90
100
120
130
140
150
Р
Е
С
П
И
Р
А
Т
О
Р
Н
Ы
Й
27.
Правило №1: Думайте о CO2 как о кислотеПравило №2: Думайте о HCO3 как об
основании
Правило №3: Если pH нормальный, то
нужно смотреть изменения CO2 и HCO3
Правило №4: Если pH низкий, то нужно
смотреть за счет какого ацидоза
Правило №5: Если pH высокий, то
нужно смотреть за счет какого алкалоза
28.
60М
Е
Т
HCO50
3
40
35
30
25
А
20
Б
15
О
Л
И
Ч
10
9
8
7
pH
7.18.30
PCO
pH 2 7.9
8
HCO 7.18
37.
1
PO 77 .6
2 7.5
5
7.4
7.3
8
7.2
7.1
7.0
6.9
6.8
6.7
6.6
6
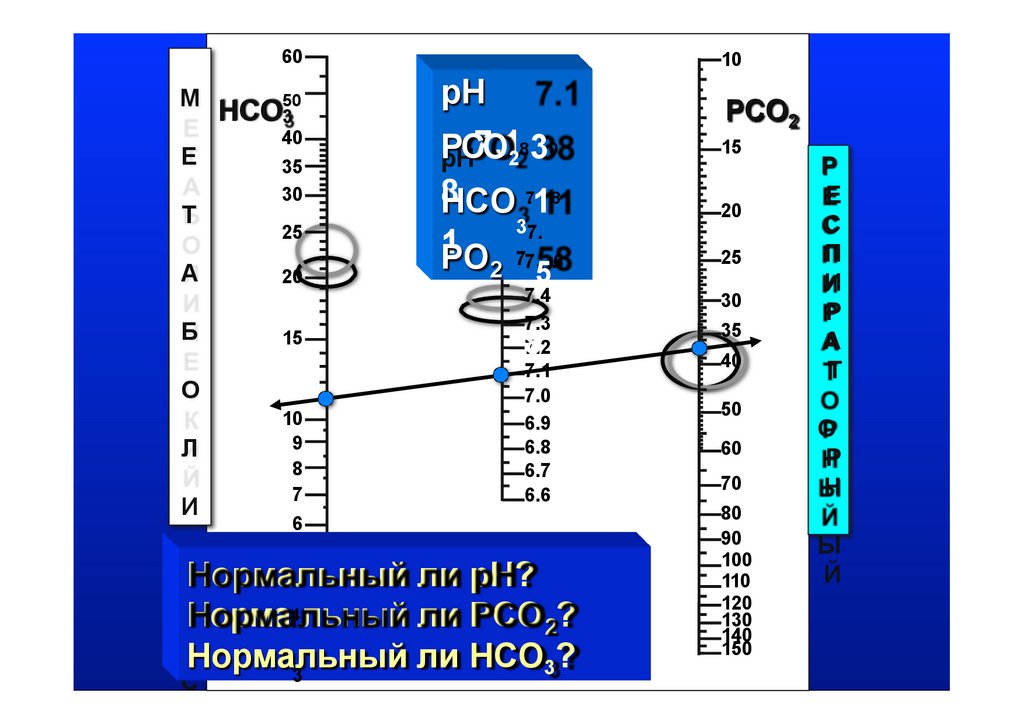
Нормальный ли рН?
ЕНорма4льный ли PCO 2?
Нормальный
ли HCO3?
3
С
10
PCO2
15
20
25
30
35
40
50
60
70
80
90
100
110
120
130
140
150
Р
Е
С
П
И
Р
А
Т
О
Р
Н
Ы
Й
29.
60М HCO50
3
Е
Т
40
35
30
25
А
20
Б
15
О
Л
И
pH
7.18.30
PCO
pH 2 7.9
8
HCO 7.18
37.
1
PO 77 .6
10
9
8
7
2 7.5
5
7.4
7.3
8
7.2
7.1
7.0
6.9
6.8
6.7
6.6
6
Ч
Нормальный
ли pH?
2?
4ый ли PCO
Е
Нормальн
Да
Нормальный ли HCO3?
3
С
10
PCO2
15
20
25
30
35
40
50
60
70
80
90
Р
Е
С
П
И
Р
А
Т
О
Р
Н
Ы
1п00енсированны
Деком110
Й
й мет12а0болически
й 130
140ацидоз
150
30.
60М HCO50
3
Е
Т
40
35
30
25
А
20
Б
15
О
Л
И
pH
7 .35
8.20
PCO
p H 2 7.9
5
7. 8
HCO
1
37.
4
PO 77 .6
10
9
8
7
2 7.5
4
7.4
7.3
5
7.2
7.1
7.0
6.9
6.8
6.7
6.6
6
ЧНормальный pH?
4льный ли PCO ?
Норма
2
Е
Нормальный ли HCO3?
С
3
10
PCO2
15
20
25
30
35
40
50
60
70
80
90
100
110
120
130
140
150
Р
Е
С
П
И
Р
А
Т
О
Р
Н
Ы
Й
31.
6050
М HCO3
40
Е
Т
35
30
25
А
20
Б
15
О
Л
И
10
9
8
7
pH
7 .35
8.20
PCO
p H 2 7.9
5
7. 8
HCO
1
37.
4
PO 77 .6
2 7.5
4
7.4
7.3
5
7.2
7.1
7.0
6.9
6.8
6.7
6.6
6
Нормальный
ли pH? Да
Ч
Нормальн4ый ли PCO 2?
Е
Нормальный ли HCO3?
3
С
10
PCO2
15
20
25
30
35
40
50
60
70
80
90
Р
Е
С
П
И
Р
А
Т
О
Р
Н
Ы
Комп1110
е0н0сированны
Й
метабо
й
1л20ический
130
ацидоз140
150
32.
6050
HCO
3
М
40
Е
Т
А
Б
О
Л
И
35
30
25
20
pH
7.08.50
PCO
pH 2 7.9
5
7. 8
HCO
1
37.
3
PO 77 .6
2 7.5
3
15
10
9
8
7
6
Нормальный
ли pH?
Ч
Нормальны4 й ли PCO 2?
©
Е
Н2о мальный
HCO3?
S.T.A.B.L.E.
ли
3
®
р1
00
С
7.4
7.3
8
7.2
7.1
7.0
6.9
6.8
6.7
6.6
10
PCO2
15
20
25
30
35
40
50
60
70
80
90
100
110
120
130
140
150
Р
Е
С
П
И
Р
А
Т
О
Р
Н
Ы
Й
33.
60М
Е
Т
HCO50
3
40
35
30
25
А
20
Б
15
О
Л
И
pH
7.08.50
PCO
pH 2 7.9
5
7. 8
HCO
1
37.
3
PO 77 .6
2 7.5
3
10
9
8
7
6
Ч
Нормальный
ли pH?
4й ли PCO ?
Нормальны
Е
2
©
200
S.T.A.B.L.E.
Нормальный
ли HCO 3?
1
3
®
С
7.4
7.3
8
7.2
7.1
7.0
6.9
6.8
6.7
6.6
10
PCO2
15
20
25
30
35
40
50
60
70
Р
Е
С
П
И
Р
А
Т
О
Р
Н
Ы
Й
Декомпе1н0с0ированны
1 10
сме120
ш анн
й
13л0ический
метабо
ый140
и
80
90
34.
60М HCO50
3
Е
Т
40
35
30
25
А
20
Б
15
О
Л
И
pH
6.98.80
PCO
pH 2 7.9
0
7. 8
HCO
1
37.
5
PO 77 .6
2 7.5
2
10
9
8
7
6
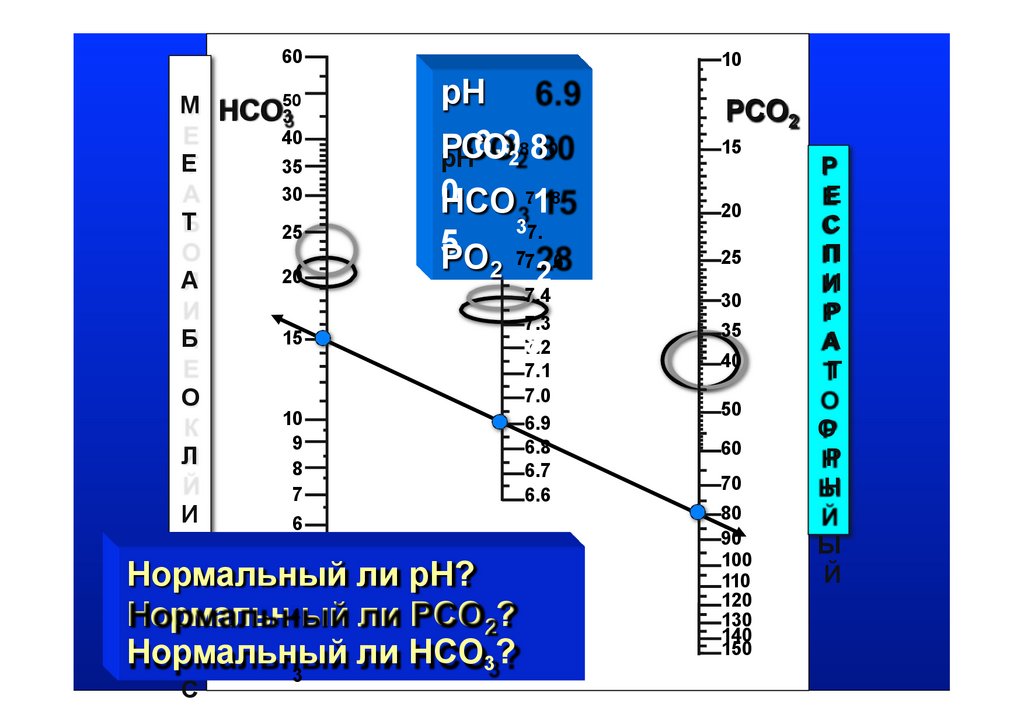
Ч
Нормальный
ли pH?
4ый ли PCO ?
Нормальн
2
Е
Нормальный ли HCO3?
С
3
7.4
7.3
8
7.2
7.1
7.0
6.9
6.8
6.7
6.6
10
PCO2
15
20
25
30
35
40
50
60
70
80
90
100
110
120
130
140
150
Р
Е
С
П
И
Р
А
Т
О
Р
Н
Ы
Й
35.
60М HCO50
3
Е
Т
40
35
30
25
А
20
Б
15
О
Л
И
pH
6.98.80
PCO
pH 2 7.9
0
7. 8
HCO
1
37.
5
PO 77 .6
2 7.5
2
10
9
8
7
6
Ч
Нормальный
ли pH?
4ый ли PCO ?
Нормальн
2
Е
Нормальный ли HCO3?
С
7.4
7.3
8
7.2
7.1
7.0
6.9
6.8
6.7
6.6
3
10
PCO2
15
20
25
30
35
Р
Е
С
П
И
Р
А
Т
40
50
60
70
80
90
О
Р
Н
Ы
Й
Декомпе1110
н0с0ированны
сме1ш20анный
й
респи1140
р3а0торный
1 50
метаболи
ч еский
и
ацидоз
36.
6050
HCO
3
М
40
Е
Т
А
Б
О
Л
И
35
30
25
20
pH
7.48.30
PCO
pH 2 7.9
5
7. 8
HCO
2
37.
2
PO 77 .6
2 7.5
7
15
10
9
8
7
6
Нормальный
ли pH?
Ч
Нормальны4й ли PCO ?
2
Е
Нормальный
ли HCO3?
3
С
7.4
7.3
5
7.2
7.1
7.0
6.9
6.8
6.7
6.6
10
PCO2
15
20
25
30
35
40
50
60
70
80
90
100
110
120
130
140
150
Р
Е
С
П
И
Р
А
Т
О
Р
Н
Ы
Й
37.
60М
е
т
HCO50
3
40
35
30
25
а
20
б
15
о
л
и
10
9
8
7
pH
7.48.30
PCO
pH 2 7.9
5
7. 8
HCO
2
37.
2
PO 77 .6
2 7.5
7
7.4
7.3
5
7.2
7.1
7.0
6.9
6.8
6.7
6.6
6
ч
Нормальный
ли pH?
Да
4 й ли PCO ?
Нормальны
2
е
©
Н2о мальный ли HCO3? Да
S.T.A.B.L.E.
3
®
р1 с
00
10
PCO2
15
20
25
30
35
40
50
60
70
80
90
100
110
р
е
с
п
и
р
а
т
о
р
н
120альные
Норм130
ы
газ1150
ы40
крови й
38.
Лактат как показательметаболических нарушений
С момента описания в 1927 году J. Meakins и
C. Long связи между повышением уровня
лактата в крови и наличием признаков
тканевой гипоксии у пациентов с
циркуляторным шоком, уровень лактата
оценивается как маркер тканевой гипоксии у
этой группы больных. С другой стороны, лактат
является нормальным конечным продуктом
гликолиза и участвует в нормальном
метаболизме в организме человека.
39.
Лактат (молочная кислота)С3Н6О3
40.
Лактат как показательметаболических нарушений
Большая часть лактата метаболизируется
печенью, а некоторая часть поглощается
сердечной мышцей, которая использует его как
энергетический материал.
Содержание лактата в норме у новорожденных
– 0,7–2,1 ммоль/л.
Развитие тяжелого лактат–ацидоза неблагоприятный прогностический признак во
всех ситуациях.
41.
Часто встречающиеся причинылактат-ацидоза
- асфиксия в родах,
- сепсис,
- шок,
- холодовой стресс у новорожденных,
- полиорганная недостаточность,
- снижение метаболизма (нарушение
печеночного кровообращения вследствие
падения АД при шоке, но не поражение
гепатоцитов при заболеваниях печени).
42.
Редко встречающиеся причинылактат-ацидоза
- D–лактат–ацидоз (D-молочную кислоту могут
вырабатывать некоторые микроорганизмы при
расщеплении глюкозы в кишечнике),
- применение адреналина (ускоряет распад
гликогена в скелетных мышцах +
вазоконстрикция мелких артерий и артериол),
- феохромоцитома,
- нитропруссид натрия (в процессе метаболизма
вызывает высвобождение цианидов,
нарушающих процессы окислительного
фосфорелирования),
43.
Редко встречающиеся причинылактат-ацидоза
- выраженный алкалоз (рН>7,6, повышается
активность рН-зависимых ферментов,
катализирующих реакции гликолиза)
- дефицит тиамина (угнетение окисления
пирувата в митохондриях, метаболизм
пировиноградной кислоты направляется по пути
образования лактата).
44.
Клиническое значение лактатаИзмерение уровня лактата крови должно быть
частью оценки любого больного в критическом
состоянии. Уровень лактата крови в качестве
маркера сложных метаболических нарушений,
является хорошим предиктором в интенсивной
практике.
По данным Roumen и Redl, опубликованным в
1993 году, лактат оказался лучшим предиктором
развития респираторного дистресс-синдрома и
полиорганной недостаточности. Снижение
уровня лактата крови на фоне интенсивной
терапии оказалось хорошим показателем ее
адекватности.
45.
Значение у новорожденныхDa Silva и Hemneber в публикации 2000 года
показали значимость и сопряженность
измеренных у новорожденного на 30 минуте
после родов таких параметров, как дефицит
оснований и уровень лактата в крови в качестве
прогностических признаков неврологических
нарушений после перенесенной внутриродовой
асфиксии. Лактемия меньше 5 ммоль/л не
приводили к неврологическим осложнениям.
Концентрация лактата более 9 ммоль/л была
связана с умеренной или тяжелой
энцефалопатией с чувствительностью 84% и
специфичностью 67%.
46.
Значение у новорожденныхК. В. Пшениснов с соавторами в 2016 г.
исследовали уровень лактата у 128
новорожденных при сроке рождения на 29-32
неделе беременности и сделали следующие
выводы:
1. Гиперлактатемия у новорожденных в
критическом состоянии носит гетерогенный
характер и может быть обусловлена
нарушениями оксигенации на всех уровнях
кислородного каскада, начиная с поражения
дыхательной системы и заканчивая
поражением внутриклеточных структур.
47.
Значение у новорожденных2. Исследование концентрации лактата у
новорожденных в критическом состоянии
является скрининговым методом диагностики
респираторных и гемодинамических
нарушений.
3. Концентрация лактата в плазме крови в
диапазоне от 2 до 4 ммоль/л в большинстве
случаев свидетельствует о респираторных
нарушениях и незначительных нарушениях
перфузии, в то время как ее увеличение более
4 ммоль/л позволяет говорить о наличии
смешанной гипоксии и требует коррекции
гемодинамической поддержки.
48.
Значение у новорожденных4. Наличие анемии является одной из
наиболее частых причин лактат-ацидоза у
новорожденных детей и требует
незамедлительной коррекции.
5. Высокие показатели концентрации лактата
в плазме крови при поступлении в отделение
АРИТ новорожденных являются
прогностически неблагоприятными признаками
и свидетельствуют о высоком риске летального
исхода.
49.
60HCO50
40
М
Е
Т
А
Б
О
Л
И
Ч
Е
С
К
И
Й
35
30
25
20
15
10
9
8
7
6
4
3
10
pH
8.0
7.9
7.8
7.7
7.6
7.5
7.4
7.3
7.2
7.1
7.0
6.9
6.8
6.7
6.6
2
15
20
25
30
35
40
50
60
70
80
90
100
120
130
140
150
Р
Е
С
П
И
Р
А
Т
О
Р
Н
Ы
Й















































 medicine
medicine








