Similar presentations:
Общая характеристика оксидов. Занятие 21
1.
Занятие 21ОБЩАЯ ХАРАКТЕРИСТИКА
ОКСИДОВ
2.
Содержание занятияМодуль 1. Понятие, распространение,
номенклатура оксидов
Модуль 2. Классификация оксидов
Модуль 3. Физические свойства оксидов
Модуль 4. Химические свойства оксидов
Модуль 5. Способы получения оксидов
3.
Модуль 1. Понятие, распространение,номенклатура
оксидов
• Оксид (синонимы: окисел, окись) - бинарное соединение
химического элемента с кислородом в степени окисления [−2], в
котором сам кислород связан с менее электроотрицательным
элементом.
Химический элемент кислород по электроотрицательности
второй после фтора, поэтому к оксидам относятся все
соединения химических элементов с кислородом за
исключением дифторид кислорода OF2.
Оксиды - распространённый тип соединений, содержащихся
в земной коре и во Вселенной. Примерами таких соединений
являются ржавчина, вода, песок, углекислый газ, минерал ысоединения металла с кислородом.
Называются они просто - оксид + название элемента. Если
валентность химического элемента переменная, то указывается
римской цифрой, заключённой в круглые скобки, после названия
химического элемента. Соединения, которые содержат атомы
кислорода, соединённые между собой, называют пероксидами
или перекисями (содержат цепочку −O−O−), супероксидами
(или надпероксидами, содержат группу О2− ) и озонидами
(содержат группу О3−) Они, строго говоря, не относятся к
категории оксидов. Также в отдельный небольшой класс обычно
выносят субоксиды — бинарные соединения с кислородом, в
которых металлы или неметаллы имеют необычно низкую
(и/или дробную) степень окисления.
4.
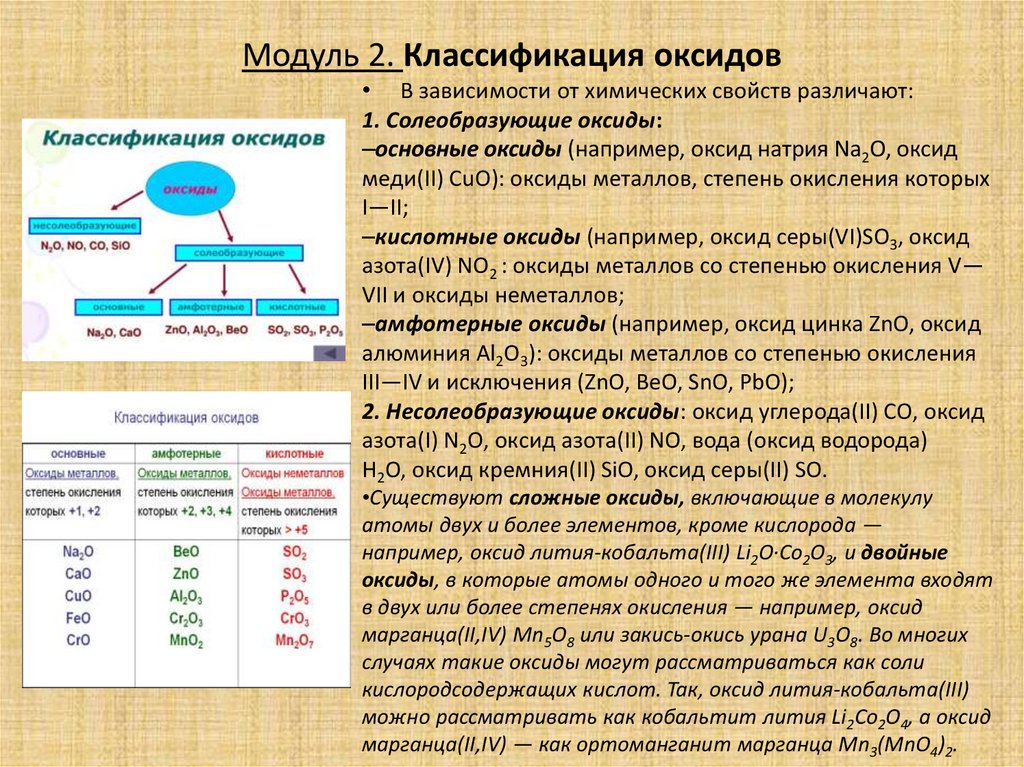
Модуль 2. Классификация оксидов• В зависимости от химических свойств различают:
1. Солеобразующие оксиды:
–основные оксиды (например, оксид натрия Na2O, оксид
меди(II) CuO): оксиды металлов, степень окисления которых
I—II;
–кислотные оксиды (например, оксид серы(VI)SO3, оксид
азота(IV) NO2 : оксиды металлов со степенью окисления V—
VII и оксиды неметаллов;
–амфотерные оксиды (например, оксид цинка ZnO, оксид
алюминия Al2О3): оксиды металлов со степенью окисления
III—IV и исключения (ZnO, BeO, SnO, PbO);
2. Несолеобразующие оксиды: оксид углерода(II) СО, оксид
азота(I) N2O, оксид азота(II) NO, вода (оксид водорода)
H2O, оксид кремния(II) SiO, оксид серы(II) SO.
•Существуют сложные оксиды, включающие в молекулу
атомы двух и более элементов, кроме кислорода —
например, оксид лития-кобальта(III) Li2O·Co2O3, и двойные
оксиды, в которые атомы одного и того же элемента входят
в двух или более степенях окисления — например, оксид
марганца(II,IV) Mn5O8 или закись-окись урана U3O8. Во многих
случаях такие оксиды могут рассматриваться как соли
кислородсодержащих кислот. Так, оксид лития-кобальта(III)
можно рассматривать как кобальтит лития Li2Co2O4, а оксид
марганца(II,IV) — как ортоманганит марганца Mn3(MnO4)2.
5.
Модуль 3. Физические свойства оксидовОксид хрома(III)
Свинцовый сурик
(оксид свинца Pb3O4)
Оксид железа(III), ржавчина
Основные и амфотерные оксиды при
комнатной температуре — твёрдые вещества
(оксиды кальция, железа и др.); кислотные
оксиды — твёрдые вещества (оксиды
фосфора, кремния), жидкости (оксиды серы
(VI) , хлора и др.) или газы (азота, серы и
др.). Все несолеообразующие оксиды
являются газами (кроме оксида кремния,
который является твёрдым веществом).
Оксиды металлов могут быть окрашены в
разные цвета: оксиды щелочных и щёлочноземельных металлов обычно белого цвета,
оксиды переходных металлов — хрома зеленый; ртути - красно-оранжевый; меди
– чёрный или красный.
Оксид кремния — самое распространённое
твёрдое вещество на Земле. Он входит в
состав почвы (песок), горных пород и
минералов. Драгоценные камни, такие как
изумруд, сапфир, горный хрусталь имеют в
своей структуре оксида кремния, при этом
атомы кремния и кислорода образуют
атомную кристаллическую решетку, и,
поэтому представляют собой тугоплавкие,
твёрдые, но хрупкие кристаллы правильной
формы.
6.
Модуль 5. Химические свойства оксидов1. Химические свойства основных оксидов:
• с кислотами с образованием соли и воды, например:
• с кислотными оксидами с образованием
соответствующей соли,
• с водой взаимодействуют только оксиды щелочных и
щелочно-земельных металлов с образованием
щёлочи
2. Химические свойства кислотных оксидов:
• с основаниями, образуя соль и воду
• с основными оксидами, образуя соль
• с водой кислотные оксиды взаимодействуют с
образованием кислот (исключение — )
3. Химические свойства амфотерных оксидов.
3.1. Проявляя свойства основных оксидов, амфотерные
оксиды взаимодействуют:
• с кислотами, образуя соль и воду
• с кислотными оксидами, образуя соль
3.2. Проявляя свойства кислотных оксидов, амфотерные
оксиды взаимодействуют:
• с щелочами, при сплавлении образуя соль и воду, а
с растворами щелочей — комплексную соль
• с основными оксидами, образуя соль
Амфотерные оксиды не взаимодействуют с водой.
7.
Модуль 5. Способы получения оксидов4Al + 3O2 → 2Al2O3
2Na + O2 → Na2O2
4Fe + 3O2 → 2Fe2O3
3Fe + 2O2 → Fe3O4
4Cr + 3O2 → 2Cr2O3
4P + 5O2(изб.) → 2P2O5
4P + 3O2(нед.) → 2P2O3
S + O2 → SO2
2SO2 + O2 = 2SO3
N2 + O2 = 2NO
1. Взаимодействие простых веществ с кислородом:
1.1. Окисление металлов
• Не взаимодействуют с кислородом золото, платина,
палладий.
• Щелочные металлы образуют преимущественно
надпероксиды состава MeO2
• Металлы с переменной степенью окисления окисляются
кислородом воздуха, как правило, до промежуточной
степени окисления (+3). Железо также горит с
образованием железной окалины — оксида железа (II, III)
1.2. Окисление неметаллов
• При образуется оксид неметалла с высшей степенью
окисления, если кислород в избытке, или оксид
неметалла с промежуточной степенью окисления, если
кислород в недостатке. Исключения: сера сгорает только
до оксида серы (IV), оксид серы (VI) можно получить
только окислением оксида серы (IV) в жестких условиях в
присутствии катализатора; азот окисляется кислородом
только при очень высокой температуре (около 2000оС),
либо под действием электрического разряда, и только до
оксида азота (II).
• Не окисляется кислородом фтор F2 (сам фтор окисляет
кислород). Не взаимодействуют с кислородом прочие
галогены (хлор Cl2, бром и др.), инертные газы (гелий He,
неон, аргон, криптон).
8.
4FeS2 + 11O2 → 2Fe2O3 + 8SO21.2. Окисление сложных веществ
• При окислении кислородом сложных
веществ, состоящих, как правило, из
двух элементов, образуется смесь
оксидов этих элементов в устойчивых
степенях окисления.
Сероводород горит с образованием
оксида серы (IV) при избытке кислорода
и с образованием серы при недостатке
кислорода
Аммиак горит с образованием простого
вещества N2, т.к. азот реагирует с
кислородом только в жестких условиях.
А вот в присутствии катализатора
аммиак окисляется кислородом до
оксида азота (II)
2H2S + 3O2(изб.) → 2H2O + 2SO2
2H2S + O2(нед.) → 2H2O + 2S
4NH3 + 3O2 →2N2 + 6H2O
4NH3 + 5O2 → 4NO + 6H2O
9.
Интересные факты об оксидах1. Оксиды способны образовывать практически все элементы, входящие в систему
Менделеева.
2. Самый распространенный оксид на Земле – это вода. Даже радуга является походным
явлением от воздействия оксидов друг с другом .
3. На сегодняшний день известно более 300 видов этих соединений.
4. Все драгоценные камни являются разновидностями оксидов. Например, рубин – это оксид
алюминия, агат – оксид кремния.
(5. Они не растворяются в воде).
6. Выброс в атмосферу оксидов серы и азота провоцируют появление кислотных дождей,
которые могут привести к гибели людей.
7. Планета Марс красная благодаря большому количеству оксида железа на ее поверхности.
8. Наверняка каждый из Вас любовался изделиями из цветного стекла. А знали ли Вы, что
окрашены они при помощи оксидов? Добавление в стекло оксида железа делает цветом от
голубого до темно красного (в зависимости от концентрации оксида), оксида урана – светложелтым, никеля – фиолетовым или коричневым.
(9. Оксиды входят в состав всех известных нам красок).
10. Наиболее распространенным оксидом в земной коре является оксид кремния. Он входит в
состав практически всех минералов и составляет 12% от общей массы Земли. Основным
минералом, который он образовывает – это песок.
Причиной эффекта «собачьей пещеры» в Италии является оксид углерода СО2. Он тяжелее
воздуха, поэтому получается так, что газ в пещере как раз покрывает собачью голову.
Невысокие животные гибнут от удушья за несколько минут. А за счёт своего роста человек
может легко пройти по ней.
В 1890 году парусное судно «Малборо» направлялось в Англию из Новой Зеландии. На борту
было 23 члена экипажа и несколько пассажиров. В Англию судно не прибыло. Лишь через 23
года корабль появился вновь возле Огненной Земли. Шёл на всех парусах и оказался
абсолютно не повреждённым. Оказывается, что причиной гибели людей стало извержение
вулкана на острове Мартиника. Вулканические газы содержали 1,6% СО.








 chemistry
chemistry








