Similar presentations:
Оксиды. Классификация. Номенклатура. Физические свойства оксидов. Химические свойства оксидов. Получение и применение оксидов
1.
17.04.20Оксиды. Классификация.
Номенклатура. Физические
свойства оксидов. Химические
свойства оксидов. Получение
и применение оксидов.
Изучите презентацию, сделайте краткий конспект, фото
конспекта отправьте учителю.
2.
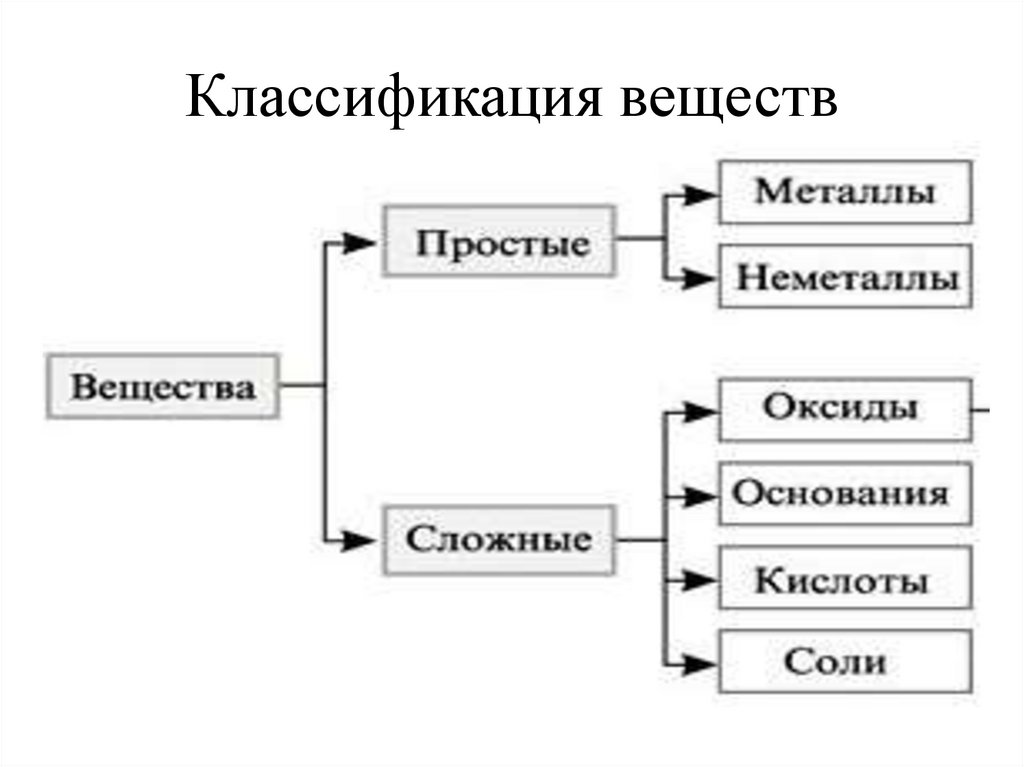
Классификация веществ3.
ОКСИД КИСЛОТА ОСНОВАНИЕЭхОу
НnAс
Ас
–
кислотный
остаток
СОЛЬ
Ме(ОН)b
Men(Aс)b
ОН
–
гидроксильная
группа
4.
Оксиды - это сложные вещества, состоящиеиз двух химических элементов, один из
которых кислород, с валентность равной 2.
Лишь один химический элемент - фтор,
соединяясь с кислородом, образует не оксид,
а фторид кислорода OF2.
5.
Номенклатура:«оксид» + «название элемента в Р.п.»
Если валентность химического элемента
переменная, то указывается римской цифрой,
заключённой в круглые скобки, после названия
химического элемента.
«оксид» + «название элемента в Р.п.» +
(переменная валентность)
6.
ФорНазваниемула
NO
оксид азота (II)
Al2O3 оксид алюминия
Форму
Название
ла
Fe2O3 оксид железа
(III)
Mn2O7 оксид марганца
(VII)
Задание 1:
Дайте названия оксидам: ZnO, K2O, CO,
N2O, CO2, NO2, BaO, CaO, CrO, Cr2O,
CrO3
7.
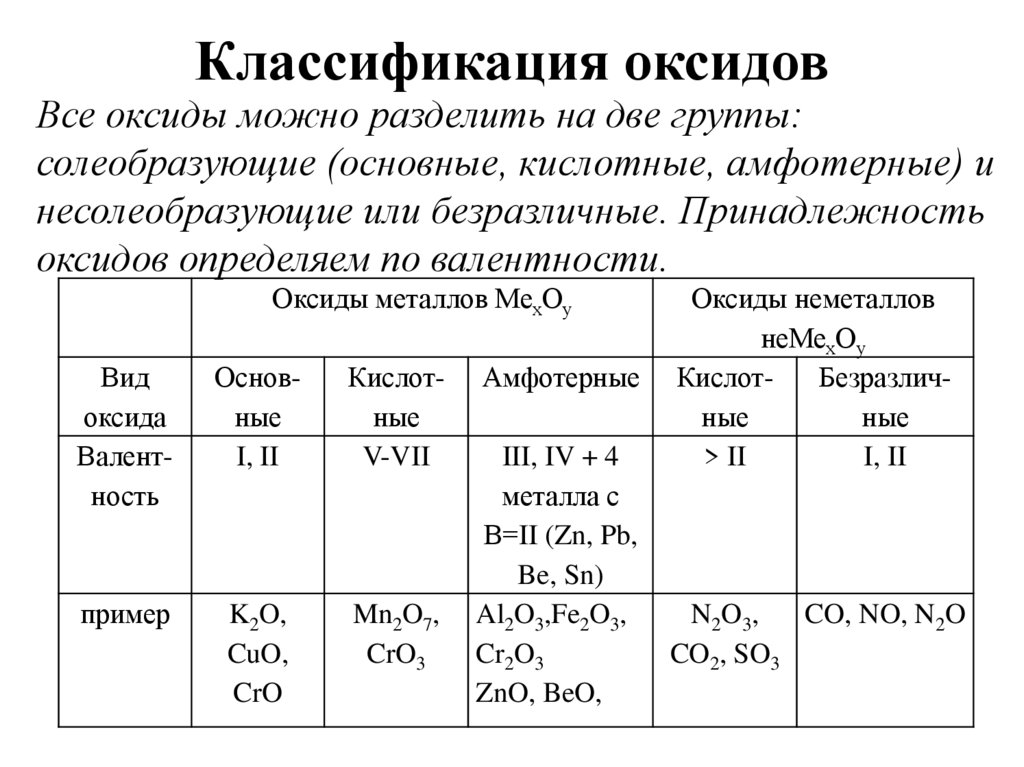
Классификация оксидовВсе оксиды можно разделить на две группы:
солеобразующие (основные, кислотные, амфотерные) и
несолеобразующие или безразличные. Принадлежность
оксидов определяем по валентности.
Оксиды металлов МехОу
Вид
оксида
Валентность
Основные
I, II
Кислотные
V-VII
пример
K2O,
CuO,
CrO
Mn2O7,
CrO3
Амфотерные
III, IV + 4
металла с
В=II (Zn, Pb,
Be, Sn)
Al2O3,Fe2O3,
Cr2O3
ZnO, BeO,
Оксиды неметаллов
неМехОу
КислотБезразличные
ные
> II
I, II
N2O 3,
CO, NO, N2O
CO2, SO3
8.
1) Основные оксиды – это оксиды, которымсоответствуют основания. К основным оксидам
относятся оксиды металлов 1 и 2 групп, а
также металлов побочных подгрупп с
валентностью I и II (кроме ZnO - оксид цинка
и BeO – оксид берилия):
оксид
название
основание название
Na2O
оксид натрия
NaOH
гидроксид натрия
CaO
оксид кальция
Ca(OH)2
гидроксид кальция
СuO
оксид меди (II)
Cu(OH)2
гидроксид меди (II)
NiO
оксид
(II)
никеля Ni(OH)2
гидроксид никеля (II)
9.
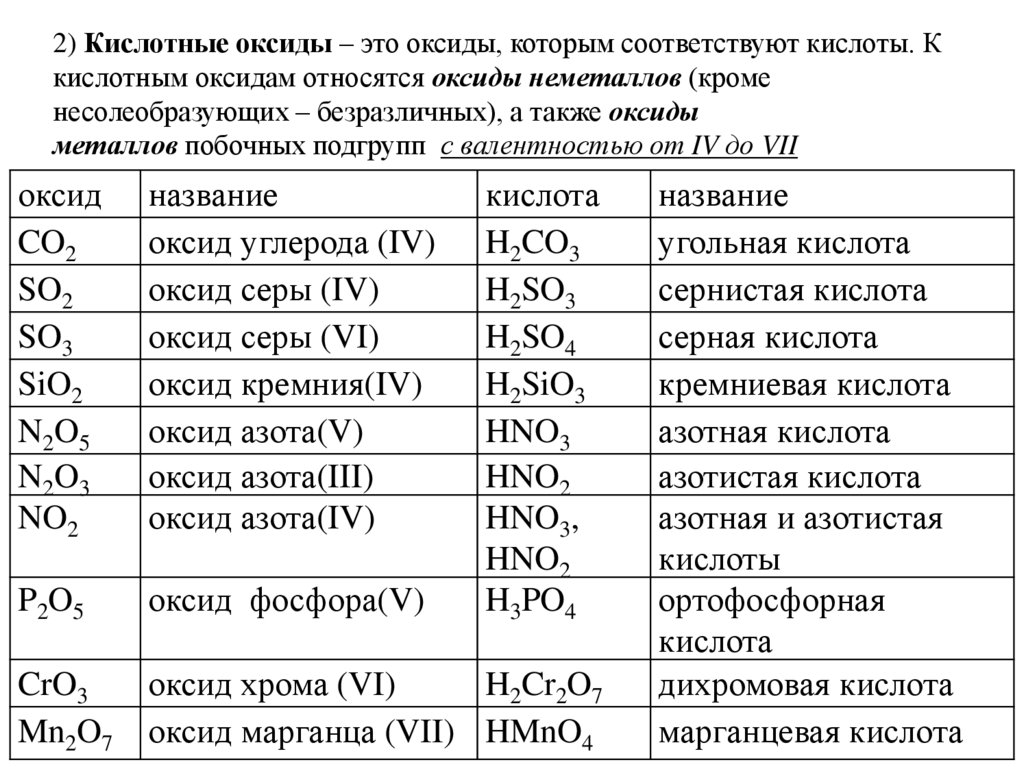
2) Кислотные оксиды – это оксиды, которым соответствуют кислоты. Ккислотным оксидам относятся оксиды неметаллов (кроме
несолеобразующих – безразличных), а также оксиды
металлов побочных подгрупп с валентностью от IV до VII
оксид
CO2
SO2
SO3
SiO2
N2O5
N2O3
NO2
название
оксид углерода (IV)
оксид серы (IV)
оксид серы (VI)
оксид кремния(IV)
оксид азота(V)
оксид азота(III)
оксид азота(IV)
кислота
H2CO3
H2SO3
H2SO4
H2SiO3
HNO3
HNO2
HNO3,
HNO2
H3PO4
P2O5
оксид фосфора(V)
CrO3
Mn2O7
оксид хрома (VI)
H2Cr2O7
оксид марганца (VII) HMnO4
название
угольная кислота
сернистая кислота
серная кислота
кремниевая кислота
азотная кислота
азотистая кислота
азотная и азотистая
кислоты
ортофосфорная
кислота
дихромовая кислота
марганцевая кислота
10.
3) Амфотерные оксиды – это оксиды, которымсоответствуют основания и кислоты. К ним
относятся оксиды металлов главных и
побочных подгрупп с валентностью III,
иногда IV, а также цинк, бериллий, свинец и
олово с валентностью II
основание
оксид
Al(OH)3
Al2O3
гидроксид
алюминия
Zn(OH)2
ZnO
гидроксид цинка
кислота
HAlO2
метаалюминевая
кислота
H2ZnO2
цинковая кислота
11.
• 4) Несолеобразующие (безразличные)оксиды – это оксиды безразличные к
кислотам и основаниям. К ним
относятся оксиды неметаллов с
валентностью I и II
(Например, N2O, NO, CO).
12.
Классификация оксидов (порастворимости в воде)
Кислотные оксиды
Растворимы в воде.
Исключение –SiO2
(не растворим в
воде)
Основные оксиды
В воде растворяются
только оксиды
щелочных и
щелочноземельных
металлов
(это металлы
I «А» и II «А» групп,
исключение Be ,Mg)
Амфотерные оксиды
С водой не
взаимодействуют.
В воде не
растворимы
13.
Задание 2:1. Выпишите отдельно химические формулы
солеобразующих кислотных и основных
оксидов: NaOH, AlCl3, K2O, H2SO4, SO3, P2O5,
HNO3, CaO, CO. Дайте им названия
2. Даны вещества: CaO, NaOH, CO2, H2SO3,
CaCl2, FeCl3, Zn(OH)2, N2O5, Al2O3, Ca(OH)2,
CO2, N2O, FeO,SO3, Na2SO4, ZnO, CaCO3, Mn2O7,
CuO, KOH, CO, Fe(OH)3. Выпишите оксиды и
классифицируйте их. Дайте названия.
14.
Получение оксидов1. Горение веществ
(Окисление
кислородом)
2.Разложение сложных
веществ
а) простых веществ
б) сложных веществ
а) солей
Сольt= Основный оксид +
Кислотный оксид
б) Нерастворимых оснований
Ме(ОН)b t= MexOy + H2O
в) кислородсодержащих кислот
НnA = Кислотный Оксид + H2O
2Mg +O2=2MgO
2H2S+3O2=2H2O
+2SO2
СaCO3=CaO+CO
2
Cu(OH)2 t= CuO
+ H2O
H2SiO3 = H2O +
SiO2
15.
ХИМИЧЕСКИЕ СВОЙСТВАОСНОВНЫХ ОКСИДОВ (правила знать
наизусть)
1. Основной оксид + Кислотный оксид =
Соль (р. соединения): CaO + SO2 = CaSO3
2. Основной оксид + Кислота = Соль +
Н2О (р. обмена)
3K2O + 2H3PO4 = 2K3PO4 + 3H2O
3. Основный оксид + Вода = растворимое
основание (р. соединения) (см. в таблицу
растворимости!!!): Na2O + H2O = 2NaOH
16.
ХИМИЧЕСКИЕ СВОЙСТВАКИСЛОТНЫХ ОКСИДОВ (правила
знать наизусть)
1. Кислотный оксид + вода = Кислота(р.
соединения): SO2 + H2O = H2SO4,
!!! SiO2 – не реагирует
2. Кислотный оксид + Основание = Соль +
Н2О (р. обмена)
P2O5 + 6KOH = 2K3PO4 + 3H2O
3. Основной оксид + Кислотный оксид = Соль (р.
соединения): CaO + SO2 = CaSO3
4. Менее летучие вытесняют более летучие из их
солей:
CaCO3 + SiO2 = CaSiO3 +CO2
17.
ХИМИЧЕСКИЕ СВОЙСТВААМФОТЕРНЫХ ОКСИДОВ
(правила знать наизусть)
• Взаимодействуют как с кислотами, так и со
щелочами.
1. Амфотерный оксид + Кислота = Соль и Вода
(р. обмена): ZnO + 2 HCl = ZnCl2 + H2O
2. Амфотреный оксид + Растворимое основание =
Соль + Вода:
ZnO + 2 NaOH + H2O = Na2[Zn(OH)4] ( в растворе)
ZnO + 2 NaOH = Na2ZnO2 + H2O (при сплавлении)
18.
Задание3:Закончите УХР, укажите тип реакции,
назовите продукты реакции
а) Na2O + H2O =
б) N2O5 + H2O =
в) CaO + HNO3 =
г) NaOH + P2O5 =
д) K2O + CO2 =
е) Cu(OH)2 = ? + ?
19.
Домашнее задание1. Выполните задания 1-3 по презентации,
фото работ присылаем учителю.
















 chemistry
chemistry








