Similar presentations:
Титриметрические методы анализа
1. Титриметрические методы анализа
Кислотно-основное титрование.Выбор индикаторов
2.
Титриметрический метод анализаВ этом методе измеряют точный объем растворов двух веществ, реагирующих между
собой, при этом концентрация одного из растворов должна быть точно известна.
Титрант (стандартный, рабочий раствор) – раствор реактива с точно известной
концентрацией.
Титрование – процесс приливания раствора с известной концентрацией к раствору с
неизвестной концентрацией.
В точке эквивалентности количество прореагировавших веществ строго эквивалентно.
Закон эквивалентов: в химической реакции с n эквивалентами одного вещества всегда
вступает во взаимодействие n эквивалентов второго и образуется по n эквивалентов
каждого продукта.
C D
A T
nэкв (A) nэкв (T)
где nэкв(A), nэкв(Т) – количество моль эквивалентов анализируемого вещества (A) и титранта (T).
Cэкв (А) V (А) Cэкв (Т) V (Т)
где Cэкв(А) и Cэкв(Т) – нормальная концентрация анализируемого вещества и титранта, соответственно.
Cэкв (А)
Сэкв (Т) V (Т)
V (А)
3.
Требования к реакциям, используемым в титриметрии1) реакция должна протекать в соответствии со стехиометрическим уравнением;
2) реакция должна протекать быстро;
3) должны отсутствовать побочные реакции;
4) должна присутствовать возможность фиксации точки эквивалентности.
Классификация титриметрических методов анализа
1) по типу реакций, лежащих в основе метода:
1.1) кислотно-основное титрование
A BH
HA B
кислота основ.
сопр.
к-та
сопр.
осн
Ацидиметрия – титрант кислота;
алкалиметрия – титрант щёлочь.
1.2) окислительно-восстановительное титрование (редоксиметрия) – окислительновосстановительные реакции, т.е. реакции, сопровождающиеся изменением степени
окисления.
C D
A B
Ox
Red
Red Ox
4.
Классификация титриметрических методов анализа1.3) комплексонометрическое титрование – реакции комплексообразования, т.е.
образование малодиссоциирующих прочных комплексных соединений;
1.4) метод осадительного титрования – реакции осаждения:
nKt mA
Ktn Am
по типу титранта:
- AgNO3 – аргентометрия;
- Hg(NO3)2 – меркуриметрия;
- BaCl2 – бариметрия.
2) по технике выполнения:
2.1) метод отдельных навесок – берут отдельные, близкие по величине навески
исходного вещества и, растворив каждую из них в произвольном количестве воды,
титруют полученные растворы.
2.2) метод пипетирования – навеску исходного вещества разбавляют водой в мерной
колбе, тщательно перемешивают, пипеткой отбирают отдельные порции раствора
(аликвоты) и титруют их.
5.
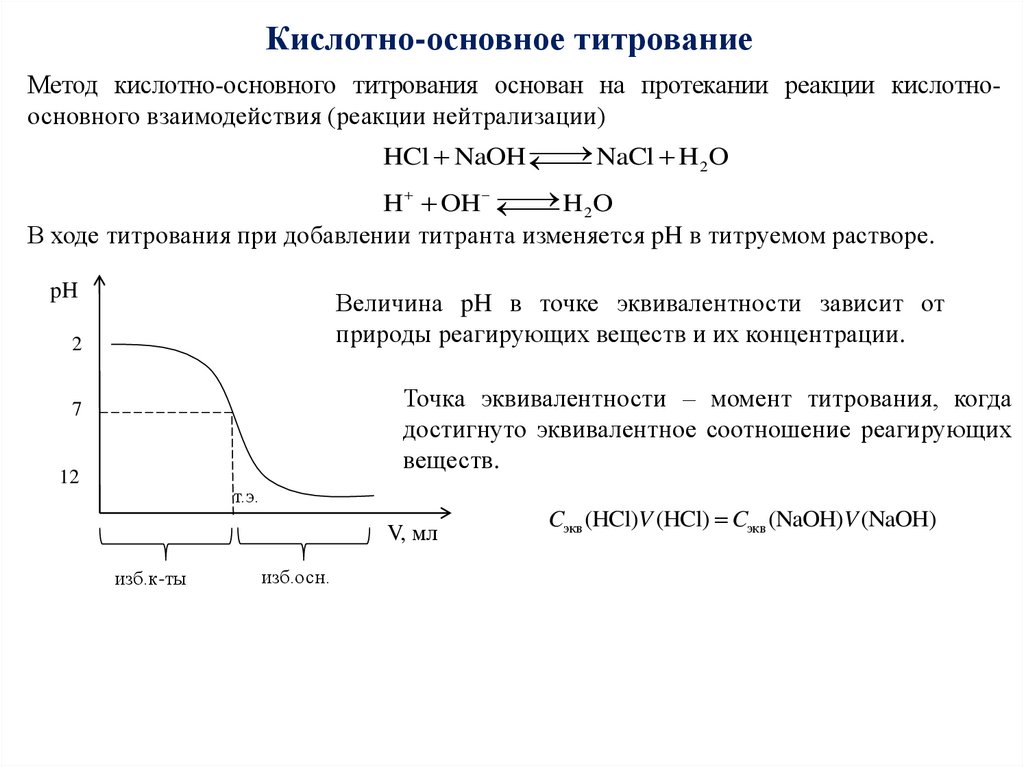
Кислотно-основное титрованиеМетод кислотно-основного титрования основан на протекании реакции кислотноосновного взаимодействия (реакции нейтрализации)
NaCl H 2O
HCl NaOH
H 2O
H OH
В ходе титрования при добавлении титранта изменяется pH в титруемом растворе.
pH
Величина pH в точке эквивалентности зависит от
природы реагирующих веществ и их концентрации.
2
Точка эквивалентности – момент титрования, когда
достигнуто эквивалентное соотношение реагирующих
веществ.
7
12
т.э.
V, мл
изб.к-ты
изб.осн.
Cэкв (HCl)V (HCl) Cэкв (NaOH)V (NaOH)
6.
Кислотно-основные индикаторыКислотно-основные индикаторы – это органические
соединения, которые изменяют свою окраску в
зависимости от pH раствора.
Требования к индикаторам:
1) Окраска индикатора должна быть интенсивной;
2) Изменение цвета индикатора должно происходить
резко, в небольшом интервале значений pH;
3) Переход окраски должен быть контрастным;
4) Изменение окраски должно быть обратимым
процессом;
5) Количество щелочи или кислоты для изменения
окраски должно быть мало.
7.
Интервал перехода окраски индикатораИнтервал перехода окраски индикатора (∆pH) – это область значений pH раствора, в
пределах которой данный индикатор меняет свою окраску.
pH pKинд 1
где Кинд – константа ионизации индикатора.
Значение pH, при котором заканчивают титрование в присутствии данного индикатора,
называется показателем титрования (pT).
Например, лакмус:
кисл. красн. красно-синяя сине-красная щел. синий
pKинд -1
pKинд+1
pT
∆pH
фиолетовая
Чем меньще интервал перехода окраски, тем ценнее индикатор.
8.
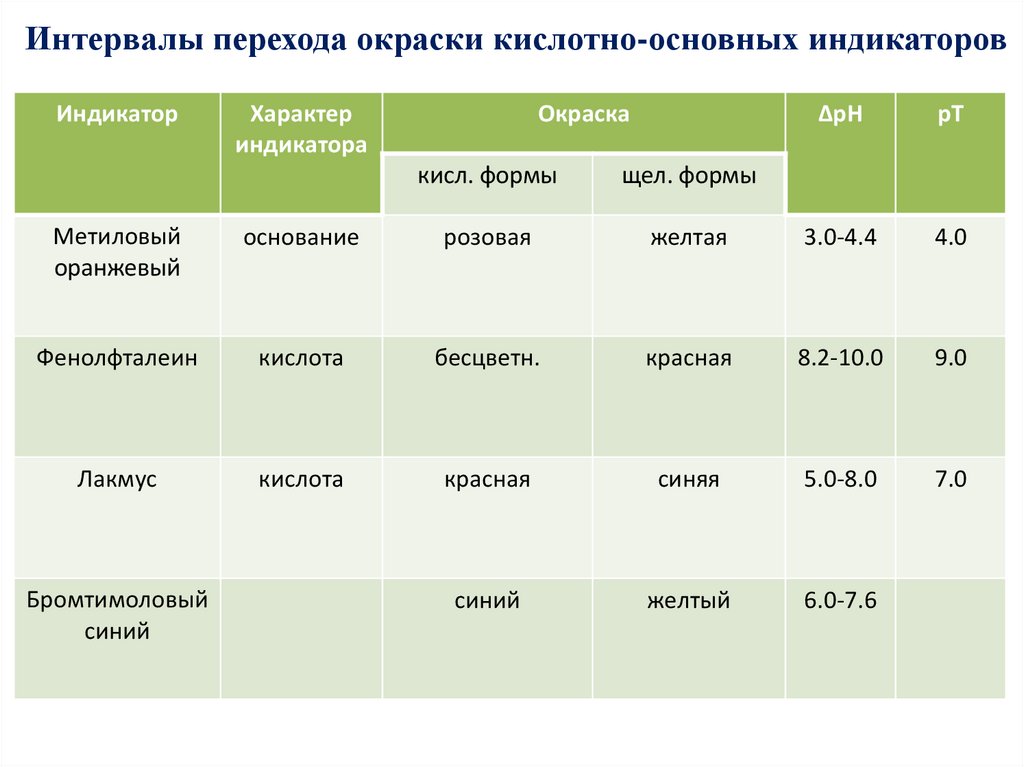
Интервалы перехода окраски кислотно-основных индикаторовИндикатор
Характер
индикатора
Окраска
кисл. формы
щел. формы
∆pH
pT
Метиловый
оранжевый
основание
розовая
желтая
3.0-4.4
4.0
Фенолфталеин
кислота
бесцветн.
красная
8.2-10.0
9.0
Лакмус
кислота
красная
синяя
5.0-8.0
7.0
синий
желтый
6.0-7.6
Бромтимоловый
синий
9.
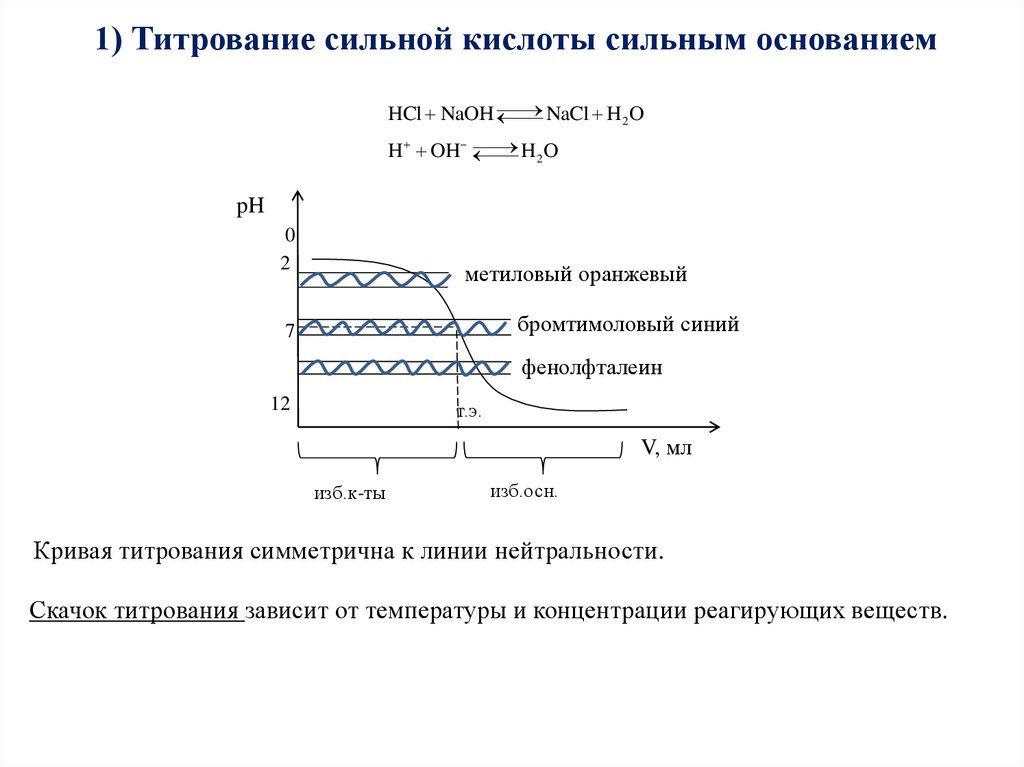
1) Титрование сильной кислоты сильным основаниемNaCl H 2O
HCl NaOH
H 2O
H OH
pH
0
2
метиловый оранжевый
бромтимоловый синий
7
фенолфталеин
12
т.э.
V, мл
изб.к-ты
изб.осн.
Кривая титрования симметрична к линии нейтральности.
Скачок титрования зависит от температуры и концентрации реагирующих веществ.
10.
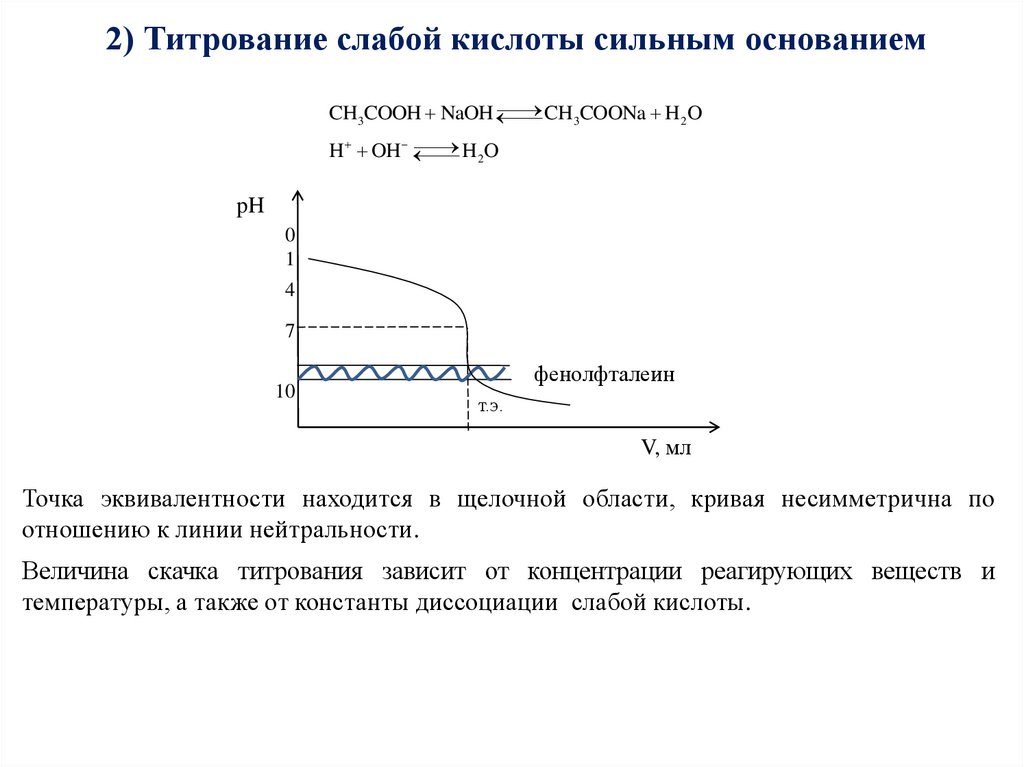
2) Титрование слабой кислоты сильным основаниемCH3COONa H 2O
CH3COOH NaOH
H 2O
H OH
pH
0
1
4
7
10
фенолфталеин
т.э.
V, мл
Точка эквивалентности находится в щелочной области, кривая несимметрична по
отношению к линии нейтральности.
Величина скачка титрования зависит от концентрации реагирующих веществ и
температуры, а также от константы диссоциации слабой кислоты.
11.
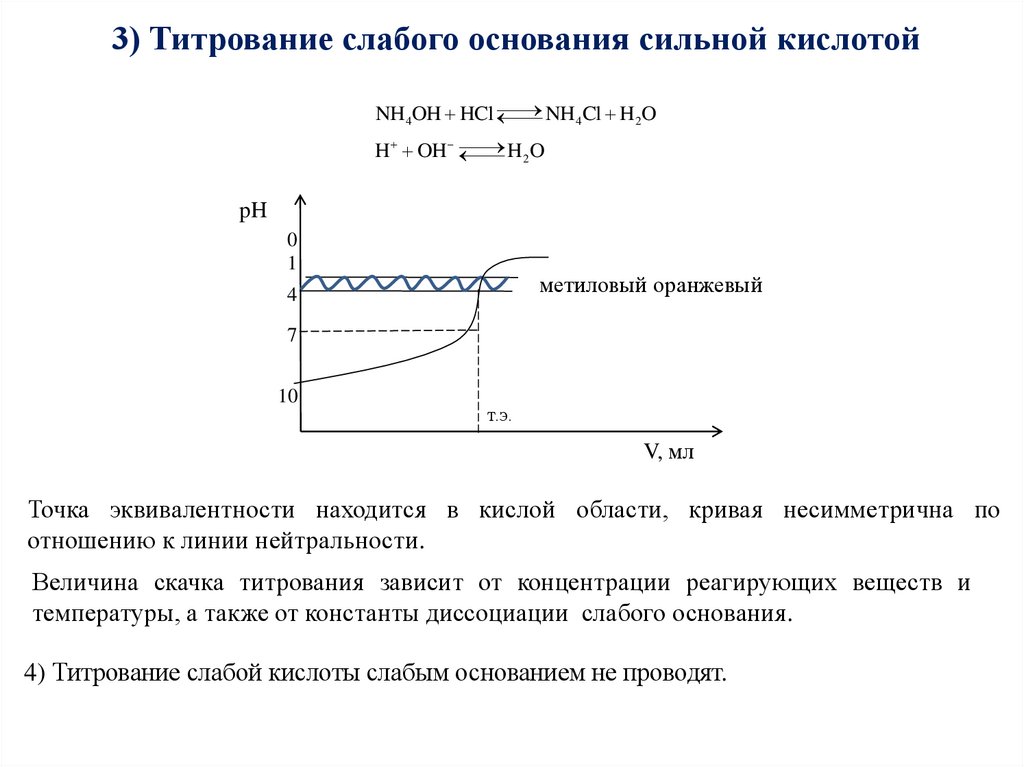
3) Титрование слабого основания сильной кислотойNH 4Cl H 2O
NH 4OH HCl
H 2O
H OH
pH
0
1
метиловый оранжевый
4
7
10
т.э.
V, мл
Точка эквивалентности находится в кислой области, кривая несимметрична по
отношению к линии нейтральности.
Величина скачка титрования зависит от концентрации реагирующих веществ и
температуры, а также от константы диссоциации слабого основания.
4) Титрование слабой кислоты слабым основанием не проводят.






 chemistry
chemistry








