Similar presentations:
Основы титриметрического анализа. Метод кислотно-основного (протолитического) титрования
1.
Основы титриметрического анализа.Метод кислотно-основного (протолитического)
титрования
2.
2Вопросы лекции 4
1. Суть и основные положения титриметрического метода анализа.
2. Закон эквивалентов. Применение закона эквивалентов в
титриметрическом анализе.
3. Титрант (реагент). Стандартный раствор. Титрование. Скачок
титрования. Точка эквивалентности и конечная точка титрования.
4. Способы определения конечной точки титрования. Индикаторы.
5. Виды титриметрических определений: прямое и обратное титрование,
определение по замещению.
6. Методы титриметрического анализа.
7. Требования, предъявляемые к реакциям в титриметрическом анализе.
8. Типы химических реакций, используемых в титриметрическом анализе.
9. Общее представление о кривых титрования.
10. Метод кислотно-основного (протолитического) титрования.
3.
3Титриметрический анализ
Титриметрический анализ – метод количественного химического анализа,
основанный на измерении объема раствора реагента (титранта) точно
известной концентрации, выраженной в единицах моль/л, израсходованного на
реакцию с определяемым веществом.
В основе титриметрического анализа закон эквивалентов - все вещества
реагируют между собой в соответствии с их эквивалентами (в эквивалентных
количествах).
n1 = n2,
где n – количество вещества, моль
n = CV,
где С - молярная концентрация, моль/л; V – объем раствора, л.
Например, для реакции, протекающей в растворе А + В = С + D,
где А - определяемое вещество; В – реагент (титрант); С и D – продукты реакции,
выражение закона эквивалентов будет иметь вид
САVА = СВVВ
(1)
4.
4Основные понятия титриметрического анализа
Титрование – медленное (по каплям) прибавление раствора реагента
(титранта) к раствору определяемого вещества до достижения состояния близкого
к состоянию эквивалентности.
Точка эквивалентности – состояние, при котором в растворе отсутствуют
исходные вещества (достигнуто состояние эквивалентности). Это теоретическое
понятие. На практике, в силу объективных причин, оно недостижимо (например,
из-за обратимости реакций).
Конечная точка титрования - состояние, близкое к состоянию
эквивалентности (точке эквивалентности). Титрование проводят до достижения
конечной точки титрования.
Индикаторы – вещества, которые при изменении какого-либо свойства
раствора (например, рН) при изменении концентрации титранта (реагента),
изменяют окраску раствора, люминесцируют, образуют осадок и т.п. Например:
фенолфталеин, метиловый оранжевый; эриохром черный Т и т.д.
НInd <--> H+ + Ind -
5.
5Стандартные растворы
1. Первичные стандартные растворы (установочные вещества).
(особенности, приготовление, требования).
Примеры: Н2С2О4*2Н2О; Na2C2O4; Na2B4O7*10Н2О; К2Сr2O7 и другие.
Первичные стандартные растворы готовят растворением точной навески реагента
и разбавлением полученного раствора до определенного объема. Первичные стандартные
растворы должны удовлетворять следующим требованиям:
1. Быть химически чистыми (массовая доля примесей не должна превышать 0,05%)
или должен быть известен простой способ очистки вещества от примесей.
2. Состав соединения должен строго отвечать химической формуле.
3. Вещество должно быть химически устойчивым при хранении (не изменяться при
высушивании, не быть гигроскопичным, не взаимодействовать с компонентами
атмосферы).
4. Вещество должно иметь по возможности большую молекулярную массу, чтобы
уменьшить погрешность при взвешивании.
2. Вторичные стандартные растворы (особенности приготовления,
определение концентрации).
Примеры: HCl, NaOH, KMnO4 и другие.
6.
6Вторичные
стандартные
растворы
готовят
растворением
приблизительной навески реагента (KOH, NaOH) или разбавлением более
концентрированного раствора (HCl, H2SO4, HNO3). Для приготовления раствора
используют приблизительно установленную навеску вещества, получают
растворы с приблизительной концентрацией. Концентрацию вторичных
стандартных растворов устанавливают титрованием подходящими первичными
стандартами
(установочными
веществами).
Растворы
называются
стандартизованными растворами или растворами с установленным титром.
Мерная посуда (мерные колбы, мерные пипетки и пипетки Мора, бюретки;
калибровка мерной посуды)
Мерная колба (положение глаз при доведении
уровня жидкости до метки)
7.
7Допустимые отклонения вместимости мерной посуды
Вместимость,
мл
5
10
25
50
100
200
250
500
1000
2000
Допустимая максимальная погрешность, мл
Мерные
колбы
Пипетки
Бюретки
0,03
0,05
0,08
0,10
0,12
0,15
0,30
0,50
0,01
0,02
0,03
0,05
0,08
-
0,01
0,02
0,03
0,05
0,10
-
Колибровка мерной посуды.
8.
8Индикаторы
НInd <--> H+ + Ind –
Например, эриохром черный Т
H3Ind ↔ H2Ind- ↔ HInd2- ↔ Ind3рН
винно-красная
0–6
синяя
6 – 11
оранжевая
11 - 14
Индикатор
Область перехода
окраски
рТ
Метиловый
оранжевый
3,1 - 4,4
орнаж. – желтая
4,0
Метиловый
красный
4,4 – 6,2
красный – желтый
5,5
лакмус
5,0 – 8,0
красный - синий
7,0
фенолфталеин
8,0 – 10,0
бесцв. – малин.
9,0
9.
9Кривые титрования. Выбор индикатора. Индикаторные погрешности.
Например, титрование Н2SO4 раствором NaOH.
10.
10Классификация методов титриметрического анализа
1. Кислотно-основное титрование (протолитическое): ацидометрия и
алкалиметрия.
2. Комплексометрическое титрование: роданометрия, фторометрия,
комплексонометрия и т.д.
3. Окислительно-восстановительное (редокс) титрование: бихроматометрия,
перманганатометрия и т.д.
4. Осадительное титрование (седиметрия).
Требования к титриметрическим реакциям
1. Стехиометричность взаимодействия.
2. Необратимость.
3. Достаточно большая скорость реакции.
4. Отсутствие побочных реакций.
5. Возможность определения конечной точки титрования.
11.
11Основные приемы титрования
1. Прямое титрование – титрование, при котором определяемый
компонент непосредственно титруют подходящим титрантом (или наоборот).
2. Обратное титрование (титрование по остатку).
Пример: определения азота по методу Кьельдаля:
а) Образец (N) (конц. H2SO4) NH4+ + ...
б) NH4+ + NaOH(конц.) NH3 + ...
в) NH3 + HCl(в изб.) NH4Cl
г) HCl(изб.) + NaOH ... (титрование)
n(NH3) = n(HCl) – n(NaOH).
Применяется в случаях, когда мала скорость прямой реакции, отсутствует
подходящий индикатор, возможны потери определяемого вещества, например, изза его летучести и т.п.
12.
3. Титрование заместителя. Проводят стехиометрическую реакциюопределяемого вещества с вспомогательным компонентом, а образующийся в
эквивалентном количестве продукт оттитровывают подходящим титрантом.
Пример: иодометрическое определение меди
2Сu2+ + 4J- 2CuJ + J2
J2 + 2S2O32- S4O62- + 2Jn(Cu2 ) = n(S2O32-).
Применяется в случаях, когда определяемое вещество непосредственно
не реагирует с реагентом или их взаимодействие не является стехиометричным,
образуются побочные продукты и т.д.
12
4. Реверсивное титрование. Титрование раствора стандартного вещества
раствором определяемого вещества. Применяется в случаях, когда определяемое
вещество неустойчиво при условиях, в которых производится титрование.
Например, окисление нитритов перманганатом калия происходит в кислой среде,
однако нитриты в кислой среде неустойчивы.
Поэтому стандартный раствор перманганата калия, подкисленный серной
кислотой, титруют раствором нитрита, концентрацию которого хотят определить.
NO2- + MnO4- + 6H+ → NO3- + Mn2+ + 3H2O
13.
13Для более точного расчета погрешности, учитывают все стадии, на
которых погрешность возникает:
1. при взвешивании вещества;
2. при растворении навески;
3. при приготовлении растворов;
4 при проведении анализа.
Наибольшая погрешность возникает при проведении анализа (стадия 4), ей
соответствуют последние три слагаемые в уравнении (1). Если она значительно
превышает погрешности, возникающие на стадиях взвешивания, растворения
навески, приготовления растворов (стадии 1, 2, 3), то этими погрешностями
обычно пренебрегают.
14.
14Тестирование единичных результатов (Q – тест)
Для выявление грубо ошибочных единичных измерений их тестируют
посредством проведения Q – теста. Чаще всего при проведении Q – теста
доверительную вероятность принимают равной 90 %. Это означает, что после
тестирования будут исключены все сомнительные значения, вероятность
присутствия в которых погрешностей превышает 10 %.
При проведении Q –теста все результаты определения располагают по
порядку от наименьшего до наибольшего: х1, х2, х3, ..., хn.
Для первого и последнего результатов рассчитывают Q – коэффициенты
по формулам
x
x
x
x
2
1
Q
1
x
x
n
1
n
n
1
Q
2
x
x
n
1
Больший из показателей (Q1 или Q2) сравнивают с табличным значением Q.
Если для тестируемого результата полученное значение Q превышает табличное,
то данный результат признают грубо ошибочным и исключают из тестируемой
совокупности результатов.
Если результат х1 или хn будет исключен, то число оставшихся результатов
уменьшится на 1 и тогда Q – тест повторяют для (n – 1) значений. Так
продолжают до тех пор, пока не будут исключены все результаты, полученные с
недопустимо грубыми погрешностями.
15.
15Значения Q – критерия в зависимости от общего числа выполненных
определений (n) и от принятой доверительной вероятности (P)
Р, %
Общее число измерений, n
3
4
5
6
7
8
9
10
90
0,94
0,76
0,64
0,56
0,51
0,47
0,44
0,41
95
0,98
0,85
0,73
0,64
0,59
0,54
0,51
0,48
99
0,99
0,93
0,82
0,74
0,68
0,63
0,60
0,57
16.
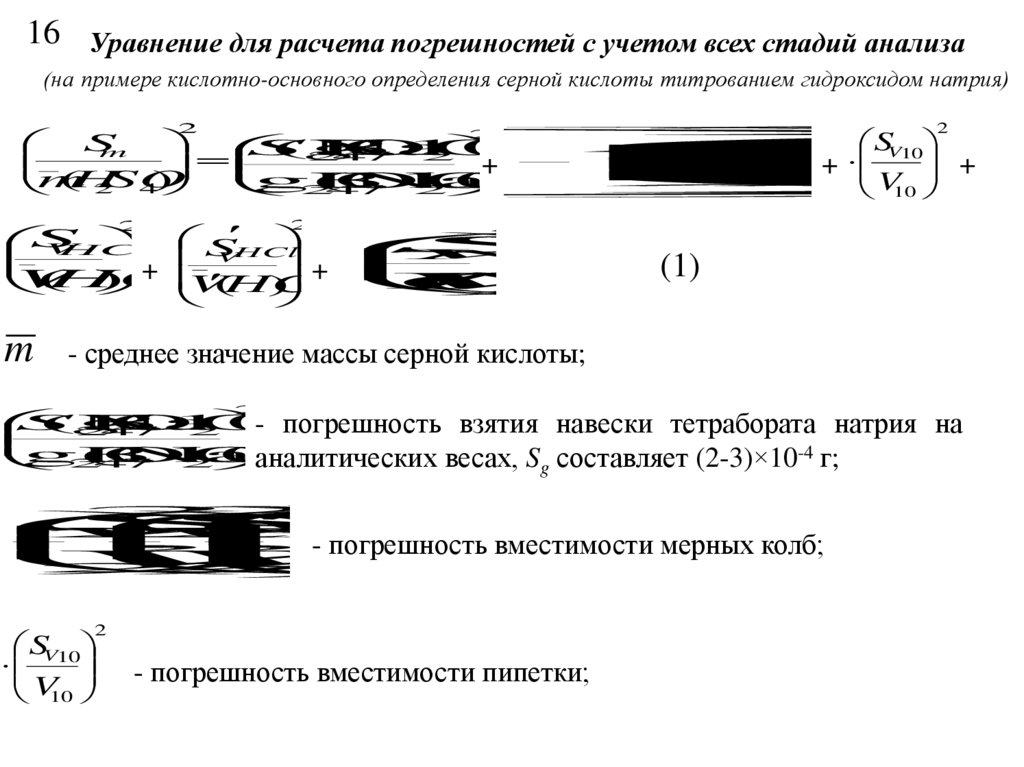
16 Уравнение для расчета погрешностей с учетом всех стадий анализа(на примере кислотно-основного определения серной кислоты титрованием гидроксидом натрия)
2
2
2
2
2
2
S
S
SV10
S
S
V
1
Sg
(Na
B
O
.10H
O)
m
V
V
2
2
2
4
7
2
+
+
+
m
V
V
V
(
H
SO
)
g(Na
B
O
.10H
O)
V
2
2
1
2
4
247 2
10
2
2
S
V
HCl
VHCl
S
+
+
V
(
HCl
)
(HCl
V
)
m
2
S
V
NaOH
(1)
V
(
NaO
)
- среднее значение массы серной кислоты;
2
Sg
(Na
B
O
.10H
O)
- погрешность взятия
2
4
7
2
g(Na
B
O
.10H
O)
аналитических весах, S
2
4
7
2
навески тетрабората натрия на
-4
g составляет (2-3)×10 г;
2
2
2
S
S
S
V
100
V
V
250
200
,
,
- погрешность вместимости мерных колб;
V
V
V
250
200
100
2
SV10
V
10
- погрешность вместимости пипетки;
17.
172
S
- погрешность определения объема по бюретке, при титровании
V
HCl
тетрабората натрия хлороводородной кислотой, где
V V
V
(
HCl
)
n
2
i
1
S
V
i
n
1
2
S
V
HCl
- погрешность определения объема по бюретке при титровании
n
V
(
HCl
)
гидроксида натрия хлороводородной кислотой, где
V
2
V
i
i
1
S
V
n
1
2
S
V
NaOH
- погрешность определения объема по бюретке при титровании
V
(
NaOH
)
n
2
гидроксида натрия серной кислотой, где
S
V
2
V V
i
1
i
n
1
S
t
S
m
m
0
,
95
Рассчитав
,
вычисляют
S
,
а
затем
e
m
O
m
(
H
S
)
n
2
4
Конечный результат массы серной кислоты записывают с учетом
доверительного интервала m m , например: m
(
H
SO
)= (0,223±0,002) г.
2
4
18.
18Результаты статистической обработки удобно представлять в виде таблицы,
например, для Р = 0,95, f= n - 1 = 7 – 1 = 6, t0,95;6= 2,45
xi,
2,15
2,10
2,10
2,15
2,20
2,20
2,15
2,15
d x
x
i
0,00
0,05
0,05
0,00
0,05
0,05
0,00
d2
2
(
x
x
)
i
S
n
1
t S
n
х
Sr
S
x
0,0000
0,0025
0,0025
0,0000
0,0025
0,0025
0,0000
0,04
0,04
1,9 %
19.
19Значения коэффициентов Стьюдента для расчета доверительных интервалов
Число
измерени
й, n
Степени
свободы,
f=n-1
2
Коэффициенты Стьюдента при значениях доверительной
вероятности, %
80
90
95
99
99,9
1
3,08
6,31
12,7
63,7
637
3
2
1,89
2,92
4,30
9,92
31,6
4
3
1,64
2,35
3,18
5,84
12,9
5
4
1,53
2,13
2,78
4,60
8,60
6
5
1,48
2,02
2,57
4,03
6,86
7
6
1,44
1,94
2,45
3,71
5,96
8
7
1,42
1,90
2,36
3,50
5,40
9
8
1,40
1,86
2,31
3,36
5,04
10
9
1,38
1,83
2,26
3,25
4,78
20.
20Статистическая обработка результатов титриметрического анализа
Результат анализа, приведенный без учета погрешностей, не имеет
практической ценности. Конечный результат, который является результатом
анализа, приводят в виде m m . Для расчета погрешности ∆m ( )
вычисляют стандартное отклонение
n
2
m
m
i
1
S i
n
1
S
t
0
,
95
;
n
где tP,n- коэффициент Стьюдента для доверительной вероятности Р (обычно
принимается равным 0,95) и числа параллельных результатов n.
21.
Методы протолитического (кислотно-основного) тированияПротолитическим (кислотно-основным) называется метод титриметрического
анализа, основанный на проведении в процессе титрования протолитической
(кислотно-основной) химической реакции.
Методы протолитического титрования
Ацидиметрическое тирование
(ацидиметрия) – титрование растворами
Кислот (определение веществ, обладающих
основными свойствами)
Алкалиметрическое титрование
(алкалиметрия) – титрование раствором щелочей
(определение веществ, обладающих
кислотными свойствами)
22.
Рабочие растворы и индикаторы кислотно-основного титрованияАцидиметрия – 0.1000 моль/л растворы НCl, Н2SO4
Первичные (установочные) растворы – Na2CO3, Na2B4O7·10H2O
Алкалиметрия – 0.1000 моль/л раствор NaOH
Первичные (установочные) растворы – H2C2O4·2H2O
(щавелевая кислота), H2C4H4O4 (янтарная кислота),
C6H5COOH (бензойная кислота)
Индикатор
Область перехода
окраски
рТ
Метиловый
оранжевый
3,1 - 4,4
орнаж. – желтая
4,0
Метиловый
красный
4,4 – 6,2
красный – желтый
5,5
лакмус
5,0 – 8,0
красный - синий
7,0
фенолфталеин
8,0 – 10,0
бесцв. – малин.
9,0





















 chemistry
chemistry








