Similar presentations:
Титриметрические методы анализа. Кислотно-основное титрование
1.
Титриметрические методыанализа. Кислотно-основное
титрование
2.
План1. Основные понятия титриметрии. Точка стехиометричности
(эквивалентности) и конечная точка титрования. Классификация
титриметрических методов анализа и способов титрования
(прямое,
обратное,
косвенное,
титрование
заместителя).
Требования, предъявляемые к реакциям в титриметрическом
анализе.
2. Стандартные растворы и стандартные вещества. Расчеты,
связанные с приготовлением растворов и титрованием.
3. Кислотно-основное титрование.
Титранты и стандартные
вещества. Обнаружение конечной точки титрования. Кислотноосновные
индикаторы.
Кривые
титрования.
Погрешности
титрования.
3.
Вопрос 1Основные понятия титриметрии.
Точка стехиометричности (эквивалентности) и
конечная точка титрования.
Классификация титриметрических методов анализа и
способов титрования (прямое, обратное, косвенное,
титрование заместителя).
Требования, предъявляемые к реакциям в
титриметрическом анализе
4.
Основные понятия титриметрииТитриметрические методы анализа – это методы, основанные на
измерении количества реагента, израсходованного для полного
протекания реакции с определяемым веществом
Титрование – это процесс определения вещества, при котором к нему
постепенно добавляют небольшие порции реагента (титранта) до того
момента, пока всё определяемое вещество не вступит в реакцию
Точка эквивалентности (точка стехиометричности) – это момент
титрования, при котором количество добавленного титранта становится
химически эквивалентным количеству определяемого вещества. Точка
эквивалентности – теоретическое понятие.
Конечная точка титрования (КТТ) – это момент титрования, при
котором изменение свойства системы указывает на достижение
эквивалентности
Внимание!!! В идеальном случае точка эквивалентности и конечная
точка титрования должны совпасть. Но вследствие несовершенства
зрительного анализатора, применяемых индикаторов и приборов,
количество титранта, затраченного для титрования, оказывается, как
правило, немного большим или немного меньшим, чем это нужно для
достижения химической эквивалентности.
5.
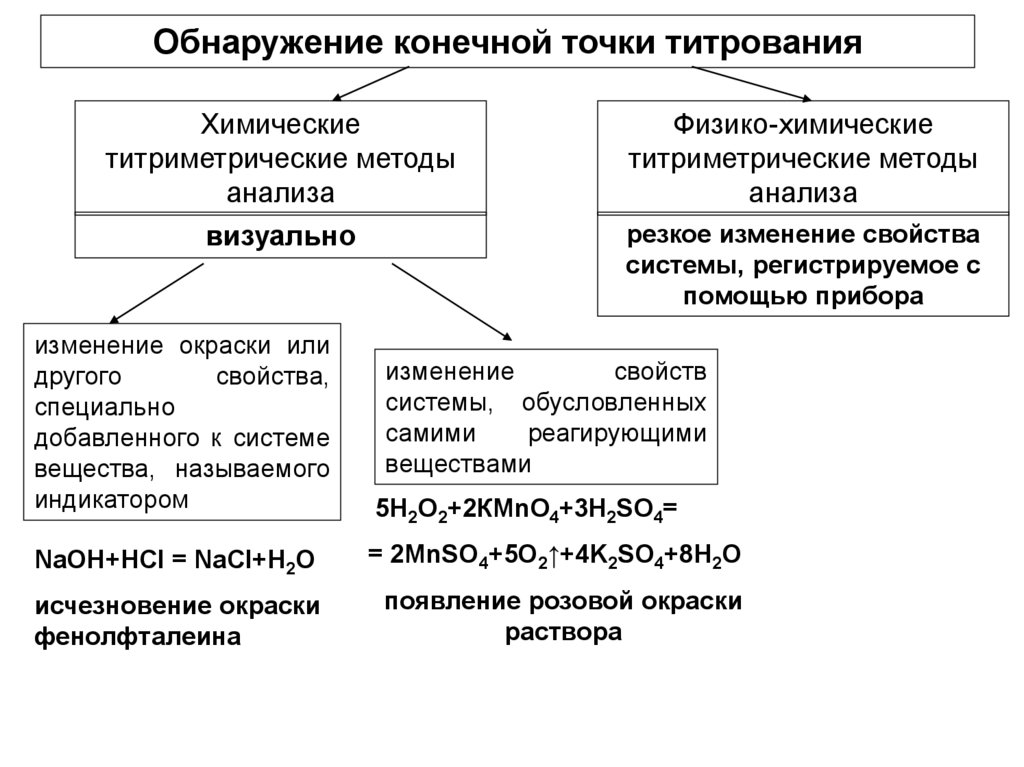
Обнаружение конечной точки титрованияХимические
титриметрические методы
анализа
визуально
изменение окраски или
другого
свойства,
специально
добавленного к системе
вещества, называемого
индикатором
Физико-химические
титриметрические методы
анализа
резкое изменение свойства
системы, регистрируемое с
помощью прибора
изменение
свойств
системы, обусловленных
самими
реагирующими
веществами
5Н2О2+2КМnO4+3H2SO4=
NaOH+HCI = NaCI+H2O
= 2MnSO4+5O2↑+4K2SO4+8H2O
исчезновение окраски
фенолфталеина
появление розовой окраски
раствора
6.
Классификация титриметрических методов анализа испособов титрования
Классификация
титриметрических
методов
анализа в зависимости от типа химической реакции,
протекающей между определяемым веществом и
титрантом:
I.
1. кислотно-основное титрование
2. комплексометрическое титрование
3. осадительное титрование
4. окислительно-восстановительное титрование
7.
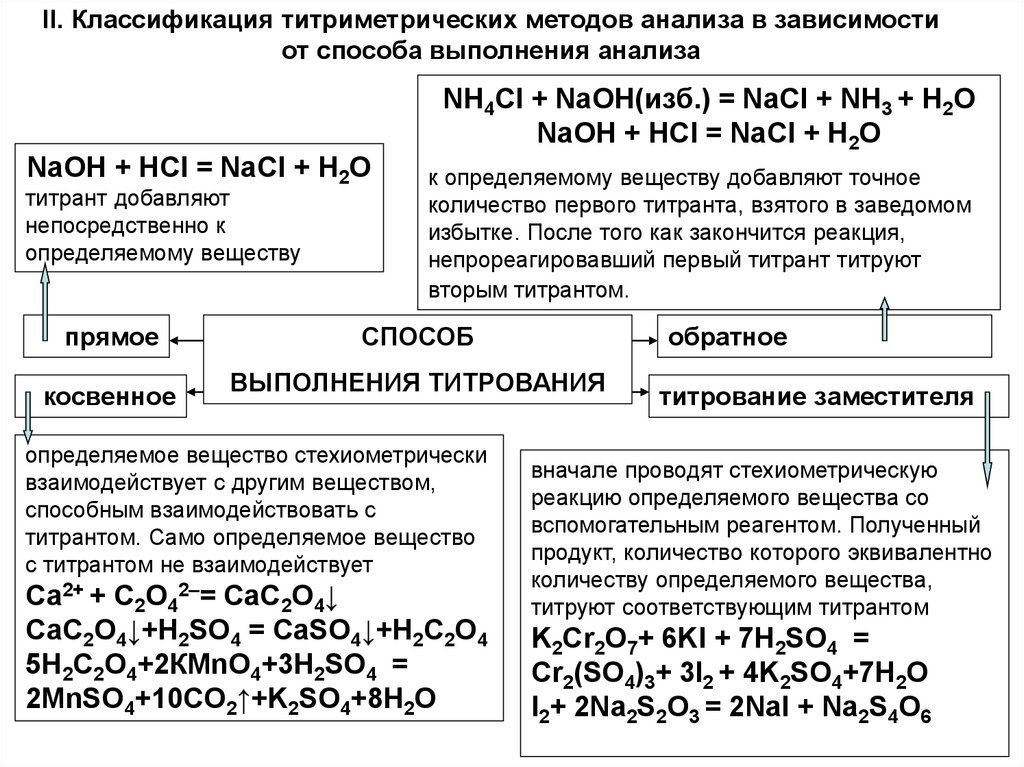
II. Классификация титриметрических методов анализа в зависимостиот способа выполнения анализа
NH4CI + NaOH(изб.) = NaCI + NH3 + H2O
NaOH + HCI = NaCI + H2O
NaOH + HCI = NaCI + H2O
титрант добавляют
непосредственно к
определяемому веществу
прямое
косвенное
к определяемому веществу добавляют точное
количество первого титранта, взятого в заведомом
избытке. После того как закончится реакция,
непрореагировавший первый титрант титруют
вторым титрантом.
СПОСОБ
обратное
ВЫПОЛНЕНИЯ ТИТРОВАНИЯ
определяемое вещество стехиометрически
взаимодействует с другим веществом,
способным взаимодействовать с
титрантом. Само определяемое вещество
с титрантом не взаимодействует
Са2+ + С2О42–= СаС2О4↓
СаС2О4↓+Н2SO4 = СaSO4↓+H2C2O4
5Н2C2О4+2КМnO4+3H2SO4 =
2MnSO4+10CO2↑+K2SO4+8H2O
титрование заместителя
вначале проводят стехиометрическую
реакцию определяемого вещества со
вспомогательным реагентом. Полученный
продукт, количество которого эквивалентно
количеству определяемого вещества,
титруют соответствующим титрантом
K2Cr2O7+ 6KI + 7H2SO4 =
Cr2(SO4)3+ 3I2 + 4K2SO4+7H2O
I2+ 2Na2S2O3 = 2NaI + Na2S4O6
8.
Требования к реакциям, лежащим в основе прямого титрованияРеакция, лежащая в основе прямого титрования, должна:
1. протекать количественно, иначе говоря, иметь большую константу
равновесия, поскольку нет возможности добавлять избыток реагента
2. протекать быстро и, по возможности, при комнатной
температуре
3. быть стехиометричной, т.е. протекать строго согласно уравнению
реакции. Изменение условий не должно влиять на её ход и на
свойства конечных продуктов.
Кроме того
4. должен существовать способ обнаружения (визуальный или
инструментальный) конечной точки титрования
9.
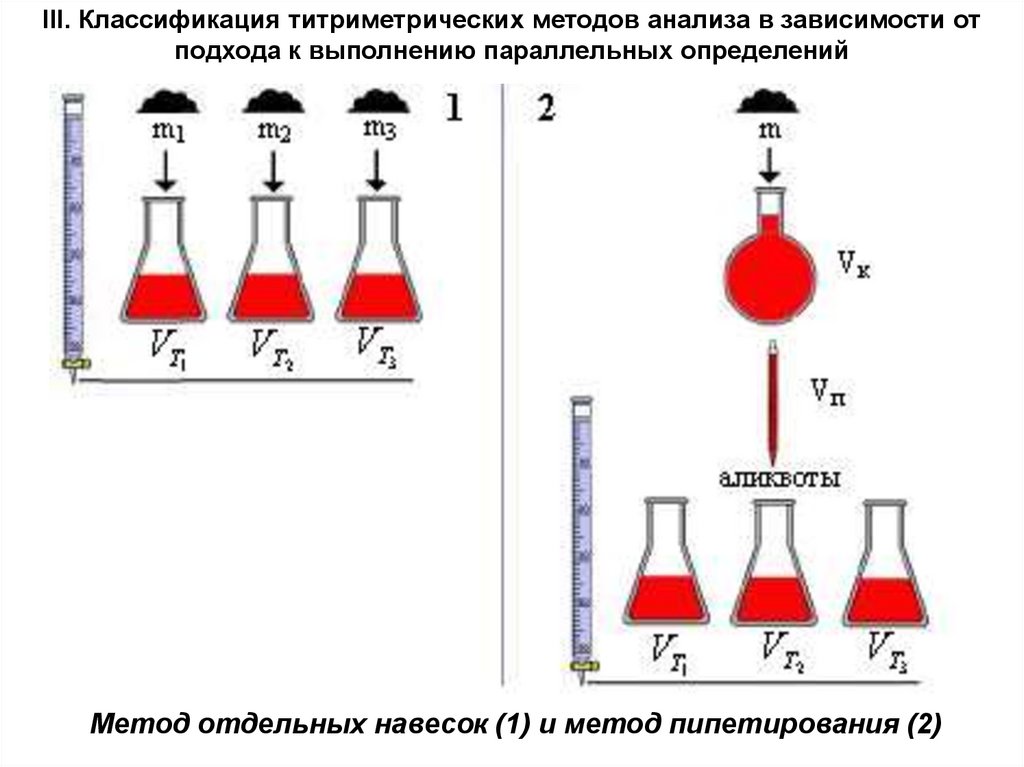
III. Классификация титриметрических методов анализа в зависимости отподхода к выполнению параллельных определений
Метод отдельных навесок (1) и метод пипетирования (2)
10.
Метод отдельных навесок заключается в том, что n навесоквещества (m1, m2 и т.д.), взятых на аналитических весах,
растворяют в необходимых объемах растворителя (точность
измерения объема раствора не важна: важна точность
измерения массы навески), каждый полученный раствор
титруют.
Метод пипетирования заключается в титровании равных
порций раствора (аликвот), отбираемых мерной пипеткой из
мерной колбы определенного объема, в которой растворена
навеска анализируемого вещества.
Метод отдельных навесок более трудоёмок, требует больших
количеств анализируемого объекта. Однако результаты анализа
этим методом имеют меньшую неопределённость (результат
зависит от неопределённости взятия навески, а в методе
пипетирования также и от измерения объёмов исходного
раствора и аликвот), вследствие чего он чаще используется,
например, в фармакопейном анализе. Метод пипетирования
более экспрессен и менее трудоемок.
11.
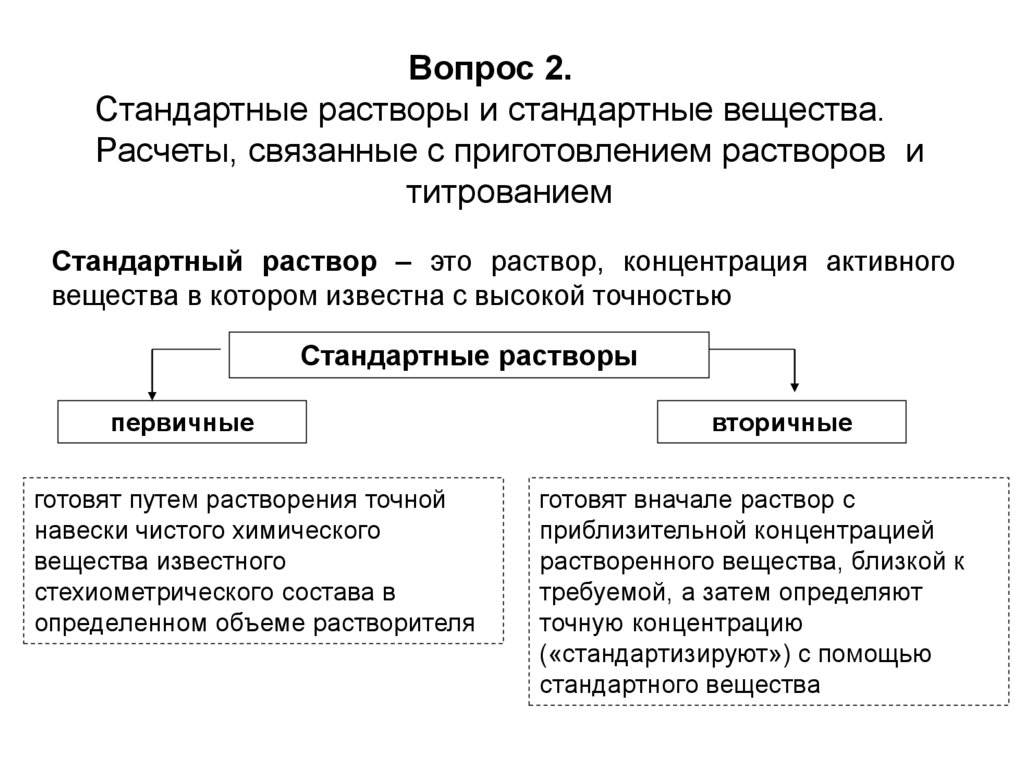
Вопрос 2.Стандартные растворы и стандартные вещества.
Расчеты, связанные с приготовлением растворов и
титрованием
Стандартный раствор – это раствор, концентрация активного
вещества в котором известна с высокой точностью
Стандартные растворы
первичные
готовят путем растворения точной
навески чистого химического
вещества известного
стехиометрического состава в
определенном объеме растворителя
вторичные
готовят вначале раствор с
приблизительной концентрацией
растворенного вещества, близкой к
требуемой, а затем определяют
точную концентрацию
(«стандартизируют») с помощью
стандартного вещества
12.
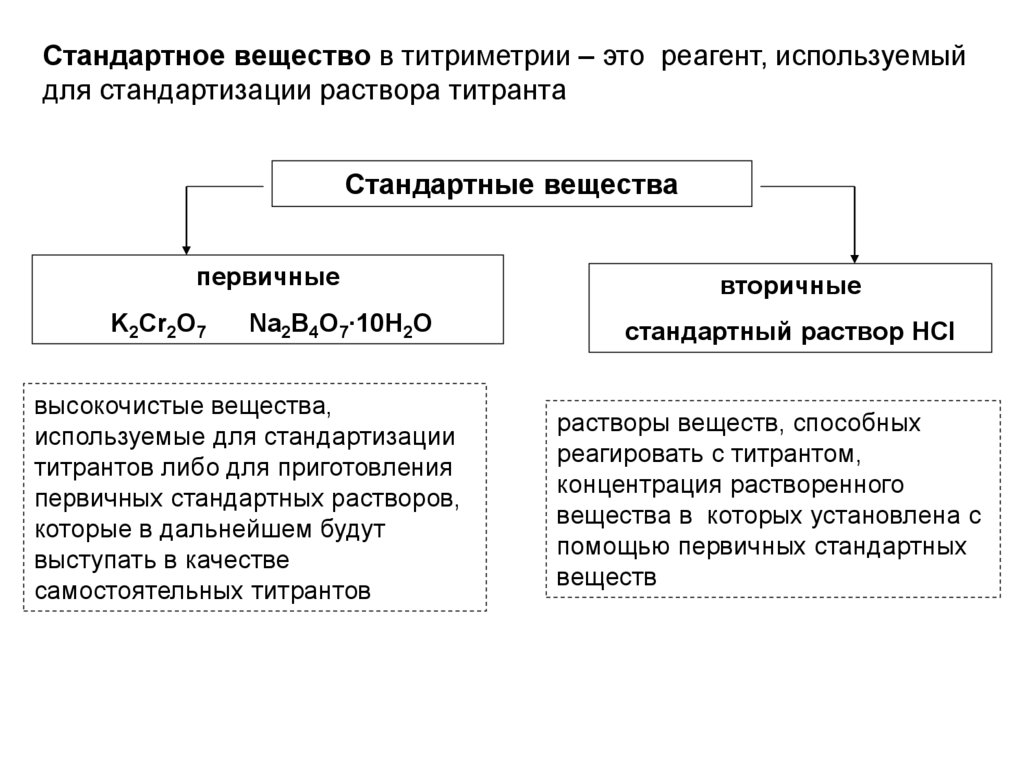
Стандартное вещество в титриметрии – это реагент, используемыйдля стандартизации раствора титранта
Стандартные вещества
первичные
K2Cr2O7
Na2B4O7∙10H2O
высокочистые вещества,
используемые для стандартизации
титрантов либо для приготовления
первичных стандартных растворов,
которые в дальнейшем будут
выступать в качестве
самостоятельных титрантов
вторичные
стандартный раствор HCI
растворы веществ, способных
реагировать с титрантом,
концентрация растворенного
вещества в которых установлена с
помощью первичных стандартных
веществ
13.
Соединения, используемые в качестве первичныхстандартных веществ обладают следующими
свойствами
1. их состав строго соответствует химической формуле
2. выпускаются промышленностью в чистом виде (квалификация не
ниже «ч.д.а.») либо легко подвергаются очистке
3. устойчивы при обычных условиях
4. обычно нелетучи и безводны (можно использовать и
кристаллогидраты, если они устойчивы)
5. имеют большую молярную массу (меньше погрешность при
измерении массы навески)
14.
Расчёты, связанные с приготовлением растворов и титрованиема) Расчёты, связанные с приготовлением растворов
Титр раствора – это массовая концентрация, имеющая размерность
г/мл
Молярная (с) – отношение количества растворенного вещества к
объему раствора. Понятие «молярная концентрация» может
относиться как к формульной единице вещества, так и к его
эквиваленту. Молярную концентрацию выражают в моль/дм3 (моль/л)
Например,
с(HCI) = 0,1 моль/дм3 или 0,1 М HCI;
с(1/5 KMnO4 ) = 0,05 моль/дм3 или 0,05 М (1/5 KMnO4)
Титр соответствия (титр по определяемому веществу) показывает
массу определяемого вещества, взаимодействующего с 1 см3 данного
титранта. Например, титр 0,1000 М HCl по NaOH равен 4,000·10-3 г/см3
(ТHCI/NaOH= 4,000·10-3 г/см3)
15.
б) Расчёты, связанные с титрованиемКоличество эквивалента определяемого вещества равно
количеству эквивалента титранта
n( f экв1 В1 ) n( f экв 2 В2 )
Расчет массовой доли вещества в анализируемом объекте
1. Метод отдельных навесок
а) Способ прямого титрования (либо косвенного, либо
титрования заместителя)
m( B)
100%
g
m( B) n( f ЭКВ В) f ЭКВ М ( В)
n( f ЭКВ В) С ( f ЭКВ ,Т ВT ) VТ 10 3
C ( f ЭКВ ,Т ВТ ) VT 10 3 f ЭКВ М ( В)
g
100
16.
б) Способ обратного титрования'
'
'
''
''
''
3
(C ( f ЭКВ
В
)
V
C
(
f
В
)
V
)
10
f ЭКВ М ( В)
,Т T
T
ЭКВ, Т Т
T
g
100
2. Метод пипетирования
а) Способ прямого титрования (либо косвенного, либо
титрования заместителя). В расчётную формулу вводят
множитель, называемый фактором разбавления (VК/VП). Он
показывает, какая часть раствора, приготовленного из навески,
используется для титрования (составляет аликвоту)
3
C ( f ЭКВ ,Т ВТ ) VT 10 f ЭКВ М ( В ) VК
100
g
VП
17.
б) Способ обратного титрования'
'
'
''
''
''
3
(C ( f ЭКВ
В
)
V
C
(
f
В
)
V
)
10
f ЭКВ М ( В) VК
,Т T
T
ЭКВ, Т Т
T
100
g
VП
Если заранее рассчитана величина титра соответствия
Т ВТ / В С( f ЭКВ ,Т ВT ) f ЭКВ М ( В) 10
Т ВТ / В VT
g
100
3
18.
Вопрос 3.Кислотно-основное титрование. Титранты и
стандартные вещества. Обнаружение конечной
точки титрования. Кислотно-основные индикаторы.
Кривые титрования. Погрешности титрования
Кислотно-основным
называется
титриметрический метод
анализа, основанный на использовании протолитических реакций
Кислотно-основное титрование может проводиться как в водной
среде, так и в неводных растворителях
В зависимости от природы титранта различают кислотноосновное титрование:
1. ацидиметрическое
(титрант – кислота: ОН– + Н3О+→ 2Н2О; В + Н3О+ = ВН++Н2О)
2. алкалиметрическое
(титрант – основание: Н3О++ ОН– = 2Н2О; НА + ОН– = А– + Н2О)
19.
Титранты и стандартные веществаАцидиметрия
Титранты – HCI; H2SO4 – вторичные стандартные растворы
Для стандартизации растворов кислот используют первичные
стандартные растворы, обладающие основными свойствами
• декагидрат тетрабората натрия (бура):
Na2B4O7 + 2HCI + 5H2O = 4B(OH)3 + 2NaCI
• карбонат натрия, который можно получить при прокаливании
гидрокарбоната или оксалата натрия:
NaHCO3 → Na2CO3 ← Na2C2O4
Na2CO3 + 2HCI =2NaCI + H2CO3
20.
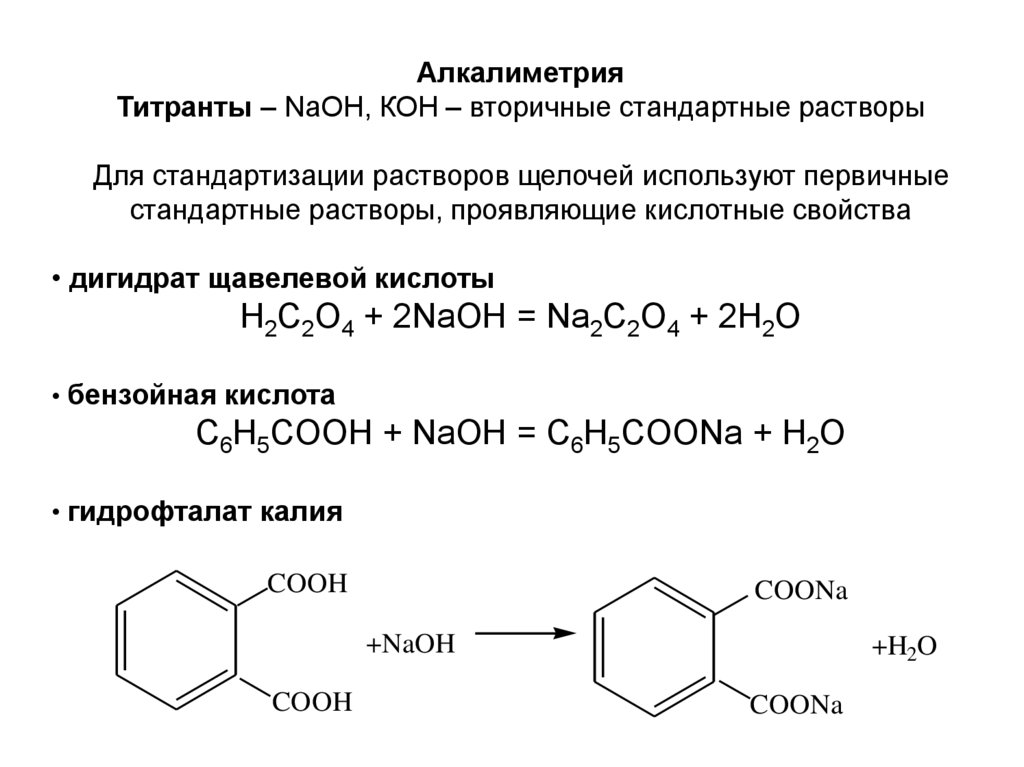
АлкалиметрияТитранты – NaOH, КОН – вторичные стандартные растворы
Для стандартизации растворов щелочей используют первичные
стандартные растворы, проявляющие кислотные свойства
• дигидрат щавелевой кислоты
H2C2O4 + 2NaOH = Na2C2O4 + 2H2O
• бензойная кислота
С6Н5СOOH + NaOH = С6Н5СOONa + H2O
• гидрофталат калия
COOH
COONa
+NaOH
COOH
+H2O
COONa
21.
Обнаружение конечной точки титрования. Кислотно-основныеиндикаторы
Индикатор (лат. indicator – указатель) – это вещество, видимо
изменяющее
свои
свойства
(окраску,
люминесценцию,
растворимость) при изменении концентрации какого-либо
компонента в растворе.
Внимание !!! У правильно выбранного индикатора изменение
окраски должно происходить в точке эквивалентности или
вблизи неё
22.
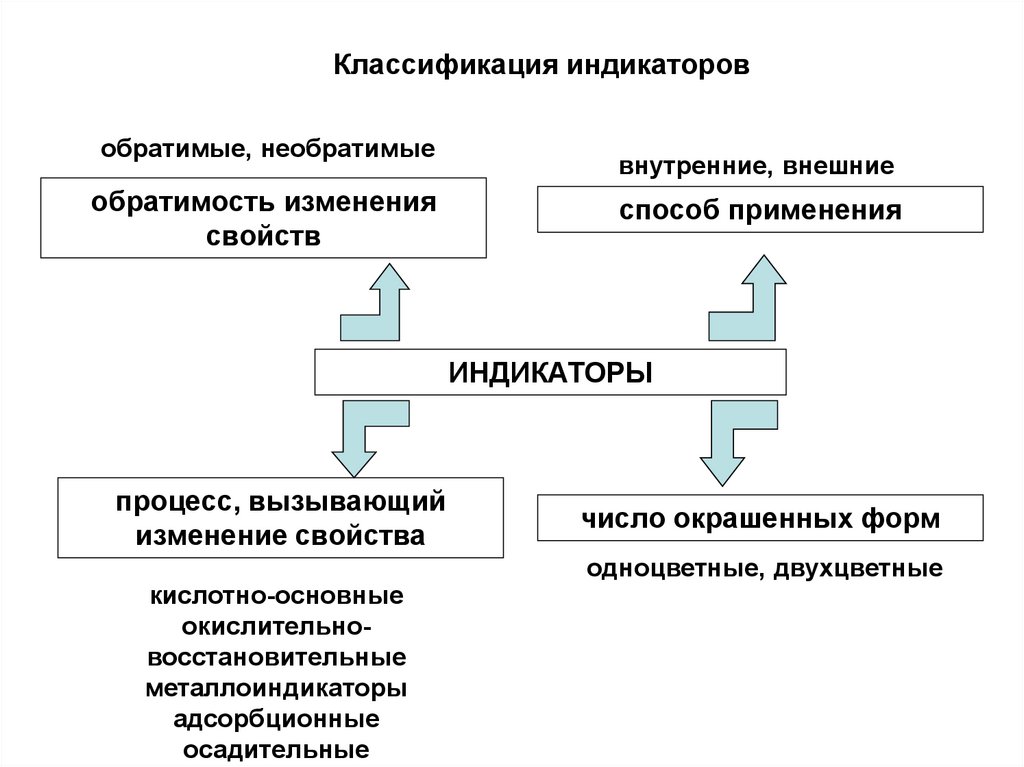
Классификация индикаторовобратимые, необратимые
обратимость изменения
свойств
внутренние, внешние
способ применения
ИНДИКАТОРЫ
процесс, вызывающий
изменение свойства
кислотно-основные
окислительновосстановительные
металлоиндикаторы
адсорбционные
осадительные
число окрашенных форм
одноцветные, двухцветные
23.
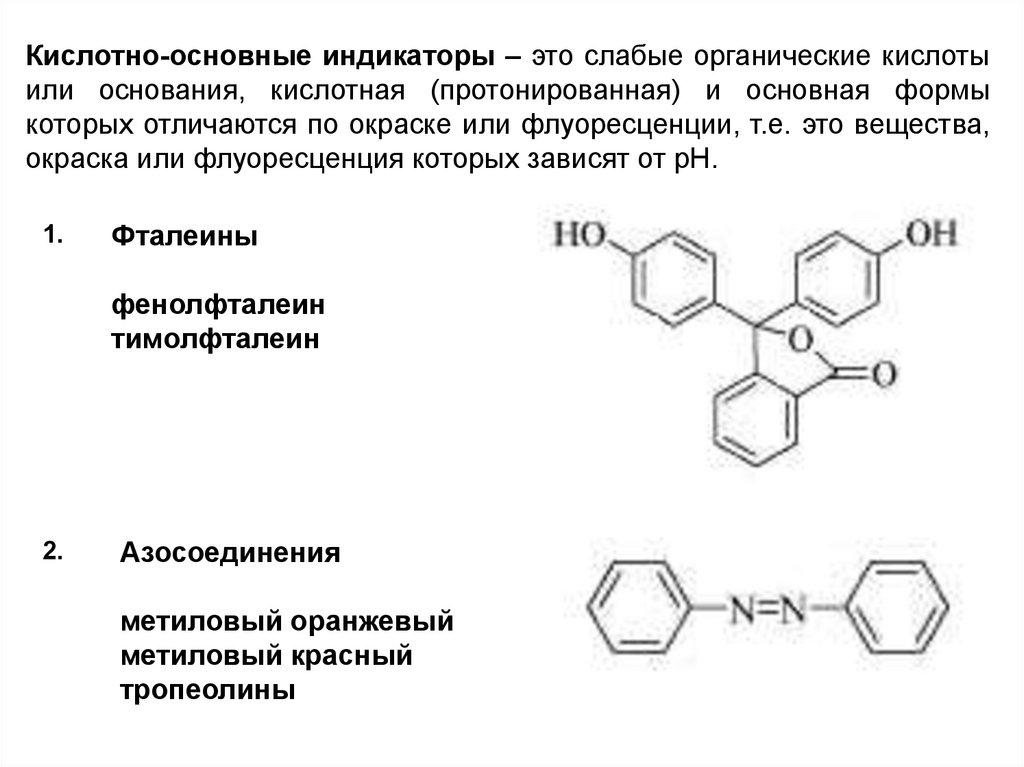
Кислотно-основные индикаторы – это слабые органические кислотыили основания, кислотная (протонированная) и основная формы
которых отличаются по окраске или флуоресценции, т.е. это вещества,
окраска или флуоресценция которых зависят от рН.
1.
Фталеины
фенолфталеин
тимолфталеин
2.
Азосоединения
метиловый оранжевый
метиловый красный
тропеолины
24.
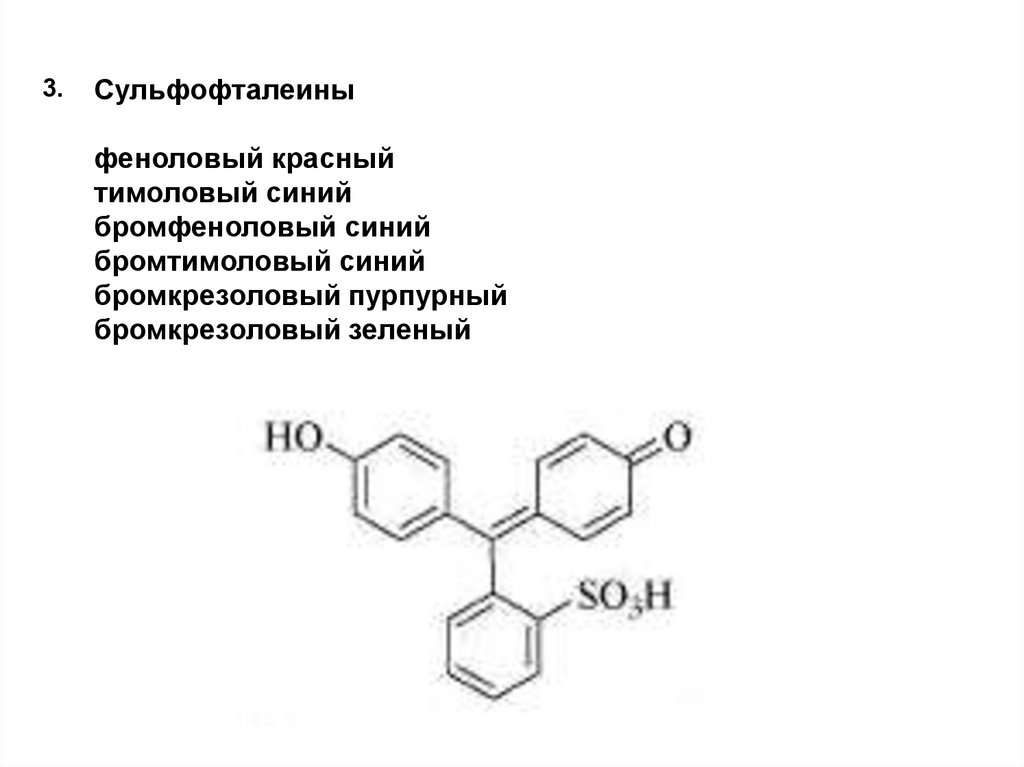
3.Сульфофталеины
феноловый красный
тимоловый синий
бромфеноловый синий
бромтимоловый синий
бромкрезоловый пурпурный
бромкрезоловый зеленый
25.
Метиловый оранжевыйдвухцветный индикатор, основная форма окрашена в жёлтый цвет,
кислотная (протонированная) – в красный. Полоса поглощения
протонированной формы сдвинута в сторону больших длин волн
(батохромно), а кроме того, протонированная форма более
интенсивно поглощает электромагнитное излучение видимого
диапазона, чем непротонированная
Внимание!!! Изменение окраски метилового оранжевого и любых
других кислотно-основных индикаторов происходит не
одномоментно, а в определённом интервале рН, называемом
интервалом перехода окраски индикатора
HInd+ +H2O ↔ Ind + H3O+
[ Ind ][ H 3O ]
Ка
[ HInd ]
[ HInd ]
[ H 3O ] K a
[ Ind ]
26.
Внимание!!! В среднем, человеческий глаз замечает изменениеокраски, когда концентрация одной окрашенной формы
становится в 10 раз больше, чем другой
[HInd+] / [Ind] ≥10 окраска раствора индикатора соответствует
окраске кислотной формы
[Ind] / [HInd+]≥10 окраска обусловлена основной формой
Переход окраски двухцветного индикатора
10 ≤ ([HInd+] / [Ind]) ≤ 0,1
рНперехода = рКа ± 1
Границы интервала pKa ± 1 соблюдаются в том случае, если интенсивность
окраски обеих форм одинакова. В действительности это обычно не так. У
метилового оранжевого pKa = 3,36, а интервал перехода окраски: 3,1 - 4,6. Это
объясняется тем, что протонированная форма имеет больший молярный
коэффициент светопоглощения и для того, чтобы окраска раствора
индикатора соответствовала окраске кислотной формы, достаточно, чтобы её
концентрация не в 10, а приблизительно в 2 раза превышала концентрацию
основной формы
27.
Показатель титрования (рТ) – это значение рН, при которомзаканчивают титрование с данным индикатором
Внимание!!! Величина показателя титрования находится
примерно в середине интервала перехода окраски индикатора,
например, у метилового оранжевого рТ ≈ 4
Интервал перехода окраски индикаторов зависит от: температуры;
ионной силы; присутствия в растворе посторонних веществ
(например, этанола), влияющих на кислотно-основные свойства
индикатора
Внимание!!! У метилового оранжевого и других двухцветных
индикаторов интервал перехода не зависит от концентрации
индикатора в растворе
28.
Метиловый красныйДвухцветный индикатор, интервал перехода окраски этого
индикатора от красной к желтой находится в области рН 4,4 - 6,2;
рКа = 5
Фенолфталеин
Одноцветный индикатор, появление малиновой окраски происходит
в интервал рН 8,1-9,8; рТ=9
Внимание!!! Интервал перехода окраски фенолфталеина и
других одноцветных индикаторов зависит от их концентрации в
растворе, что является недостатком таких индикаторов
29.
Требования, предъявляемые к кислотно-основным индикаторам1. должны обладать интенсивной окраской (иметь большой
молярный коэффициент светопоглощения)
2. изменение их окраски должно быть контрастным (большая
разность между длинами волн, соответствующими максимумам
поглощения кислотной и основной форм)
3. желательно, чтобы интервал перехода окраски должен быть узким,
а процесс изменения окраски – обратимым
Для повышения контрастности изменения окраски используют
смешанные и контрастные индикаторы
Смешанный индикатор состоит из двух индикаторов, имеющих
примерно одинаковый интервал перехода окраски, причём окраска
одного из индикаторов является дополнительной для другого
Контрастный индикатор «работает» по такому же принципу, что и
смешанный, однако, вместо второго индикатора используется
вещество, окраска которого не зависит от рН
Смеси из трёх и более индикаторов называются универсальными
индикаторами. Универсальные индикаторы обычно используют
для количественного определения рН.
30.
Кривая титрования – график зависимости параметрасистемы, связанного с концентрацией титруемого
вещества, титранта или продукта реакции, от степени
протекания процесса титрования (например, от
количества добавленного титранта)
Кривые титрования строят для того, чтобы
1. наглядно представить себе, что происходит при
титровании
2. объяснить почему для титрования данного вещества
подходит один, но не подходит другой индикатор
3. оценить индикаторную погрешность титрования
31.
Степень оттитрованности (f) – это отношение уже добавленногораствора титранта к тому его объему, который необходимо добавить
до достижения точки эквивалентности
f
VT ДОБ
VTЭКВ
Если концентрации титруемого вещества и титранта в растворе
одинаковы, то степень оттитрованности равна отношению
добавленного объема титранта к начальному объему раствора
титруемого вещества
T ДОБ
f
V
V0
По оси абсцисс при построении кривых титрования обычно
откладывают объём добавленного стандартного раствора титранта или
степень оттитрованности. По оси ординат, в случае кривых титрования
для кислотно-основного титрования, откладывают значение рН
раствора.
32.
Внимание!!! На любой кривой титрования можно условновыделить 4 участка
1. исходная точка
2. участок до скачка титрования
3. скачок титрования, включая точку эквивалентности
4. участок после скачка титрования
Скачком титрования называется участок кривой титрования,
соответствующий резкому изменению свойств системы (в случае
кислотно-основного титрования – резкому изменению рН) вблизи
точки эквивалентности (обычно в интервале значений степени
оттитрованности 0,999 – 1,001)
В зависимости от природы определяемого вещества и титранта
различают 4 основных случая кислотно-основного титрования
и, соответственно, 4 типа кривых титрования
1. титрование сильной кислоты сильным основанием
2. титрование сильного основания сильной кислотой
3. титрование слабой кислоты сильным основанием
4. титрование слабого основания сильной кислотой
33.
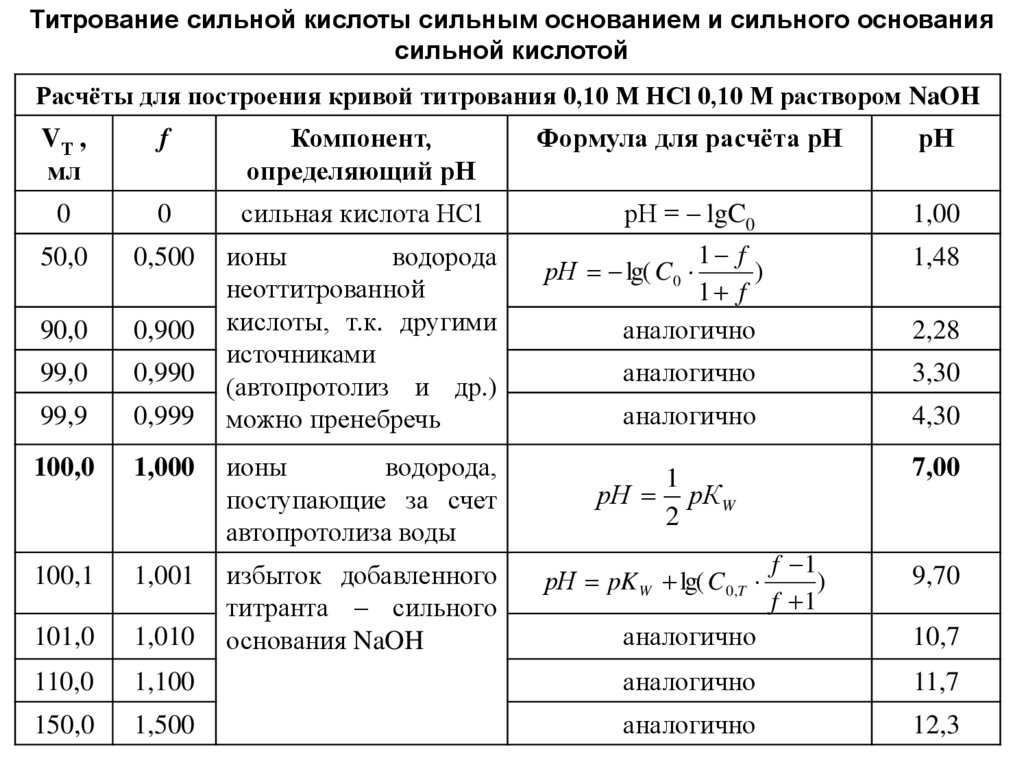
Титрование сильной кислоты сильным основанием и сильного основаниясильной кислотой
Расчёты для построения кривой титрования 0,10 М HCl 0,10 М раствором NaOH
VТ ,
мл
f
Компонент,
определяющий рН
Формула для расчёта рН
рН
0
0
сильная кислота HCl
рН = – lgC0
1,00
50,0
0,500
0,900
1 f
)
1 f
аналогично
1,48
90,0
99,0
0,990
аналогично
3,30
99,9
0,999
ионы
водорода
неоттитрованной
кислоты, т.к. другими
источниками
(автопротолиз и др.)
можно пренебречь
аналогично
4,30
100,0
1,000
ионы
водорода,
поступающие за счет
автопротолиза воды
100,1
1,001
101,0
1,010
избыток добавленного
титранта – сильного
основания NaOH
110,0
150,0
рН lg( C0
2,28
7,00
1
рН рК W
2
рН pK W lg( C 0,T
f 1
)
f 1
9,70
аналогично
10,7
1,100
аналогично
11,7
1,500
аналогично
12,3
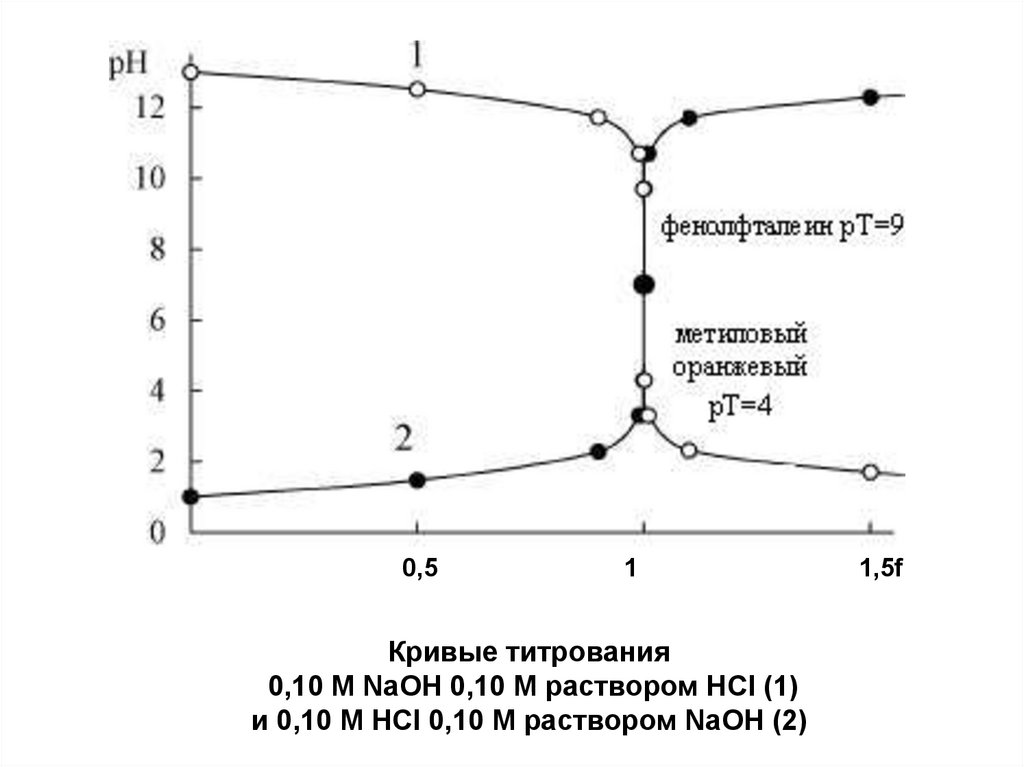
34.
0,51
Кривые титрования
0,10 М NaOH 0,10 M раствором HCl (1)
и 0,10 M HCl 0,10 M раствором NaOH (2)
1,5f
35.
Титрование слабой кислоты сильным основанием и слабого основаниясильной кислотой
Расчёты для построения кривой титрования 0,10 М HСООН (рКа = 3,75)
0,10 М раствором NaOH
f
Компонент,
определяющий рН
Формула для расчёта рН
0
слабая кислота
НСООН
рН
0,100
буферная смесь
НСООН/НСОО–
рН рК а lg
0,500
то же
аналогично
3,75
0,900
то же
аналогично
4,74
0,990
то же
аналогично
5,75
1,00
слабое основание
НСОО–
8,22
1,01
сильное основание
ОН–
C
1
( рК W рК а lg 0 )
2
1 f
f 1
рH pK W lg( C 0,T
)
f 1
1,10
то же
аналогично
11,2
1,50
то же
аналогично
12,3
1
( рК а lg C 0 )
2
1 f
f
рН
рН
2,38
2,80
10,7
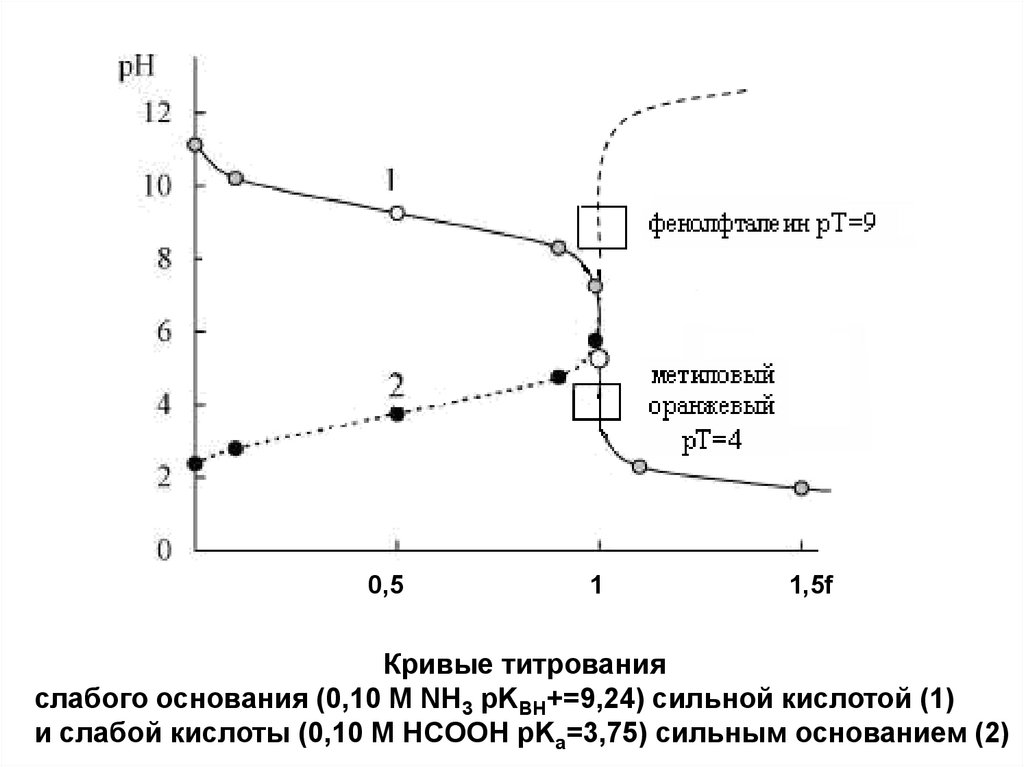
36.
0,51
1,5f
Кривые титрования
слабого основания (0,10 M NH3 pKBH+=9,24) сильной кислотой (1)
и слабой кислоты (0,10 M HCOOH pKa=3,75) сильным основанием (2)
37.
На величину скачка титрования при кислотно-основном титрованиивлияют следующие параметры
1. концентрация титруемого вещества и титранта (при уменьшении
концентрации титруемого вещества и титранта величина скачка
титрования уменьшается, поэтому титриметрический метод нельзя
использовать для определения веществ в сильно разбавленных
растворах),
2. сила титруемой кислоты или основания (величина скачка
титрования также становится меньше
при
уменьшении силы
титруемой кислоты или основания; прямое титрование таких кислот
как H3BO3 (pKa = 9,24) или NH4+ (pKa = 9,24) в водных растворах с
удовлетворительной погрешностью невозможно и поэтому для их
определения используют специальные приёмы)
3. температура (температура влияет на величину скачка титрования
менее заметно, чем концентрация или сила титруемой кислоты или
основания; при повышении температуры константа автопротолиза
воды увеличивается, поэтому величина скачка кислотно-основного
титрования в водном растворе уменьшается)
4. ионная сила раствора (влияет на величину скачка титрования
аналогично температуре)
38.
Погрешности титрованияМогут возникать на любой стадии титриметрического анализа
В зависимости от причины возникновения погрешности в
титриметрических методах анализа, как и погрешности вообще, могут
быть случайные (причина неизвестна) и систематические (вызваны
постоянно действующим фактором; могут быть устранены)
Систематические в свою очередь бывают положительные
(определяемое
вещество
все
время
перетитровывается)
и
отрицательные
(определяемое
вещество
все
время
недотитровывается)
Причины появления систематических погрешностей
1. использование неверно откалиброванной посуды;
2. неправильная техника титрования (слишком быстрое добавление
титранта);
3. неточное считывание объёма титранта, израсходованного для
титрования;
4. несовпадение точки эквивалентности и рТ индикатора
(наиболее часто встречающаяся причина)
39.
Погрешности, обусловленные несовпадением точки эквивалентности ирТ индикатора, называются индикаторными
Индикаторные погрешности в кислотно-основном титровании
удобно разделить на 4 вида
1. Водородная индикаторная погрешность
В КТТ в растворе присутствует избыток Н3О+ по сравнению с ТЭ.
Может возникнуть при недотитровании сильной кислоты (в таком
случае погрешность отрицательная) либо когда сильная кислота
используется в качестве титранта и добавлена в избытке
(положительная погрешность)
n( H 3O )
СV
10 pT V
H
n( H 3O )исх
С0V0
C0V0
Если концентрации титруемого вещества и титранта одинаковы (V = 2V0)
pT
2 10
H
C0
.
40.
2. Гидроксидная индикаторная погрешностьВ КТТ в растворе присутствует избыток ОН– по сравнению с ТЭ.
Может возникнуть при недотитровании сильного основания
(отрицательная погрешность) либо в том случае, когда сильное
основание используется в качестве титранта и добавлено в избытке
(положительная погрешность)
10 pT рКW V
10 pT pKW
ОН
2
.
C0V0
C0
3. Кислотная индикаторная погрешность
В КТТ в растворе остается недотитрованная слабая кислота, может
быть только отрицательной. Величина кислотной погрешности
представляет собой молярную долю неоттитрованной кислоты.
[ H 3O ]
[ HA]
1
НА
pT pKa
C НА
[ H 3O ] K a
1 10
41.
4. Основная индикаторная погрешностьВ КТТ в растворе остается недотитрованное слабое основание.
Может быть только отрицательной (если, конечно, исключить
гипотетический случай использования слабой кислоты или
основания в качестве титранта).
В
1
1 10
рК
ВН
рТ





























 chemistry
chemistry








