Similar presentations:
Карбоновые кислоты. Что такое карбоновые кислоты?
1.
СnH2n+1COOHКарбоновые
кислоты
2.
Что такое карбоновые кислоты?КАРБОНОВЫЕ КИСЛОТЫ – органические соединения,
содержащие одну или несколько карбоксильных групп –
СООН.
Название происходит от лат. carbo – уголь и греч. oxys –
кислый.
Карбоксильная группа (сокращенно —COOH) функциональная группа карбоновых кислот - состоит из
карбонильной группы и связанной с ней гидроксильной
группы.
Общая формула одноосновных карбоновых кислот
R—COOH.
3.
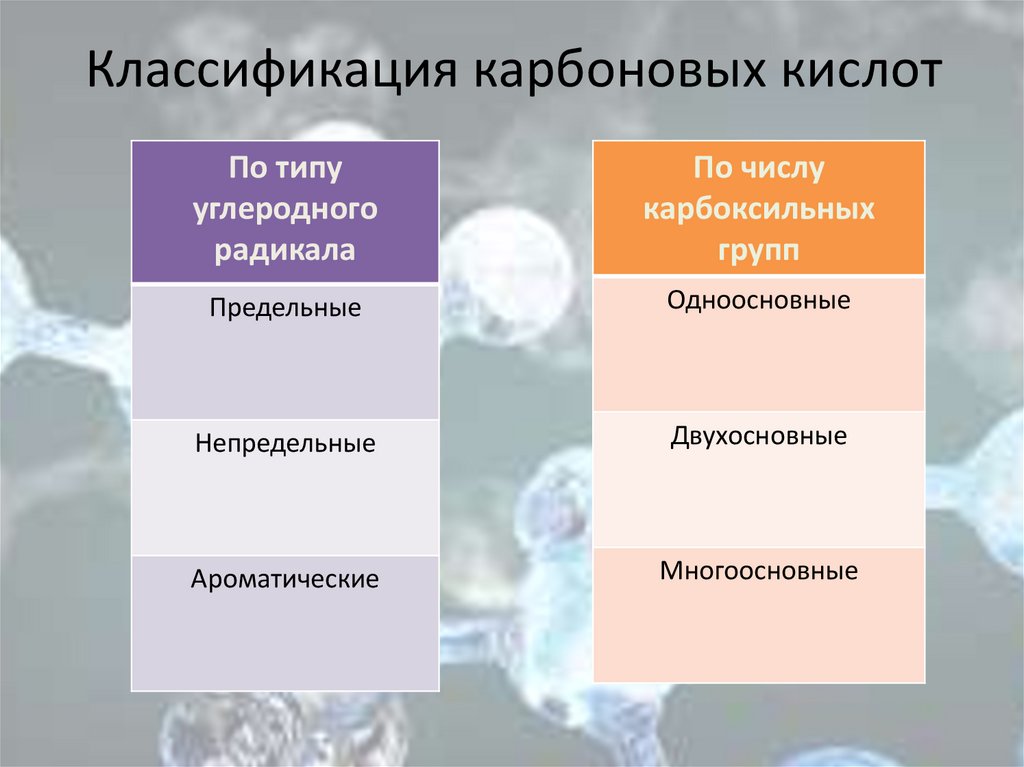
Классификация карбоновых кислотПо типу
углеродного
радикала
По числу
карбоксильных
групп
Предельные
Одноосновные
Непредельные
Двухосновные
Ароматические
Многоосновные
4.
Физические свойства карбоновыхкислот
Карбоновые кислоты, благодаря карбоксильной группе, полярны и могут
участвовать в образовании межмолекулярных водородных связей. Такими
связями с молекулами воды объясняется неограниченная растворимость
низших кислот (C1-C4) в воде и спирте. Высшие кислоты в воде растворяются
плохо. Хорошо растворяются в этиловом спирте и диэтиловом эфире. Это
связано с гидрофобными свойствами УВ-радикала в кислоте: чем больше масса
радикала, тем меньше кислота растворима в воде.
• Низшие кислоты – бесцветные, резко пахнущие жидкости, начиная с
пентановой (валериановой) кислоты – маслянистые жидкости, высшие
кислоты - твердые вещества без вкуса и запаха.
• Для карбоновых кислот характерна межмолекулярная ассоциация. Так,
жидкие карбоновые кислоты, например уксусная кислота, существуют в
виде димеров. В водных растворах димеры распадаются на мономеры.
5.
6.
Получение карбоновых кислот• 1. Окисление первичных спиртов и альдегидов.
• 2. Окисление неразветвленных алкенов
• 3. Окисление алкинов.
• 4.Окисление алканов (промышленный метод)
RCH2CH2R' + 5/2O2 = RCOOH + R'COOH + H2O
Окисление осуществляют при катализе реакции солями
кобальта или марганца.
7.
• Гидролитические методы.а) Кислотный гидролиз нитрилов
RCN + 2H2O + HX =RCOOH + NH4X
б) Основной гидролиз нитрилов
RCN + H2O + NaOH =RCOONa + NH3
• Гидрокарбоксилироание галогеналканов и
алкенов.
8.
Химические свойства карбоновыхкислот
Горение:
CH3COOH + 2O2 2CO2 + 2H2O
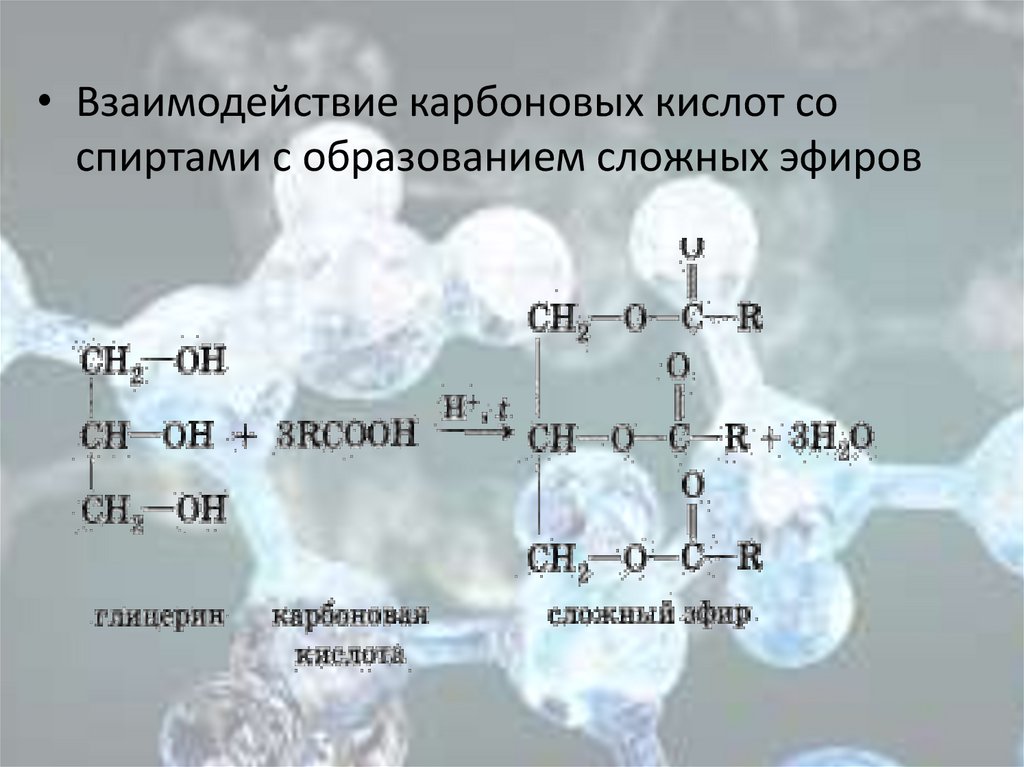
Этерификация (реакция карбоновых кислот со спиртами,
приводящая к образованию сложного эфира):
+Н2О
Замещение в углеводородном радикале:
CH3—CH2—COOH + Cl2
CH3—CHCl—COOH + HCl
пропионовая кислота
-хлорпропионовая кислота
HCOOH + Ag2O(аммиачный раствор)
CO2 + H2O + 2Ag
9.
• Взаимодействие с металлами, стоящими вэлектрохимическом ряду напряжений до
водорода. Так, железо восстанавливает водород
из уксусной кислоты:
2СН3—СООН + Fe —> (CH3COO)2Fe + Н2
• Взаимодействие с основными оксидами с
образованием соли и воды:
2R—СООН + СаО —> (R—СОО)2Са + Н20
• Взаимодействие с гидроксидами металлов с
образованием соли и воды (реакция
нейтрализации):
R—СООН + NaOH —> R—COONa + Н20
• 2R—СООН + Са(ОН)2 —> (R—СОО)2Са + 2Н20
10.
• Взаимодействие карбоновых кислот соспиртами с образованием сложных эфиров
11.
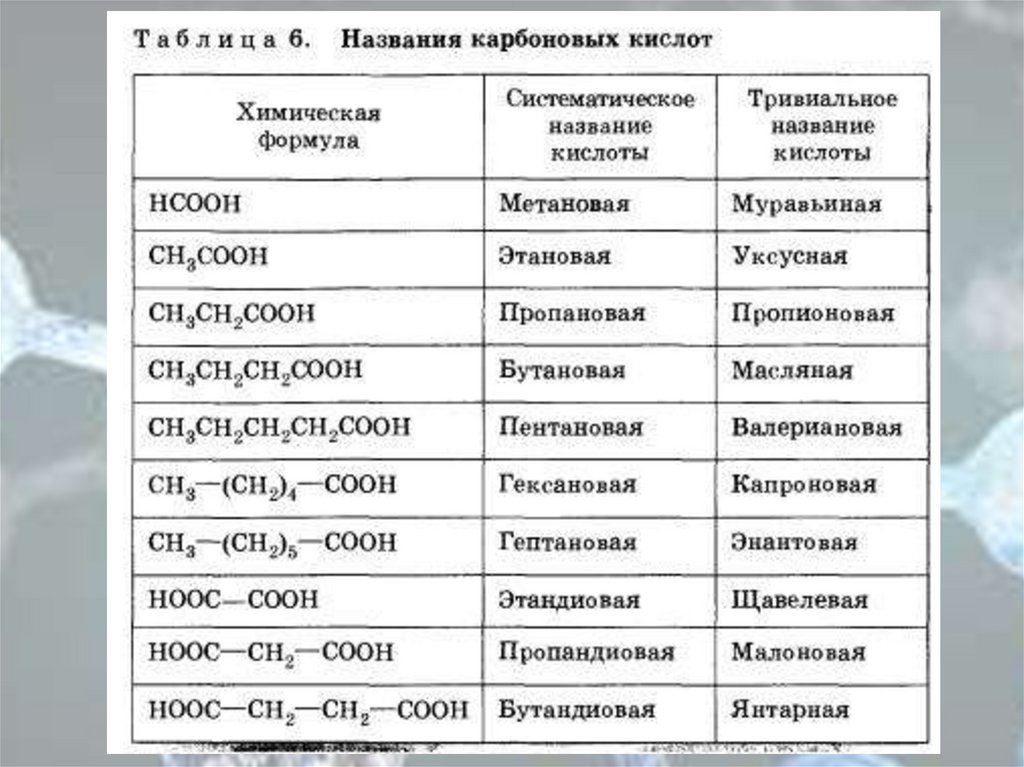
Алгоритм составления названийкарбоновых кислот
• Найдите главную углеродную цепь - это самая
длинная цепь атомов углерода, включающая
атом углерода карбоксильной группы.
• Пронумеруйте атомы углерода в главной
цепи, начиная с атома углерода
карбоксильной группы.
• Назовите соединение по алгоритму для
углеводородов.
• В конце названия допишите суффикс "-ов",
окончание "-ая" и слово "кислота".
12.
Карбоновые кислоты в нашей жизни• Молочная кислота (С3Н6О3). Она
содержится в квашеной капусте,
соленых огурцах, образуется при
созревании сыра.
• Муравьиная кислота НСООН. Она
содержится в соке крапивы, хвое,
фруктах, а также в небольших количествах в поте и моче.









 chemistry
chemistry








