Similar presentations:
Разработка экспертной системы прогноза результатов рассмотрения заявок о регистрации медицинских препаратов
1.
Факультет информационных технологий и анализабольших данных
Департамент анализа данных и машинного обучения
Разработка экспертной системы прогноза результатов
рассмотрения заявок о регистрации медицинских
препаратов Евразийской экономической комиссией
Выполнила студентка группы ЗМ-ПИ21-10
Радченко Виолетта Витальевна
Руководитель к.т.н., доцент
Петросов Давид Арегович
2.
Актуальность ВКРЦелевая аудитория
Потребность
Граждане государства и
представители бизнеса
Быстро и удобно получать
актуальную обратную связь
из достоверных источников
Уполномоченные органы
ЕЭК
Повышение качества и
скорости принятия
решений, оптимизировать
процессы в медицинской
сфере
3.
Цели и задачиЦели
Задачи
Увеличение
удовлетворенности
пользователей сервисом
Снижение нагрузки на ЕЭК
Предоставление удобного и
быстрого доступа к прогнозам
для лучшего
информирования заявителя
по подробностям работы по
регистрационному делу.
Применить различные
методы прогнозирования с
построением целого ряда
моделей
Выявить и обосновать выбор
лучшей прогнозной модели
Реализовать функционал
предиктивной аналитики в
личном кабинете
пользователя при заполнении
анкеты
4.
Объект исследованияОбъектом исследования является деятельность органов
Евразийского экономического союза и Евразийской
экономической комиссии в частности
Евразийский экономический союз – это международная
организация региональной экономической интеграции, в
которую входят: Республика Армения, Республика
Беларусь, Республика Казахстан, Кыргызская Республика
и Российская Федерация.
Целью создания ЕАЭС было обеспечение свободы
движения товаров, услуг, капитала и рабочей силы, а
также проведение скоординированной, согласованной
или единой политики в отраслях экономики.
5.
Предмет исследованияОП №34 «Формирование, ведение и использование единой
информационной базы данных мониторинга безопасности,
качества и эффективности медицинских изделий»,
в рамках которого государства следят за производимыми и
распространяемыми на территории Союза медицинскими
изделиями, обмениваются информацией об инцидентах и
принимают решения регистрации изделия для оборота на
территории ЕАЭС.
6.
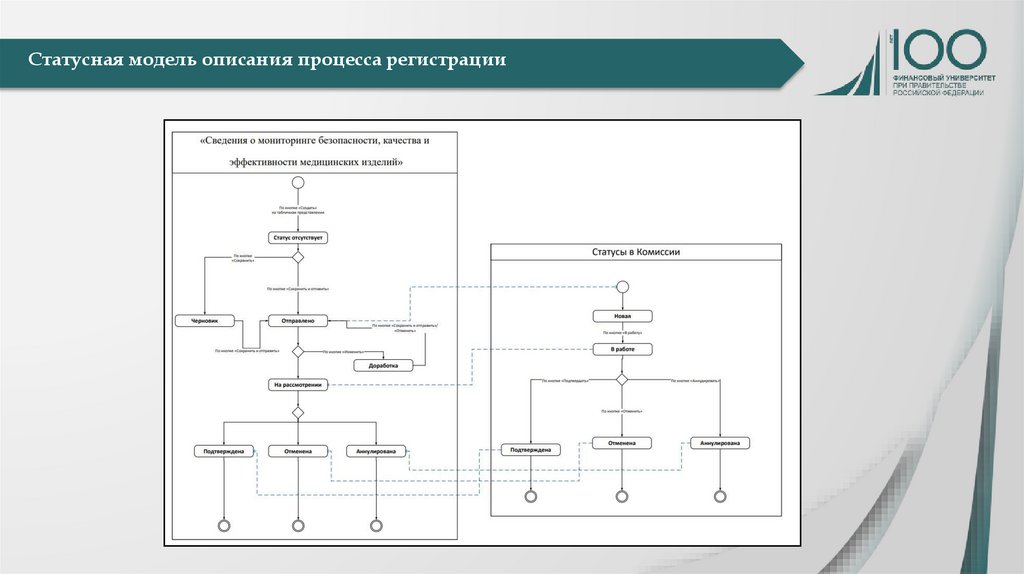
Статусная модель описания процесса регистрации7.
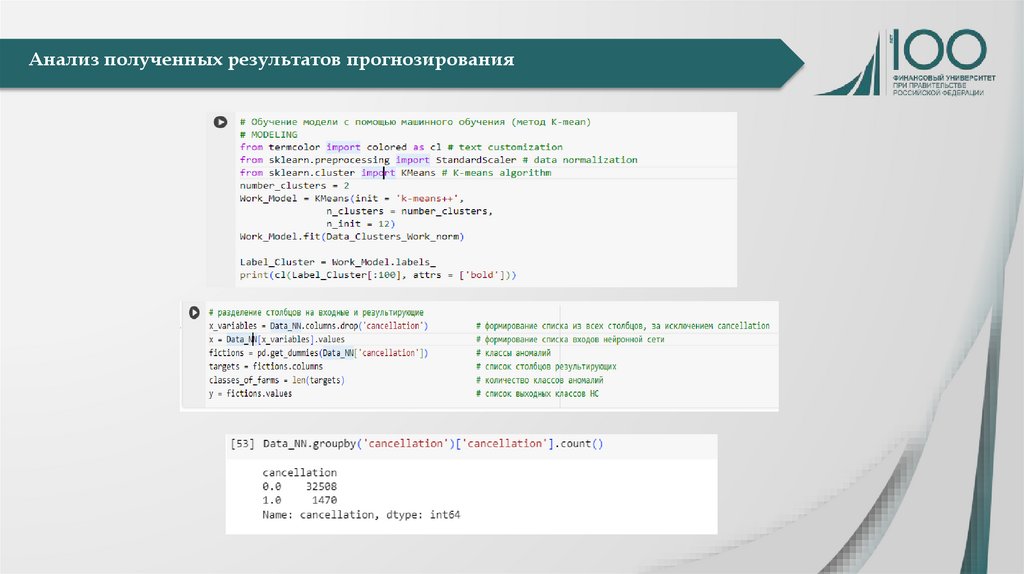
Формулирование результатовНаучные результаты
Практические результаты
Составление
оптимизированного
алгоритма
прогнозирования;
Выявление списка
параметров, по которым
наблюдается высокая
корреляция результата по
заявке;
Снижение нагрузки на
государственный орган
Предоставление
пользователям возможности
получения предварительной
информации по вероятности
отказа/одобрения по заявке и
форматов корректировки
бизнес-процессов для
повышения ее уровня;
8.
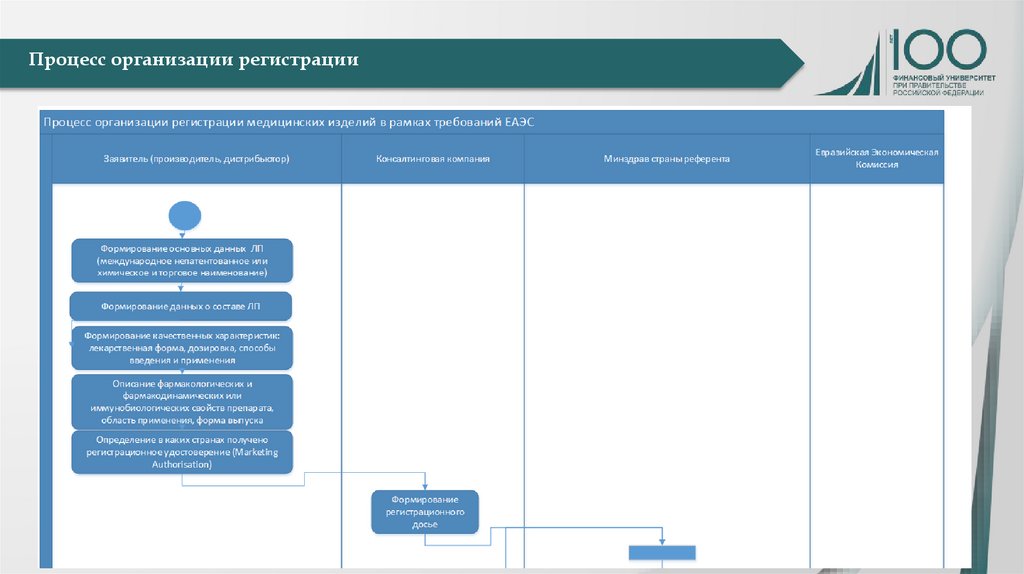
Процесс организации регистрации9.
Процесс организации регистрации10.
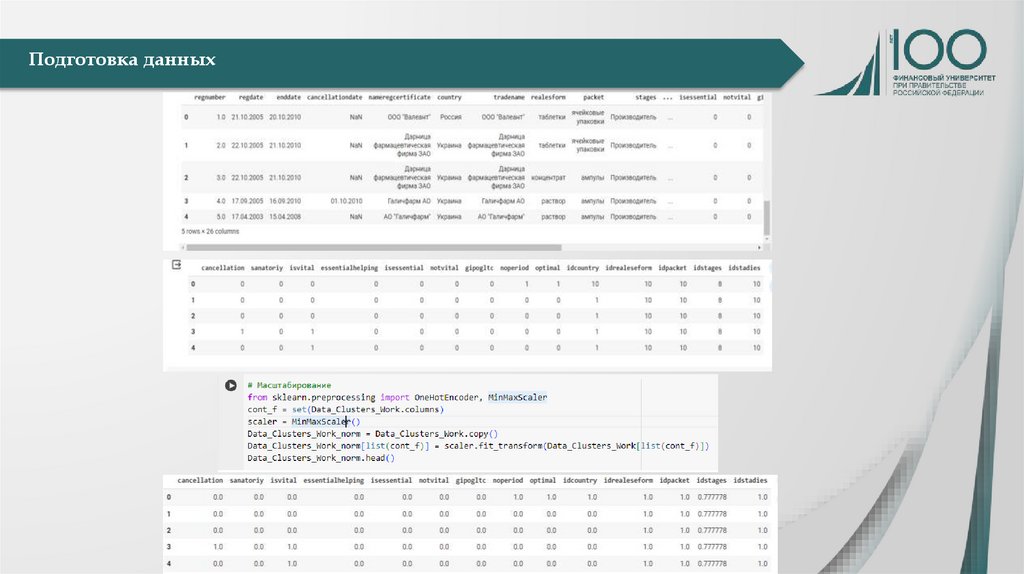
Обзор и подготовка данных«Правила регистрации и
экспертизы лекарственных средств
для медицинского применения»
Иные факторы
Использование этапа проверки
качества продукции в рамках
производственного процесса;
Фиксация в рамах компании или
групп компаний основных стадий
производственного цикла, а не
только фасовки и упаковки;
Внедрение производственных
мощностей на территории
Российской Федерации, а также
членов участников ЕАЭС:
Республики Беларусь, Республики
Армении, Кыргызской Республики.
Является ли препарат
жизненноважным;
Отсутствие аналогов для
регистрируемого препарата;
Использование препаратов в
учреждениях здравоохранения для
оказания скорой
специализированной медицинской
помощи;
Использование препаратов в
учреждениях здравоохранения для
предоставления санаторнокурортного лечения.
11.
Обзор и подготовка данныхДанные, подаваемые в рамках
регистрационного дела:
основные данные лекарственного
препарата (международное
непатентованное или химическое и
торговое наименование);
данные о составе и действующем веществе;
данные об используемой лекарственной
форме, дозировке, способе введения и
применения;
описание фармакологических и
фармакодинамических или
иммунобиологических свойств препарата,
область применения, форма выпуска;
наличие иных регистрационных
удостоверений (Marketing Authorisation).
данные по зарегистрированным
препаратам
данные по дате регистрации
лекарственного препарата;
данные по дате прекращения
регистрации лекарственного
препарата;
данные по дате
предоставления
аргументированного отказа;
данные по торговой марке,
которую представляет
препарат при ее наличии.
12.
Обзор и подготовка данныхПоказатели, напрямую характеризующие рассмотренные
лекарственные средства медицинского назначения
Наименование показателя в открытом
ресурсе
Регистрационный номер
Дата регистрации
Дата окончания регистрации
Дата отказа по регистрации или в
перерегистрации
Наименование имеющегося сертификата
Страна заявителя
Производитель или название компании
дистрибьютора
Международное наименование
Описание препарата в виде данных о
лекарственной форме, используемой
упаковке
Данные по производственным процессам,
включенным в стадии работы с
лекарственным препаратом
Общий код регистрации
Описание показателя
Примечание о расчете показателя
Номер регистрации в открытой базе
Переменная показателя в модели
Устанавливается на основании принципа
автоинкремента
Дата начала регистрационного периода
Формируется на основании регистрационных
документов
Дата окончания регистрационного
Формируется на основании регистрационных
периода
документов
Дата запрета реализации препарата
Формируется на основании регистрационных
документов
Данные сертификационного документа
Формируется на основании сертификационных
документов
Страна производителя или дистрибьютора Определяется на основании регистрационных
документов)
Производитель или название компании
Определяется на основании регистрационных
дистрибьютора
документов
Международное наименование
Определяется на основании регистрационных
лекарственного средства
документов (при наличии)
Общее описание препарата, включая
Определяется на основании регистрационных
различные данные о дозировке, форме
документов
выпуска, упаковке
Производственные стадии
Определяется на основании регистрационных
документов по производителю
regnumber
Данные сертификационного документа
barcodes
Нормативный документ
Данные нормативного документа
Фармацевтическая группа
Данные по фармацевтической группе
Формируется на основании сертификационных
документов
Определяется на основании регистрационных
документов (при наличии)
Определяется на основании регистрационных
документов (при наличии)
regdate
enddate
cancellationdate
nameregcertificate
country
tradename
internationalname
formrelease
stages
normativedocumentation
pharmacotherapeuticgroup
13.
Обзор и подготовка данныхПоказатели, опосредовано влияющие на процесс регистрации
лекарственного средства
Описание показателя
Примечание
Включение лекарственного средства в список
жизненно важных препаратов
Включение лекарственного средства в список
используемых для регулирования уровня инсулина
Использование лекарственного средства при
оказании скорой специализированной медицинской
помощи
Переменная показателя в модели
(по данным списка жизненно важных
препаратов)
(по данным инсулиновых препаратов и
аналогов)
(по данным препаратов, используемых
при оказании скорой
специализированной медицинской
помощи)
Применение лекарственного средства для санаторно- (по данным препаратов, используемых
курортного лечения в Российской Федерации
при санаторно-курортном лечении)
isvital
Список лекарственных средств дополнительного
назначения
Отсутствие аналогов лекарственного средства на
рынке ЕАЭС
Средства, зарегистрированные в странах ЕАЭС и там
производимые
Средства, производимые в дружественных странах,
не входящих в ЕАЭС
notvital
(по данным средств дополнительного
назначения)
gipogltc
essentialhelping
sanatoriy
isessential
Согласно требованиям регистрации
лекарственных средств в ЕАЭС
Согласно списку недружественных стран
noperiod
optimal
14.
Обзор и подготовка данныхРесурсы, используемые для сбора данных
Единый реестр зарегистрированных лекарственных средств Евразийского экономического союза
(https://portal.eaeunion.org/sites/commonprocesses/ru-ru/Pages/DrugRegistrationDetails.aspx )[22].
Единая база данных лекарственных средств, не соответствующих требованиям по качеству, а также
фальсифицированных
и
(или)
контрафактных
лекарственных
средств
(https://portal.eaeunion.org/sites/odata/_layouts/15/Registry/PMM03/TableView.aspx) [23].
Единая база данных по приостановленным, отозванным и запрещенным к медицинскому
применению
лекарственным
средствам
(https://portal.eaeunion.org/sites/odata/_layouts/15/Registry/PMM03/TableView.aspx) [24].
Государственный реестр лекарственных средств (https://minzdrav.gov.ru/opendata/7707778246grls/visual) [25].
Приказ Министерства здравоохранения РФ от 28 октября 2020 г. № 1165н «Об утверждении
требований к комплектации лекарственными препаратами и медицинскими изделиями укладок и
наборов
для
оказания
скорой
медицинской
помощи»
(https://www.garant.ru/products/ipo/prime/doc/74859168/#0) [26].
Лекарства, дженерики которых не производят в России ( https://journal.tinkoff.ru/short/rus-generics/)
(полный список на данный момент только составляется ) [27, 28].
Жизненно необходимые и важнейшие лекарственные препараты [Электронный ресурс]: URL:
https://mosgorzdrav.ru/ru-RU/citizens/health/drugs.html [29].



















 medicine
medicine








