Similar presentations:
Фармацевтическая разработка лекарственных препаратов и разработка производственных процессов фармацевтических субстанций
1.
Фармацевтическая разработка лекарственныхпрепаратов и разработка производственных
процессов активных фармацевтических
субстанций в рамках ЕАЭС
Аниконова Мария Андреевна
ведущий эксперт Управления № 4 по качеству лекарственных средств
Центра экспертизы и контроля ГЛС
26 июня 2024
Федеральное государственное бюджетное учреждение
«Научный центр экспертизы средств медицинского применения»
Министерства здравоохранения Российской Федерации
2.
Нормативно-правовая базаРегистрация лекарственного препарата
Требование
предоставления
сведений о
фармацевтической
разработке
Решение Совета Евразийской
экономической комиссии
от 03.11.2016 N 78
"О Правилах регистрации и
экспертизы лекарственных средств
для медицинского применения"
3.
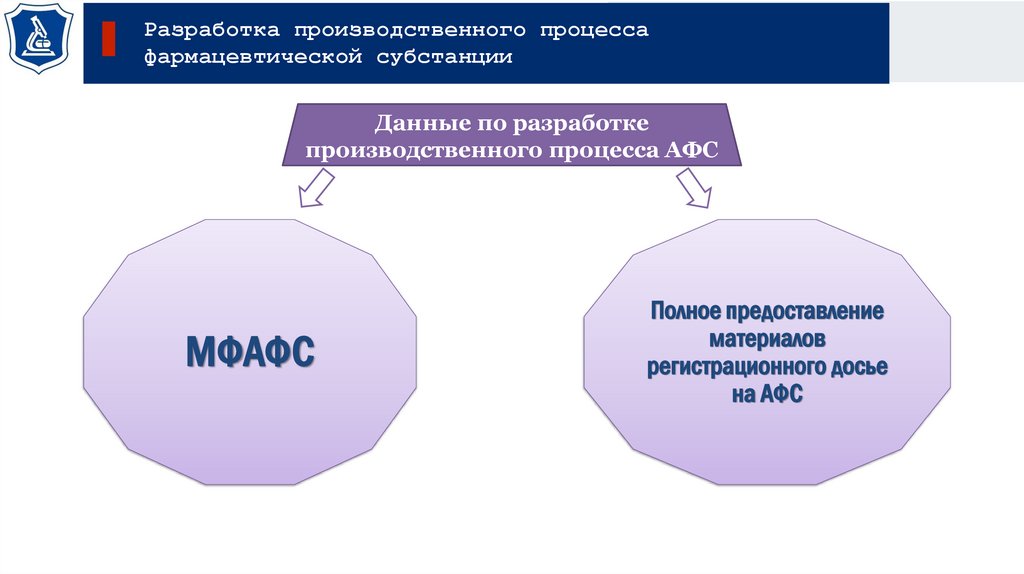
Разработка производственного процессафармацевтической субстанции
Данные по разработке
производственного процесса АФС
МФАФС
Полное предоставление
материалов
регистрационного досье
на АФС
4.
Разработка производственного процессафармацевтической субстанции
Рекомендация Коллегии
Евразийской экономической
комиссии от 22.12.2020 N
26
«О Руководстве по
разработке и производству
активных фармацевтических
субстанций»
5.
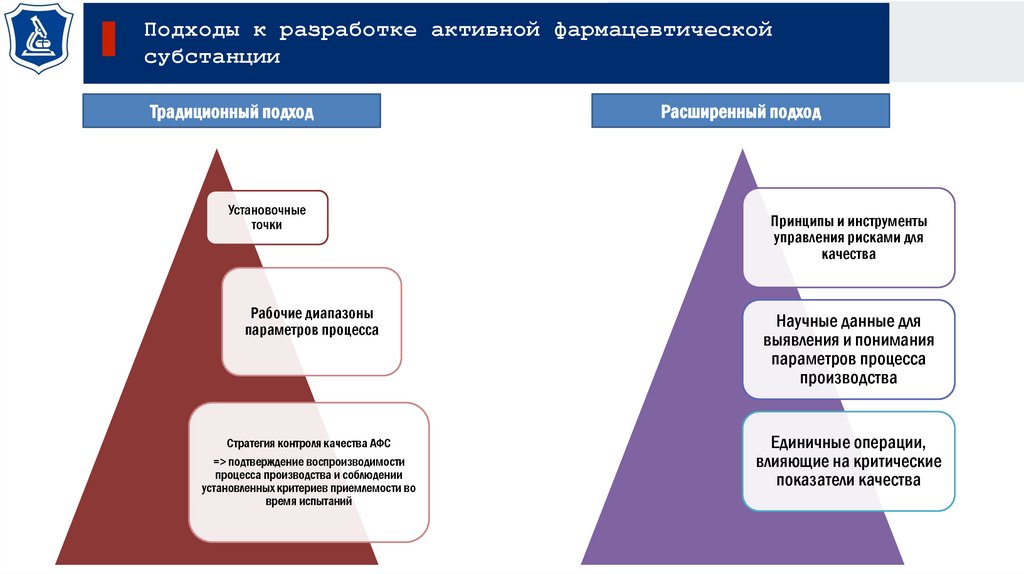
Подходы к разработке активной фармацевтическойсубстанции
Традиционный подход
Установочные
точки
Расширенный подход
Принципы и инструменты
управления рисками для
качества
Рабочие диапазоны
параметров процесса
Научные данные для
выявления и понимания
параметров процесса
производства
Стратегия контроля качества АФС
=> подтверждение воспроизводимости
процесса производства и соблюдении
установленных критериев приемлемости во
время испытаний
Единичные операции,
влияющие на критические
показатели качества
6.
Разработка производственного процессафармацевтической субстанции
Производитель определяет какие из остаточных органических растворителей
и элементных примесей, используемых при производстве, он будет
контролировать
Целесообразность выбора должна быть обоснована!
Решение Коллегии Евразийской
экономической комиссии
от 04.10.2022 N 138
«Об утверждении Требований к проведению
исследований (испытаний) лекарственных
средств в части оценки и контроля
содержания примесей»
7.
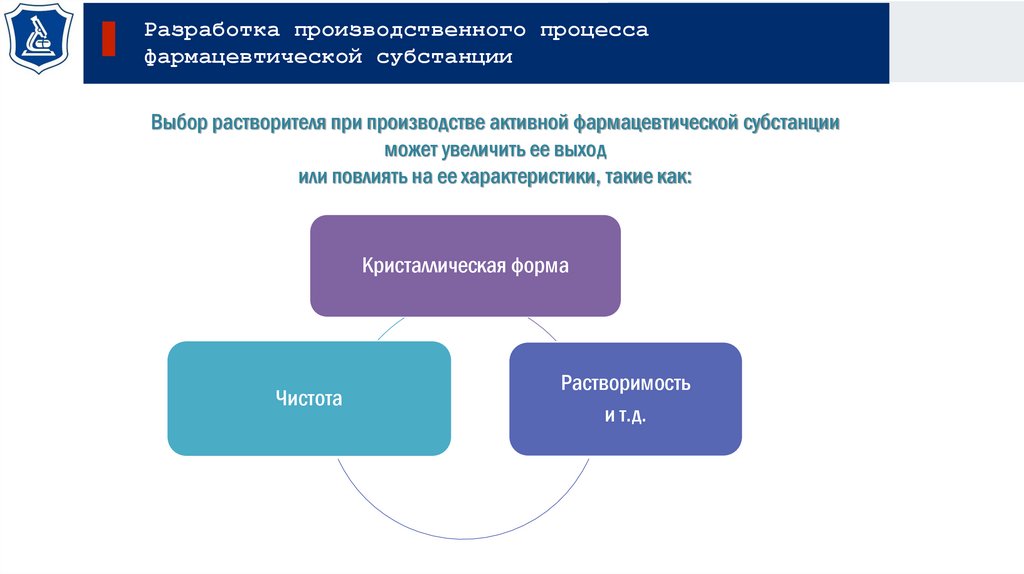
Разработка производственного процессафармацевтической субстанции
Выбор растворителя при производстве активной фармацевтической субстанции
может увеличить ее выход
или повлиять на ее характеристики, такие как:
Кристаллическая форма
Чистота
Растворимость
и т.д.
8.
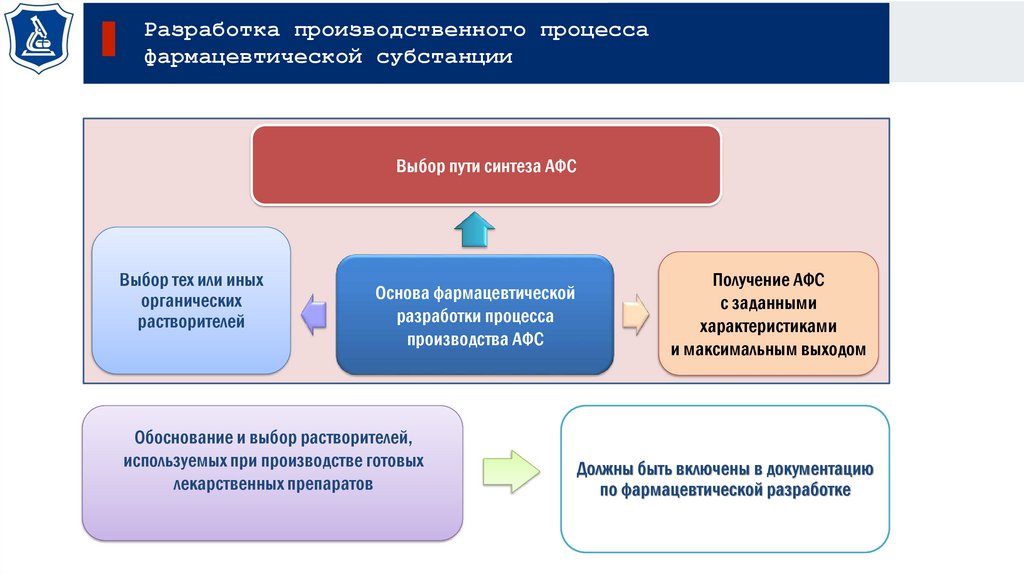
Разработка производственного процессафармацевтической субстанции
Выбор пути синтеза АФС
Выбор тех или иных
органических
растворителей
Основа фармацевтической
разработки процесса
производства АФС
Обоснование и выбор растворителей,
используемых при производстве готовых
лекарственных препаратов
Получение АФС
с заданными
характеристиками
и максимальным выходом
Должны быть включены в документацию
по фармацевтической разработке
9.
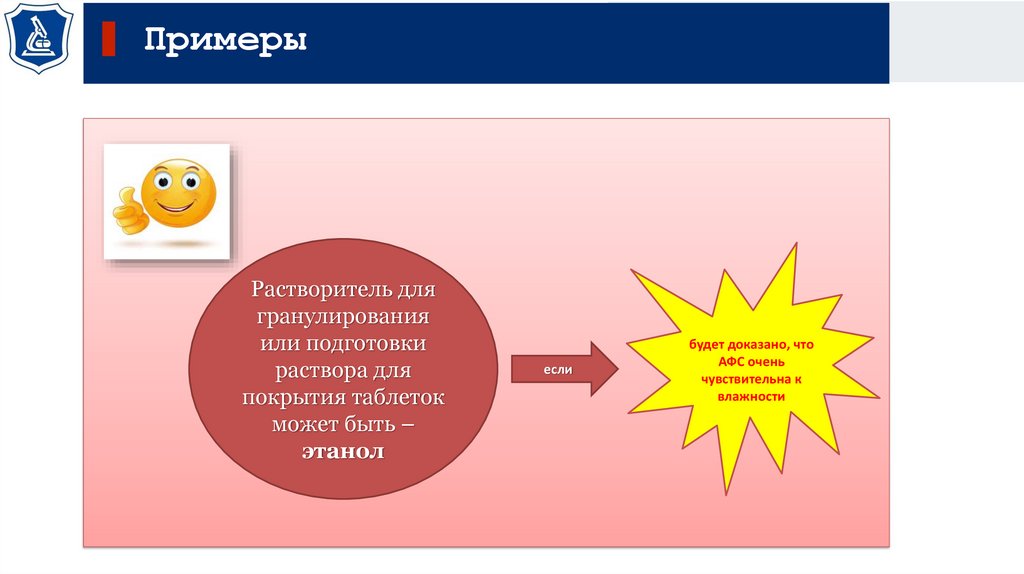
ПримерыРастворитель для
гранулирования
или подготовки
раствора для
покрытия таблеток
может быть –
этанол
если
будет доказано, что
АФС очень
чувствительна к
влажности
10.
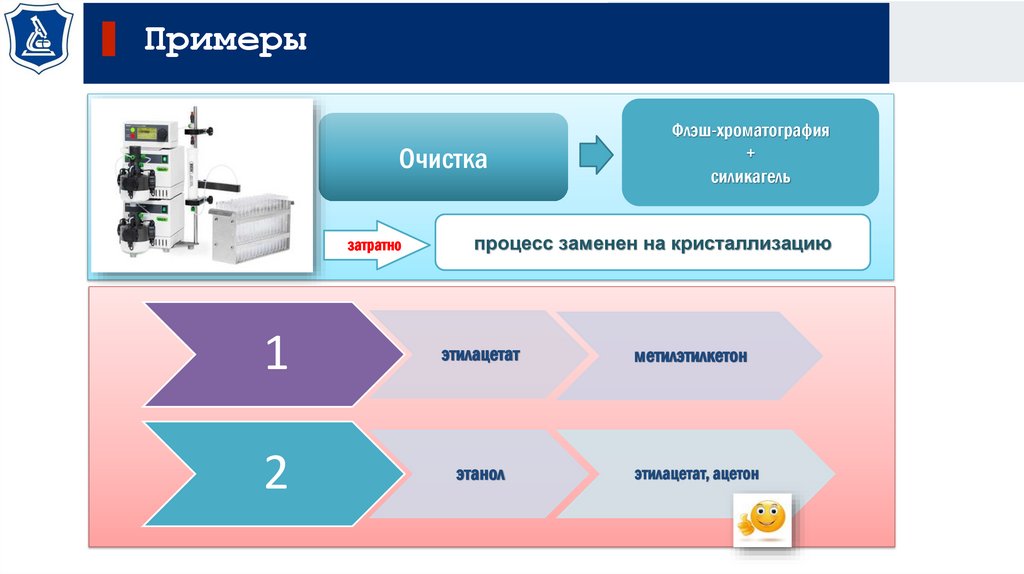
ПримерыОчистка
затратно
Флэш-хроматография
+
силикагель
процесс заменен на кристаллизацию
1
этилацетат
метилэтилкетон
2
этанол
этилацетат, ацетон
11.
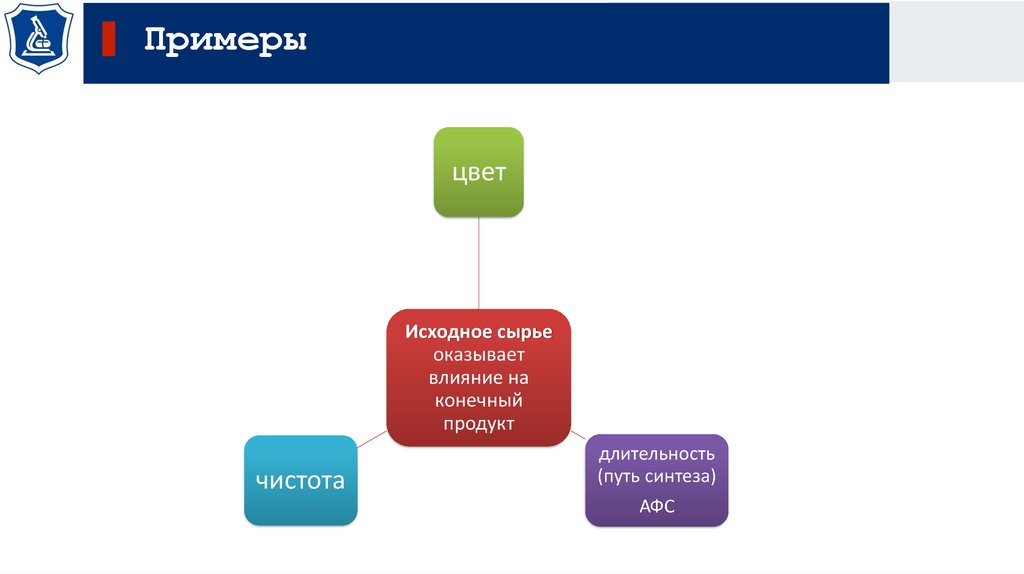
Примерыцвет
Исходное сырье
оказывает
влияние на
конечный
продукт
чистота
длительность
(путь синтеза)
АФС
12.
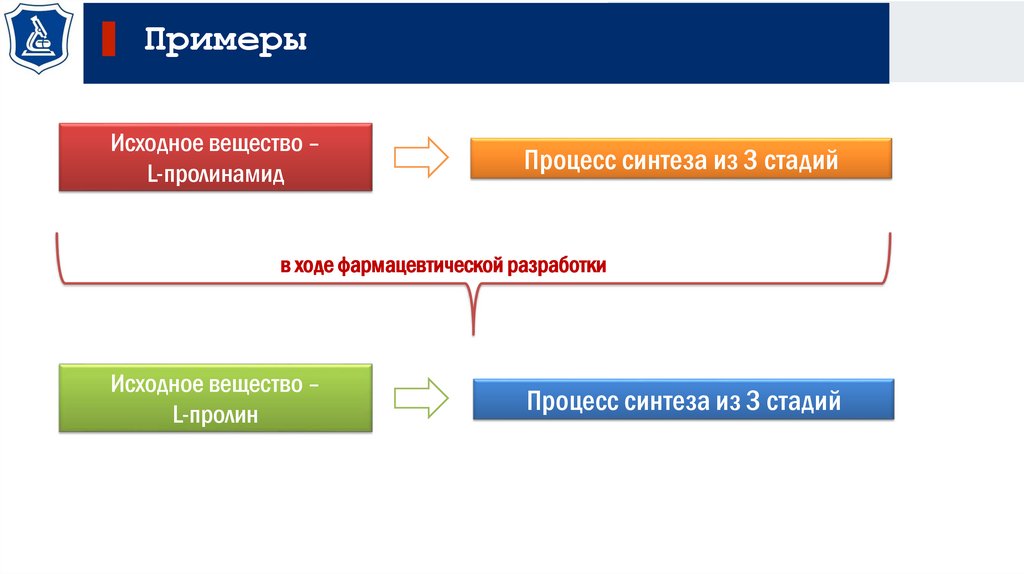
ПримерыИсходное вещество –
L-пролинамид
Процесс синтеза из 3 стадий
в ходе фармацевтической разработки
Исходное вещество –
L-пролин
Процесс синтеза из 3 стадий
13.
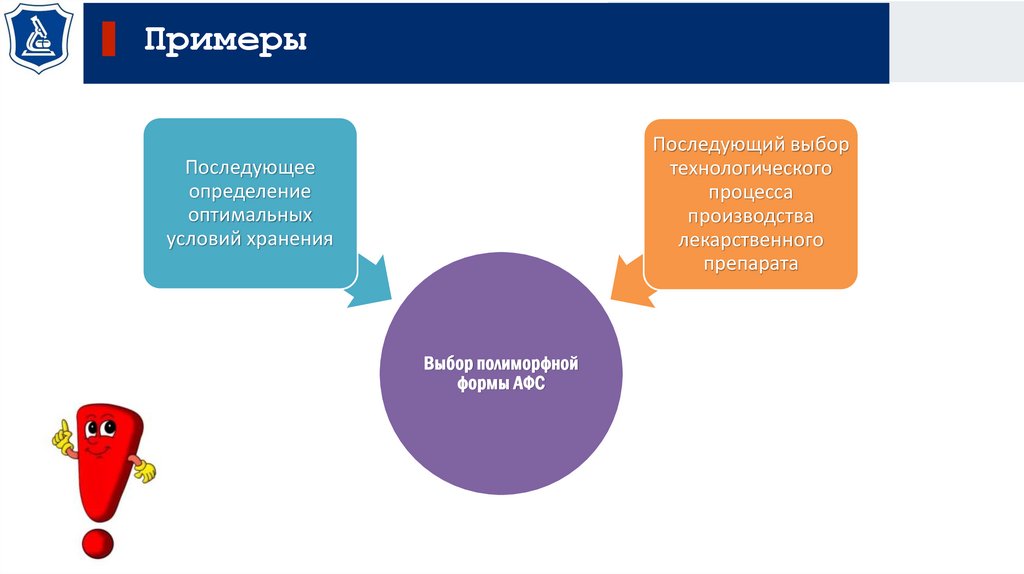
ПримерыПоследующий выбор
технологического
процесса
производства
лекарственного
препарата
Последующее
определение
оптимальных
условий хранения
Выбор полиморфной
формы АФС
14.
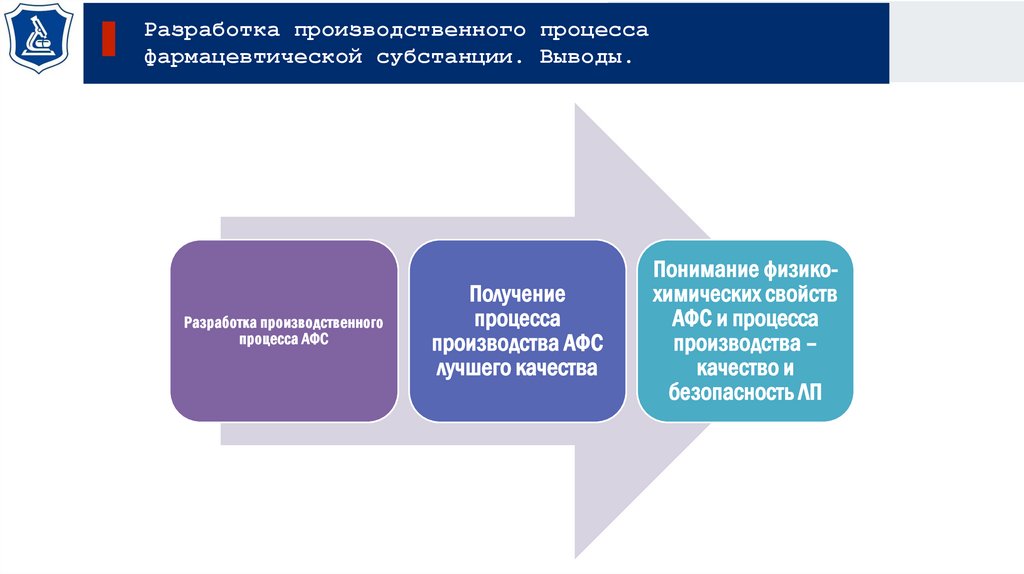
Разработка производственного процессафармацевтической субстанции. Выводы.
Разработка производственного
процесса АФС
Получение
процесса
производства АФС
лучшего качества
Понимание физикохимических свойств
АФС и процесса
производства –
качество и
безопасность ЛП
15.
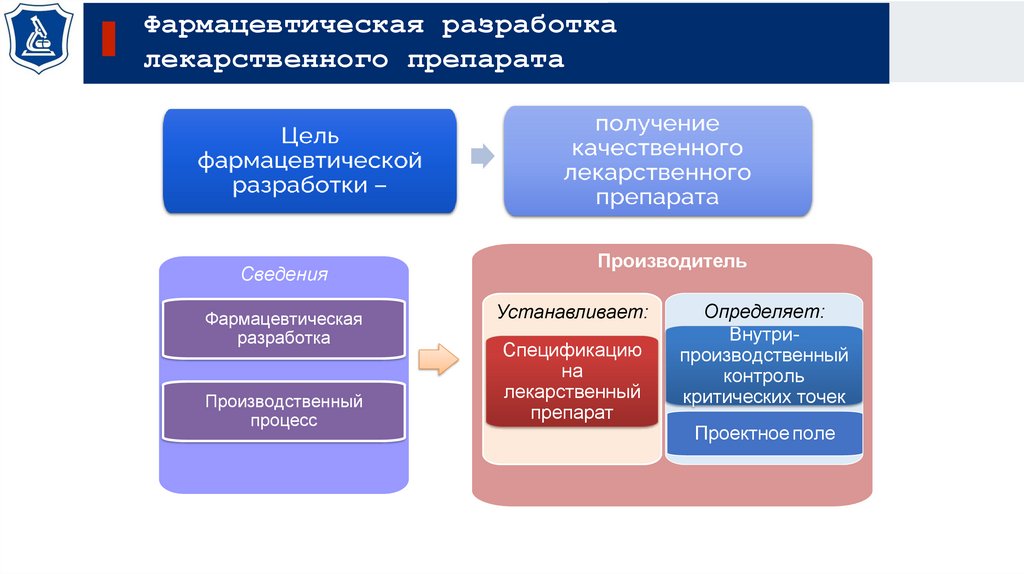
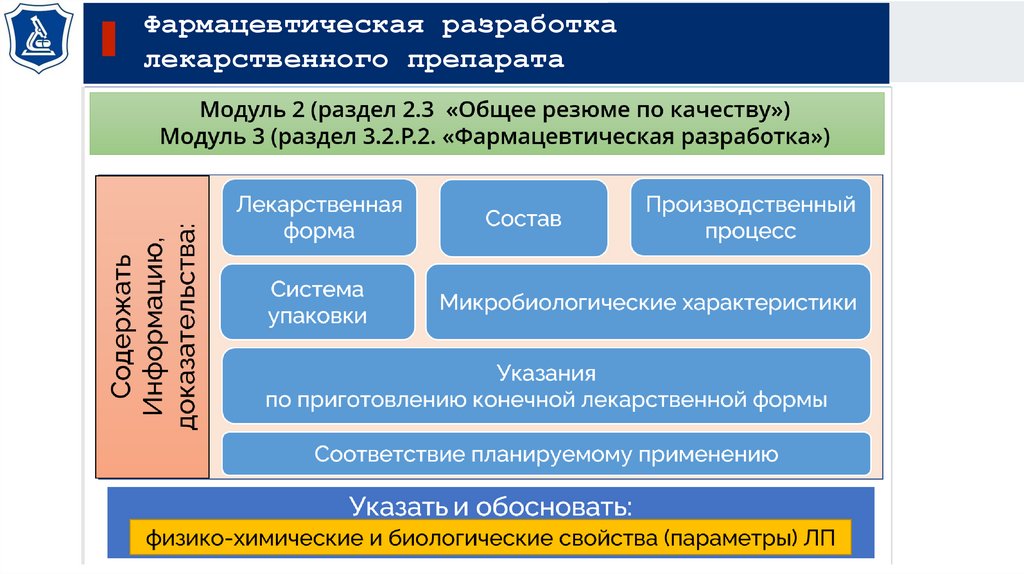
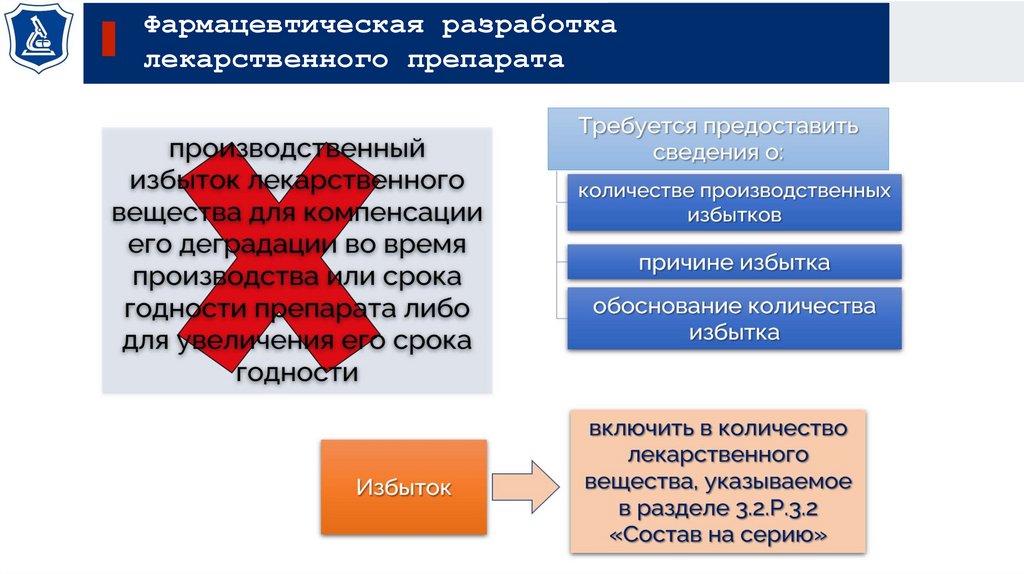
Фармацевтическая разработкалекарственного препарата
Сведения
Фармацевтическая
разработка
Производственный
процесс
Производитель
Устанавливает:
Спецификацию
на
лекарственный
препарат
Определяет:
Внутрипроизводственный
контроль
критических точек
Проектное поле
16.
Фармацевтическая разработкалекарственного препарата
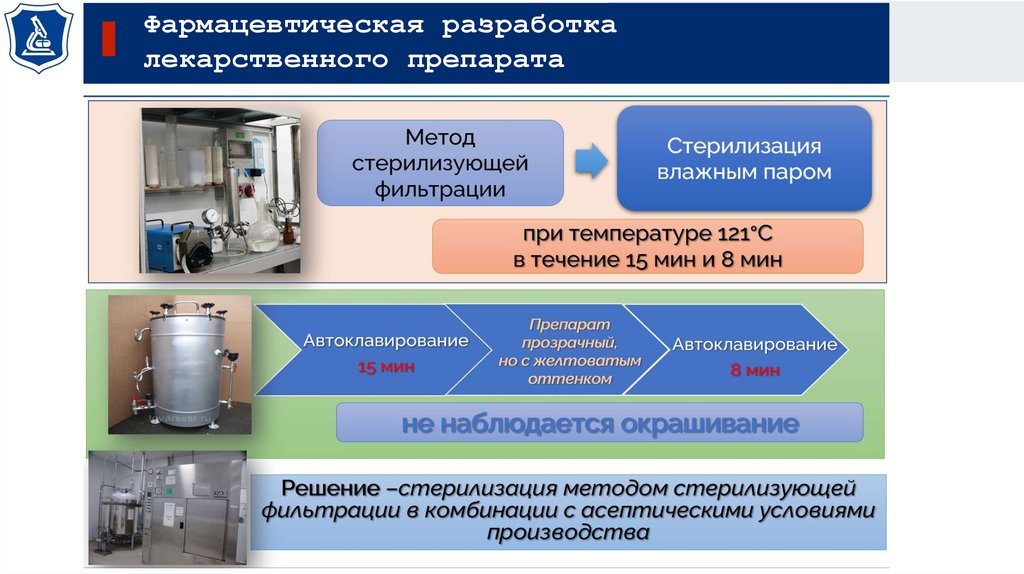
17.
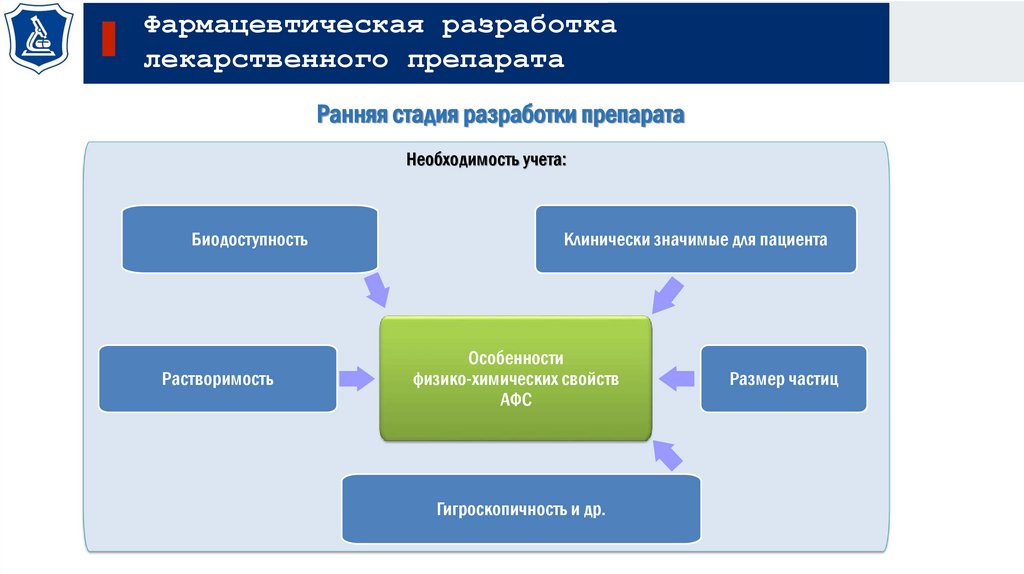
Фармацевтическая разработкалекарственного препарата
Ранняя стадия разработки препарата
Необходимость учета:
Биодоступность
Растворимость
Клинически значимые для пациента
Особенности
физико-химических свойств
АФС
Гигроскопичность и др.
Размер частиц
18.
Фармацевтическая разработкалекарственного препарата
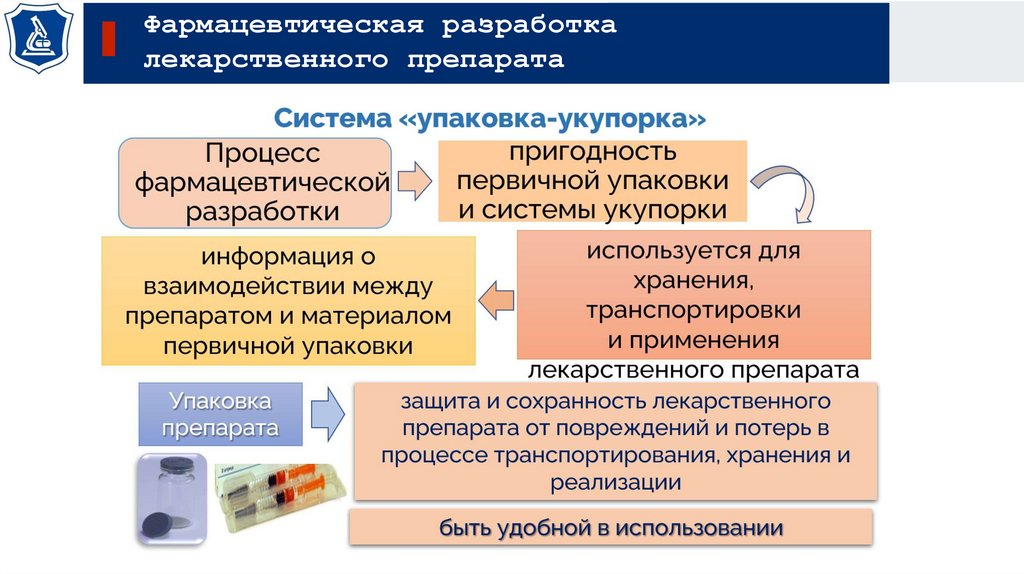
19.
Фармацевтическая разработкалекарственного препарата
20.
Фармацевтическая разработкалекарственного препарата
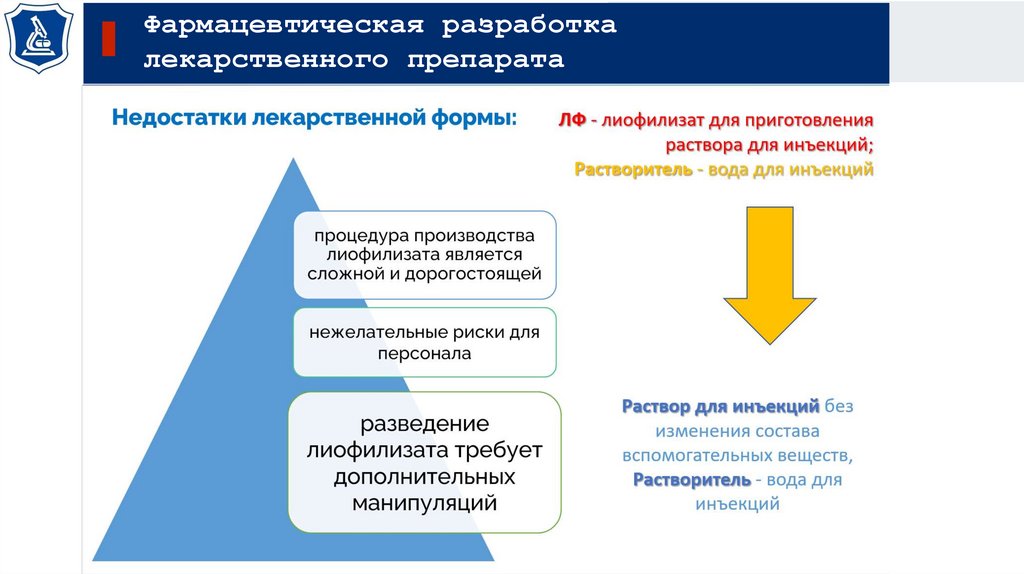
Суспензии для приема внутрь и порошкообразные
лекарственные препараты, подлежащие ресуспендированию
Испытания:
Растворение
нерастворимые
фармацевтические
субстанции
21.
Фармацевтическая разработкалекарственного препарата
Таблетки с риской
Риска предназначена для
разделения таблетки на
равные дозы
для обеспечения точности получения пациентом
назначенной дозы – оценивается
эффективность риски/рисок по однородности
массы разделенных частей
22.
Фармацевтическая разработкалекарственного препарата
Таблетки с риской
Риска не предназначена для
разделения таблетки на
равные дозы
для обеспечения точности получения пациентом
назначенной дозы –
обоснование необходимости наличия риски
23.
Фармацевтическая разработкалекарственного препарата
24.
Фармацевтическая разработкалекарственного препарата
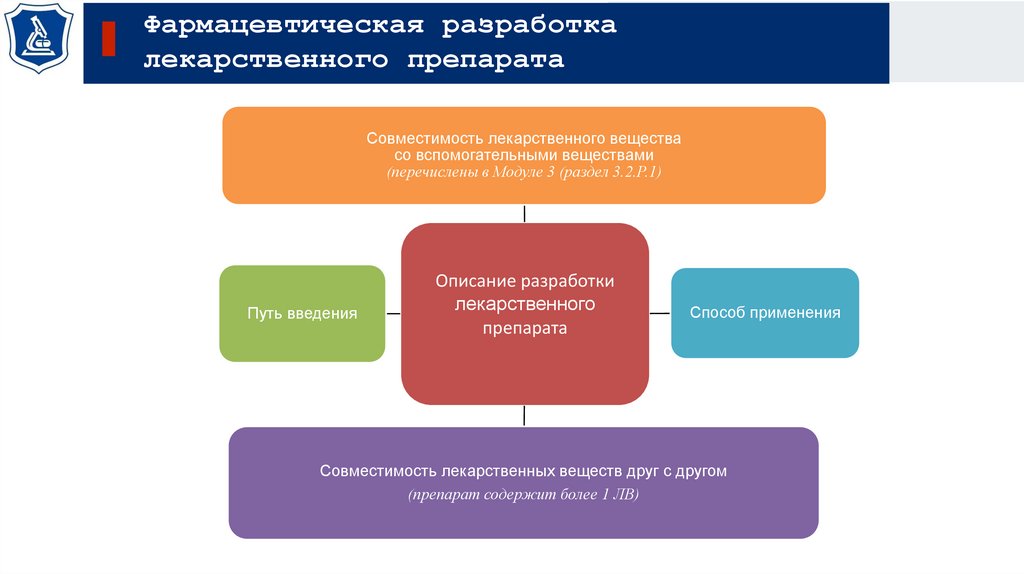
Совместимость лекарственного вещества
со вспомогательными веществами
(перечислены в Модуле 3 (раздел 3.2.P.1)
Путь введения
Описание разработки
лекарственного
препарата
Способ применения
Совместимость лекарственных веществ друг с другом
(препарат содержит более 1 ЛВ)
25.
Фармацевтическая разработкалекарственного препарата
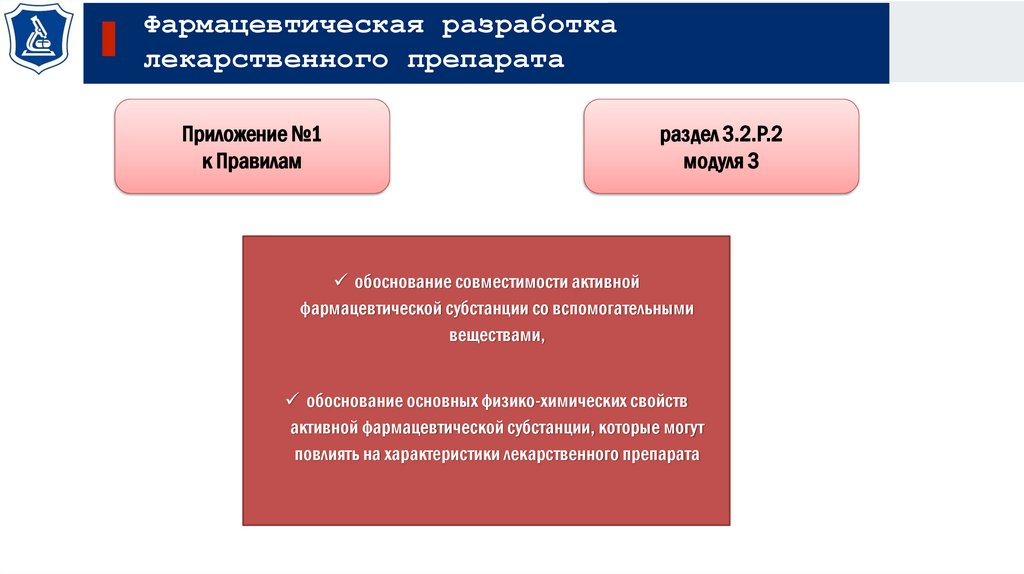
Приложение №1
к Правилам
раздел 3.2.Р.2
модуля 3
обоснование совместимости активной
фармацевтической субстанции со вспомогательными
веществами,
обоснование основных физико-химических свойств
активной фармацевтической субстанции, которые могут
повлиять на характеристики лекарственного препарата
26.
Фармацевтическая разработкалекарственного препарата
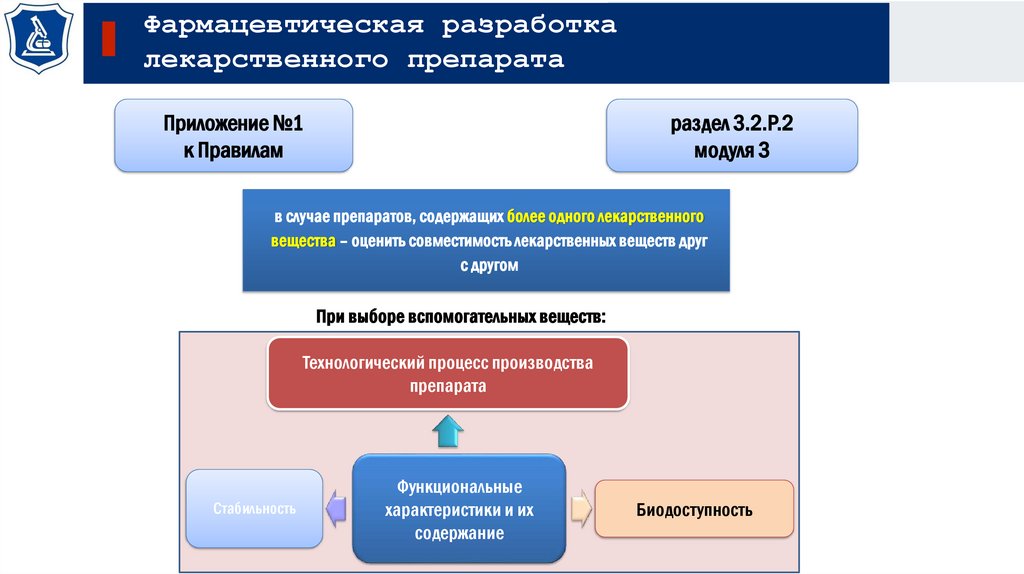
Приложение №1
к Правилам
раздел 3.2.Р.2
модуля 3
в случае препаратов, содержащих более одного лекарственного
вещества – оценить совместимость лекарственных веществ друг
с другом
При выборе вспомогательных веществ:
Технологический процесс производства
препарата
Стабильность
Функциональные
характеристики и их
содержание
Биодоступность
27.
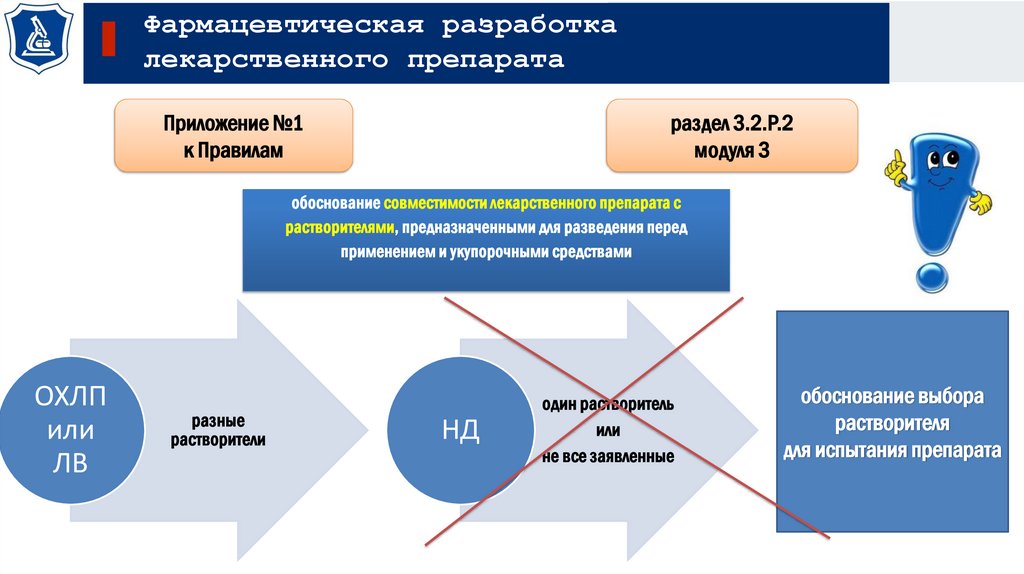
Фармацевтическая разработкалекарственного препарата
Приложение №1
к Правилам
раздел 3.2.Р.2
модуля 3
обоснование совместимости лекарственного препарата с
растворителями, предназначенными для разведения перед
применением и укупорочными средствами
ОХЛП
или
ЛВ
разные
растворители
НД
один растворитель
или
не все заявленные
обоснование выбора
растворителя
для испытания препарата
28.
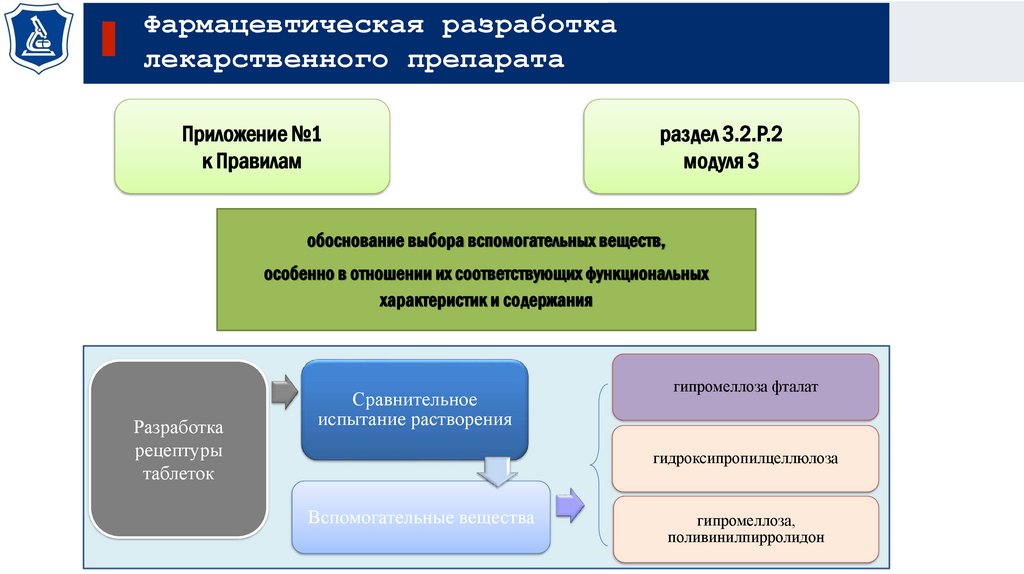
Фармацевтическая разработкалекарственного препарата
Приложение №1
к Правилам
раздел 3.2.Р.2
модуля 3
обоснование выбора вспомогательных веществ,
особенно в отношении их соответствующих функциональных
характеристик и содержания
Разработка
рецептуры
таблеток
Сравнительное
испытание растворения
гипромеллоза фталат
гидроксипропилцеллюлоза
Вспомогательные вещества
гипромеллоза,
поливинилпирролидон
29.
Фармацевтическая разработкалекарственного препарата
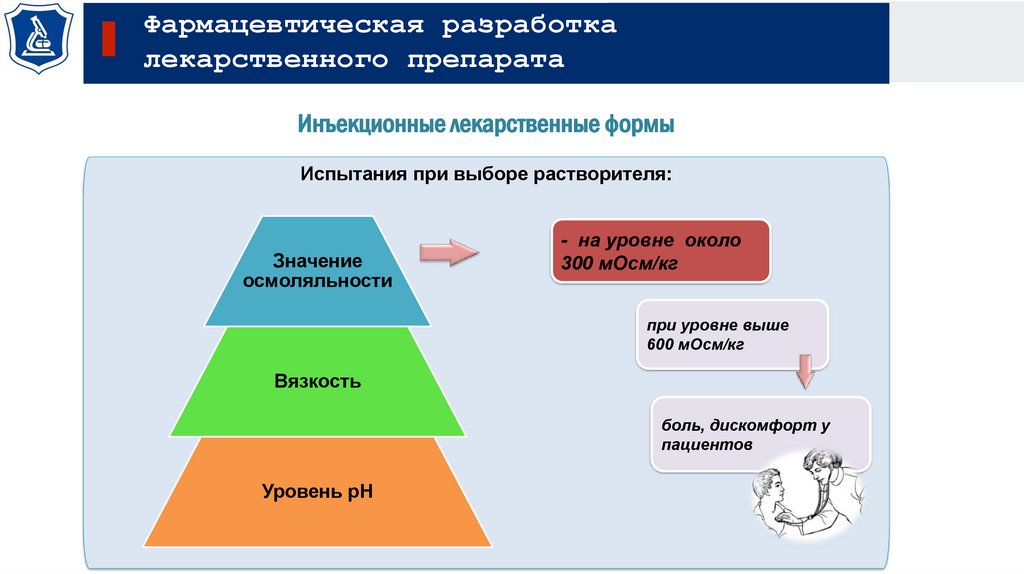
Инъекционные лекарственные формы
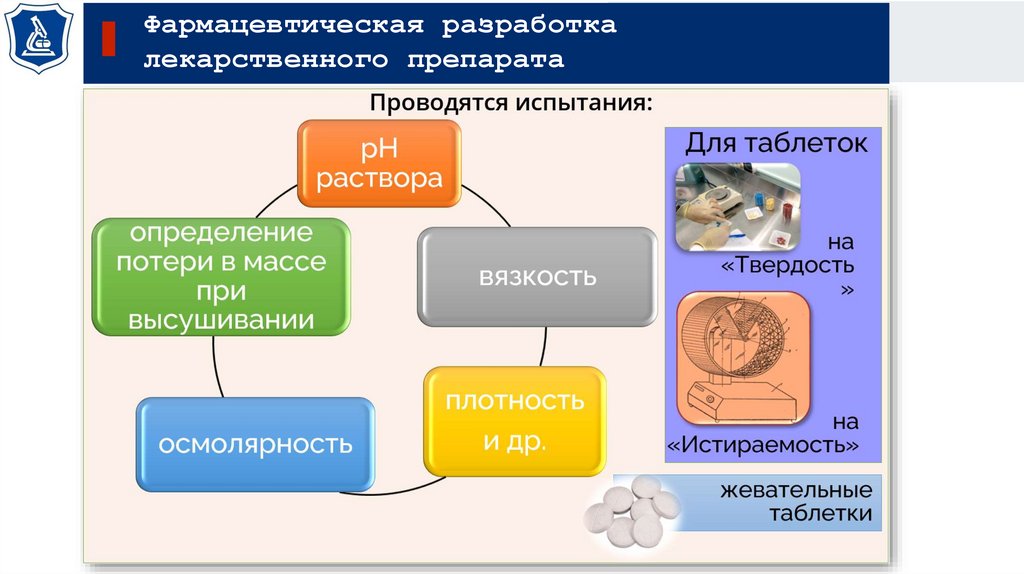
Испытания при выборе растворителя:
Значение
осмоляльности
- на уровне около
300 мОсм/кг
при уровне выше
600 мОсм/кг
Вязкость
боль, дискомфорт у
пациентов
Уровень рН
30.
Фармацевтическая разработкалекарственного препарата
Лекарственные формы, предназначенные для подкожного
введения
Не должны иметь слишком высокую кислотность
или щелочность
(для предотвращения риска развития выраженного местного раздражения)
Используют натрия гидроксид, фосфорную и хлористоводородную кислоты и др.
(для корректировки pH раствора)
Какое значение рН в спецификации обеспечивает минимальную деградацию водного раствора
препарата в течение предполагаемого срока годности?
Приготовление лабораторных серий препарата с разными значениями рН и помещение на
хранение в заявленных условиях хранения и при условиях ускоренной деградации
Проведение контроля на содержание родственных примесей
31.
Фармацевтическая разработкалекарственного препарата
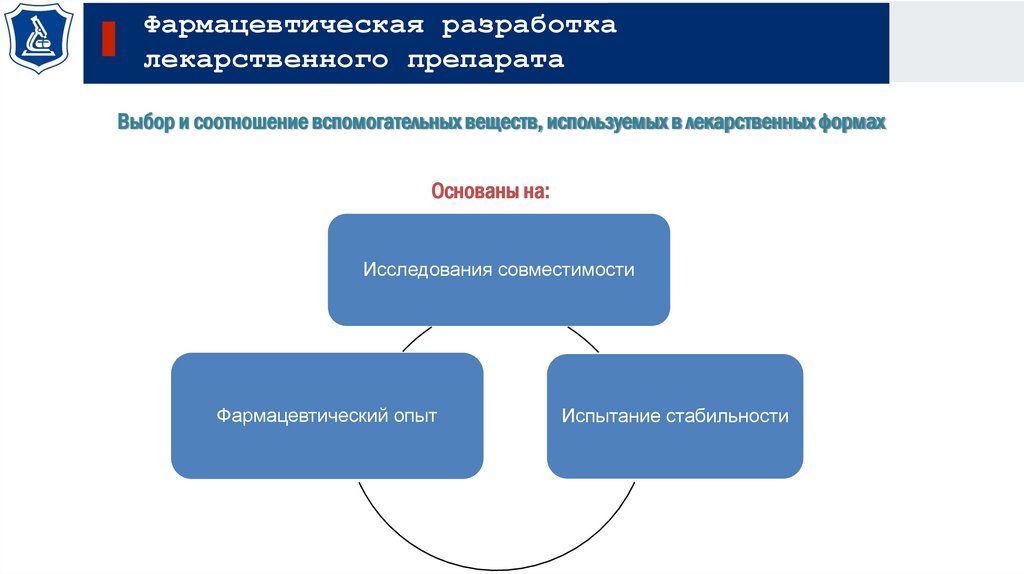
Выбор и соотношение вспомогательных веществ, используемых в лекарственных формах
Основаны на:
Исследования совместимости
Фармацевтический опыт
Испытание стабильности
32.
Фармацевтическая разработкалекарственного препарата
33.
Фармацевтическая разработкалекарственного препарата
34.
раздел 3.2.Р.2.3модуля 3
Препарат Х представляет собой твердую дозированную лекарственную форму.
Технология данного препарата разработана с учетом свойств компонентов, входящих в ее состав.
Технология производства таблеток включает следующие стадии:
• просев и смешение АФС;
• грануляция;
• сушка гранулята;
• просев высушенного гранулята;
• опудривание гранулята;
• таблетирование.
Результаты испытаний демонстрируют, что выбранная технология позволяет производить лекарственный
препарат с удовлетворительными физико-химическими свойствами
35.
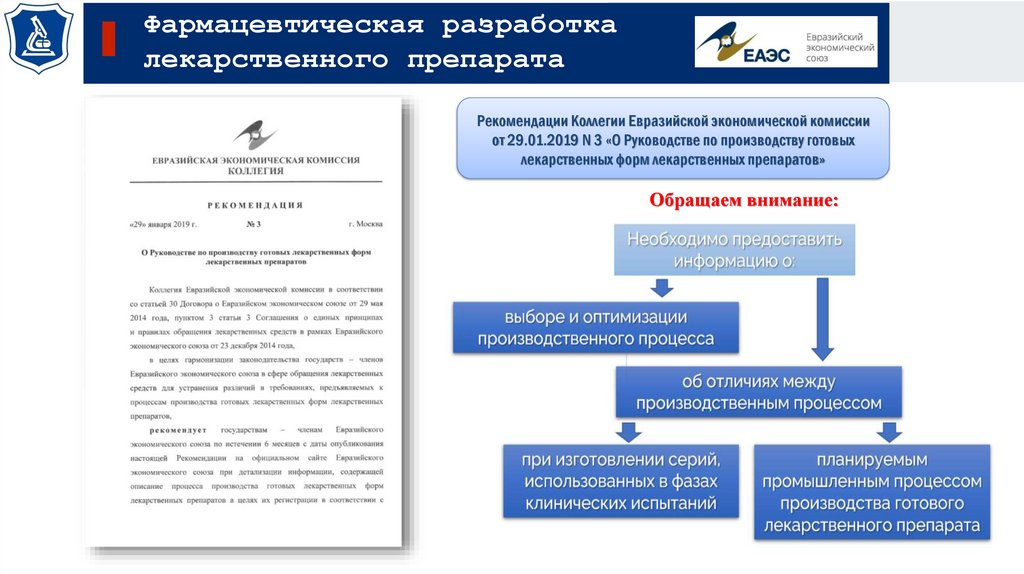
Фармацевтическая разработкалекарственного препарата
Рекомендации Коллегии Евразийской экономической комиссии
от 29.01.2019 N 3 «О Руководстве по производству готовых
лекарственных форм лекарственных препаратов»
Обращаем внимание:
36.
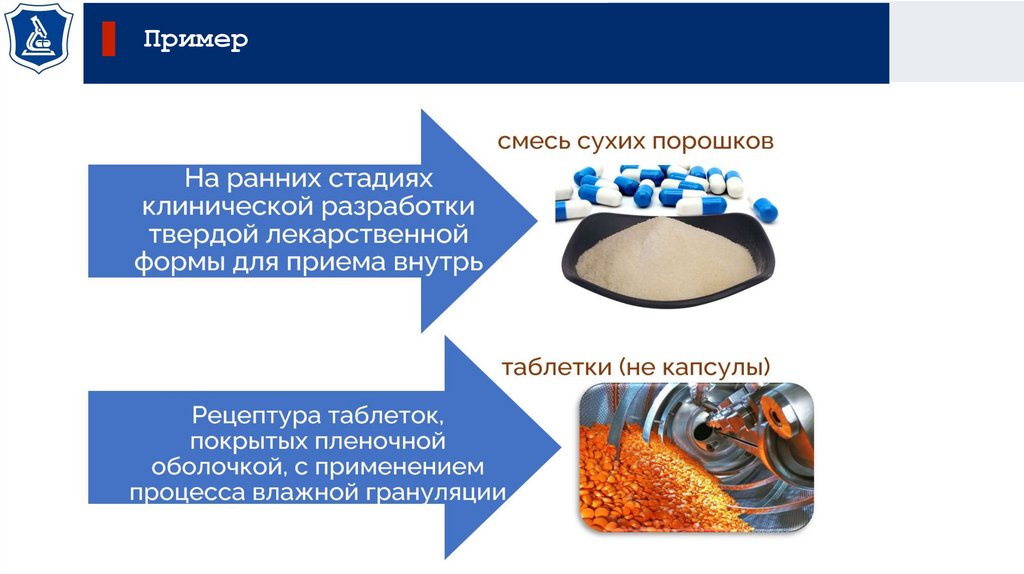
Пример37.
Фармацевтическая разработкалекарственного препарата
38.
Фармацевтическая разработкалекарственного препарата
39.
Фармацевтическая разработкалекарственного препарата
40.
Фармацевтическая разработкалекарственного препарата
41.
ЗаключениеВне зависимости от выбранного вами лекарственного препарата
(оригинальный или воспроизведенный) фармацевтическая
разработка должна быть полной и обоснованной,
включать критичные показатели качества (физические,
химические, биологические или микробиологические
свойства),
которые должны находиться в соответствующем пределе,
диапазоне или
иметь соответствующее распределение,
чтобы обеспечить желаемое качество препарата
42.
БлагодарюЗа внимание!












 medicine
medicine








