Similar presentations:
Промышленные системы непрерывного роста культивирования клеток
1. ПРОМЫШЛЕННЫЕ СИСТЕМЫ НЕПРЕРЫВНОГО РОСТА КУЛЬТИВИРОВАНИЯ КЛЕТОК
Выполнила: маг.2292 М Г.П. Плотникова2.
НЕПРЕРЫВНОЕ КУЛЬТИВИРОВАНИЕБОЛЕЕ ПЕРСПЕКТИВНО
Сущность:
-- в ферментаторе поддерживаются
постоянные условия среды,
-- микроорганизмы остаются в определенном
физиологическом состоянии;
-- подается свежая питательная среда и
удаляется избыток среды с продуктами
метаболизма,
-- поддерживается фаза экспоненциального
роста.
3.
4.
Если для культивирования продуцентаиспользуется один ферментатор - гомогеннонепрерывный процесс.
Если используется батарея ферментаторов это гетеро-непрерывный процесс, так как в
каждом ферментаторе, соединенном в
батарею, поддерживаются постоянные
условия.
5.
При непрерывномкультивировании микроорганизмов
отсутствует смена фаз развития культуры.
Скорость потока питательной среды и отвода
культуральной
жидкости
из
системы
необходимо
отрегулировать,
чтобы
концентрация клеток оставалась постоянной.
В стерильных условиях непрерывный метод
обеспечивает
сохранение
культуры
в
физиологически
активном
состоянии
длительное время.
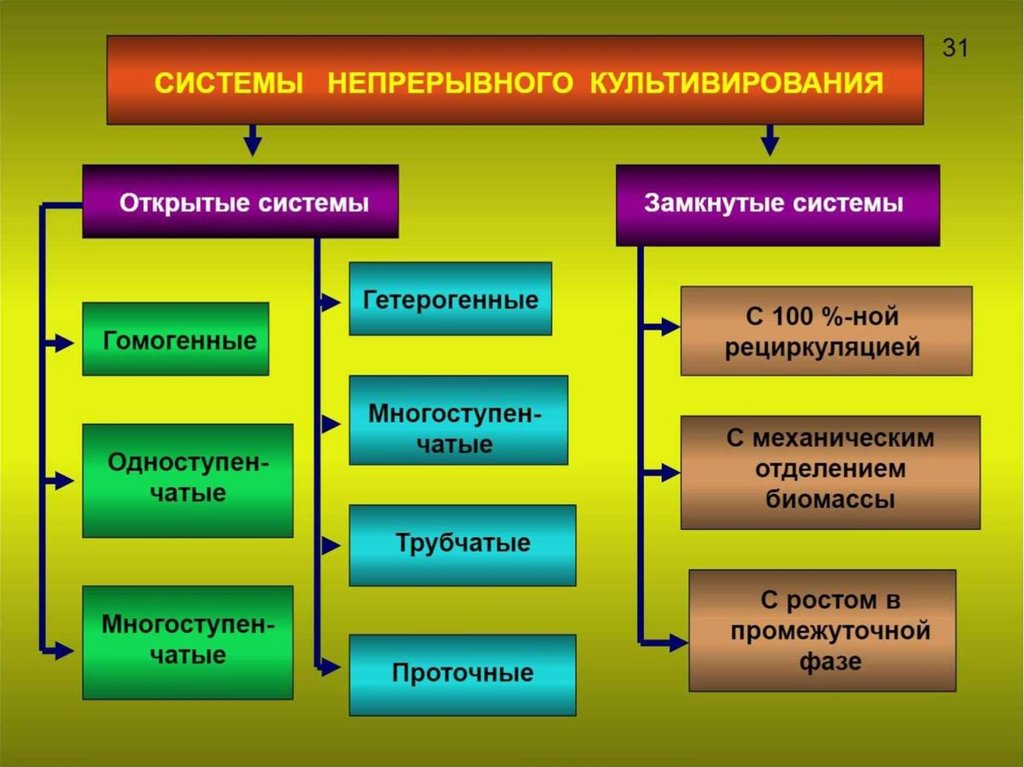
6. Две разновидности непрерывных процессов
- тубулярные;питательная среда и посевной материал
непрерывно поступают в аппарат, в котором
нет обратного смешения.
- хемостатные;
питательная среда и посевной материал
поступают в аппарат, в котором происходит
постоянное перемешивание.
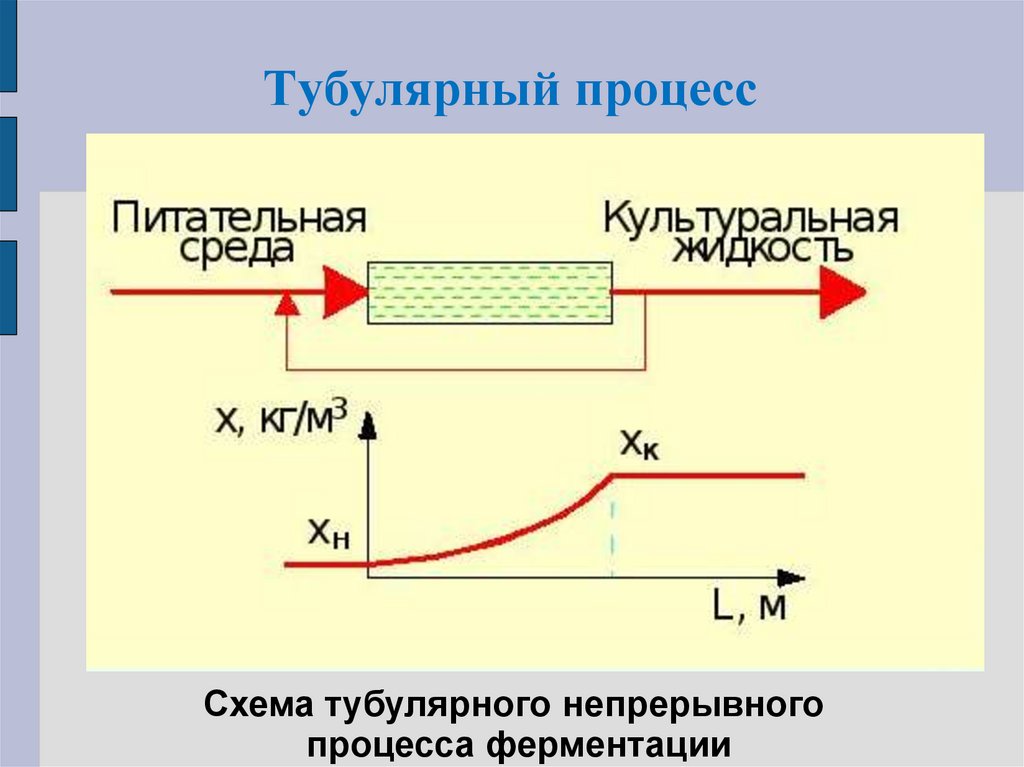
7. Тубулярный процесс
Жидкость на входе в аппарат смешивается спосевным материалом.
По мере их продвижения в аппарате
одновременно осуществляются рост биомассы
и процесс ферментации.
Движение может быть горизонтальным или
вертикальным (аппарат башенного типа:
движение жидкости снизу вверх) для
анаэробных процессов.
8. Тубулярный процесс
Схема тубулярного непрерывногопроцесса ферментации
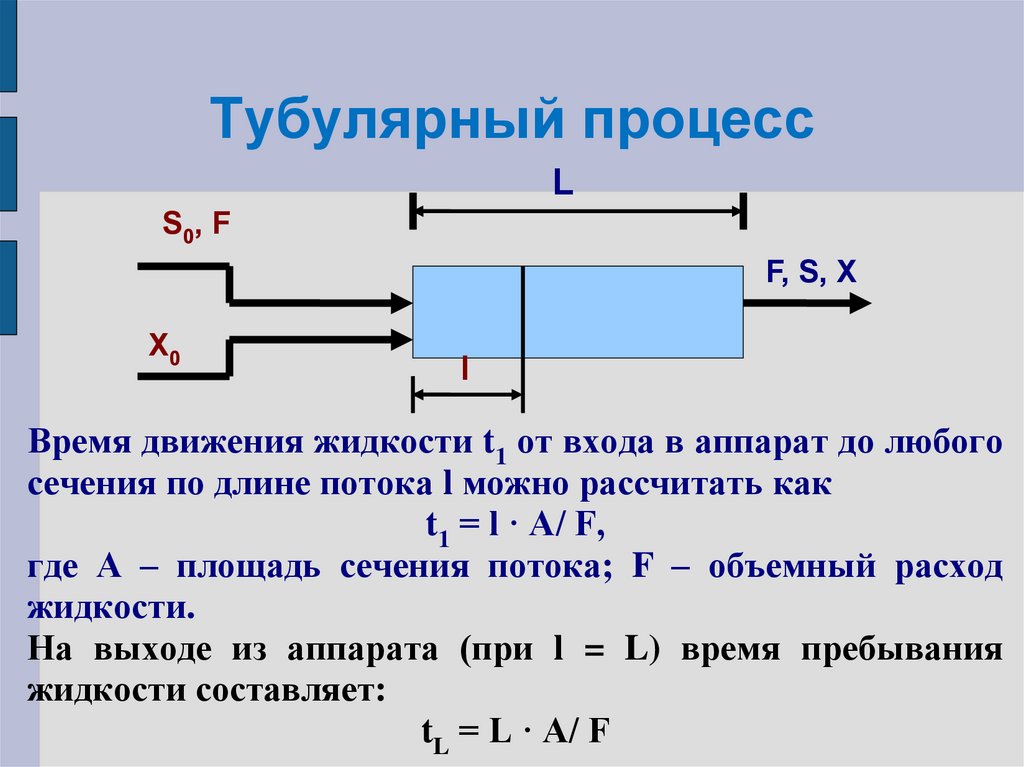
9. Тубулярный процесс
LS0, F
F, S, X
X0
l
Время движения жидкости t1 от входа в аппарат до любого
сечения по длине потока l можно рассчитать как
t1 = l · A/ F,
где А – площадь сечения потока; F – объемный расход
жидкости.
На выходе из аппарата (при l = L) время пребывания
жидкости составляет:
tL = L · A/ F
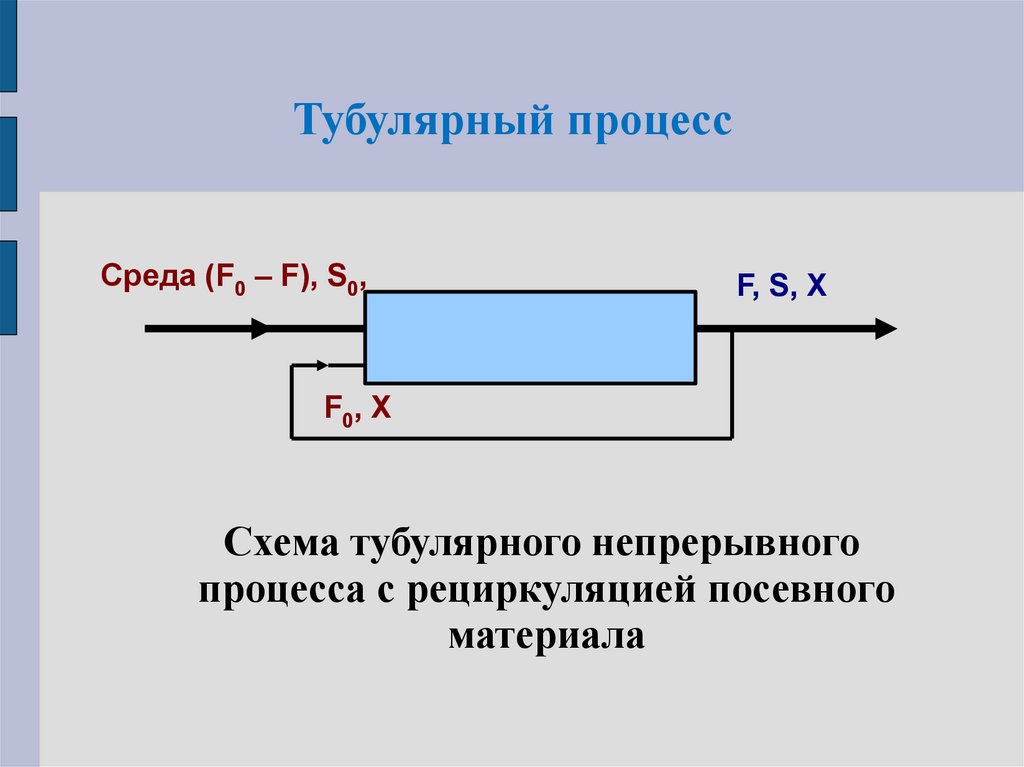
10. Тубулярный процесс
Тубулярный процесс с учетом закономерностейпротекания процесса ферментации полностью
подобен периодическому.
Сложность: в непрерывной подаче посевного
материала
решается
путем
организации
рециркуляции части потока с выхода аппарата
на вход.
11.
Тубулярный процессСреда (F0 – F), S0,
F, S, X
F0, X
Схема тубулярного непрерывного
процесса с рециркуляцией посевного
материала
12. Тубулярный процесс
Преимуществомтубулярного
процесса
является
возможность
более
полного
исчерпания субстрата (как и в периодическом
процессе).
Недостатком – невозможность организовать
аэрацию во всех зонах по длине аппарата;
большая склонность к инфицированию.
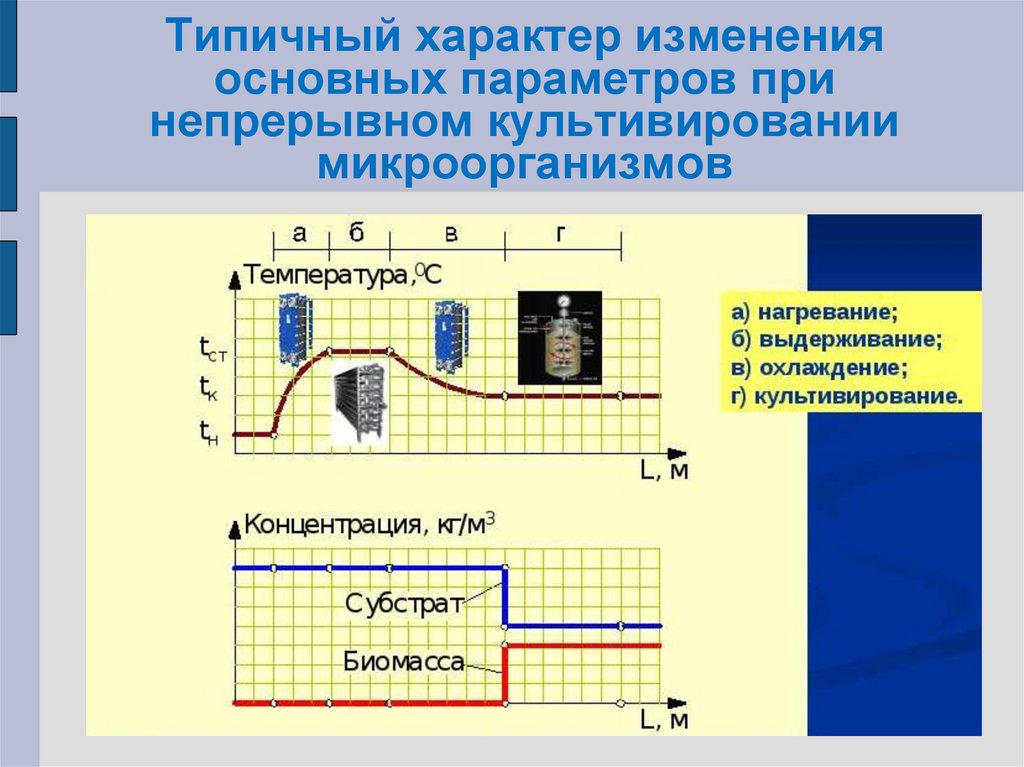
13. Типичный характер изменения основных параметров при непрерывном культивировании микроорганизмов
14. Фундаментальный принцип непрерывного культивирования
15. Влияние основных параметров процессов на удельную скорость роста
16. Влияние температуры на удельную скорость роста
µ=µm f1(t) f2(рН) f3(С) f4(S) f5(P)f2(рН) f3(t) f4(S) f5(P) = const
µ=µmt f1(t)
где µmt – максимально возможное значение удельной
скорости роста при постоянных pH,C, S, P и при самой
благоприятной температуре.
F1(t)= µ/µmt
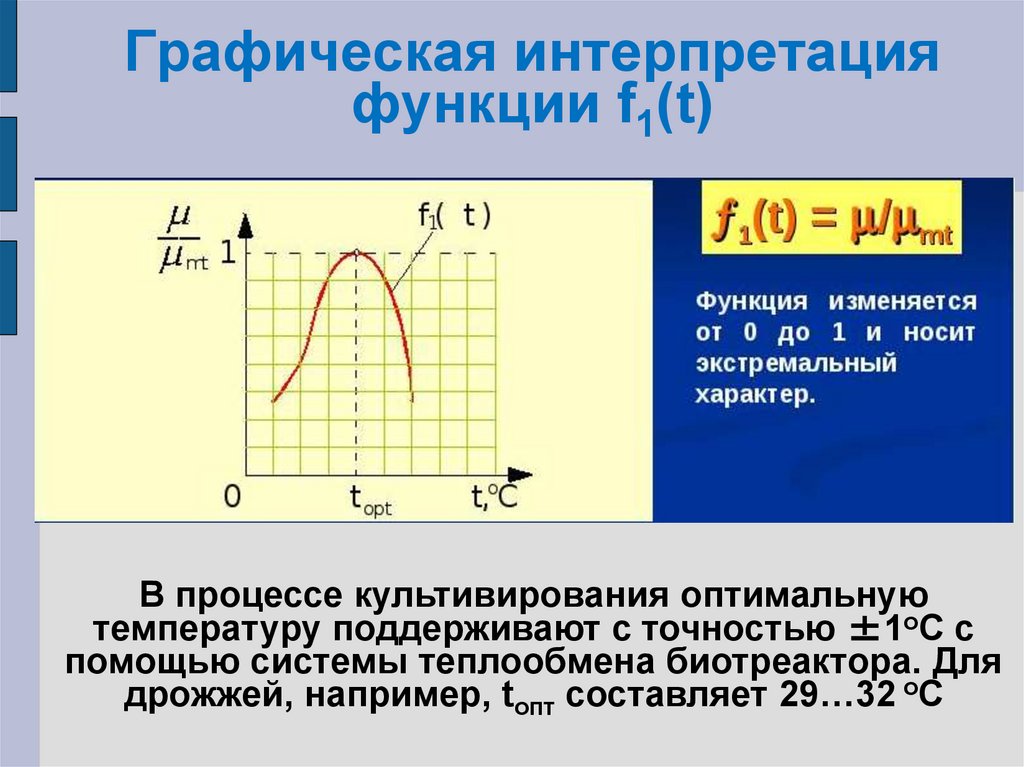
17. Графическая интерпретация функции f1(t)
В процессе культивирования оптимальнуютемпературу поддерживают с точностью ±1оС с
помощью системы теплообмена биотреактора. Для
дрожжей, например, tопт составляет 29…32 оС
18. Влияние рН на удельную скорость роста
µ=µm f1(t) f2(рН) f3(С) f4(S) f5(P)f1(t) f3(С) f4(S) f5(P) = const
µ=µmрН f2(рН)
где µmрН – максимально возможное значение удельной
скорости роста при постоянных t, С, S, P и при самом
благоприятном значении рН.
f2(pH)= µ/µmpH
Аналитическое выражение не установлено!
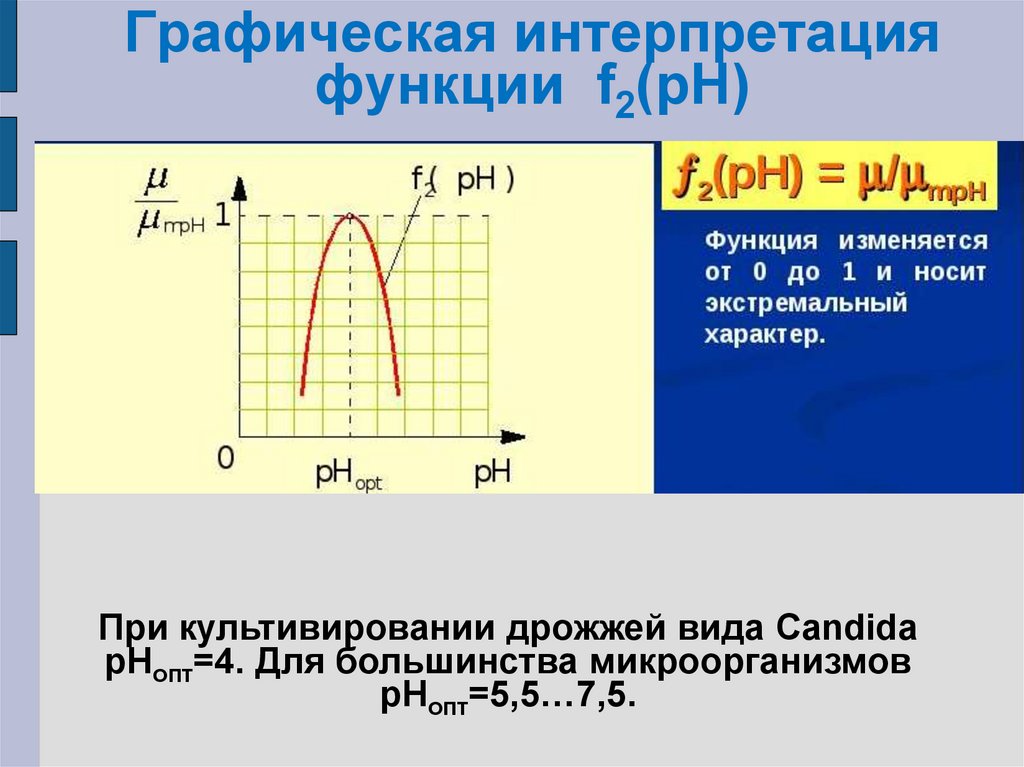
19. Графическая интерпретация функции f2(рН)
При культивировании дрожжей вида CandidapHопт=4. Для большинства микроорганизмов
pHопт=5,5…7,5.
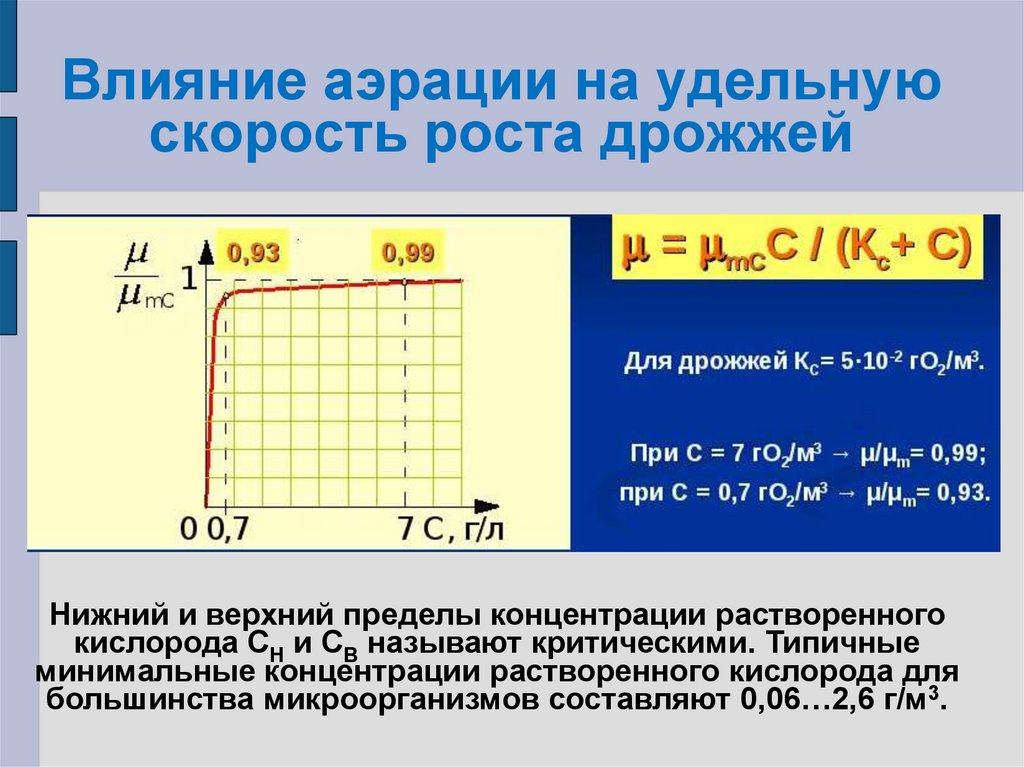
20. Влияние аэрации на удельную скорость роста
Кислород плохо растворим в жидкости. Например, равновеснаяконцентрация растворенного кислорода в воде при нормальных
условиях и при контакте ее с воздухом, в котором 21% О2 (то есть при
парциальном давлении 150 мм.рт. ст.), составляет около 7 г/м3.
В культуральных жидкостях, представляющих солевые растворы,
растворимость кислорода ниже и обычно лежит в пределах 4…6 г/м3.
В то же время скорость потребления кислорода большинством
микроорганизмов достаточно велика и составляет 0,2…0,3 г/(м3хс).
При такой инстенсивности дыхания растворенный кислород будет
потреблен культурой за очень короткий промежуток времени.
µ=µm f1(t) f2(рН) f3(С) f4(S) f5(P)
f1(t) f2(рН) f4(S) f5(P) = const
µ=µmС f3(С)
где µmС – максимально возможное значение удельной скорости роста
при постоянных t, pH, S, P и при самом благоприятном значении C.
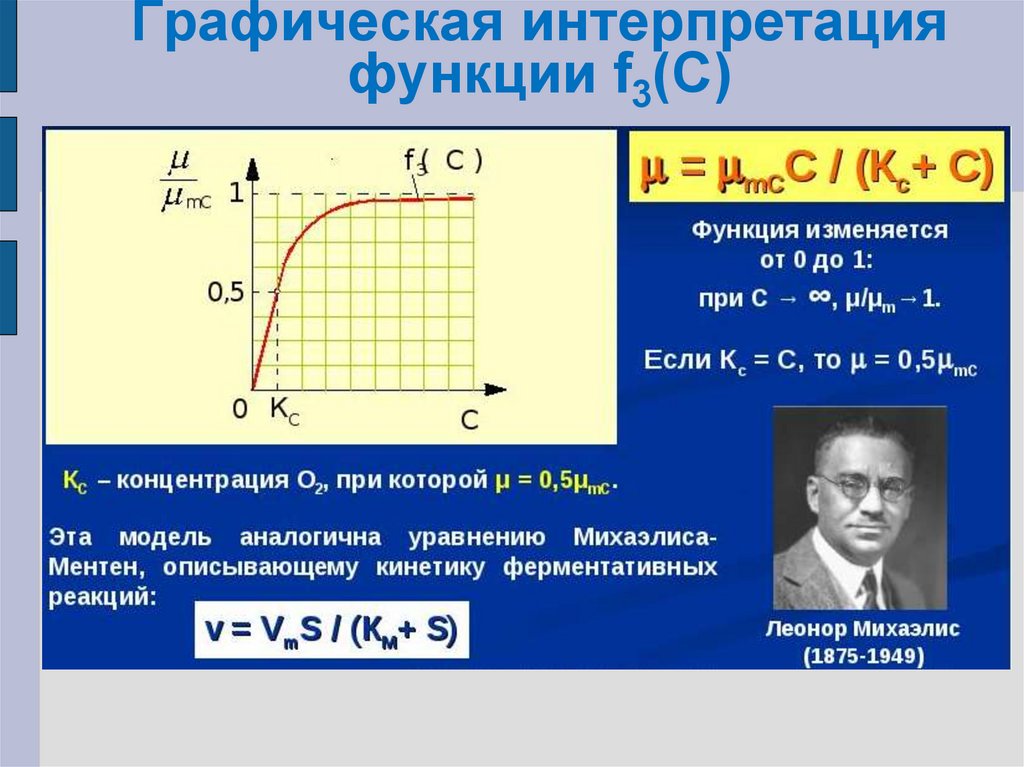
F3(C)= µ/µmC=C/(KC+C)
µ = µmCC/(KC+C)
21. Графическая интерпретация функции f3(С)
22. Влияние аэрации на удельную скорость роста дрожжей
Нижний и верхний пределы концентрации растворенногокислорода СН и СВ называют критическими. Типичные
минимальные концентрации растворенного кислорода для
большинства микроорганизмов составляют 0,06…2,6 г/м3.
23. Влияние лимитирующего субстрата на удельную скорость роста
µ=µm f1(t) f2(рН) f3(С) f4(S) f5(P)f1(t) f2(рН) f3(С) f5(P) = const
µ=µmS f4(S)
где µmS – максимально возможное значение удельной
скорости роста при постоянных t, pH, С, P и при самом
благоприятном значении S.
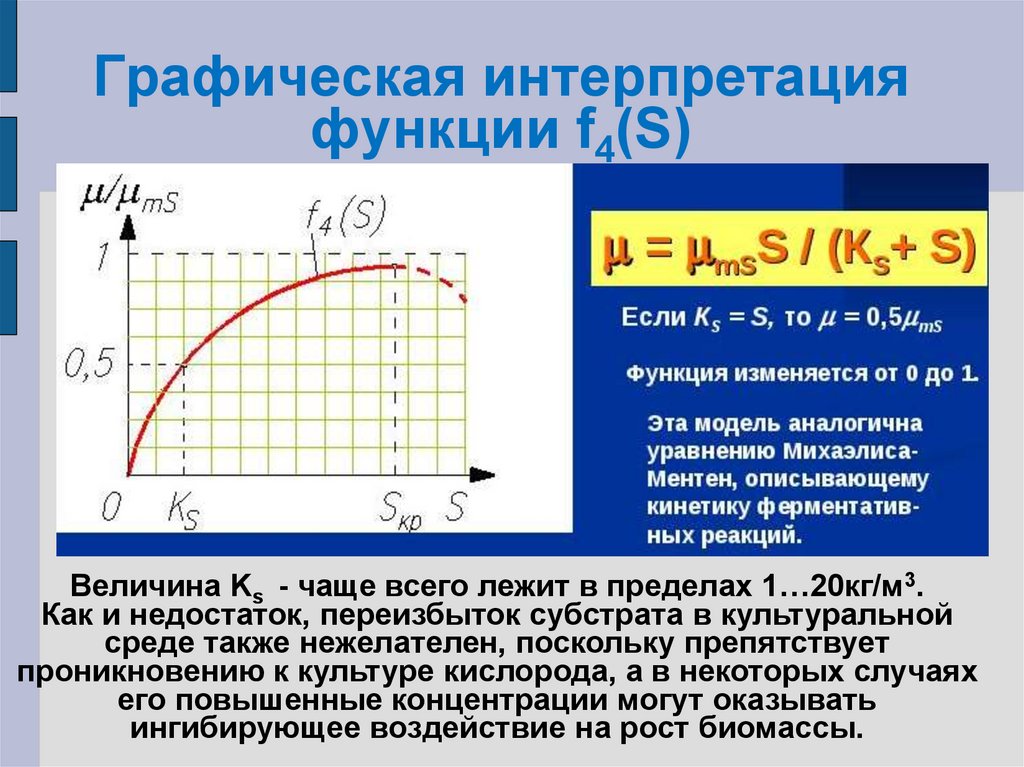
F4(S)= µ/µmS=S/(KS+S)
µ = µmSS/(KS+S)
24. Графическая интерпретация функции f4(S)
Графическая интерпретацияфункции f4(S)
Величина Ks - чаще всего лежит в пределах 1…20кг/м3.
Как и недостаток, переизбыток субстрата в культуральной
среде также нежелателен, поскольку препятствует
проникновению к культуре кислорода, а в некоторых случаях
его повышенные концентрации могут оказывать
ингибирующее воздействие на рост биомассы.
25. Влияние продуктов метаболизма на удельную скорость роста
µ=µm f1(t) f2(рН) f3(С) f4(S) f5(P)f1(t) f2(рН) f3(С) f4(S) = const
µ=µmР f5(P)
где µmР – максимально возможное значение удельной
скорости роста при постоянных t, pH, С, S и при самом
благоприятном значении Р.
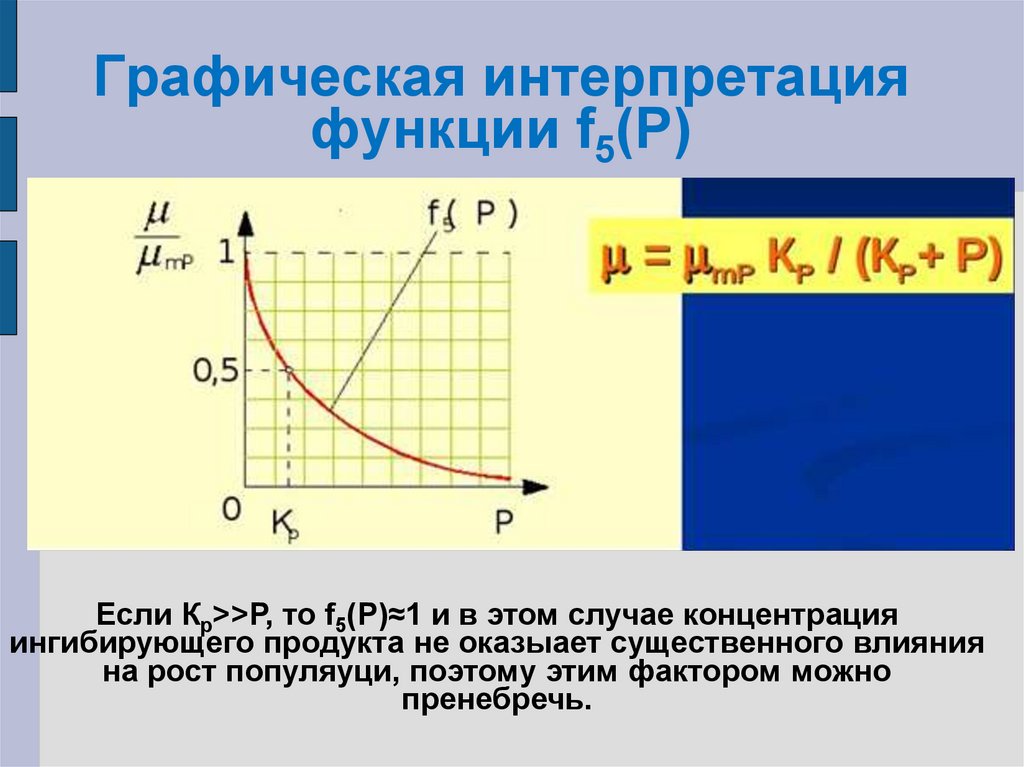
f5(P)= µ/µmP=KP/(KP+P)
µ = µmPKP/(KP+P)
26. Графическая интерпретация функции f5(P)
Графическая интерпретацияфункции f5(P)
Если Кр>>Р, то f5(P)≈1 и в этом случае концентрация
ингибирующего продукта не оказыает существенного влияния
на рост популяуци, поэтому этим фактором можно
пренебречь.
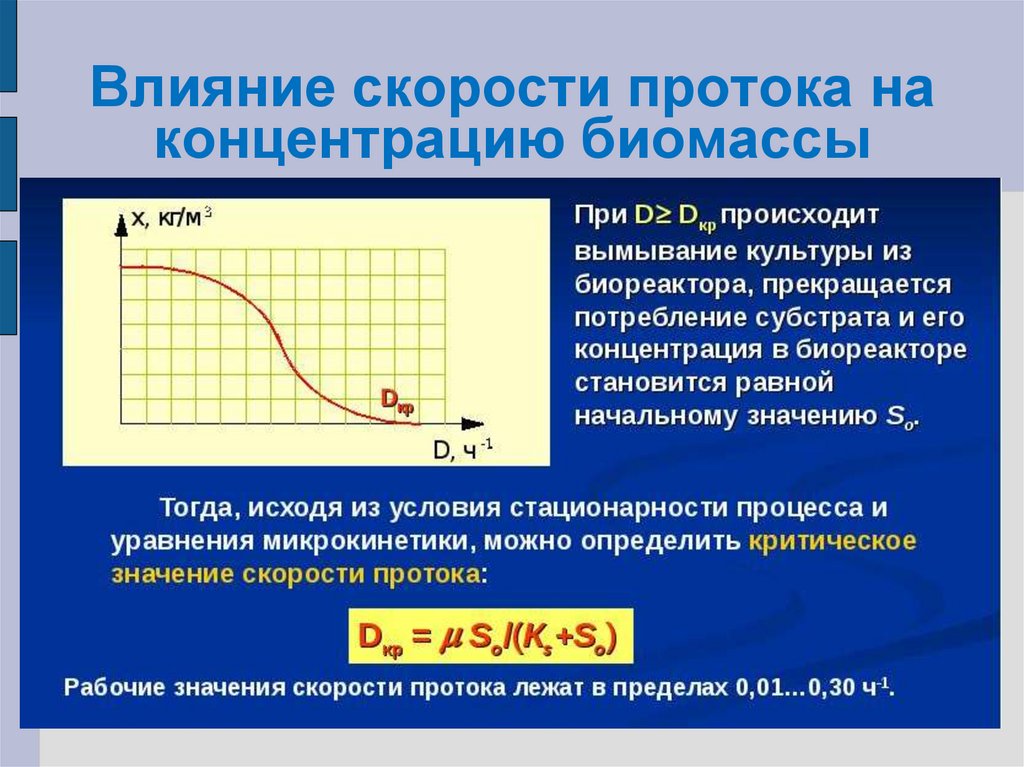
27. Влияние скорости протока на концентрацию биомассы
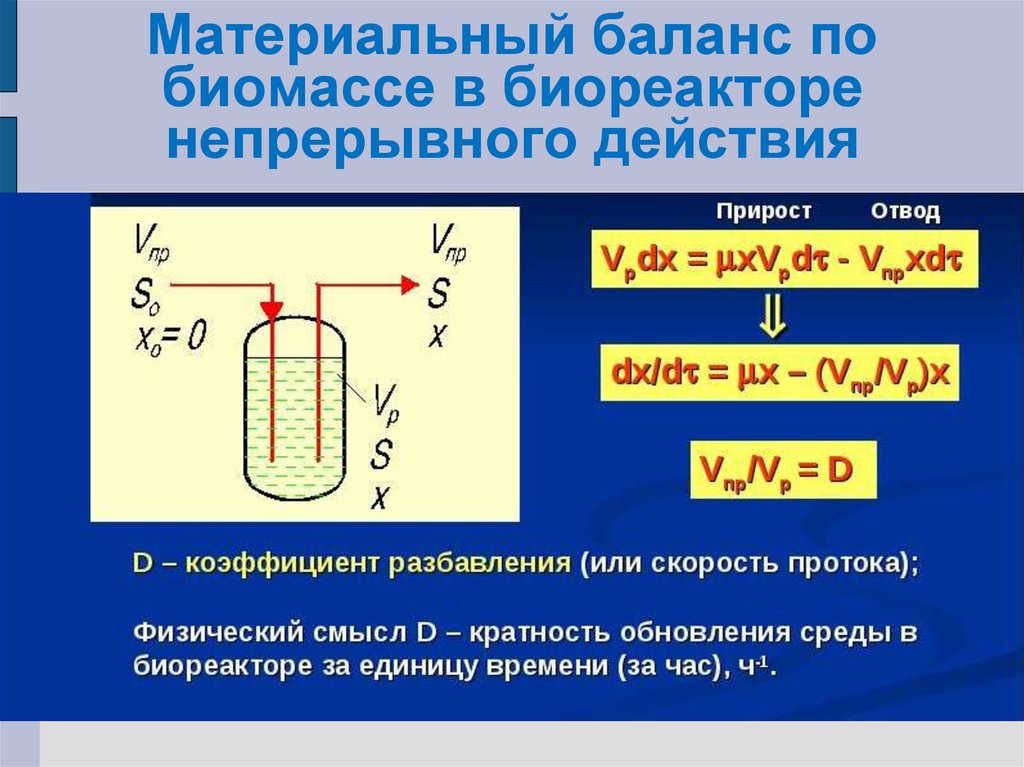
28. Материальный баланс по биомассе в биореакторе непрерывного действия
29. Хемостатный процесс непрерывного культивирования
Ферментация протекает в аппарате смешалкой;
В аппарат с постоянной скоростью
подается свежая питательная среда;
Из аппарата с такой же скоростью
отводится ферментационная среда,
содержащая биомассу, продукт
метаболизма и остатки субстрата.
Предполагают, что в любой точке аппарата
и на выходе из него концентрации S, X, P
равны.
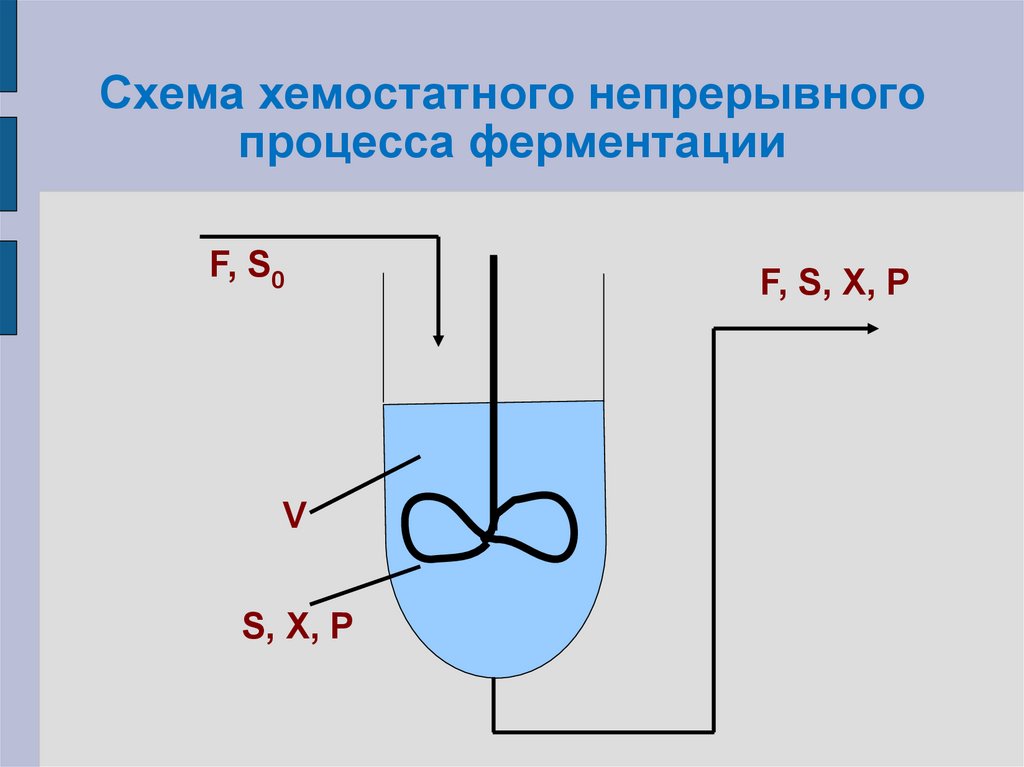
30. Схема хемостатного непрерывного процесса ферментации
F, S0V
S, X, P
F, S, X, P
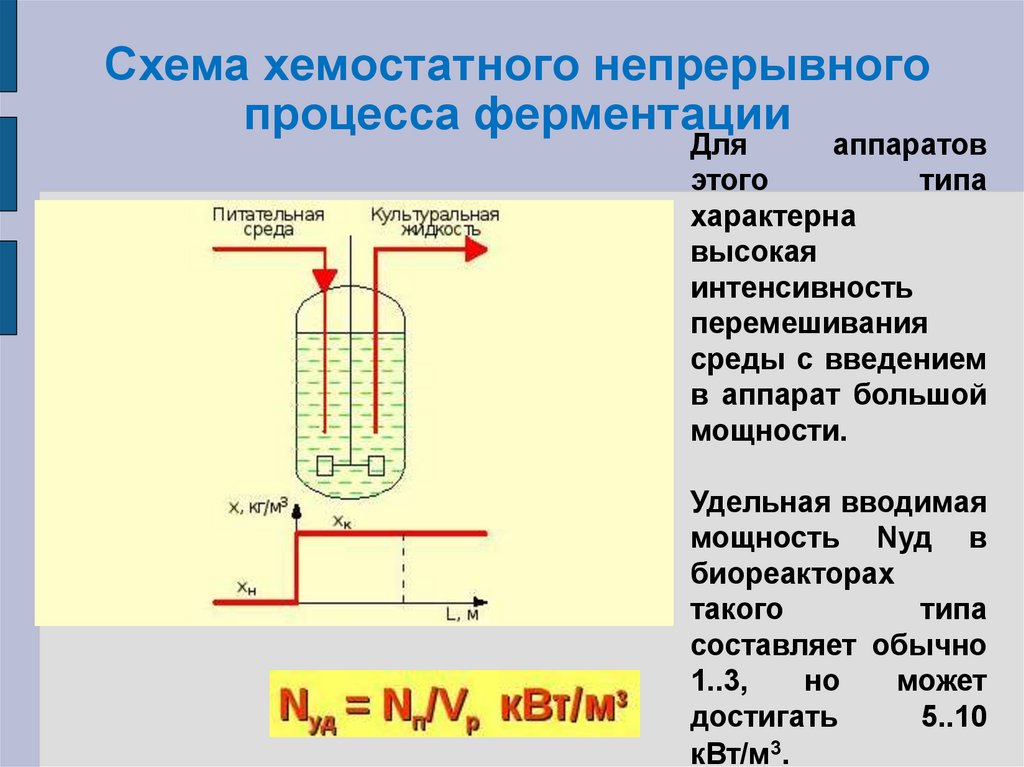
31. Схема хемостатного непрерывного процесса ферментации
Дляаппаратов
этого
типа
характерна
высокая
интенсивность
перемешивания
среды с введением
в аппарат большой
мощности.
Удельная вводимая
мощность Nуд в
биореакторах
такого
типа
составляет обычно
1..3,
но
может
достигать
5..10
кВт/м3.
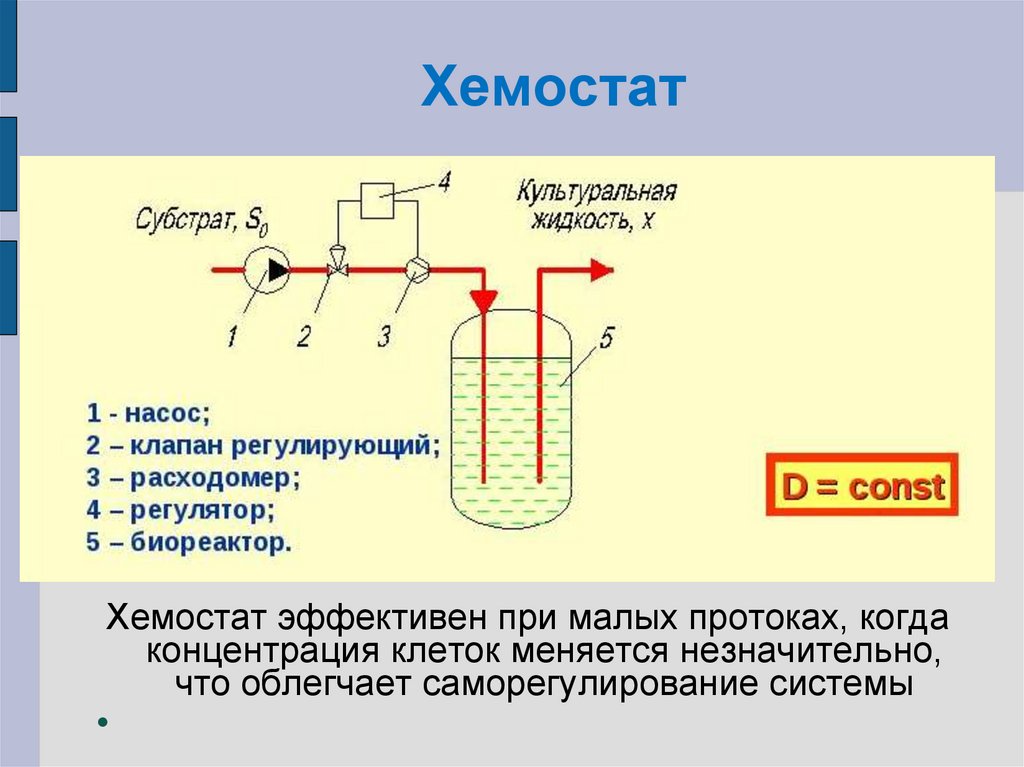
32. Хемостат
ХемостатХемостат эффективен при малых протоках, когда
концентрация клеток меняется незначительно,
что облегчает саморегулирование системы
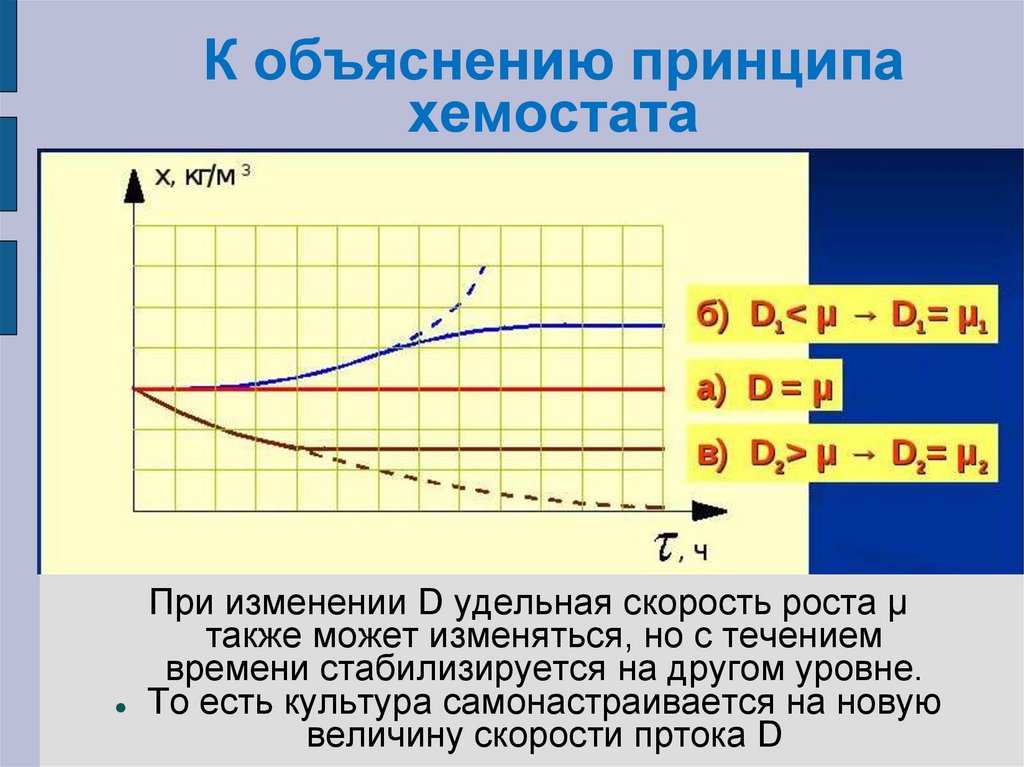
33. К объяснению принципа хемостата
К объяснению принципахемостата
При изменении D удельная скорость роста μ
также может изменяться, но с течением
времени стабилизируется на другом уровне.
То есть культура самонастраивается на новую
величину скорости пртока D
34.
Посевной материал на вход в аппарат неподают непрерывно.
Засев производится единовременно при
запуске
культуры
от
периодического
процесса, биомасса непрерывно сохраняется
в ферментере и специального подсева не
нужно.
Закономерности
хемостатного
процесса
описаны с помощью математической модели
кинетики процесса
35. Допущения для математической модели:
μ = μm(S/KS + S); (по Моно)μ = 0 (отсутствует диссимиляция биомассы),
QP = 0 (нет образования продуктов
метаболизма),
Ǭ = 0 (нет инактивации продукта
P
метаболизма),
mS = 0 (нет затрат на поддержание
жизнедеятельности культуры).
36. Выражение для материального баланса в ферментере
V dX/dt = μmS/(KS+S)· XV – FX;V dS/dt = FS0 – 1/YXS ·μmS/(KS+S)·XV – FS
Приток
Расход на рост биомассы
Отток
Здесь V-объем ферментационной
жидкости в аппарате, сохраняемый на
постоянном уровне.
Принимаем: D = F/V, где D – скорость
разбавления, ч-1
37.
систему уравнений:V dS/dt = FS0 – 1/YXS · μmS/(KS+S) · XV – FS;
V dX/dt = μmS/(KS+S) · XV – FX;
можно записать упрощенно:
dS/dt = D (S0-S) – 1/YXS μX;
dX/dt = μX – DX;
Введем в уравнение dX/dt = μX – DX;
вместо μ зависимость μ(S):
dX/dt = μmS/(KS+S) - DX
dS/dt = D (S0-S) – 1/YXS μX;
38.
В непрерывном хемостатном процесседовольно быстро устанавливается
стационарное состояние,
при котором
скорость роста биомассы будет равна
скорости ее вымывания из аппарата,
скорость притока субстрата за вычетом
оттока остаточного субстрата равна
скорости его расходования на рост
микроорганизмов.
при этом dX/dt = 0, dS/dt = 0
39.
Решая при этих условиях уравнениебаланса биомассы, получаем:
μ X – DX = 0 и μ = D,
в установившемся состоянии удельная
скорость
роста
равна
скорости
разбавления D (параметр, задаваемый
оператором).
Если в установившемся состоянии в
момент времени t0 по каким-либо
причинам μ ≠ D, возникает переходный
процесс по биомассе.
40. В хемостате осуществляется саморегулирование
Из уравнения dX/dt = μX – DX следует, чтоесли μ>D, то скорость роста биомассы в
аппарате dX/dt > 0 и биомасса возрастает.
При этом она потребляет из среды больше
субстрата, концентрация его снижается,
уменьшается и μ.
Устанавливается
новое
равновесное
состояние μ=D при большей концентрации
биомассы.
41. В хемостате осуществляется саморегулирование
Если величина μ < D, то dX/dt < 0, иконцентрация
биомассы
начнет
снижаться,
соответственно
будет
возрастать концентрация субстрата.
При
этом
новое
установившееся
состояние будет при более низкой
концентрации биомассы.
42. Графические зависимости между установившимися значениями X и S в хемостатном процессе и скоростью разбавления D называют
хемостатными кривыми.X, S
Хемостатные
кривые X(D) и
S(D)
в
стационарном
состоянии
D
43.
Хемостатнаякривая
X(D)
имеет
особеннность:
концентрация
биомассы
снижается до нуля при повышении скорости
разбавления до некоторого критического
значения.
физически это означает, что культура
вымывается. выходит больше биомассы, чем
может вырасти.
При каких значениях Dкр происходит
вымывание?
X = YXS [S0 – KSD/ (μm – D)] = 0;
S0 = KSDкр/ (μm – Dкр); Dкр = μmS0/(KS+S0)
44.
Отсюда следует, что вид хемостатной кривойзависит от S0.
При D = 0, X = YXSS0
Начальное положение хемостатной кривой и
точка вымывания зависят от концентрации
субстрата в свежей среде (подпитке) S0.
Эта величина наряду со скоростью разбавления
является параметром, с помощью которого
можно управлять процессом.
45.
Интересную особенность имеет зависимостьстационарной
(остаточной)
концентрации
субстрата от начальной (входной) концентрации.
В уравнении S = KSD/ (μm – D) нет, ничего кроме
D и кинетических констант KS, μm.
46.
парадоксальныйвывод:
при
любом
изменении концентрации субстрата во
входящем потоке S0 в стационарном
состоянии
при
заданной
скорости
разбавления устанавливается одна и та же
остаточная концентрация субстрата S.
Именно это свойство хемостата дало ему
название:
концентрация
субстрата
(химического соединения) стабилизируется
сама по себе независимо от колебаний на
входе.
47. Что регулируется оператором?
- скорость разбавления; (поэтому процессиногда называют «спидостат»).
Возникает вопрос: к чему стремиться?
производительность процесса QX (количество биомассы, образующейся в единицу
времени единицей объема среды в аппарате)
для непрерывного процесса:
QX = DX, после подстановки выражения
X = YXS [S0 – KSD/ (μm – D)]
QX = DYXS [S0 – KSD/ (μm – D)]
48.
Практический интерес представляетопределение
условий
(скорости
разбавления) при которых величина
будет оптимальной.
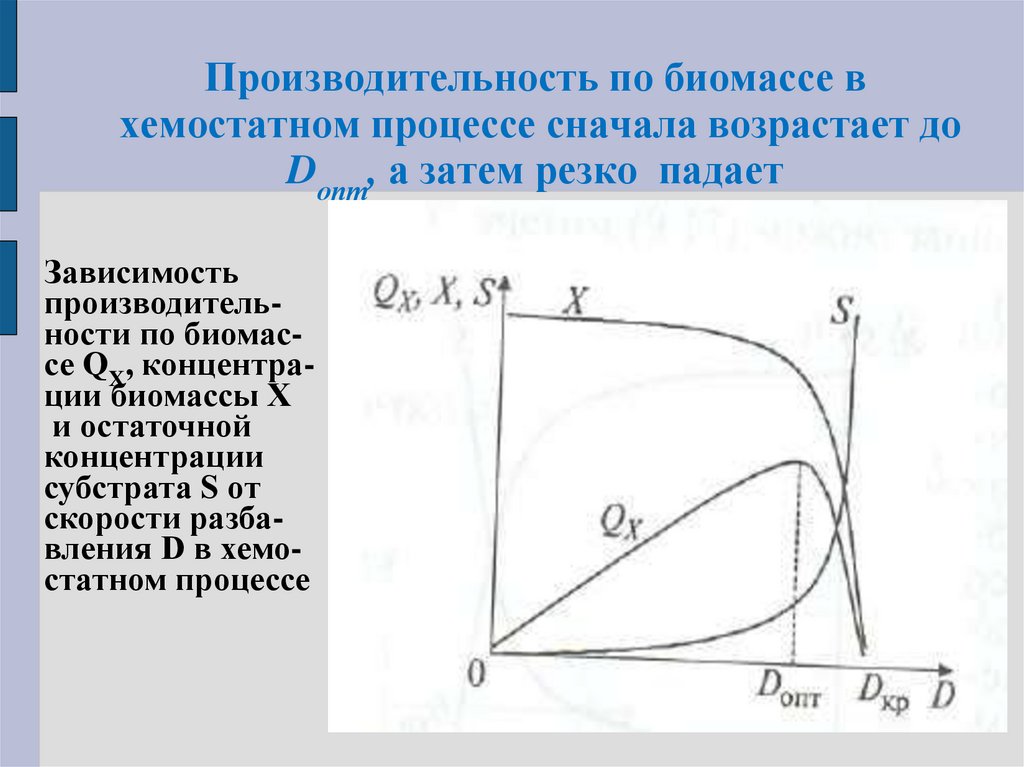
49. Производительность по биомассе в хемостатном процессе сначала возрастает до Donт, а затем резко падает
Зависимостьпроизводительности по биомассе QX, концентрации биомассы Х
и остаточной
концентрации
субстрата S от
скорости разбавления D в хемостатном процессе
50.
Для непрерывного процесса в том же аппаратепроизводительность по биомассе определяется
следующим образом.
Чтобы
найти
максимально
возможную
производительность непрерывного процесса в
том же аппарате, в котором проводили и
периодический процесс, надо проанализировать
формулу для QХопт.
Из нее следует, что чем больше концентрация
субстрата на входе в аппарат, тем больше оптимальная концентрация биомассы.
51. ОТКЛОНЕНИЯ ОТ ТЕОРИИ ХЕМОСТАТА ПРИ ЛИМИТИРОВАНИИ ПРОЦЕССА РАЗЛИЧНЫМИ СУБСТРАТАМИ
Хемостатные кривые X(D) чувствительны кизменению кинетических зависимостей при
лимитировании
процесса
различными
субстратами.
Углерод.
Отклонение
от
классической
хемостатной кривой (снижение концентрации
биомассы при малых скоростях разбавления)
связано с повышенным расходом субстрата на
поддержание
жизнедеятельности
микроорганизмов при малых удельных скоростях
роста биомассы.
52.
Если решить систему уравнений:dX/dt = μmS/(KS+S) - DX
dS/dt = D (S0-S) – 1/YXS μX;
с учетом затрат на поддержание
жизнедеятельности, получится хемостатная
кривая
53.
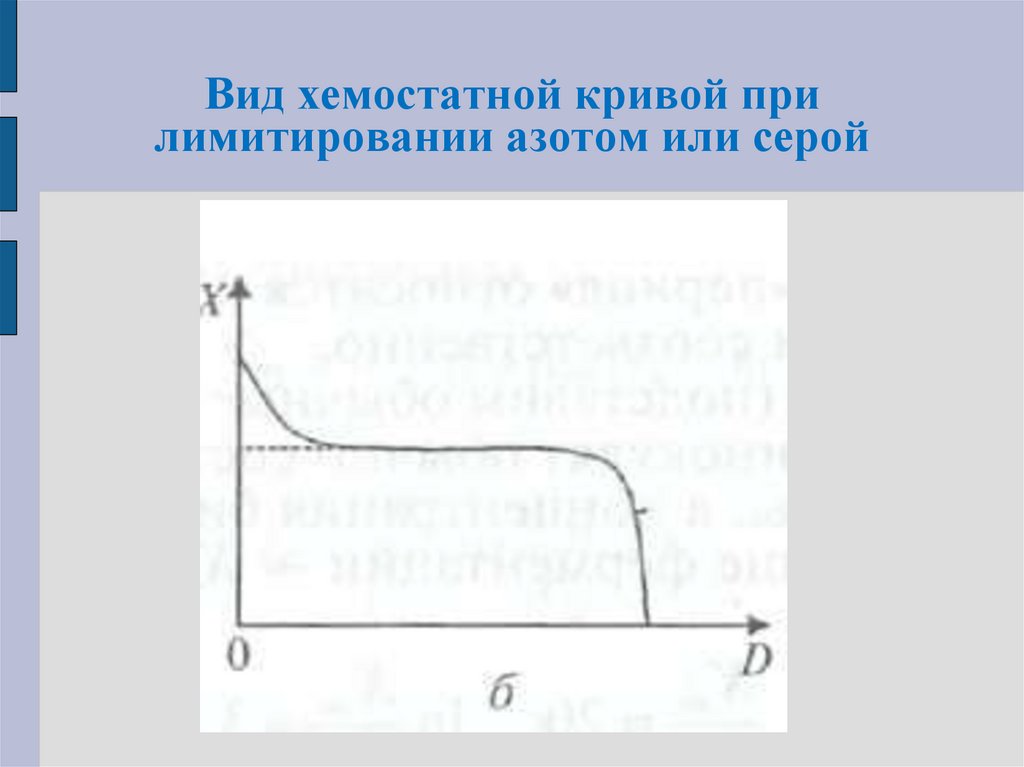
Азот или сера. Наблюдаемые отклоненияотражают превышение концентрации биомассы
при малых скоростях разбавления по сравнению с
идеальным хемостатом. Клетки при малой
скорости
роста
накапливают
резервные
соединения (полисахариды, полиоксибутират,
липиды), и по массе их как бы становится
больше.
Такой режим лимитирования в обиходе называют
«жировым». Если выражать концентрацию
биомассы не в г/л, а в числе клеток на литр,
получается обычная форма графика.
54. Вид хемостатной кривой при лимитировании азотом или серой
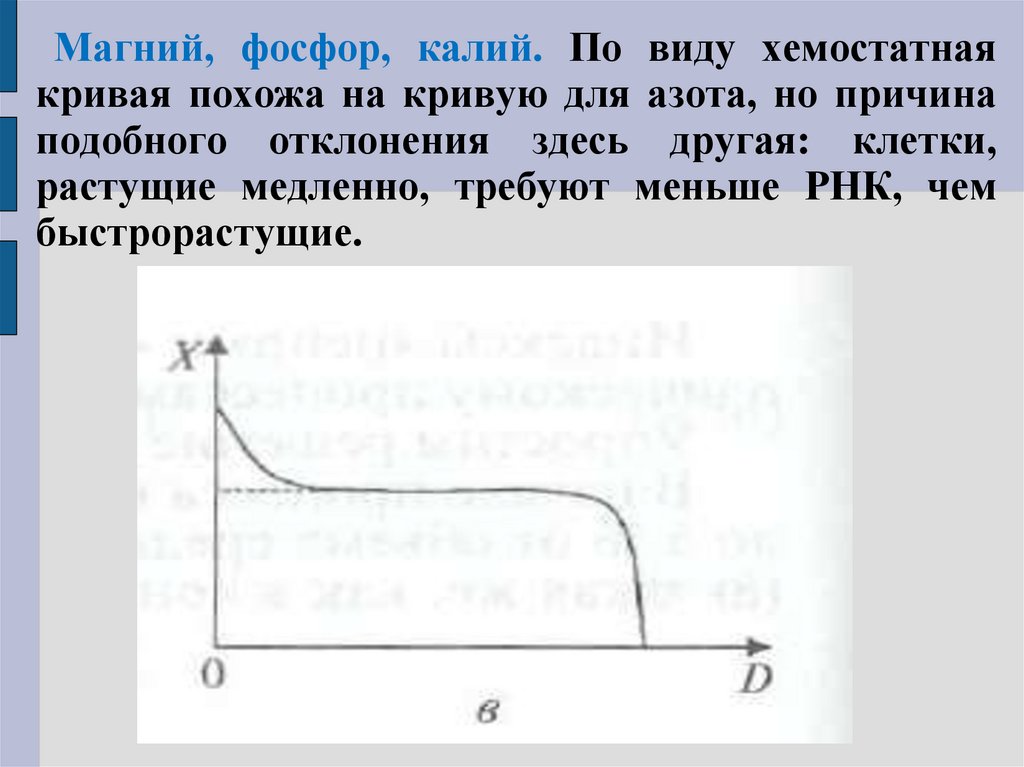
55. Магний, фосфор, калий. По виду хемостатная кривая похожа на кривую для азота, но причина подобного отклонения здесь другая:
клетки,растущие медленно, требуют меньше РНК, чем
быстрорастущие.
56.
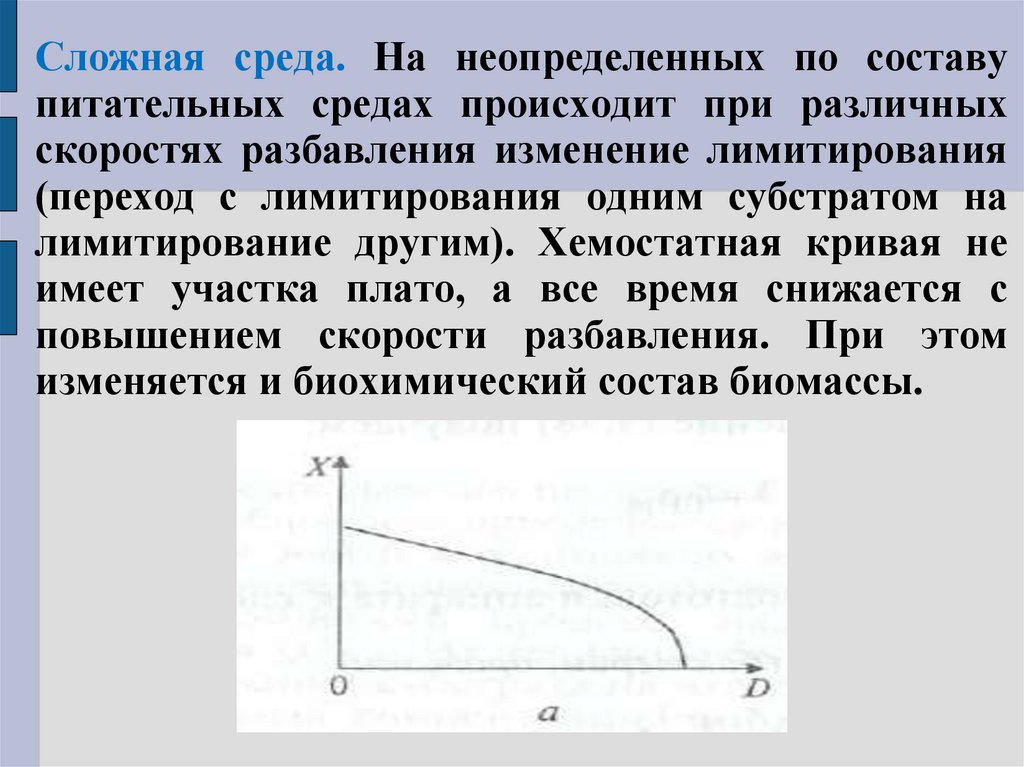
Сложная среда. На неопределенных по составупитательных средах происходит при различных
скоростях разбавления изменение лимитирования
(переход с лимитирования одним субстратом на
лимитирование другим). Хемостатная кривая не
имеет участка плато, а все время снижается с
повышением скорости разбавления. При этом
изменяется и биохимический состав биомассы.
57.
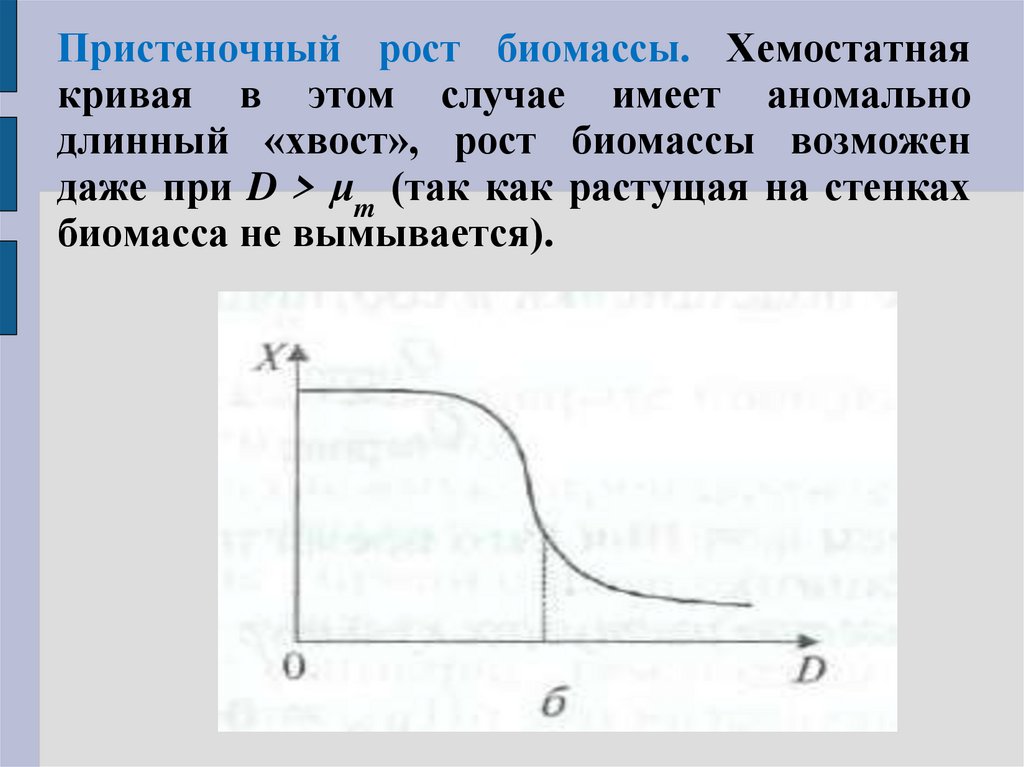
Пристеночный рост биомассы. Хемостатнаякривая в этом случае имеет аномально
длинный «хвост», рост биомассы возможен
даже при D > μm (так как растущая на стенках
биомасса не вымывается).
58. ХЕМОСТАТНЫЙ ПРОЦЕСС КУЛЬТИВИРОВАНИЯ, ЛИМИТИРОВАННЫЙ КИСЛОРОДОМ
Кинетикароста
аэробных
культур
микроорганизмов зависит от двух субстратов.
Вторым является кислород. Общая зависимость
представлена в виде альтернативного уравнения.
59. Если ферментационное оборудование недостаточно интенсивное, эта зависимость вырождается в однофакторную зависимость от
концентрации растворенного кислорода С:Уравнение баланса биомассы в непрерывном
процессе с лимитированием кислородом
такое же, как при лимитировании обычным
субстратом, только вместо концентрации не
газообразного
субстрата S в уравнении
использована концентрация растворенного
кислорода С:
60.
Из условия стационарности dX/dt = Оможно найти значение установившейся
концентрации растворенного кислорода:
61.
с возрастанием коэффициентаразбавления
продуктивность
все
время снижается, так
как снижается скорость
сорбции кислорода.
При некотором достаточно малом значении
скорости
разбавления
концентрация
негазообразного субстрата снижается настолько,
что начинает лимитировать рост биомассы.
При этом зависимость QX(D) приобретает вид,
характерный для хемостата. Этот участок
изображен пунктирной линией.
62.
в этом случае оптимальной скоростьюразбавления
является
точка
переключения
лимитирования
с
растворенного в жидкости субстрата S на
кислород.
Повышение
величины
KLa
(т.
е.
массообменных возможностей аппарата)
позволяет сдвинуть эту точку вправо и
получить
более
высокую
производительность
процесса
по
биомассе.
63. АВТОСЕЛЕКЦИЯ В НЕПРЕРЫВНОМ ПРОЦЕССЕ
В ходе процесса культивирования подвоздействием
космических
лучей
и
различных мутагенных факторов в культуре
происходят изменения, в результате которых
может появиться штамм, имеющий более
высокую удельную скорость роста, чем
исходный.
С этого момента оба штамма начинают
конкурировать за субстрат.
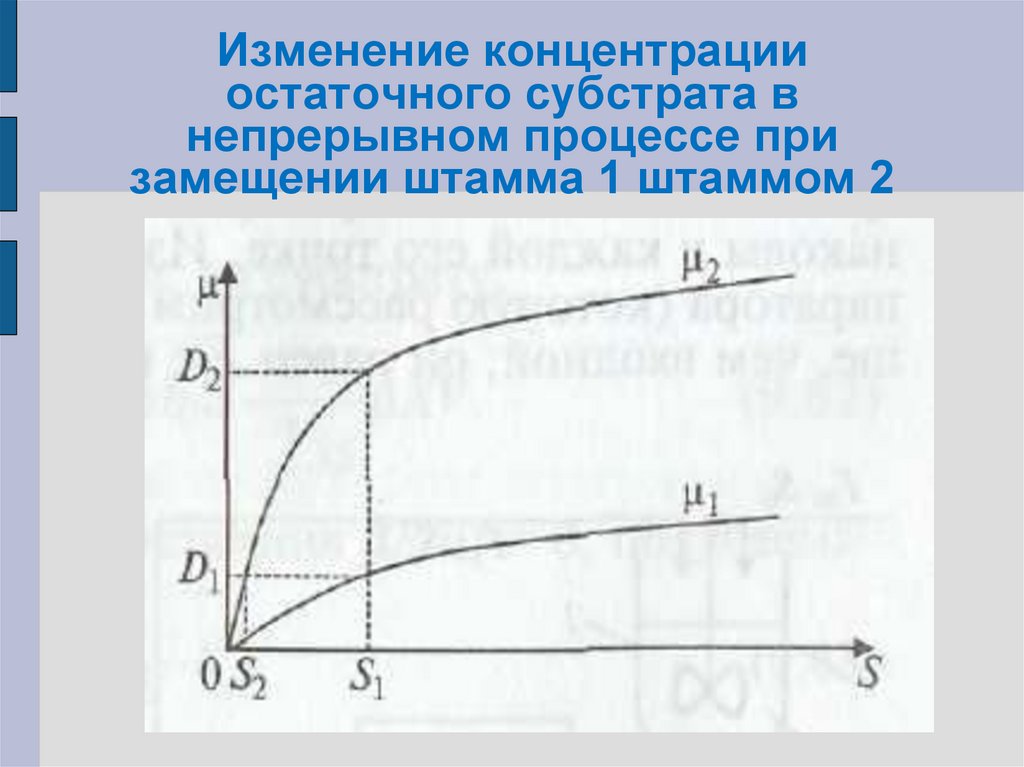
64. Изменение концентрации остаточного субстрата в непрерывном процессе при замещении штамма 1 штаммом 2
65.
Если процесс протекает при скоростиразбавления D1 то исходный штамм
обеспечивает саморегулирование процесса
при концентрации S1.
Если вначале процесс стабилизирован на
уровне S1 то для штамма-мутанта μ2(S1) = D2
значительно больше D1.
Следовательно, концентрация биомассы
этого штамма растет:
66.
Рост происходит до тех пор, покаконцентрация субстрата не снизится до S2.
При
этом
исходный
штамм
станет
вымываться из аппарата, поскольку μ1(S2) <
= D1, и тогда
Если
наблюдать
за
концентрацией
биомассы
в непрерывном процессе
культивирования, то можно заметить
скачкообразное повышение концентрации,
свидетельствующее
о
самопроиз
вольной селекции (автоселекции) новых
штаммов.
67. Внешнее проявление автоселекции в непрерывном процессе
68.
Одним из недостатков хемостата являетсяего склонность к вымыванию культуры.
Для борьбы с этим явлением используется
комплекс «ферментер-сепаратор».
69. Схема: ферментер-сепаратор
70.
При работе комплекса «ферментерсепаратор» концентрация субстрата навыходе из ферментера S уменьшается по
сравнению с обычным хемостатом, а
производительность системы по биомассе
Qкомпл. увеличивается.
71. Основные направления использования комплекса «ферментер-сепаратор»:
повышение производительности системынепрерывного культивирования, если этого
невозможно достичь просто за счет
повышения исходной концентрации
субстрата So, например при очистке сточных
вод или утилизации
малоконцентрированных растворов
субстрата;
более полное потребление из среды субстрата.
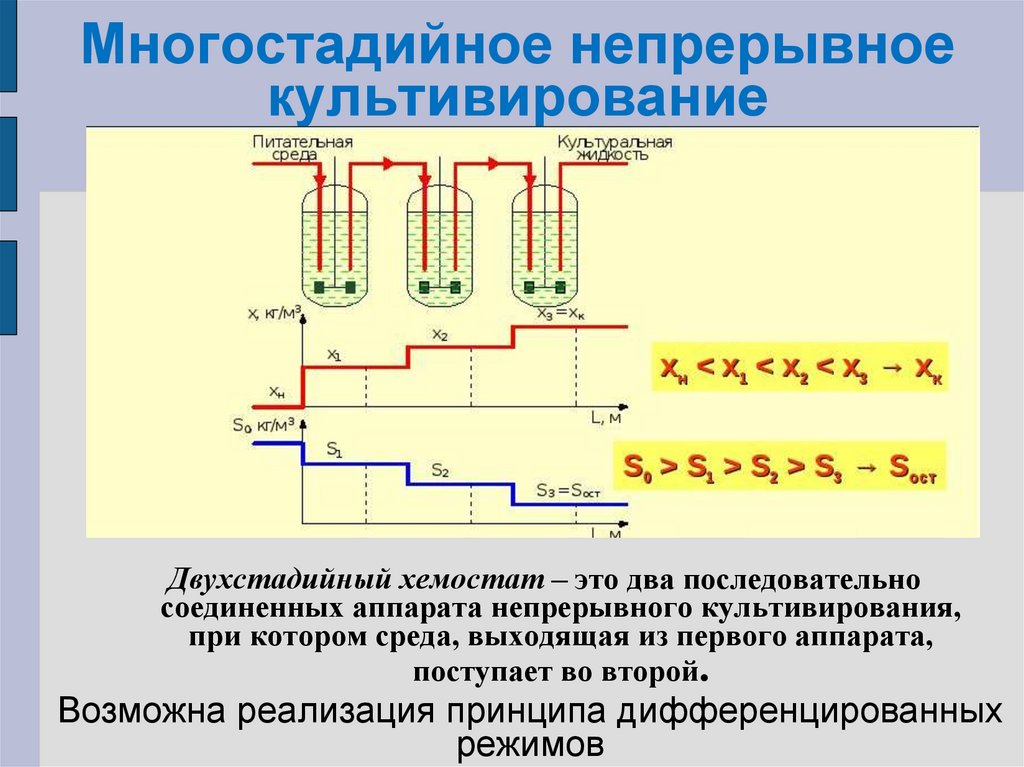
72. Многостадийное непрерывное культивирование
Двухстадийный хемостат – это два последовательносоединенных аппарата непрерывного культивирования,
при котором среда, выходящая из первого аппарата,
поступает во второй.
Возможна реализация принципа дифференцированных
режимов
73. Особенности двухстадийного хемостата:
1.Удельная скорость роста биомассы во второмаппарате не равна скорости разбавления, как в
одностадийном
хемостате,
а
меньше
ее.
Следовательно, концентрация биомассы во
втором аппарате никогда не может стать равной
нулю при любом разбавлении.
Задавая высокую скорость разбавления во
втором аппарате, можно не беспокоиться, что
произойдет вымывание культуры. Значение
удельной скорости роста во втором хемостате
будет
возрастать,
и
будет
возрастать
экономический коэффициент
74.
Особенности двухстадийногохемостата:
2.Концентрация субстрата во втором аппарате
всегда меньше, чем в первом. Для
дополнительного
прироста
биомассы
требуется субстрат, который расходуется из
запаса, имеющегося во входящем потоке.
Пример: выращивание кормовых дрожжей на
парафинах нефти. Остаточный субстрат вместе с
биомассой идет в кормовой продукт, но то, что
хорошо для микроорганизмов, — не всегда хорошо
для животных. В системе очистки стоков - остаточная
концентрация субстрата, ее снижение - цель всего
процесса.
75. Особенности двухстадийного хемостата:
3. Концентрация биомассы во втором аппаратевсегда больше, чем в первом. Существующая в
первом аппарате биомасса проходит через
второй аппарат транзитом, а к ней добавляется
приросшая в нем биомасса.
4.
Общая
продуктивность
двухстадийного
хемостата
не
превышает
суммарной
продуктивности эквивалентной по объему
системы из двух параллельно работающих
одностадийных
хемостатов.
Но при этом больше концентрация биомассы в
выходном потоке, что облегчает выделение и
концентрирование
биомассы,
И
другая
особенность,
снижается
остаточная
концентрация субстрата.
76. Особенности двухстадийного хемостата:
5.Важная особенность двухстадийного и
многостадийного хемостатов: последующие
аппараты должны быть более интенсивными
по массопередаче кислорода, так как они
«обслуживают»
большую
концентрацию
биомассы.
77.
6. Двухстадийный хемостат часто оказываетсяудобным для тех процессов, в которых целевым
продуктом является не биомасса, а продукт
метаболизма.
Обычно для оптимального протекания процессов
биосинтеза продуктов метаболизма требуются
условия,
отличающиеся
от
фазы
роста
микроорганизмов:
более
низкая
скорость
протока, меньшая концентрация в среде
лимитирующего субстрата.
В этом случае в
первом
аппарате
поддерживают
условия,
оптимальные для роста микроорганизмов, а во
втором — для биосинтеза продуктов метаболизма
78. Непрерывное культивирование с внешним регулированием параметров
турбидостат;респиростат;
рН-стат;
теплостат;
оксистат;
нутристат
79. Турбидостат
Скорость разбавления в аппарате неподдерживается на постоянном уровне, а
регулируется
в
зависимости
от
концентрации биомассы.
способ измерения концентрации биомассы —
определение степени поглощения светового
потока
суспензией.
Он
называется
турбидиметрическим.
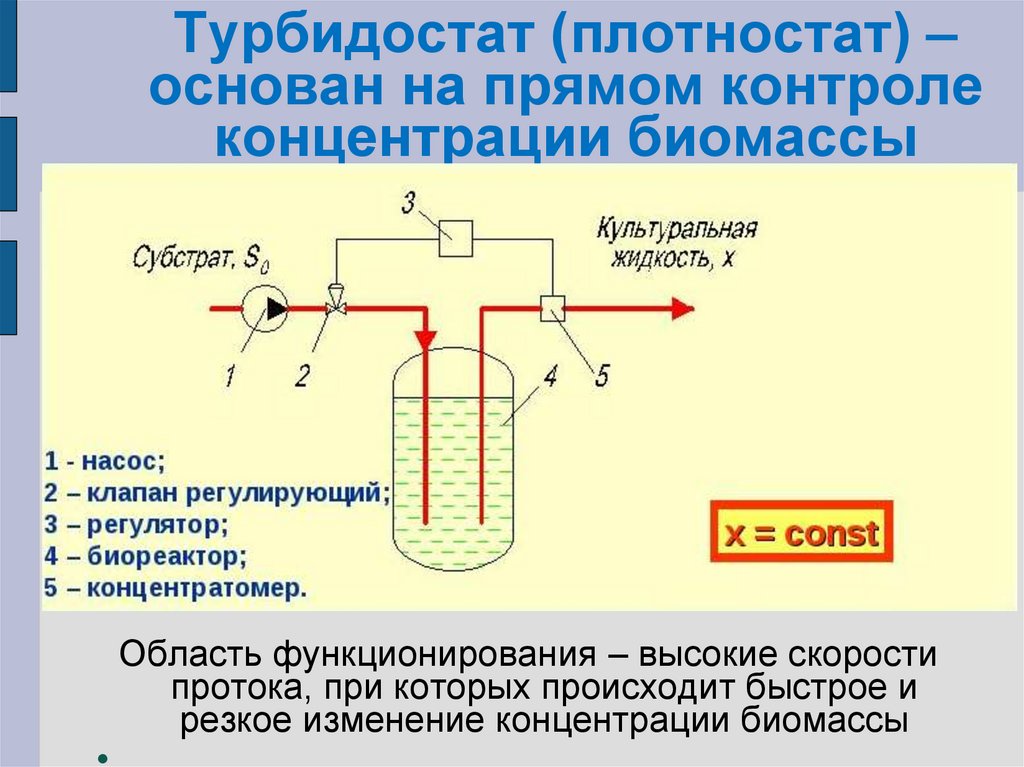
80. Турбидостат (плотностат) – основан на прямом контроле концентрации биомассы
Турбидостат (плотностат) –основан на прямом контроле
концентрации биомассы
Область функционирования – высокие скорости
протока, при которых происходит быстрое и
резкое изменение концентрации биомассы
81. Респиростат
с помощью газоанализаторов кислородаили углекислого газа можно измерять
интенсивность дыхания культуры
регулируя интенсивность дыхания, можно
регулировать и концентрацию биомассы, а
следовательно, скорость подачи субстрата
82. Лучше не поддерживать дыхание на постоянном уровне, а все время искать скорость разбавления, обеспечивающую его максимум
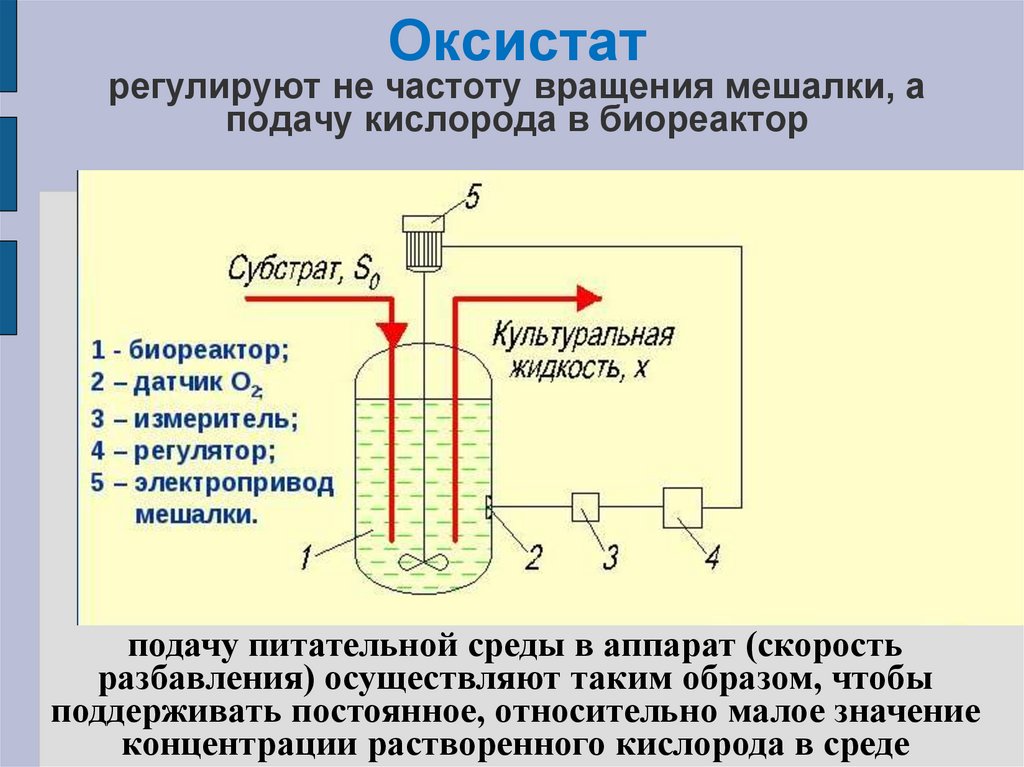
83. Оксистат регулируют не частоту вращения мешалки, а подачу кислорода в биореактор
подачу питательной среды в аппарат(скорость
разбавления)
осуществляют
таким образом, чтобы поддерживать
постоянное, относительно малое значение
концентрации растворенного кислорода в
среде
подачу питательной среды в аппарат (скорость
разбавления) осуществляют таким образом, чтобы
поддерживать постоянное, относительно малое значение
концентрации растворенного кислорода в среде
84. рН-стат
Ростмикроорганизмов
зачастую
сопровождается
выделением
в
среду
некоторых кислот (закислением). Замедление
же роста при недостатке субстрата вызывает,
наоборот,
защелачивание
культуры,
выражающееся в повышении рН. В некоторых
процессах величина рН используется как
параметр, в зависимости от которого в
аппарат подается питательная среда.
85.
Скорость подачи субстрата регулируетсятаким образом, чтобы величина рН
поддерживалась на некотором постоянном
уровне.
Исключают регулирование рН другими
способами — подачей в аппарат щелочи
или кислоты.
86. Нутристат
подача питательной среды в аппаратосуществляется так, чтобы поддерживать
заданное значение концентрации субстрата
S
87.
Трудноподдерживать
необходимую
концентрацию в зоне ингибирования роста,
если
эта
повышенная
концентрация
способствует
оптимальной
скорости
биосинтеза продукта метаболизма.
Этот способ имеет неудобство: необходимо
непрерывно
измерять
концентрацию
субстрата в аппарате, что не всегда просто
осуществить
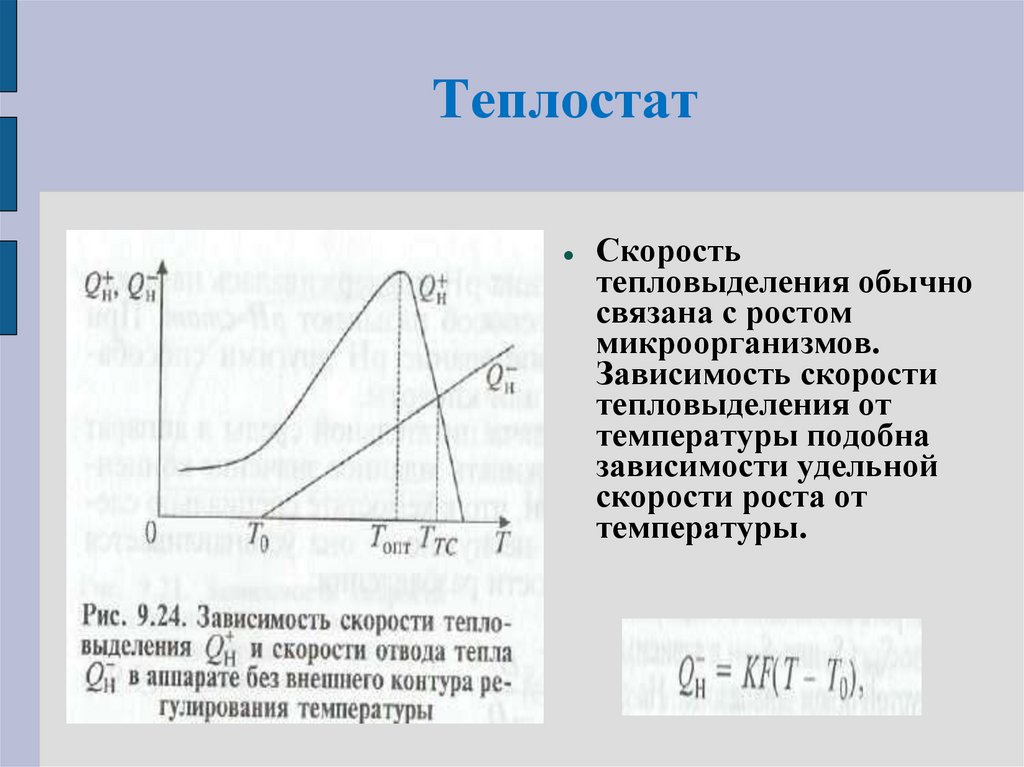
88. Теплостат
Скоростьтепловыделения обычно
связана с ростом
микроорганизмов.
Зависимость скорости
тепловыделения от
температуры подобна
зависимости удельной
скорости роста от
температуры.
89. Преимущества и недостатки непрерывного способа культивирования микроорганизмов
ПРЕИМУЩЕСТВАРост биомассы можно поддерживать
неопределенно долго.
2. Можно исключить влияние физических или
химических факторов на рост и на
образование продукта при постоянной
скорости роста.
3. Можно за счет разбавления поддерживать
постоянную концентрацию биомассы.
4. Можно длительно поддерживать рост,
лимитированный
одним
заданным
субстратом,
и
изучать
влияние
лимитирования на состав клеток и их
активность.
1.
90. Преимущества:
5. Состав среды можно оптимизировать методомимпульсных добавок.
6. При непрерывном культивировании удобно
определять кинетические константы, выход
биомассы.
7. Результаты, полученные при непрерывном
культивировании, часто более надежны и
воспроизводимы,
чем
в
периодическом
процессе.
8. Процесс имеет большую производительность и
относительно малое непродуктивное время
(лишь в период запуска).
9. Облегчены механизация и автоматизация.
10. При постоянстве технологических режимов
постоянно и качество продукта.
91. Преимущества:
11. Невысокий износ измерительных приборов всвязи со стерилизацией
12. Снижается опасность контакта обслуживающего
персонала с микроорганизмами.
13. Непрерывные процессы можно использовать для
автоселекции микроорганизмов.
Недостатки:
1. Меньшая гибкость, регулировать можно лишь
некоторые параметры (скорость разбавления,
среду, концентрацию кислорода, температуру).
2. Более высокие требования к постоянству качества
сырья.
3. Большие капитальные вложения (непрерывная
стерилизация среды, автоматизация и т. д.).
92. Недостатки:
4. Трудно обеспечить непрерывное дозированиенерастворимых твердых субстратов
5. Больше опасность инфицирования из-за большей
длительности культивирования.
6. Возможность «вырождения» культуры (за счет
автоселекции) из-за большого времени
культивирования.
7. Не всегда можно достичь оптимального выхода
продуктов метаболизма, не связанных с ростом.
8. Пристеночный рост и агрегатирование клеток
могут вызвать вымывание культуры из
аппарата.
9. Трудно культивировать в непрерывном режиме
мицелиальные культуры из-за их вязкости и
гетерогенности.


































































 biology
biology








