Similar presentations:
Промышленное получение микробной биомассы и метаболитов
1.
Объекты биотехнологии и ихпромышленное использование
Лекция 3. Промышленное получение
микробной биомассы и метаболитов
Доцент кафедры микробиологии, канд. биол наук
Василенко Светлана Леонидовна
1
2.
Процессыпромышленной
биотехнологии
принято
подразделять на 2 большие группы: производство
биомассы и получение продуктов метаболизма.
Производство микробной биомассы – самое крупное
микробиологическое производство.
Микробные клетки сами по себе могут служить конечным
продуктом производственного процесса.
2
3.
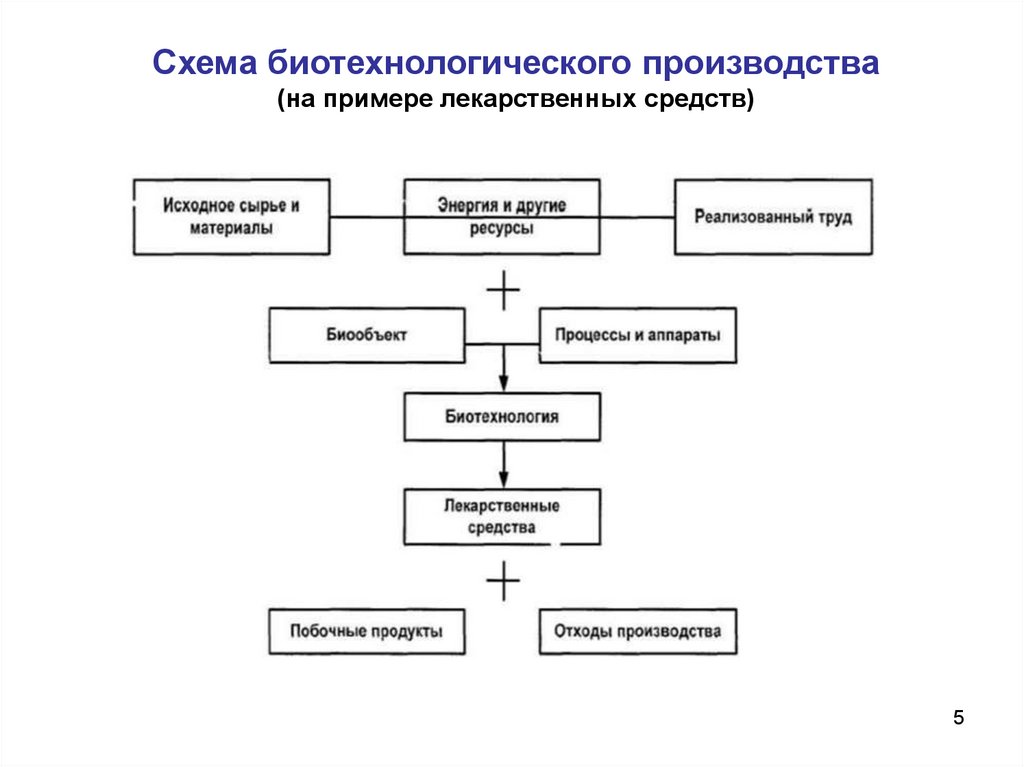
Биотехнологическое производствоТехнологический процесс биотехнологического производства
представляет
собой
совокупность
взаимосвязанных
технологическими
потоками
операций,
обеспечивающих
переработку исходных материалов в готовый продукт.
Выделяют
5
стадий,
этапов,
биотехнологического производства.
или
операций,
Две начальные стадии включают подготовку необходимой
культуры
микроорганизма-продуцента
(т.е.,
биологически
действующего
начала),
сырья
и
оборудования.
При
осуществлении микробиологического синтеза необходимы
стадии обработки сырья, приготовления питательной среды,
стерилизация воздуха, поддержания чистой культуры и
приготовления посевного материала, которая могла бы
постоянно или по мере необходимости использоваться в
процессе.
3
4.
Биотехнологическое производствоТретья стадия - стадия ферментации, на которой происходит
образование целевого продукта (биотехнологическая стадия). На
этой стадии идет микробиологическое превращение компонентов
питательной среды сначала в биомассу, затем, если это необходимо,
в целевой метаболит.
На четвертом этапе из культуральной жидкости выделяют и
очищают целевые продукты. Процессы выделения и очистки, часто
занимающие важное место среди др. технологических операций,
определяются химической природой получаемого вещества и могут
включать
экстракционные
и
хроматографические
методы,
кристаллизацию, фильтрацию, осаждение и др.
Заключительная стадия промышленного
приготовление товарных форм продуктов.
производства
-
Общим свойством большинства продуктов микробиологического
синтеза является их недостаточная стойкость к хранению,
следовательно, на заключительной стадии производства крайне
важны способы стабилизации и консервации целевых продуктов.
4
5.
Схема биотехнологического производства(на примере лекарственных средств)
5
6.
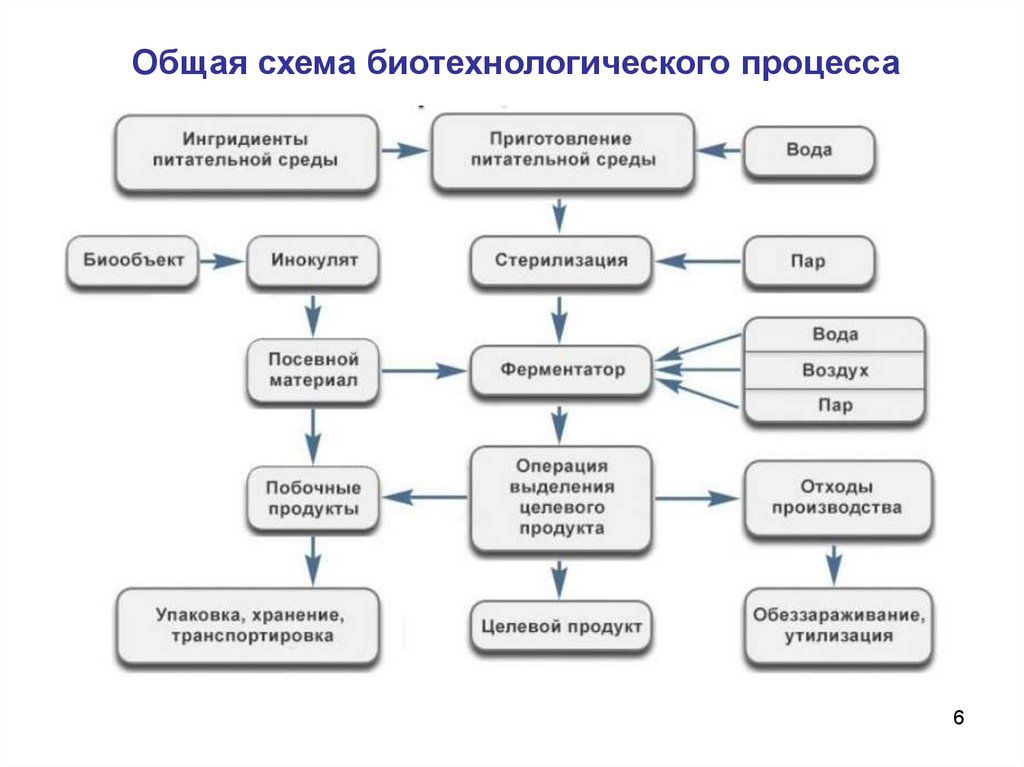
Общая схема биотехнологического процесса6
7.
Центральной среди этапов промышленного производстваявляется стадия ферментации.
Под
ферментацией
понимают
всю
совокупность
последовательных
операций
от
внесения
в
заранее
приготовленную и термостатированную среду инокулята до
завершения
процессов
роста,
биосинтеза
или
биотрансформации.
Выбор процесса ферментации зависит не только от
потребностей организма, но и от того, для чего будет
использована культура, то есть, от конечной цели
эксперимента.
7
8.
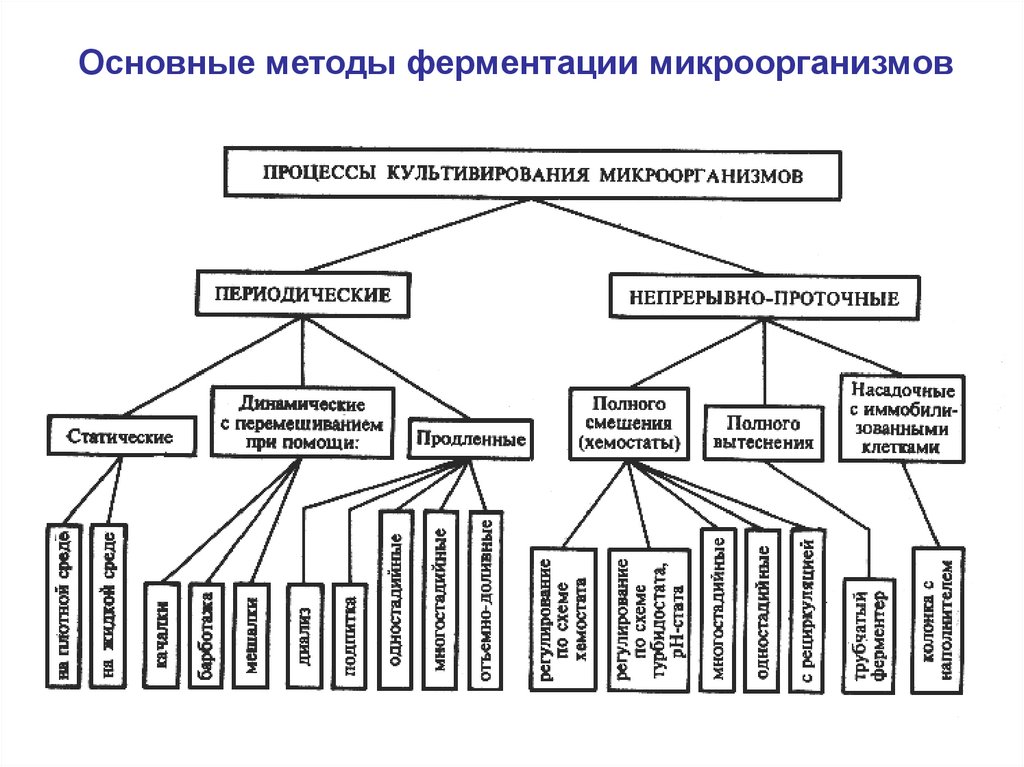
Классификация процессов ферментации- по состоянию питательной среды или по основной фазе
(поверхностные и глубинные; твердофазные и жидкофазные);
- по наличию или отсутствию перемешивания (динамические
или статические);
- по содержанию кислорода (на аэробные, анаэробные и
факультативно-анаэробные);
- по способу действия (закрытые, чаще периодические, и
открытые, чаще непрерывные);
- по количеству ферментеров (одно-, дву- и многостадийные);
- по способу управления (хемостатные, турбидостатные,
оксистатные, рН-статные и другие);
- по степени защищенности от посторонней микрофлоры
(асептические, условно асептические и неасептические );
- по числу видов микроорганизмов.
8
9.
Основные методы ферментации микроорганизмов9
10.
Ферментация микроорганизмовна твердой поверхности
Преимущества:
1. В случае культур, выращенных на твердой среде, нет
необходимости использовать оборудование для сбора клеток,
поскольку в этих культурах клетки находятся уже в
сконцентрированном состоянии.
2.
Твердые
культуры
относительно
свободны
от
макромолекулярных компонентов и полностью свободны от
частиц питательной среды.
3. На твердых средах можно получать результаты, которые
невозможно достичь другим путем.
10
11.
Ферментация микроорганизмовна твердой поверхности
Недостатки:
1. Твердая культура имеет ограничения при выращивании
больших количеств биомассы.
2. Твердые культуры не обеспечивают однородность
популяции клеток, т. е. культура гетерогенна в физиологическом
отношении. Гетерогенна культура и в техническом смысле, так
как клетки микроорганизмов и питательная среда распределены
неравномерно.
3. Твердые культуры характеризуются небольшим числом
клеток в пересчете на данное количество среды.
11
12.
Ферментация микроорганизмовна твердой поверхности
Твердофазная ферментация используется в основном для
выращивания грибов. В качестве твердой фазы могут выступать
различные виды растительного сырья.
1. Дешевое производство и возможность использования
субстратов, которые непригодны для других способов
культивирования.
2. Некоторые процессы протекают значительно интенсивнее.
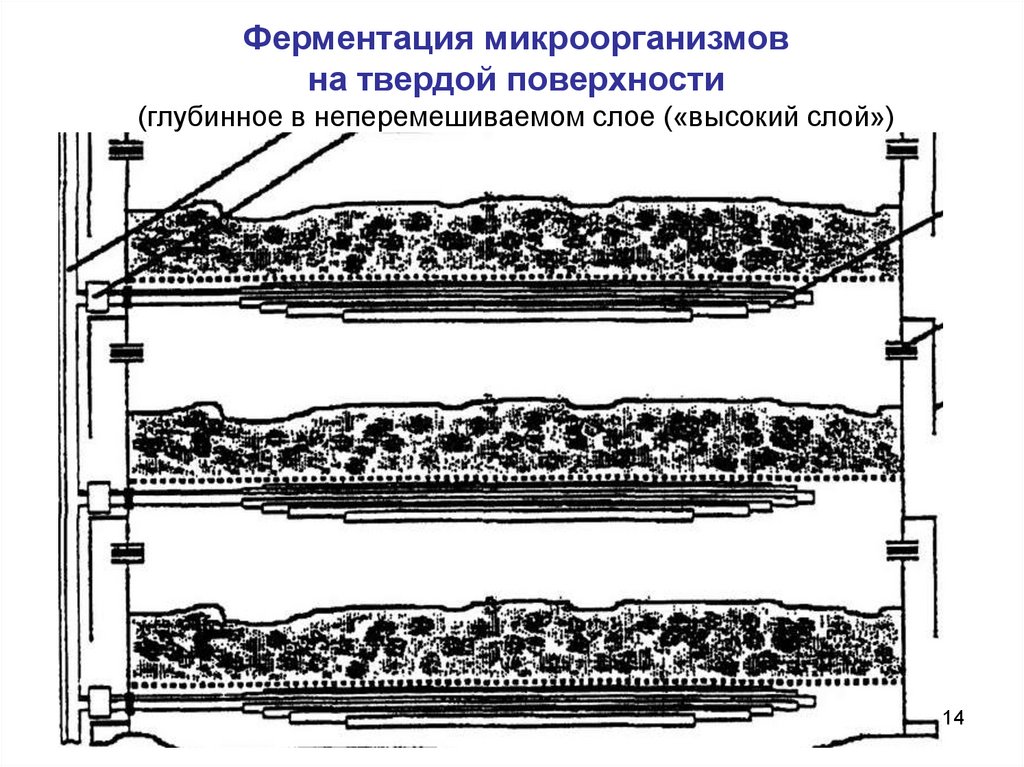
Варианты твердофазной ферментации:
1. Поверхностное («тонкий слой»),
2. Глубинное в неперемешиваемом слое («высокий слой»),
3. Выращивание в перемешиваемой и аэрируемой массе.
12
13.
Ферментация микроорганизмовна твердой поверхности (поверхностное («тонкий слой»)
13
14.
Ферментация микроорганизмовна твердой поверхности
(глубинное в неперемешиваемом слое («высокий слой»)
14
15.
Ферментация микроорганизмовна твердой поверхности
(выращивание в перемешиваемой и аэрируемой массе)
15
16.
Преимуществами твердофазной ферментации являются:- простота конструкций биореакторов (растильных или
бродильных камер),
- простота систем подачи воздуха
- простота
режима.
регулирования
температурно-влажностного
Недостатками твердофазной ферментации являются:
- низкая эффективность использования субстрата
- низкая продуктивность;
- сложность механизации
культивирования,
и
автоматизации
процесса
- сложность стерилизации,
- сложность загрузки-разгрузки лотков и кювет и др.
16
17.
Производство уксусаВ Германии разработан метод производства уксуса твердофазным
способом (в 1823 г. Шуценбахом продана данная технология).
Суть ее – затор (специальным образом подготовленное сырье,
содержащее низкомолекулярные углеводы), содержащий этанол,
стекает сверху вниз в башенном ацетаторе, сквозь большой слой
буковой стружки, тщательно вымоченной в уксусе, в то время как
снизу поступает свежий воздух. Для загрузки в аппараты используют
только буковые стружки, закрученные в рулон диаметром от 2 до 5 см
и высотой от 3 до 6 см. Они служат уксуснокислым бактериям
основой с большой поверхностью и покрываются толстым слоем этих
бактерий. Серьезные требования предъявляются и к древесине. Она
должна быть совершенно лишена любых видов гнили, так же можно
сказать, что по этой и другим причинам стружки для уксусного
производства имеют довольно высокую стоимость.
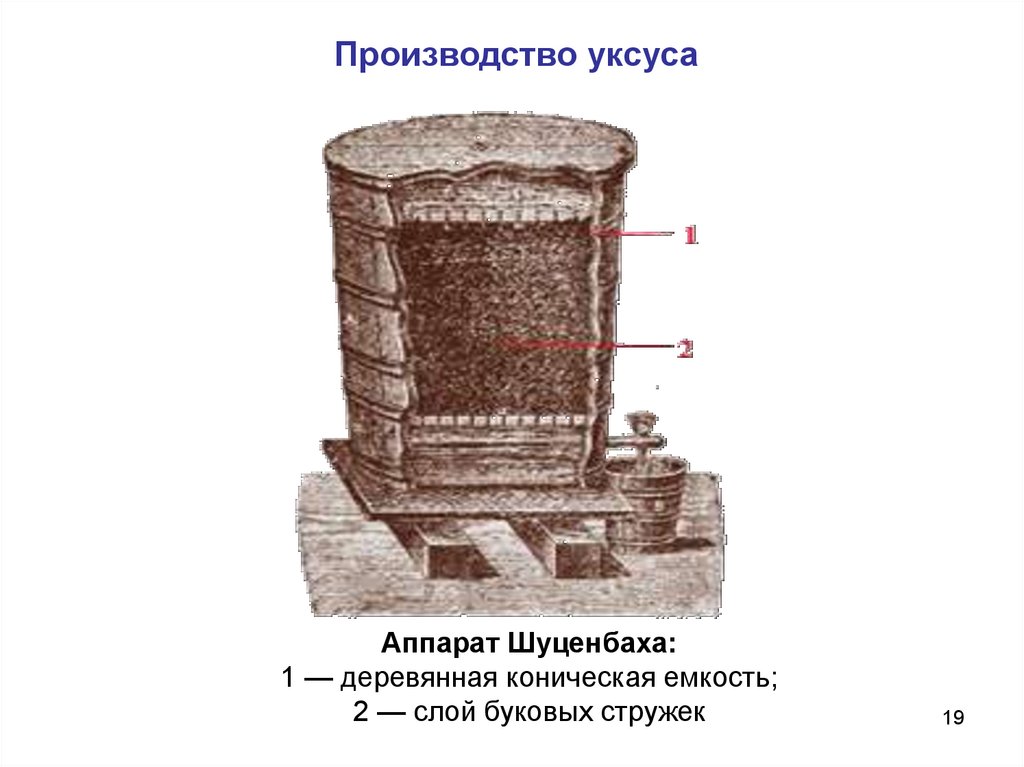
Основным аппаратом, в котором получают уксусную кислоту по
методу Шуценбаха, является деревянный чан конической формы. На
расстоянии 200 - 300 мм от основного днища в нем устанавливают
горизонтальную перфорированную перегородку.
17
18.
Производство уксусаВерхняя часть аппарата на 2/3 заполняется стружками,
которые орошаются питательной для бактерий средой,
содержащей некоторое количество уксусной кислоты (чаще
всего это 6%-ный раствор), этиловый спирт (3-4%) и небольшое
количество аммонийных и фосфатных солей.
По мере протекания раствора бактерии, закрепившиеся, или
иммобилизованные на стружках, окисляют спирт в уксусную
кислоту. В нижней части аппарата скапливаются готовая
продукция - 9%-ный уксус.
В процессе окисления выделяется тепло, которое повышает
температуру внутри аппарата до 30-35°С. В результате разницы
температур создается естественная и довольно интенсивная
конвекция. Воздух поступает в патрубки под ложным днищем,
проходит через аппарат и выходит в верхней его части. Так сама
собой осуществляется аэрация, необходимая для работающих
бактерий.
18
19.
Производство уксусаАппарат Шуценбаха:
1 — деревянная коническая емкость;
2 — слой буковых стружек
19
20.
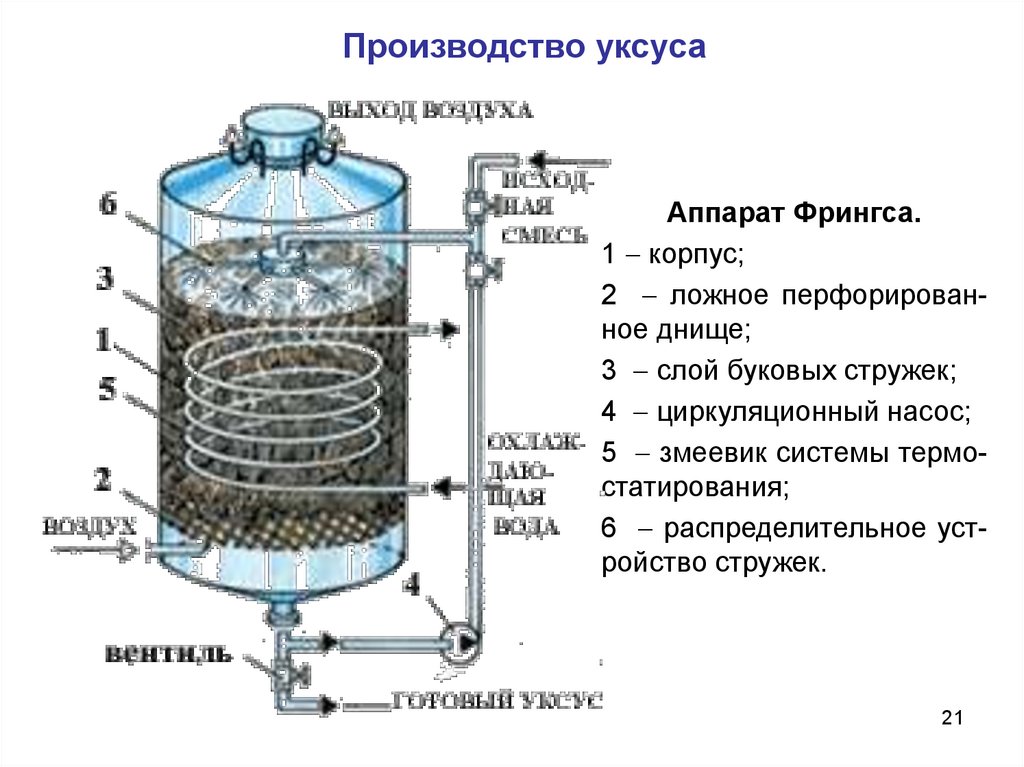
Производство уксусаСпособу Шуценбаха аналогичен циркуляционный способ
Фрингса, в настоящее время на подавляющем большинстве
предприятий производство уксуса ведется именно этим способом.
Эта технология имеет немало общего с методом Шуценбаха.
Здесь также используются аппараты, наполненные стружками, также
на стружках иммобилизованы уксуснокислые бактерии, и также
масса стружек орошается питательным раствором, содержащим
спирт, уксусную кислоту и минеральные соли.
Однако есть и существенные различия между этими методами.
Прежде всего, это касается размера аппаратов. На некоторых
предприятиях объем их заполнения стружками рабочей камеры
достигает 60 м3.
В такой аппарат через специальную распределительную систему
подают 10%-ный раствор спирта со скоростью в несколько раз
большей, чем по методу Шуценбаха. При помощи насоса раствор
многократно циркулирует через аппарат до тех пор, пока весь спирт
не окислиться и не образуется 9%-ный раствор кислоты.
Около 10% исходного чистого спирта в этом процессе теряется.
20
Цикл длится 5 - 6 дней, после чего повторяется.
21.
Производство уксусаАппарат Фрингса.
1 корпус;
2 ложное перфорированное днище;
3 слой буковых стружек;
4 циркуляционный насос;
5 змеевик системы термостатирования;
6 распределительное устройство стружек.
21
22.
Ферментеры для производства уксуса22
23.
Вповерхностных
твердофазных
процессах
роль
биореакторов выполняют большие, площадью до нескольких кв.
метров,
лотки,
или
подносы,
из
алюминия
или
культивационные камеры.
При твердофазной ферментации процесс протекает в
вентилируемых растильных камерах, в которых на стеллажах
размещают лотки с твердой средой. Для лучшей аэрации среды
подаваемый в камеру увлажненный стерильный воздух проходит
через перфорированное днище лотков.
В большинстве твердофазных процессов отсутствует
перемешивание, рост микроорганизмов происходит по принципу
колонизации: по мере размножения они распространяются из
точек внесения в субстрат по всему его объему.
При этом отдельные зоны в толще субстрата избыточно
населяются клетками и возникает локальная нехватка
питательных ресурсов, значительная часть субстрата остается
нетронутой
23
24.
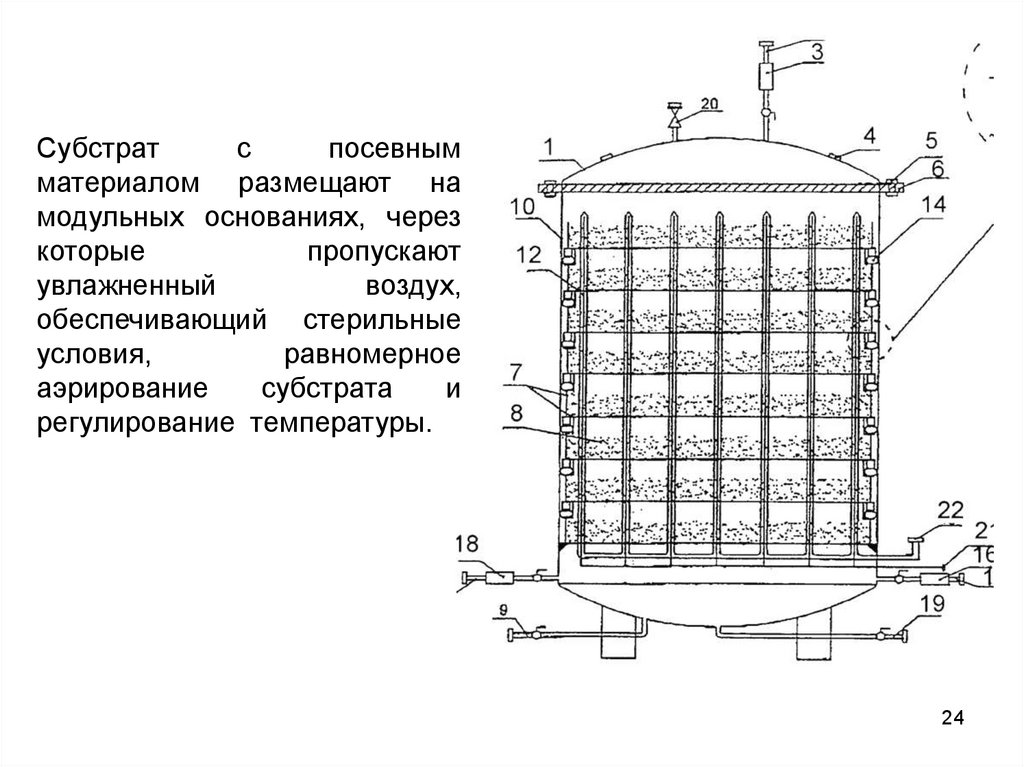
Субстратс
посевным
материалом размещают на
модульных основаниях, через
которые
пропускают
увлажненный
воздух,
обеспечивающий стерильные
условия,
равномерное
аэрирование
субстрата
и
регулирование температуры.
24
25.
2526.
2627.
2728.
Поверхностные жидкофазные процессыДля выращивания мицелиальных грибов при получении
органических кислот, ферментных препаратов, кормовой
биомассы в биотехнологических производствах используют
поверхностные жидкофазные процессы.
Для
этих
целей
применяется
кюветный
способ
ферментации. Среда загружается в стерильные кюветы,
размещаемые на открытых стеллажах в растильных камерах с
регулируемым температурно-влажностным режимом.
Вентиляцию помещений осуществляют очищенным и
стерильным воздухом, который одновременно выполняет
функцию теплового агента.
Микроорганизмы растут в виде пленки
поверхности жидкой питательной среды.
биомассы
на
После завершения процесса культуральная жидкость
сливается из кювет через вмонтированные в днища штуцеры и
поступает на обработку.
28
29.
Простейшая классификация процессовсуспензионной глубинной ферментации
1) периодическая ферментация;
2)
продленная
оптимизированная
ферментация с подпиткой или диализом;
периодическая
3) многоциклическая ферментация;
4) полунепрерывная ферментация;
5) непрерывно-синхронная ферментация;
6) непрерывная ферментация.
29
30.
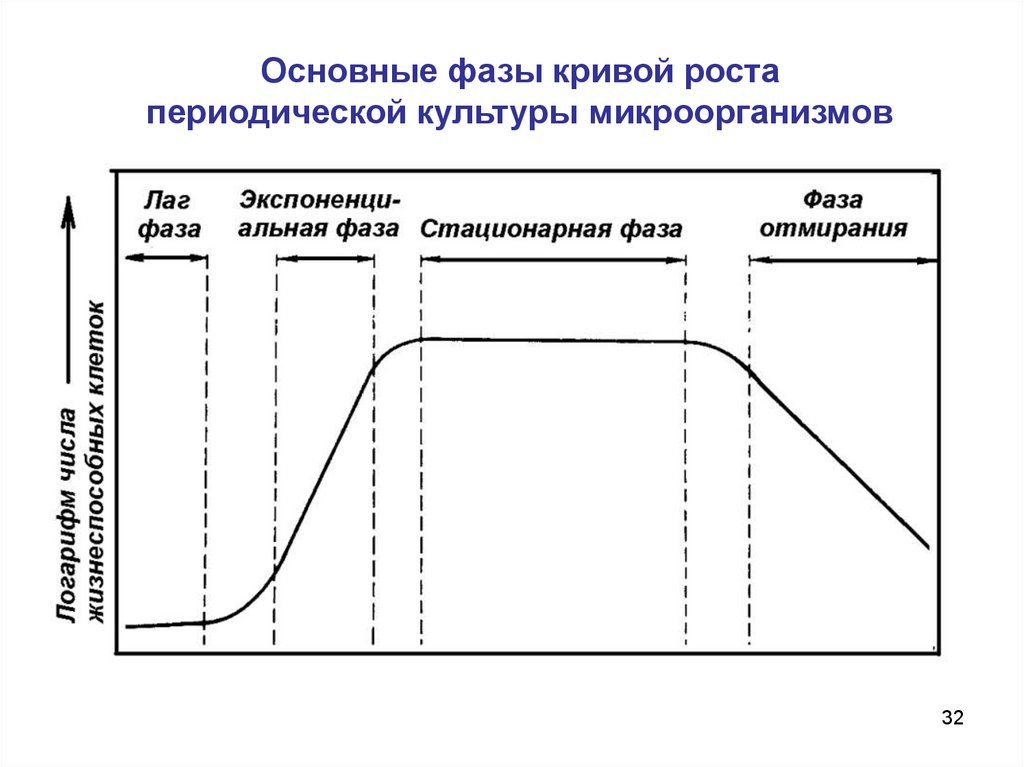
Периодическая ферментацияПериодический
метод
ферментации
предусматривает
внесение посевного материала в питательную среду (инокуляция
клетками среды) в начале процесса и получение культуры по
достижении заданной фазы развития популяции.
Концентрация микроорганизмов в периодической культуре
нарастает и останавливается либо из-за лимитирования
субстратом, либо из-за ингибирования токсичными
продуктами жизнедеятельности.
Практически все
являются закрытыми.
системы
периодической
ферментации
30
31.
Периодическая ферментацияПри изучении динамики роста культур микроорганизмов
необходимо строго соблюдать некоторые условия:
1) жизнеспособность засева;
2) наличие в среде культивирования всех необходимых
питательных веществ;
3) отсутствие в среде ингибиторов, подавляющих рост клеток;
4) поддержание в
химических условий.
среде
оптимальными
всех
физико-
31
32.
Основные фазы кривой ростапериодической культуры микроорганизмов
32
33.
Под урожаем клеток (Х) понимают разность междумаксимальной и исходной массой бактерий:
X = Xmaх – Хо.
Особенно важно отношение урожая клеток к количеству
потребленного субстрата (X/S). Если обе эти величины
выражают в весовых единицах, то отношение Х/S,
называемое экономическим коэффициентом, обозначают
через Y :
Y = dХ/dS,
где dX – увеличение биомассы,
потреблению субстрата в количестве dS.
соответствующее
Важность экономического коэффициента состоит в том,
что он выражает количественные потребности организма в
пище.
33
34.
Если же урожай (в граммах) относят к числу молейпотребленного субстрата, то экономический коэффициент,
называемый в этом случае молярным экономическим
коэффициентом, обозначают через Уm.
Молярный экономический коэффициент позволяет связать
урожай клеток с полученным из какого-либо источника энергии
(какого-либо субстрата) количеством АТФ.
УАТФ энергетический коэффициент, выражающийся в граммах
клеточной массы на 1 моль АТФ.
Скорость потребления субстрата культурой в данный момент
времени выражается соотношением:
dS/dT = qX,
где X – биомасса, а коэффициент q известен как
метаболический коэффициент или удельная скорость
метаболизма. Метаболический коэффициент можно выразить
также через экономический коэффициент и удельную скорость
роста и представить в таком виде:
34
q = /Y.
35.
Если удовлетворены все необходимые требования, то втечение единицы времени dt увеличение биомассы dX должно
быть пропорционально количеству биомассы X и интервалу
времени, т. е.:
dX = Х dt,
откуда
dХ/dt = Х или = dХ/dt 1/X
Дифференциальное отношение dХ/dt выражает скорость
роста популяции клеток. Параметр , обозначающий скорость
роста единицы биомассы (1/Х) (dХ/dt), называется удельной
скоростью роста.
35
36.
Для того, чтобы рассчитать время генерации клеток можноиспользовать уравнение, учитывая геометрическую прогрессию
роста:
N = No 2n , откуда lgN = lgNo + n lg2,
где N число клеток.
Отсюда число клеточных делений (n) составит:
n = lgN lgN0 / lg2
Константа скорости деления или число клеточных делений
в единицу времени t-to можно вычислить по формуле: ν=n/t,
а время одной генерации (g) по формуле:
g=t/n=1/ν
36
37.
Многоциклическая ферментацияМногоциклическими процессами ферментации называют
такие, в которых цикл выращивания культуры повторяется
многократно без многократной стерилизации емкости.
Зависимость концентрации микроорганизмов и удельной
скорости роста от времени в каждом цикле многоциклического
процесса
имеет
характер,
аналогичный
таковому
в
периодическом процессе.
Продленная периодическая оптимизированная
ферментация
Продленный периодический процесс, как и периодический,
предусматривает одноразовую загрузку и разгрузку ферментера.
Однако цикл развития микроорганизмов в продленном
периодическом процессе удлиняется либо за счет подпитки
(периодической или непрерывной), либо за счет длительного
37
удержания клеток в системе (диализ).
38.
Продленная периодическая оптимизированнаяферментация
Продленный периодический процесс, как и периодический,
предусматривает одноразовую загрузку и разгрузку ферментера.
Однако цикл развития микроорганизмов в продленном
периодическом процессе удлиняется либо за счет подпитки
(периодической или непрерывной), либо за счет длительного
удержания клеток в системе (диализ).
38
39.
Ферментация с подпиткойЕсли зависимость удельной скорости роста от количества
субстрата имеет насыщение, то исходную концентрацию
субстрата можно задать сразу побольше в пределах плато, где
влияние субстрата на скорость роста биомассы невелико или
вообще отсутствует. В этом случае пока концентрация субстрата
не снизится до критического уровня подпитку можно не
производить.
Если зависимость удельной скорости роста биомассы от
концентрации субстрата имеет экстремум, то подпитка
требуется уже с самого начала процесса для поддержания его на
оптимальном уровне.
Подпитка может осуществляться импульсно или по каплям в
течение всего процесса.
39
40.
Ферментация с подпиткойПрактически получается, что скорость подпитки возрастает во
времени по экспоненте. И концентрация биомассы возрастает по
экспоненте из-за почти постоянной удельной скорости роста при
постоянной величине субстрата. Такие культуры часто называют
«расширенными» или «экспоненциальными».
Варианты способ управления подпиткой:
1. Заранее рассчитывается программа изменения подпитки во
времени, и субстрат подается в аппарат без информации о том, с
какой скоростью его потребляет культура. Это может привести
как к избытку, так и к недостатку субстрата в среде.
2. Субстрат подается по одному из косвенных параметров,
связанных с ростом культуры.
40
41. Диализные системы
Ферментация с повторяющимися подпиткамиДиализные системы
Диализ – исторический первый метод очистки – был
предложен Т. Грэхемом в 1861 г. для удаления из системы
низкомолекулярных веществ.
Суть этого метода заключается в том, что культура
развивается в пространстве, ограниченном полупроницаемой
мембраной, а продукты диффундируют во внешний раствор.
Диализные мембраны
Для ферментации с диализом используются мембраны,
отличающиеся размером пор. Диализные мембраны
задерживают клетки и макромолекулы, но проницаемы для
таких мелких молекул, как основные питательные компоненты,
требующиеся микроорганизмам для их роста.
Диализные мембраны изготавливают из пергамента,
целлофана, ацетатцеллюлозы, полиамида, поликарбоната,
кремния и др.
41
42.
Для микробиологических целей следует принимать вовнимание такие факторы, как автоклавируемость мембран,
размер их пор, высокий уровень отсечки, химическая
инертность и проницаемость (которая в свою очередь
определяется пористостью, емкостью и толщиной мембраны),
а также наибольший экономический коэффициент.
Преимущества процесса диализа:
1) работа в мягких условиях температуры и рН;
2) отсутствие органических растворителей;
3) возможность высокой степени очистки клеток от
примесей низкомолекулярных соединений, солей и металлов.
Недостатки:
1) возможность
забивания их пор;
обрастания
диализных
мембран
и
2) низкая скорость диализа, определяемая молекулярной
диффузией
42
43.
Для повышения эффективности диффузионного способаферментации объем диализной жидкости должен быть
значительно больше объема диализуемой культуры, или
же диализную жидкость следует менять.
Кроме того, мембраны должны иметь достаточную
площадь,
чтобы
обеспечивалась
удовлетворительная
скорость диффузии. Система культивирования с диализом
может действовать in vivo или in vitro в периодическом и
непрерывном режимах или при их сочетании.
43
44.
Кспецифическим
преимуществам
использования
диализа при выращивании микроорганизмов относятся:
1) удлинение экспоненциальной фазы роста в
периодической культуре, что позволяет получать высокие
плотности живых клеток;
2) увеличение стационарной фазы роста культур, что
позволяет увеличить выход метаболитов, связанных с этой
фазой;
3) удаление или разведение ингибирующих продуктов
метаболизма;
4) установление состояния
уровнем метаболизма;
равновесия
с
высоким
5) получение метаболитов, свободных от клеток, и,
наоборот, клеток, свободных от макромолекул среды.
44
45.
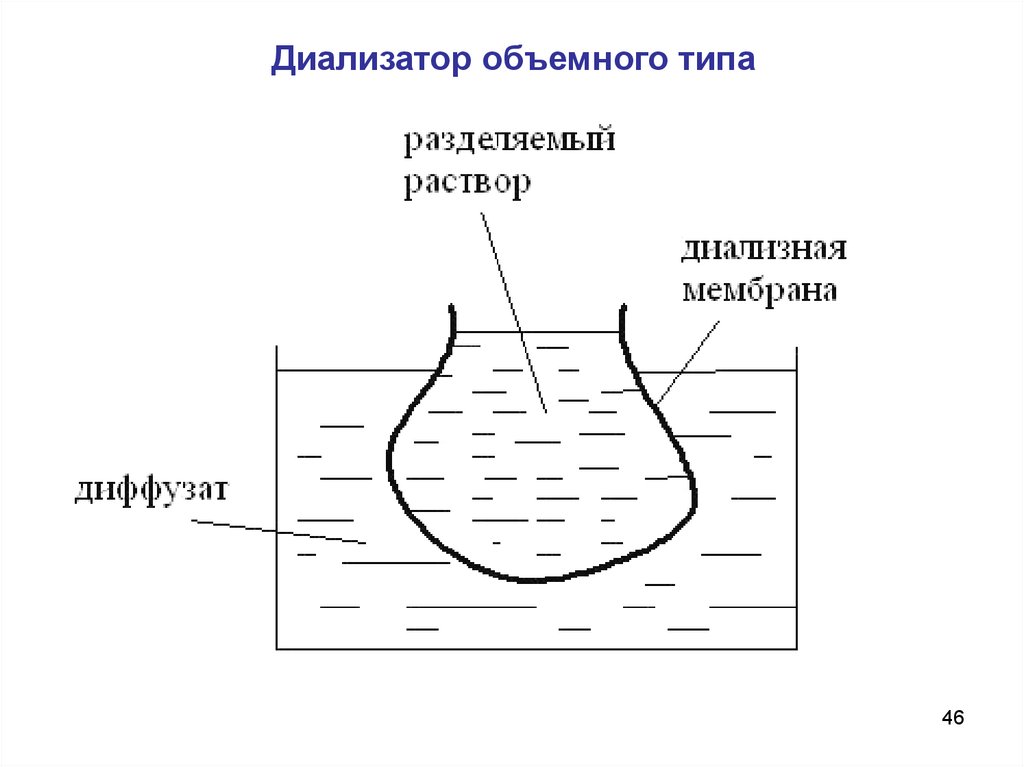
Типы диализаторов.Диализатор объемного типа
Конструкция диализатора такого типа чрезвычайно проста и
представляет собой «мешок» из диализной мембраны,
погруженный в диффузат.
Достоинствами такой конструкции является крайняя простота
и дешевизна. Но аппараты данной конструкции имеют ряд
существенных недостатков.
Во-первых, в таком аппарате малая удельная поверхность и
довольно большая толщина мембран для обеспечения их
механической прочности.
Во-вторых, процесс диализа протекает крайне медленно, т.к.
и диализат, и разделяемый раствор неподвижны и мембраны
имеют большую толщину.
45
46.
Диализатор объемного типа46
47.
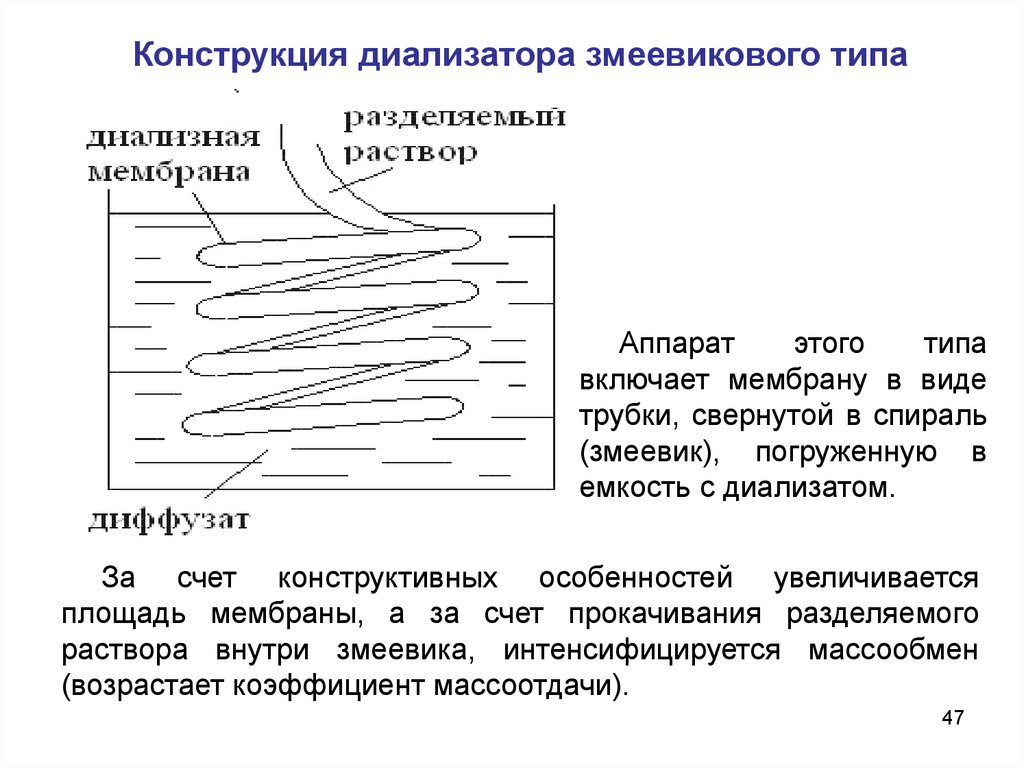
Конструкция диализатора змеевикового типаАппарат
этого
типа
включает мембрану в виде
трубки, свернутой в спираль
(змеевик), погруженную в
емкость с диализатом.
За счет конструктивных особенностей увеличивается
площадь мембраны, а за счет прокачивания разделяемого
раствора внутри змеевика, интенсифицируется массообмен
(возрастает коэффициент массоотдачи).
47
48.
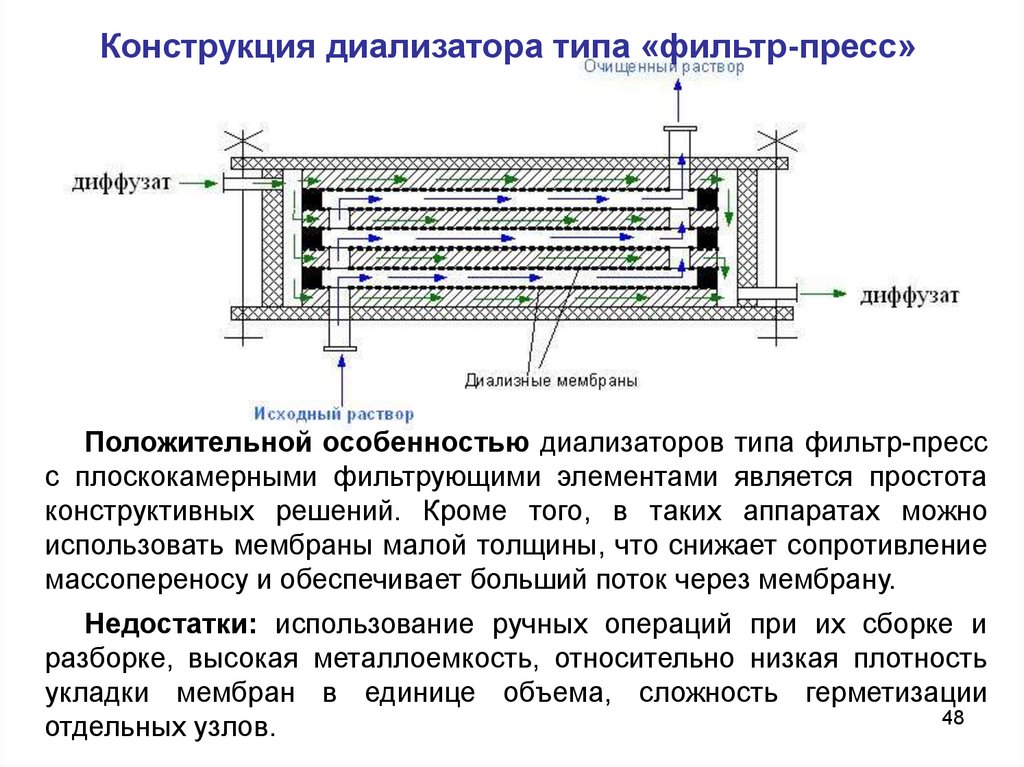
Конструкция диализатора типа «фильтр-пресс»Положительной особенностью диализаторов типа фильтр-пресс
с плоскокамерными фильтрующими элементами является простота
конструктивных решений. Кроме того, в таких аппаратах можно
использовать мембраны малой толщины, что снижает сопротивление
массопереносу и обеспечивает больший поток через мембрану.
Недостатки: использование ручных операций при их сборке и
разборке, высокая металлоемкость, относительно низкая плотность
укладки мембран в единице объема, сложность герметизации
48
отдельных узлов.
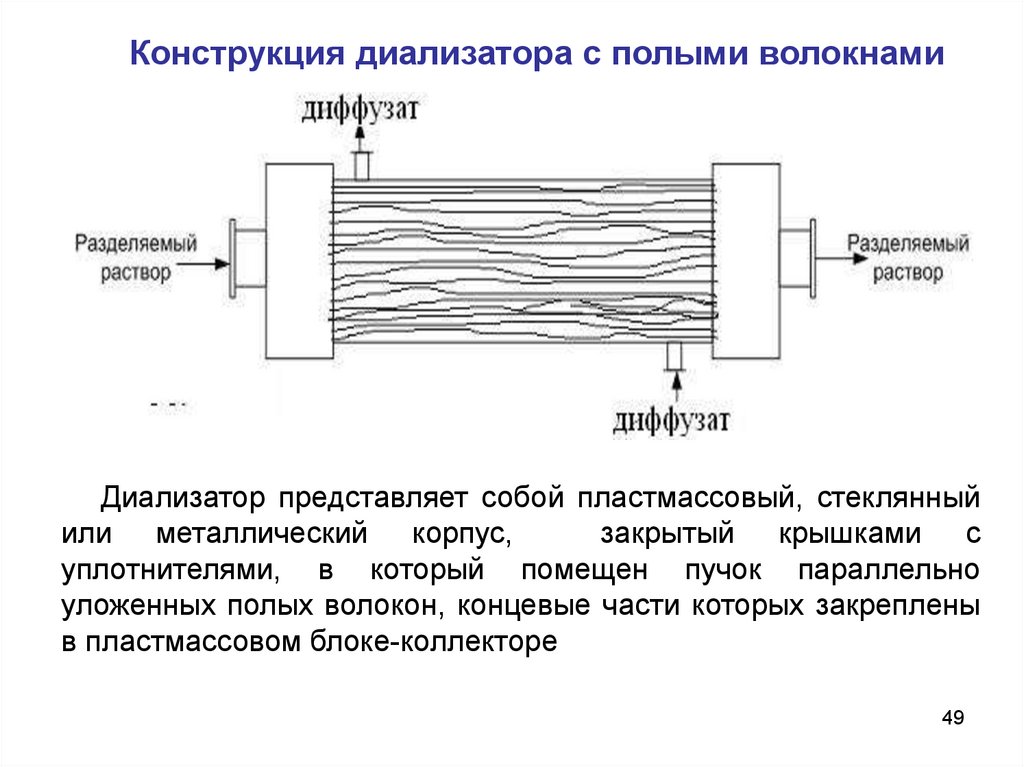
49. Конструкция диализатора с полыми волокнами
Диализатор представляет собой пластмассовый, стеклянныйили металлический корпус,
закрытый крышками с
уплотнителями, в который помещен пучок параллельно
уложенных полых волокон, концевые части которых закреплены
в пластмассовом блоке-коллекторе
49
50.
В лабораторной и производственной практике диализныекультуры применяются в основном в трех случаях:
1) для концентрирования недиффундирующего продукта,
2) для уменьшения концентрации диффундирующего
токсического продукта,
3)
для
накопления
и
отделения
от
клеток
диффундирующего продукта.
Преимущества процесса диализа:
1) работа в мягких условиях температуры и рН;
2) отсутствие органических растворителей;
3) возможность высокой степени очистки клеток от
примесей низкомолекулярных соединений, солей и металлов.
Недостатки:
1) возможность обрастания диализных мембран и
забивания их пор;
2) низкая скорость диализа, определяемая молекулярной
50
диффузией.
51.
ЭлектродиализНекоторых недостатков диализа удается избежать за счет
применения электродиализа (Доре, 1910). В этом случае
параллельно
мембранам
и
диализуемой
жидкости
накладывается электрическое поле, в результате чего анионы
и катионы из раствора диффундируют через диализные
мембраны к аноду и катоду, а клетки остаются в растворе.
В простейшем случае электродиализатор состоит из 3
камер, отделенных друг от друга полупроницаемыми
мембранами – центральной для обрабатываемого раствора, а
также для пермеата в зоне анода и пермеата в зоне катода по
обеим сторонам от центральной камеры. Мембраны при
катоде и при аноде могут быть выполнены из разного
материала, селективного для катионов и анионов.
Недостатком электродиализа является выделение при
высоком напряжении большого количества тепла, что может
привести к необратимым изменениям в системам с
биологическими компонентами.
51
52. Полунепрерывная ферментация
В полунепрерывных системах полная загрузка и разгрузкаферментера осуществляются однократно, однако в процессе
роста культуры часть ее сливается, а освободившийся объем
заливается свежей питательной средой, т.е. функционирует
отъемно-доливная или сливно-доливная система.
Следовательно,
полунепрерывная
ферментация
характеризуется частотой и объемом сливаемой выросшей
культуры и добавлением свежей питательной среды в
рабочую емкость ферментера.
Установившиеся режимы полунепрерывной ферментации
характеризуются колебанием концентрации микроорганизмов
около одной и той же постоянной величины и относительным
постоянством средней удельной скорости роста популяции.
52
53.
Полунепрерывнаяферментация
микроорганизмов
осуществляется в открытой динамической гомогенной
одностадийной системе в
любом ферментере
для
периодической
ферментации,
оснащенном
системой
перемешивания и аэрации.
Различные
варианты
полунепрерывных
систем
используются
в
производстве
дрожжей,
водорослей,
антибиотиков, лимонной кислоты и других.
53
54. Недостатки периодических и полунепрерывных процессов
• Необходимостьматериала.
частого
приготовления
посевного
• Большое непродуктивное время процесса.
• В связи с необходимостью частой стерилизации быстрее
изнашиваются измерительные приборы (датчики рН).
• Производительность по биомассе и целевому продукту
часто ниже, чем в непрерывных процессах.
• Трудность поддержания необходимых параметров.
• Процесс более опасен для человека (аппарат чаще
открывают,
моют,
что
сопряжено
с
контактом
с
микроорганизмами и продуктами их жизнедеятельности).
54
55. Непрерывная ферментация
В отличие от периодической ферментации в непрерывныхпроцессах питательная среда подается непрерывно,
удаление биомассы и продуктов ее жизнедеятельности также
осуществляется непрерывно.
По такому принципу организуются 2 разновидности
процессов непрерывной ферментации: процессы полного
(идеального) смешения, или хемостатные процессы, и
процессы полного вытеснения, или тубулярные
процессы.
Непрерывная ферментации проводится в открытой
динамической системе, которая может быть как гомогенной,
так и гетерогенной. Эта система способна к длительной
работе в постоянном установившемся режиме.
55
55
56.
Хемостатные процессы непрерывногокультивирования
Гомогенные системы идеального смешения
Любой периодический процесс можно перевести в
непрерывно-проточный. Непрерывно-проточная ферментация
открывает возможности для поддержания постоянных условий
роста путем создания такого состава питательной среды,
чтобы только один желаемый фактор лимитировал рост.
Если в таком процессе плотность популяции определяется
химическим составом среды (концентрацией лимитирующего
рост фактора), его называют хемостатной ферментацией.
Установившиеся
режимы
непрерывной
хемостатной
ферментации характеризуются постоянством концентрации
микроорганизмов и удельной скорости роста популяции.
56
57.
Изменяя концентрацию лимитирующего рост фактора,можно изменять плотность популяции, т.е. изменяя скорость
разбавления, можно получать режимы, обеспечивающие
различную скорость роста популяции. При таком методе,
регулируя скорость протока, можно воспроизвести любую точку
роста периодической культуры.
Гомогенные системы идеального смешения
В системе идеального смешения микроорганизмы растут в
биореакторе при интенсивном перемешивании в культуральной
среде, постоянной по своему составу, и, следовательно, в
каждый данный момент времени находятся в одном и том же
физиологическом состоянии, т.е. в состоянии установившегося
динамического равновесия, которое называют «steady state».
57
58. Принцип работы хемостата
В установившемся режиме скорость протока среды,отнесенная к единице объема культуры в ферментере,
называется коэффициентом разбавления (D) и равняется
удельной скорости роста. При этом культура находится в
устойчивом
стационарном
состоянии
динамического
равновесия и обладает способностью самопроизвольно
автоматически подстраиваться к изменениям условий.
При таком способе культивирования нельзя получить
устойчивого состояния только при максимальной
скорости роста. В хемостате практически можно только
приблизиться к максимальной удельной скорости роста,
но не достичь ее, потому что такая скорость роста
соответствует критической скорости разбавления, при
которой биомасса вымывается из ферментера.
58
59.
Для борьбы с данным явлением возможно использоватькомплекс «ферментер-сепаратор». В этом комплексе
выходящая из ферментера жидкость сгущается на сепараторе,
и часть сгущенного потока непрерывно возвращается в
ферментер, остальная часть идет как товарный продукт.
Осветленная жидкость сбрасывается в стоки.
Основными направлениями использования реципкуляции
являются:
повышение
производительности
системы
непрерывного культивирования и более полное потребление
субстрата из среды.
Одностадийный хемостат применяется при необходимости
воспроизвести
любую
скорость
роста
клеток,
кроме
максимальной. Двухстадийный позволяет создавать культуры
при скорости роста, близкой к максимальной, и определять
условия ее повышения. Для этого в первом ферментере
ведется культивирование при скорости разбавления, меньшей
чем удельная скорость роста, а во второй подается культура из
59
первого.
60.
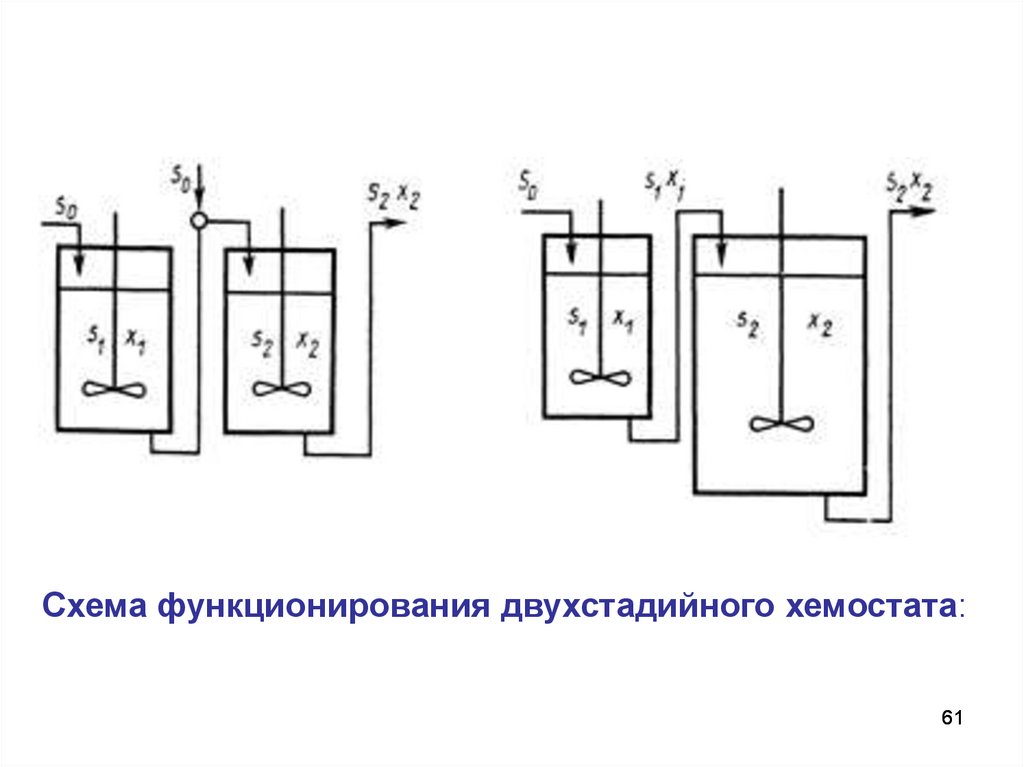
Особенности двухстадийного хемостата:1. Вымывания культуры во втором ферментере не
происходит из-за непрерывного поступления культуры из
первого. Следовательно, концентрация биомассы никогда не
сможет стать равной нулю при любой скорости разбавления.
Будет возрастать удельная скорость роста клеток и
экономический коэффициент.
2. Концентрация субстрата во втором аппарате всегда
меньше, чем в первом. Субстрат расходуется из запаса
входящего потока. Это имеет значение в тех случаях, когда
важен не только выход биомассы, но и ее чистота.
3. Концентрация биомассы во втором аппарате всегда
выше, чем в первом (учитывается прирост биомассы).
60
61.
Схема функционирования двухстадийного хемостата:61
62.
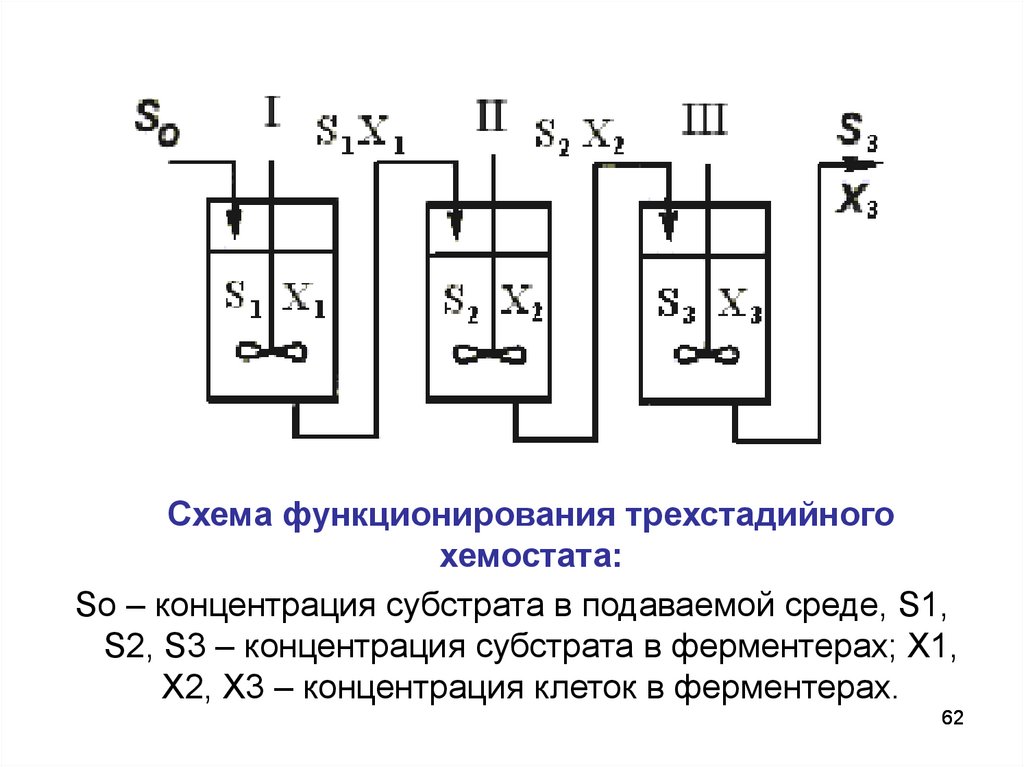
Схема функционирования трехстадийногохемостата:
So – концентрация субстрата в подаваемой среде, S1,
S2, S3 – концентрация субстрата в ферментерах; Х1,
Х2, Х3 – концентрация клеток в ферментерах.
62
63.
Другой широко известный принцип управления процессом –турбидостат. В нем подача питательной среды осуществляется
по команде фотоэлектрического элемента, регистрирующего
оптическую плотность культуры. Скорость разбавления сама
устанавливается в соответствии с заданной плотностью
популяции. Этим турбидостат отличается от хемостата, в
котором фиксируется скорость разбавления, соответственно
которой устанавливается концентрация биомассы.
Хотя теоретически взаимосвязь между концентрацией
биомассы и скоростью разбавления подчиняется одним и тем же
закономерностям в хемостате и турбидостате, методы
управления процессами различны.
Турбидостат позволяет получать максимальные скорости
роста, которые применяются при культивировании клеточных
культур, фиксированных в стадии экспоненциального роста.
Хемостаты же применяют при скоростях разбавления от
самой низкой до только приближающейся к максимальной
63
удельной скорости роста.
64.
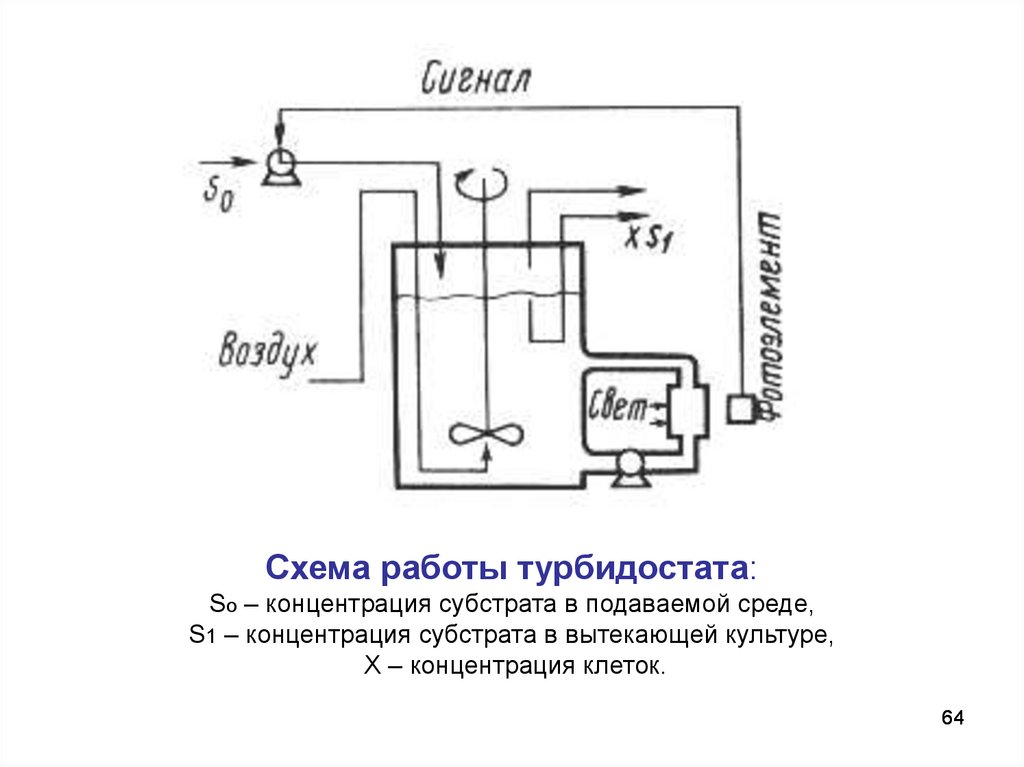
Схема работы турбидостата:So – концентрация субстрата в подаваемой среде,
S1 – концентрация субстрата в вытекающей культуре,
Х – концентрация клеток.
64
65.
В настоящее время разработаны различные вариантынепрерывного культивирования микроорганизмов, работающие по
принципу турбидостата – pH-стат, оксистат, СО2-стат,
теплостат, респиростат, вискозистат и т. д., названия
которых соответствуют задаваемому параметру. Любой параметр,
который изменяется в периодической культуре и на который
существует датчик, может быть использован для управления
ростом по типу турбидостата.
Управляющими
параметрами
могут
быть
комплексные
параметры, например, содержание кислорода и углекислоты в
отходящем воздухе, характеризующие дыхательный коэффициент.
В промышленности одностадийные хемостатные процессы
ферментации применяется для получения микробной массы или
тех продуктов, кинетика накопления которых повторяет кинетику
роста биомассы.
Многостадийные системы обычно используются для получения
вторичных продуктов микробного синтеза, кинетика накопления
которых в той или иной степени отстает от кинетики роста
биомассы. Они с успехом применяется при получении органических
65
кислот, этилового спирта и т. д.
66. Тубулярные процессы непрерывной ферментации
Системы полного вытесненияЭтот способ культивирования используется для анаэробных
условий. Открытая система полного вытеснения отличается от
системы идеального смешения тем, что культура в ней не
перемешивается и представляет собой поток жидкости через трубку.
Наиболее распространенным аппаратом является трубчатый
реактор, который может иметь различную форму (прямую, Sобразную, спиральную) и устанавливается горизонтально или
вертикально. Питательная среда и посевной материал смешиваются
на входе и непрерывно поступают в аппарат без обратного
смешения. В аппарате башенного типа жидкость движется снизу
вверх.
В момент подачи среды и посевного материала на входе в
трубчатый реактор, популяция клеток находится в начале цикла
развития. По ходу трубки культура стареет, субстрат исчерпывается,
накапливаются продукты метаболизма, и вытекающая культура
находится в состоянии, аналогичном стационарной фазе роста
66
периодической культуры.
67.
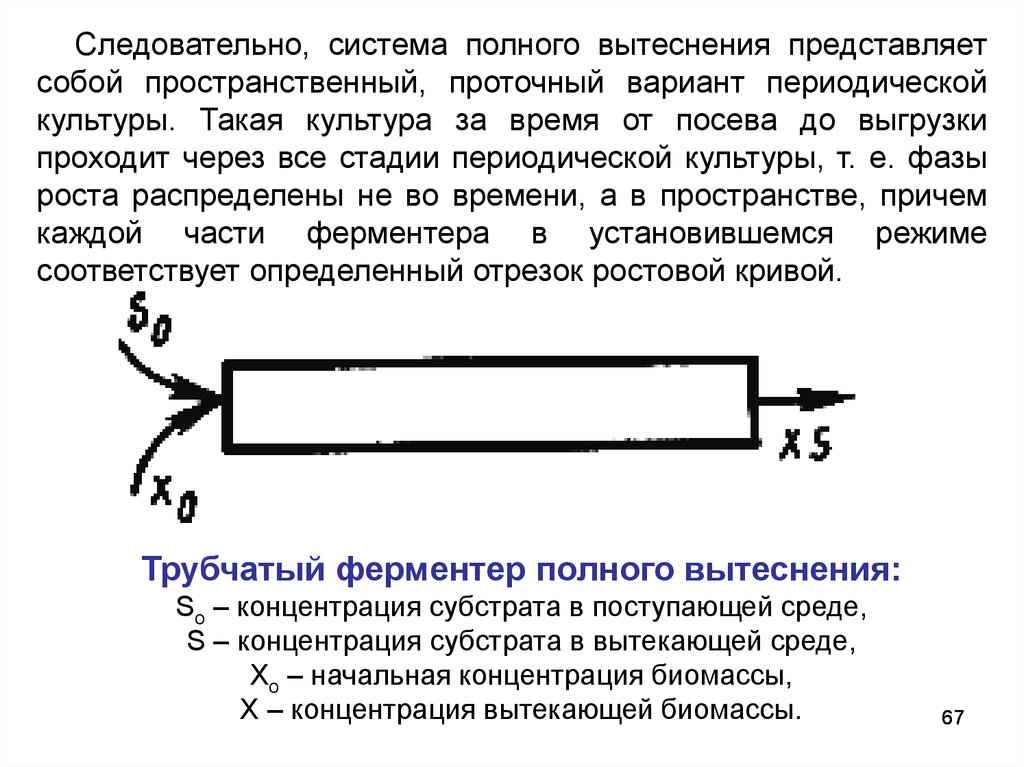
Следовательно, система полного вытеснения представляетсобой пространственный, проточный вариант периодической
культуры. Такая культура за время от посева до выгрузки
проходит через все стадии периодической культуры, т. е. фазы
роста распределены не во времени, а в пространстве, причем
каждой части ферментера в установившемся режиме
соответствует определенный отрезок ростовой кривой.
Трубчатый ферментер полного вытеснения:
So – концентрация субстрата в поступающей среде,
S – концентрация субстрата в вытекающей среде,
Хо – начальная концентрация биомассы,
Х – концентрация вытекающей биомассы.
67
68.
Преимуществом тубулярного процесса являетсявозможность более полного исчерпания субстрата (как
и в периодическом процессе),
недостатком
–
большая
склонность
к
контаминации и невозможность организовать аэрацию
по всей длине аппарата.
68
69.
Синхронно делящиеся культуры микроорганизмовКультуры
микроорганизмов,
даже
отобранные
одновременно, представляют собой совокупность клеток,
находящихся на разных стадиях своего индивидуального
развития. Следовательно, оценка физиологических свойств и
метаболической активности таких культур приводит к
получению средних результатов.
Стремление получить культуры, все клетки которых в
данный момент времени находятся в одной фазе развития,
привело к разработке метода синхронизации деления
микроорганизмов.
69
70.
Синхронизацииделения
подвергались
различные
объекты: грибы, бактерии, гетеротрофные протисты,
водоросли, а также клетки культуры ткани и т. п.
Среди бактерий синхронное размножение изучалось,
главным образом, на популяциях Escherichia coli, Salmonella
typhimurium, Corynebacterium diphtheriae и других.
Сущность метода синхронизации заключается в том, что
путем различных воздействий микробная популяция
искусственно приводится в однородное физиологическое
состояние.
Наиболее легко определяемым показателем такого
состояния популяции является одновременное (синхронное)
деление почти всех клеток культуры.
70
71.
Периодическая синхронная ферментацияДля синхронизации деления обычно применяют популяции в
фазе экспоненциального роста, когда клетки наиболее однородны
по продолжительности периода генерации.
Степень участия клеток популяции в синхронном делении
называется степенью синхронизации. Она выражается
значениями индекса синхронизации, который характеризует
степень однородности популяции и позволяет сравнить
эффективность различных синхронизирующих воздействий.
Для определения степени синхронизации наибольшее
распространение получил «индекс синхронизации» Шербаума (Is),
вычисляемый по формуле:
Is = (N1/N0 – 1) (1 – T/g),
где N0 – число клеток непосредственно перед взрывом
синхронного деления; N1 – число клеток после синхронного
деления;
Т – время, в течение которого происходит синхронное деление;
g – продолжительность одной генерации.
71
72.
Способы синхронизацииВ зависимости от характера воздействия все известные методы,
вызывающие синхронное деление, можно разделить на 3 большие
группы:
1-ая – механический отбор (селективные, или естественные
методы);
2-ая – действие физических факторов;
3-ая – химико-биологические воздействия.
Первая группа методов синхронизации (механический отбор)
заключается в механическом отборе клеток из популяции в
зависимости от их объема, массы или определенной формы
существования (споры).
Применение селективных методов основано на предположении,
что такие свойства, как объем и масса клеток, отражают в
известной мере определенное физиологическое состояние.
Эти методы имеют то преимущество, что не создают никакого
препятствия в обмене веществ у отдельных клеток, как это бывает
72
при использовании других методов.
73.
Вторая группа методов (действие физических факторов)связана с физическими воздействиями, также ведущими
популяцию к синхронному размножению. В этом направлении
наибольшее распространение получили температурные
воздействия.
Синхронизация
популяций
с
помощью
изменения
температуры культивирования достигается однократным (шок)
или многократным (сдвиги температуры между двумя уровнями)
действием более высокой или более низкой температуры по
сравнению с оптимальной для данного вида микроорганизмов.
Такое температурное воздействие, блокируя процесс
деления, не останавливает роста и развития клеток, что в
конечном итоге приводит популяцию в однородное состояние.
После снятия шока от 70 до 90 % клеток делится синхронно.
Этот вид воздействия в основном применяется для
синхронизации бактерий, протистов и клеток культуры ткани.
73
74.
Одним из методов физического воздействия, применяемыхдля синхронизации деления, является обработка клеток
сублетальными дозами рентгеновских лучей
К физическому типу воздействий можно отнести также
периодическую смену света и темноты, использованную
для получения синхронного деления одноклеточных
водорослей и цианобактерий Euglena и Chlorella (метод
считается наиболее естественным, так как основан на
цикличности развития фототрофных микроорганизмов в
связи с суточной фотопериодичностью).
74
75.
Третьягруппа
факторов
(химико-биологические
воздействия), вызывающих синхронное размножение, основана на
изменениях состава питательной среды путем введения
ингибиторов или лишения (удаления) веществ, необходимых для
деления.
Одним из наиболее распространенных методов синхронизации
этой группы является так называемый метаболический шок.
Можно получить эффект синхронизации, применяя «голодные»
среды, из которых полностью удалены важнейшие компоненты
или снижено их содержание. Последующее добавление
недостающего вещества или перенесение клеток в полноценную
среду вызывает синхронное деление.
Несмотря на разнообразие методов, способных привести
культуру к синхронному размножению, не всегда удается в
достаточной степени синхронизировать деление клеток. В таких
случаях принято сочетать различные методы.
Общим и весьма существенным недостатком периодических
синхронных культур является быстрая потеря синхронности,
75
наступающая через 2 – 3 генерации.
76.
Непрерывно-синхронная ферментацияС середины 60-х годов прошлого века началась
разработка методов получения синхронизированных культур
на протоке. Такой способ известен как непрерывносинхронный, или фазовый, метод культивирования,
гарантирующий поддержание синхронного деления клеток
неограниченно долгое время.
Метод основан на периодическом сливе из ферментера
половины объема выросшей культуры через промежутки
времени, равные одной генерации, и одновременном
добавлении равного количества свежей питательной среды,
что обеспечивает импульсную подачу источников питания.
Состав среды подбирается таким образом, чтобы при
удвоении биомассы происходило исчерпание питательных
веществ, вследствие чего рост культуры должен
приостановиться.
76
77.
Добавление свежей среды приводит к восстановлениюроста, т. е. синхронизация деления достигается голоданием
клеток по какому-либо лимитирующему рост субстрату.
Лимитирующими факторами могут служить источники азота,
углерода, минеральных солей и т. д.
Синхронное деление клеток также может быть
индуцировано изменением рН, температуры и других
условий культивирования, оказывающих воздействие на ряд
метаболических процессов клеток.
77
78.
ФЕРМЕНТАЦИЯ АНАЭРОБНЫХМИКРООРГАНИЗМОВ
Выращивание анаэробных микроорганизмов более
сложно, чем аэробов, так как контакт их клеток с кислородом
воздуха должен быть сведен к минимуму или даже
полностью исключен. Для этого используют разные приемы,
нередко комбинируя их друг с другом.
78
79.
Механические методыМетоды основаны на механическом предотвращении или
ограничении доступа кислорода воздуха к культивируемым
анаэробным клеткам.
1. Выращивание в высоком слое среды
Это наиболее простой способ ограничения доступа воздуха
к клеткам микроорганизмов. Жидкую среду наливают в сосуды
для культивирования высоким слоем (10-12 см). Так как нельзя
стерилизовать среды, если они занимают более половины
высоты сосуда, часть среды стерилизуют отдельно и
стерильно доливают ее сосуд для культивирования сразу же
после посева.
Непосредственно перед посевом среду кипятят или
прогревают на кипящей водяной бане 30-40 мин, затем быстро
охлаждают, чтобы в ней не успел раствориться кислород
воздуха, и вносят на дно посевной материал и герметично
закупоривают.
79
80.
2. Выращивание в вязких средахДиффузия кислорода в жидкость уменьшается с увеличением
ее вязкости. Поэтому в вязких средах, таких как картофельная,
или среды с кукурузной либо другой мукой, хорошо развиваются
некоторые облигатные анаэробы, например, возбудители
маслянокислого или ацетонобутилового брожения.
Вязкость жидких сред легко увеличить, если добавить к ним
0,2-0,3 % агара.
Анаэробные микроорганизмы засевают уколом в высокий
столбик полужидкой агаризованной среды. Место укола быстро
затягивается и клетки развиваются в условиях низкого
содержания кислорода.
Возможно
высев
микроорганизмов
осуществлять
в
расплавленную и быстро охлажденную среду. После внесения
микроорганизмов ее перемешивают (без доступа воздуха),
оставляют до застывания, после чего помещают в термостат.
Клетки развиваются в условиях низкого содержания кислорода,
80
вверху пробирки можно наблюдать зону отсутствия роста.
81.
3. Выращивание в толще плотной средыЭтим приемом пользуются для получения изолированных
колоний при выделении чистых культур или определении
численности анаэробных микроорганизмов.
В этом случае расплавленная и охлажденная до 45–50 °С
осветленная среда в пробирках засевается, тщательно
перемешивается для равномерного распределения клеток и:
1) пробирка герметично закупоривается (поверхность
среды может заливаться парафином, вазелиновым маслом
или их смесью) и инкубируется (метод Коха),
2) среда с культурой стерильно переносится пипеткой в
заранее подготовленную посуду – трубки Бурри, трубки
Виньяль–Вейона, чашки Петри. Титр клеток подбирается
таким образом, чтобы они располагались на некотором
удалении друг от друга.
81
82.
8283.
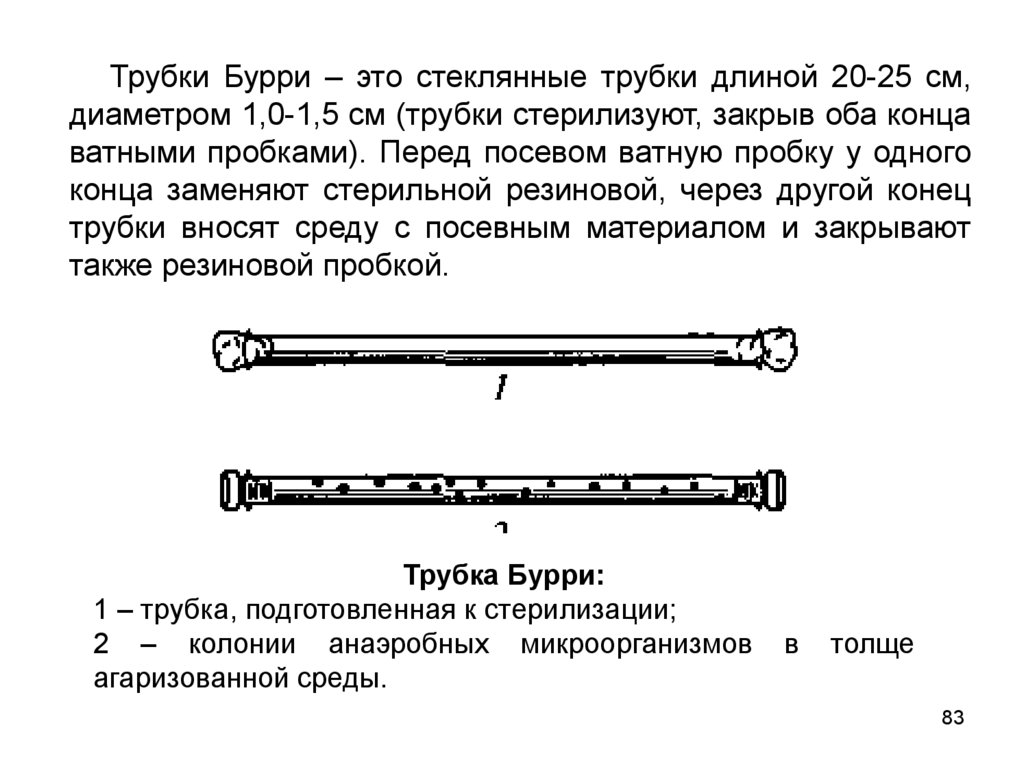
Трубки Бурри – это стеклянные трубки длиной 20-25 см,диаметром 1,0-1,5 см (трубки стерилизуют, закрыв оба конца
ватными пробками). Перед посевом ватную пробку у одного
конца заменяют стерильной резиновой, через другой конец
трубки вносят среду с посевным материалом и закрывают
также резиновой пробкой.
Трубка Бурри:
1 – трубка, подготовленная к стерилизации;
2 – колонии анаэробных микроорганизмов
агаризованной среды.
в
толще
83
84.
Вариантом описанного выше способа выращиваниямикробных клеток в трубках Бурри является метод
Виньяль-Вейона,
предполагающий
культивирование
анаэробных микроорганизмов в так называемых трубках
Виньяль-Вейона,
роль
которых
обычно
выполняют
стеклянные пастеровские пипетки длиной около 30 см и
диаметром 3–6 мм.
В начале выращивания культура микроорганизмов
вносится в пробирку с расплавленной и охлажденной до 45–
50°С питательной средой с содержанием агара
0,5%,
тщательно перемешивается и отбирается (засасывается) в
пастеровскую пипетку.
После заполнения пипетки ее вытянутый конец
запаивают, а противоположный – герметично закупоривают.
84
85.
Трубки Виньяль-Вейона85
86.
Еще одним похожим методом является метод Вейнберга, вкотором культуру анаэробов помещают в сахарный бульон, а
затем пастеровской пипеткой с запаянным концом поочередно
переносят в узкие пробирки (возможно, трубки Виньяль-Вейона) с
расплавленным и охлажденным сахарным мясопептонным
агаром. При засеве агаризованной среды пастеровская пипетка
погружается до дна пробирки.
Пробирки быстро охлаждают, и после застывания питательной
среды ее поверхность заливают смесью вазелинового масла и
парафина для препятствия просачивания кислорода.
Трубки помещают в термостат; где через 24–72 часа
формируются глубинные колонии, хорошо различимые в
проходящем свете.
Для выделения выросших колоний в стерильных условиях
трубочку вскрывают (можно надпилить трубку выше намеченной
колонии и надломать) или слегка нагревают, чтобы столбик агара
легко выскользнул в подготовленную стерильную посуду (чашка
Петри). Изолированную колонию извлекают стерильной петлей
или скальпелем и быстро переносят для дальнейшего развития86в
соответствующие условия.
87.
8788.
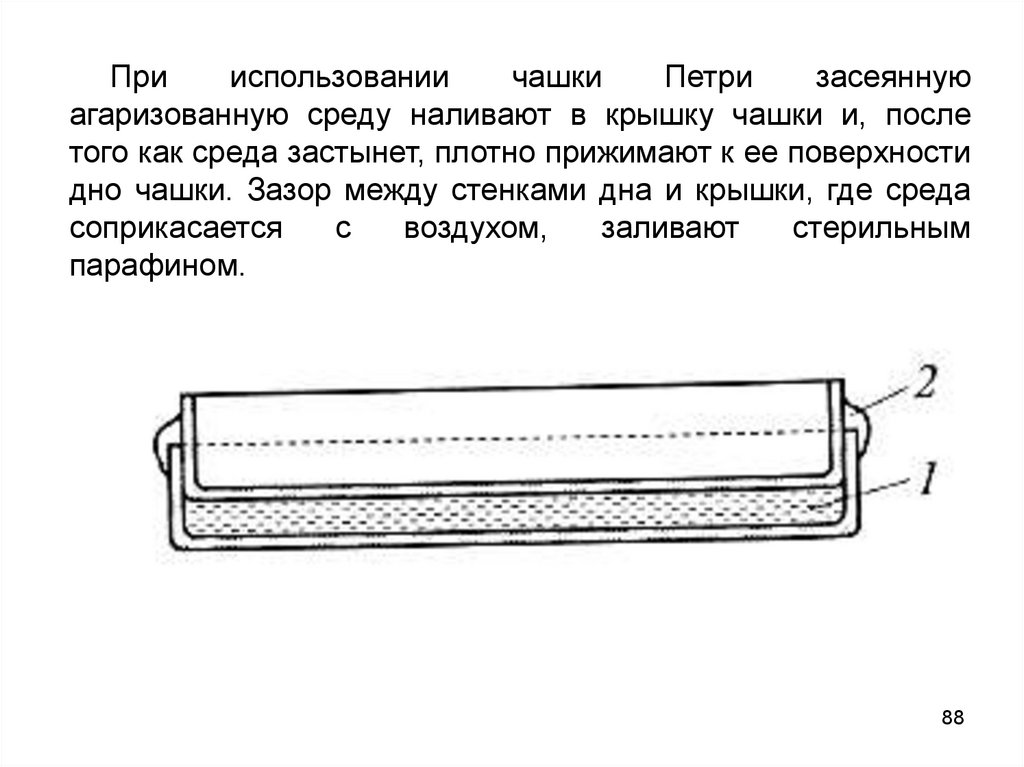
Прииспользовании
чашки
Петри
засеянную
агаризованную среду наливают в крышку чашки и, после
того как среда застынет, плотно прижимают к ее поверхности
дно чашки. Зазор между стенками дна и крышки, где среда
соприкасается
с
воздухом,
заливают
стерильным
парафином.
88
89.
При глубинном культивировании клеток анаэробныхмикроорганизмов часто возникают трудности с выделением
искомой колонии из толщи агаризованной среды.
Использование метода Перетца значительно упрощает
доступ к сформировавшимся колониям микроорганизмов. При
этом в стерильную чашку Петри кладут стерильные
стеклянные (пробковые или деревянные) палочки, на которые
помещают стеклянные пластинки (предметные стекла).
Далее в пробирку с расплавленным и охлажденным до 45–
50°С мясопептонным агаром с глюкозой вносят культуру
микроорганизмов, быстро перемешивают и выливают в чашку
Петри так, чтобы агар заполнил пространство между
стеклянной пластинкой и дном чашки. После инкубирования
под стеклянной пластинкой формируются колонии анаэробов.
Иногда для упрощения методики стеклянную пластинку
помещают непосредственно на поверхность содержащей
культуру агаризованной среды, слегка вдавливая в нее.
89
90.
Метод Перетца90
91.
Метод Цейсслера применяют для получения культурспорообразующих анаэробов. При этом среду КиттаТароцци инокулируют посевным материалом, прогревают
15–20 мин при 80°C (избавление от вегетативных клеток),
заливают поверхность среды вазелиновым маслом и
инкубируют.
Как правило, после такой тепловой обработки вырастают
преимущественно колонии споровых микроорганизмов
91
92.
Физические методыМетоды основаны на выкачивании при помощи насосов
воздуха (создание вакуума) из культуральных аппаратов
(эксикатор, стеклянный колокол, анаэростат) и замещении его
индифферентным газом (например, СО2 или Н2).
Следовательно, это эвакуационно-заместительные или
вакуум-заместительные методы.
Воздух в аппаратах может также замещаться такими
инертными газами, как гелий, аргон и др. Допустимо
применение двухкомпонентной (90-80% N2 + 10-20% CO2) или
трехкомпонентной газовых смесей (80% N2 + 10% CO2 + 10%
H2), а в редких случаях и – природного газа.
Для
поглощения
остаточного
кислорода
возможно
использование палладиевых катализаторов. С целью
поглощения водяных паров на дно аппарата помещают хлорид
кальция, силикагель и т. п.
92
93.
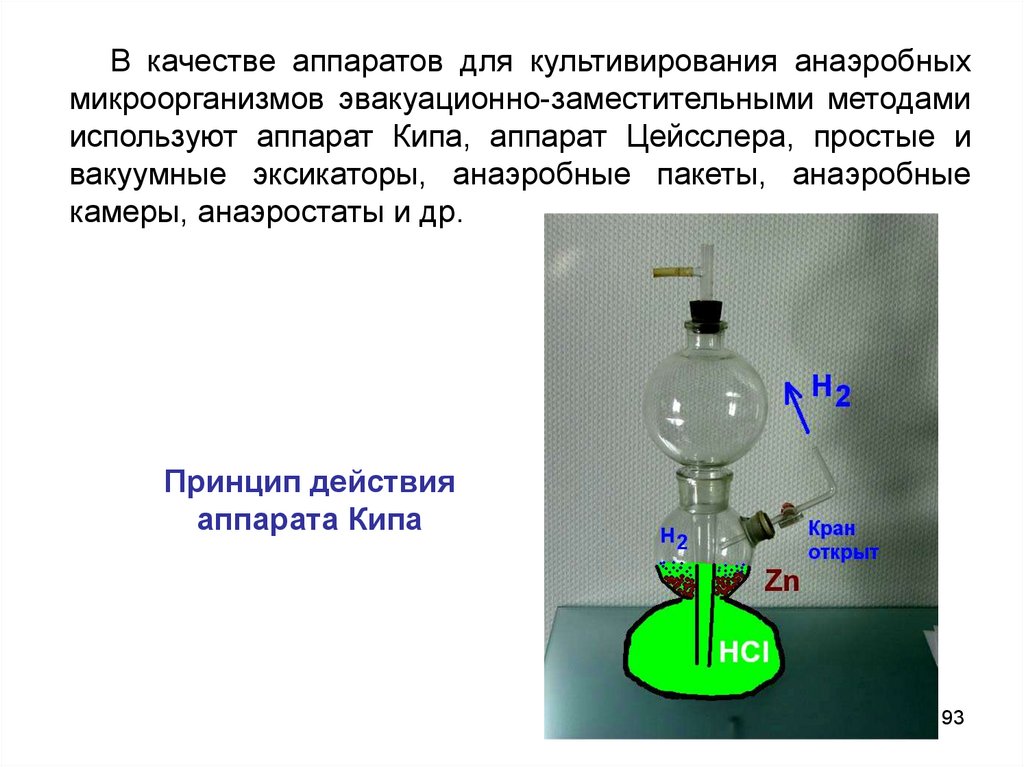
В качестве аппаратов для культивирования анаэробныхмикроорганизмов эвакуационно-заместительными методами
используют аппарат Кипа, аппарат Цейсслера, простые и
вакуумные эксикаторы, анаэробные пакеты, анаэробные
камеры, анаэростаты и др.
Принцип действия
аппарата Кипа
93
94.
Одним из самых простых в работе аппаратов длявыращивания микроорганизмов в условиях низкого
содержания кислорода является простой химический
эксикатор, в виде стеклянного лабораторного сосуда с
плотно притертой крышкой.
В такой эксикатор ставят парафиновую свечу, кладут
кусочек ваты, смоченный 96% спиртом, бумагу и т.п. и
поджигают. Эксикатор герметично закрывают крышкой.
В процессе горения органических веществ кислород
переходит в углекислый газ CO2 и водяные пары H2O, а азот
воздуха остается практически без изменений.
Следовательно, в эксикаторе после горения создается
атмосфера, в основном состоящая из смеси азота и
углекислого газа (N2 + CO2). Водяные пары конденсируются.
94
95.
9596.
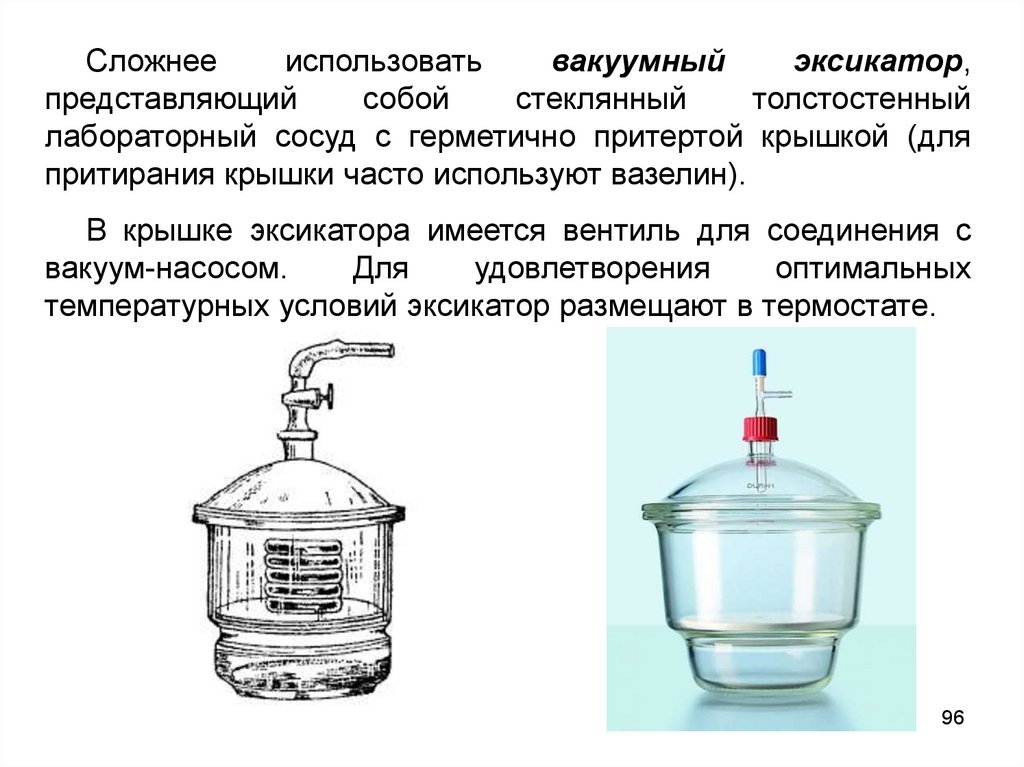
Сложнееиспользовать
вакуумный
эксикатор,
представляющий
собой
стеклянный
толстостенный
лабораторный сосуд с герметично притертой крышкой (для
притирания крышки часто используют вазелин).
В крышке эксикатора имеется вентиль для соединения с
вакуум-насосом.
Для
удовлетворения
оптимальных
температурных условий эксикатор размещают в термостате.
96
97.
Анаэробныйпакет
–
прозрачный
герметично
закрывающийся пластиковый пакет, вмещающий в зависимости от типа от 1–2 до 10–12 чашек Петри. Примером такого
способа культивирования анаэробов является использование
MAS (Microgen Atmosphere System) – настольного прибора,
предназначенного для создания необходимой атмосферы
(анаэробной, микроаэрофильной, СО2).
Чашки
Петри
с
анаэробными
микроорганизмами
помещаются
в
соответствующие
пакеты,
переносятся в вакуумную
камеру прибора, где пакеты
автоматически
заполнятся
необходимым
газом
или
газовой смесью, запечатываются и инкубируются в
стандартных условиях.
97
Пакеты снабжены индикатором кислорода.
98.
Для культивирования строгих анаэробов предложеныспециальные камеры, заполненные газовыми смесями
(чаще всего 90% N2, 5% СО2 и 5% Н2), которые содержат
внутри
все
необходимое
для
выполнения
микробиологических работ, включая термостат.
Это оборудование сложно и дорого, но оно имеет
неоспоримое преимущество – контакт клеток с кислородом
воздуха остается минимальным на всех этапах работы.
98
99.
Анаэробнаякамера
–
компактная
герметичная
перчаточная (или неперчаточная) станция, анаэробные
условия в которой создаются путем замещения воздуха
двухкомпонентными (N2 + H2) или трехкомпонентными (N2 +
CO2 + H2) газовыми смесями.
Камера
оснащена
специальными шлюзами
для введения образцов,
термостатом,
контролирующим
влажность,
приборами для регулирования
присутствия
кислорода и его вывода из
рабочей зоны.
Вместительность
камеры – до двухсот
чашек Петри.
99
100.
Анаэробные станции, как правило,изолированные термостатированные перчаточные боксы со встроенным инкубатором для
создания стабильного анаэробиоза. Время
создания анаэробных условий в рабочем
объеме составляет 2–4 часа.
Катализатор многократного использования
поддерживает строгие анаэробные условия,
удаляя из рабочей зоны даже следовые
количества кислорода.
Создание соответствующей атмосферы (чаще всего 90% N2, 5% СО2 и 5% Н2)
может осуществляться автоматически и
путем ручного управления.
Вместительность
станции
может
составлять от 300 до 900 чашек Петри.
Использование анаэробных станций
полностью
исключает
контакт
микроорганизмов с кислородом.
100
101.
Очень широко распространенным типом оборудованияявляются анаэростаты. Микроорганизмы выращивают в
анаэростатах при оптимальной температуре в условиях
вакуума. Для этого анаэробы в пробирках или чашках Петри
помещаются в аппарат, дверца которого герметически
закрывается, и вакуумным насосом из камеры откачивается
воздух до определенной степени разрежения.
После этого камера заполняется двухкомпонентными
газовыми смесями N2 (90–80%) и CO2 (10–20%) (или CO2 + H2)
и трехкомпонентными N2 (80%) + CO2 (10%) + H2 (10%)) до
избыточного давления ~67 кПа (500 мм рт. ст.),
предотвращающего проникновение кислорода воздуха.
В зависимости от особенностей конструкции и размеров
различают громоздкий макроанаэростат и портативный
микроанаэростат.
101
102.
Макроанаэростат – это, как правило, прямоугольныйметаллический короб, в котором располагается толстостенный
герметично закрывающийся цилиндрический котел. Внутри
котла имеются съемные металлические полочки для штативов
и чашек Петри, и электрическая подсветка. Короб снабжен
двойными стенками, между которыми находится вода для
обогрева, удаляемая через кран на задней стенке.
Уровень воды определяется с помощью
поплавка, помещенного в металлическую
трубку, выходящую наружу через верхнюю
стенку.
Подогрев
воды
осуществляется
электрически, а постоянство температуры
поддерживается терморегулятором.
В крышку аппарата вмонтировано стекло,
позволяющее
контролировать
развитие
микроорганизмов. В верхней стенке анаэростата находятся вакуумметр и игольчатые
работающие
попеременно
краны
для
соединения с вакуумным насосом и внешней
системой источника бескислородных газов.
102
103.
Микроанаэростат – это, как правило,цилиндрический, герметично закрываемый
аппарат из металла или пластмассы,
объемом от 2 до 7 литров. В крышку
микроанаэростата встроены вакуумметр и
краны для соединения с вакуумным насосом
и
внешней
системой
источника
бескислородных газов.
Поскольку
аппарат
не
оснащен
системой подогрева, для культивирования
микроорганизмов
его
помещают
в
термостат.
Оптически
прозрачные
пластиковые
конструкции
микроанаэростатов для контроля присутствия кислорода снабжены специальными
полосками-индикаторами (метиленовый
синий, и др.), которые обесцвечивается
при удалении кислорода.
103
104.
Анаэростат АЭ-01Анаэростатом
может
служить обычный вакуумный
стеклянный эксикатор.
Из анаэростата откачивают
воздух, а затем, как правило,
заполняют его газовой смесью,
состоящей из азота (90-80%) и
углекислоты
(10-20%),
до
достижения
избыточного
давления, которое исключает
возможность
диффузии
кислорода воздуха.
Анаэростат АЭ-01 предназначен для культивирования в
чашках
Петри
микроорганизмов
группы
облигатных
анаэробов и микроаэрофилов.
104
105.
Для культивирования анаэробныхмикроорганизмов можно использовать
системы, в которых в качестве активных
компонентов используется неорганический карбонат, аскорбиновая кислота,
активированный уголь и вода.
Также применяются современные
системы генерации атмосферы, не
требующие
добавления
воды
или
присутствия катализатора.
В таких системах после вскрытия индивидуальной упаковки
конверта процесс газообразования начинается при контакте с
воздухом. Активное вещество – аскорбиновая кислота. Данные
системы снабжены прочными герметичными поликарбонатными камерами, вмещающими 12 чашек Петри.
105
106.
В 1965 г. Брюер и Алгайер разработали автономнуюанаэробную систему, которая не требовала использования
баллонов с газом, вакуумных насосов и прочего внешнего
оборудования и основывалась на использовании конверта
одноразового применения для генерирования водорода.
Модификация данной системы позволила также генерировать
диоксид углерода.
В специальных камерах газогенерирующая система типа
«GasPak» образует водород и СО2 в замкнутом пространстве
и эффективно поглощает кислород.
Специальные газогенерирующие пакеты GasPak, GasPak+,
CampyPak или CampyPak+ не требуют дополнительного
оборудования
и
применяются
для
культивирования
факультативных и облигатных анаэробных микроорганизмов.
106
107.
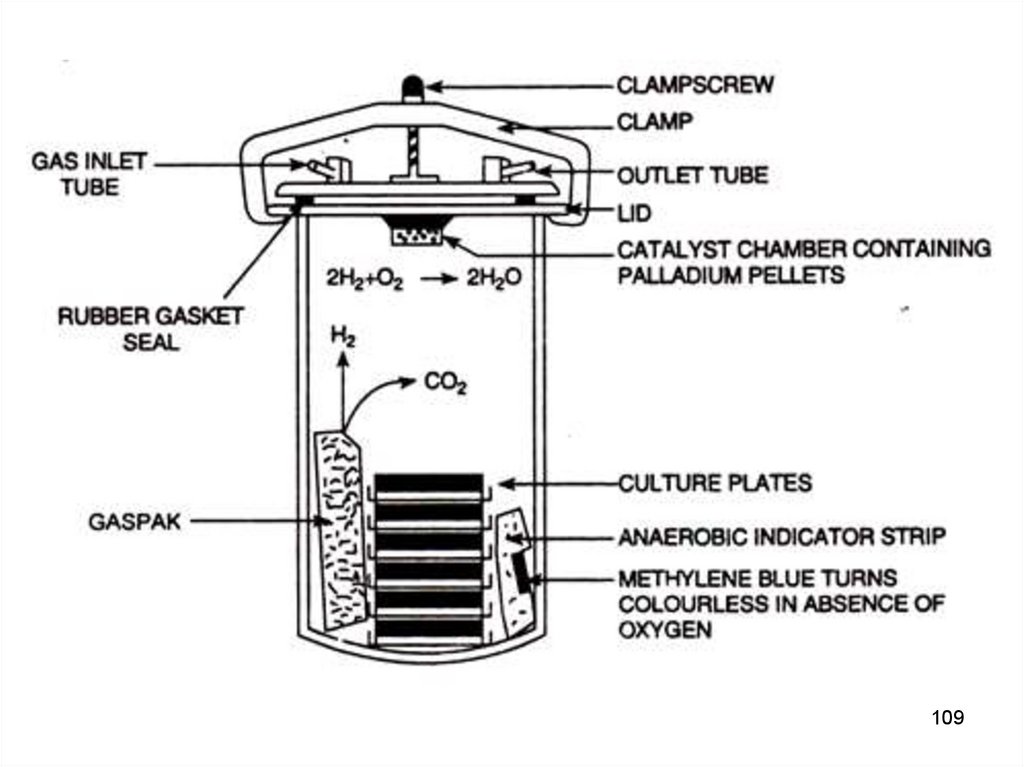
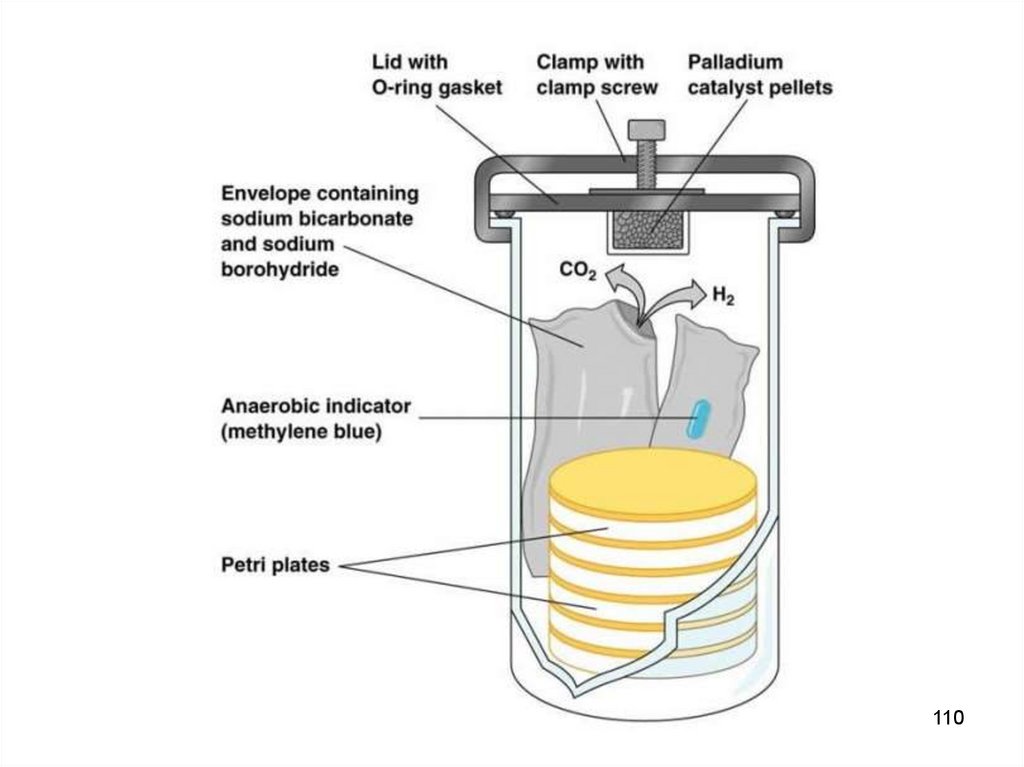
Двумя основными составляющими GasPakсистемы являются:
1.
герметично
закрывающийся,
контейнер с прозрачными стенками;
анаэробной
пластиковый
2. одноразовый конверт, генерирующий водород и
двуокись углерода, таблетки боргидрида натрия и
бикарбоната натрия с лимонной кислотой и палладиевый
катализатор
(покрытые
палладиумом
алюминиевые
частицы).
GasPak конверты активируются добавлением воды,
которая перемещается по серии каналов к прокладке из
фильтровальной
бумаги,
регулирующей
скорость
поступления воды в отсек к газогенерирующим таблеткам.
Таким
образом
высвобождение газа.
обеспечивается
постепенное
107
108.
Водород, генерируемый таблеткой боргидрида натрия придобавлении воды, в присутствии палладиевого катализатора
соединяется со свободным молекулярным кислородом с
последующим образованием молекул воды.
Диоксид углерода, регенерируемый после активации
таблетки бикарбоната натрия и лимонной кислоты (реакция
идет в отсутствии катализатора), уже через 1 час достигает в
контейнере концентрации 4–10 %. При этом скорость
высвобождения газа также регулируется прокладкой из
фильтровальной бумаги.
Для культивирования ограниченного
количества
биомассы
анаэробных
микроорганизмов возможно применение
с конвертами GasPak герметичных
газонепроницаемых пластиковых пакетов
или контейнеров малого размера
108
109.
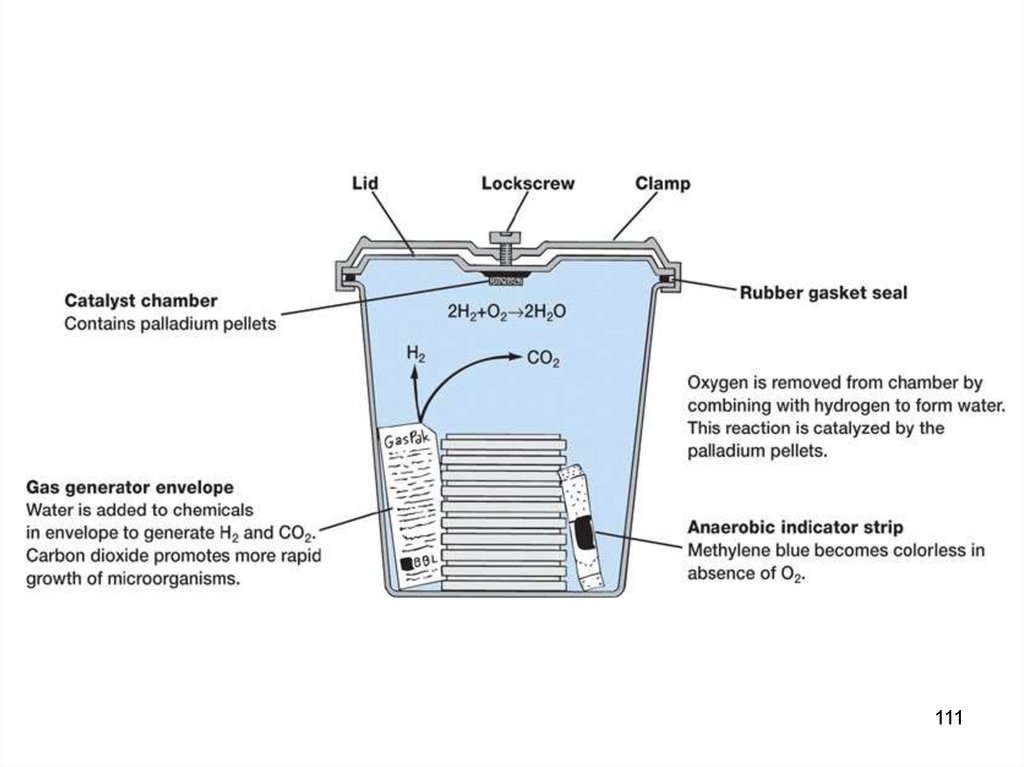
109110.
110111.
111112.
112113.
Анаэростат для анаэробногокультивирования 12 чашек Петри
113
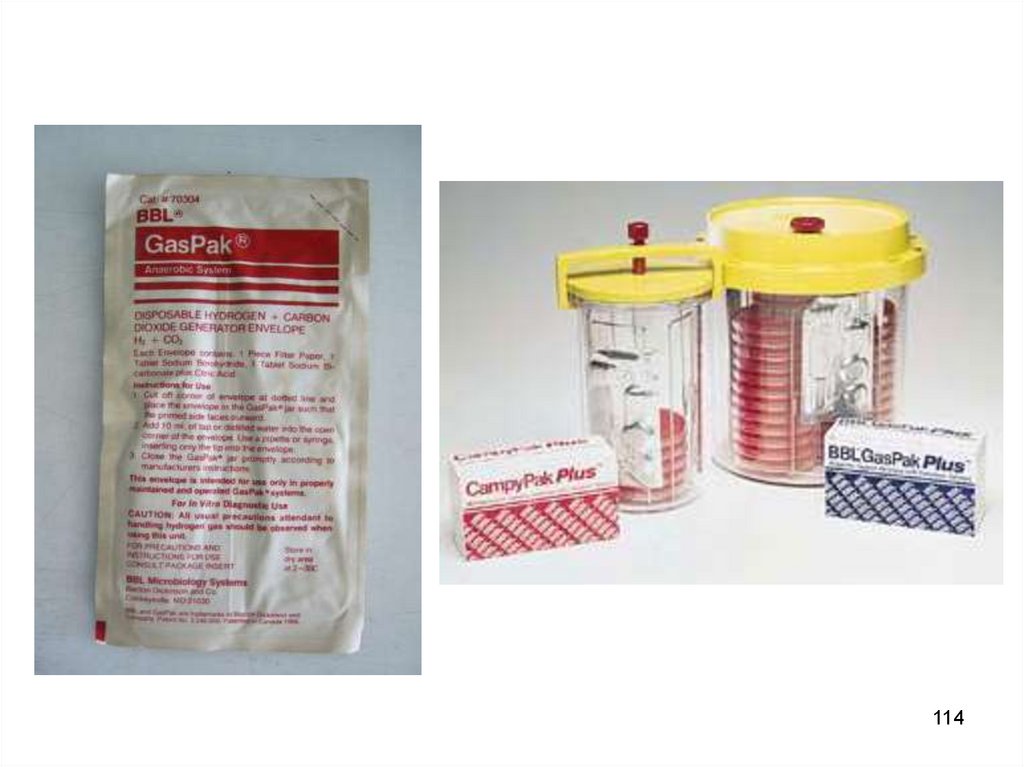
114.
114115.
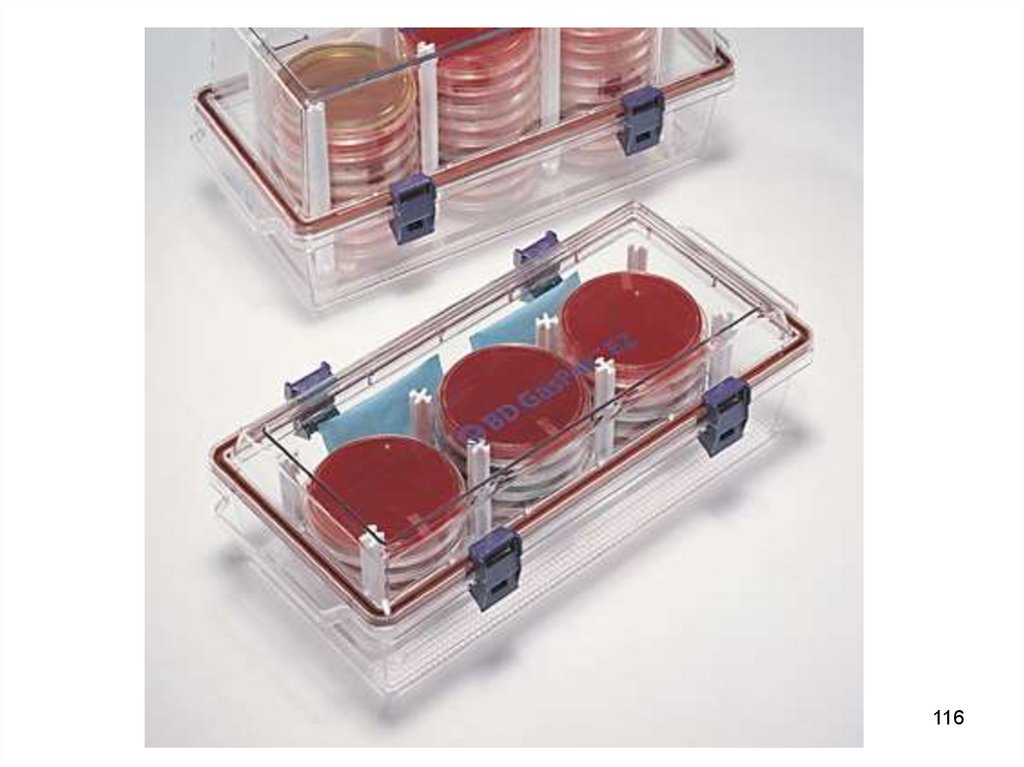
Одновременная загрузка 36 чашек Петри115


























































































 biology
biology








