Similar presentations:
Титан. Хром
1.
Титан.Хром.
2.
Химический элемент №22. Титан.Титан (Titanium),Ti,— химический элемент IV группы
периодической системы элементов Д. И. Менделеева.
Порядковый номер 22, атомный вес 47,90.
Электронная формула титана имеет
вид: 1s2|2s22p6|3s23p63d2|4s2.
Данная конфигурация позволяет атому титана проявлять две
степени окисления: +2 и +4.
Номер элемента обозначает заряд ярда, следовательно у
титана заряд ядра - +22, масса ядра – 47,87.
Титан находится в четвертом периоде, в побочной
подгруппе. Номер периода указывает на количество
электронных слоев. Номер группы обозначает количество
валентных электронов. Побочная подгруппа указывает на
то, что титан относится к d-элементам.
3.
История открытияВ 1791 году английский химик У. Грегор нашёл в песке из
местечка Менакан (Англия, Корнуолл) новую «землю»,
названную им менакановой.
В 1795 году немецкий химик М. Клаирот открыл в
минерале рутиле неизвестную еще землю, металл которой
он назвал Титан [в греч. мифологии титаны — дети Урана
(Неба) и Геи (Земли)].
В 1797 году Клапрот доказал тождество этой земли с
открытой У. Грегором.
Чистый титан выделен в 1910 году американским
химиком Хантером.
4.
Нахождение в природеТитан относится к числу наиболее распространённых в природе
элементов, его содержание в земной коре составляет 0,6% (весовых).
Встречается главным образом в виде
двуокиси TiO2
или её соединений — титанатов. Известно
свыше 60 минералов, в состав которых входит титан Он содержится
также в почве, в животных и растительных организмах.
Ильменит FeTiO3, рутилTiO2служат основным сырьём для
получения титана.
5.
Промышленный способ добычи титана был разработан тольков 40-х гг. XX века.
Способы получения титана
В связи с тем, что в природе не существует титановых руд,
человеку приходится извлекать его путём хлорирования
рудных концентратов с их последующим восстановлением с
помощью магния или натрия.
TiCl4 + 2Mg = Ti + 2MgCl2
Для удаления примесей магния и его соли полученную смесь
продуктов нагревают под вакуумом
6.
Титан обладает следующими физическими свойствами:Таблица – Основные физические свойства титана
Свойство
Цвет
Структура
Температура
плавления, °С
Значение
Серебристо-белый
Высокая прочность и
взякость
1665
7.
Химические свойстваТитан является очень активным металлом, но его оксидная
пленка не даёт ему взаимодействовать при нормальных
условиях ни с морской водой, ни даже с «царской водкой».
Поэтому все реакции протекают при повышенных
температурах.
1.Реакции с простыми веществами:
Ti + 2Cl2 = TiCl4
Ti + O2 = TiO2
2. Сложные вещества:
Азотная кислота действует на титан только в форме порошка,
в то время как разбавленная серная кислота реагирует с
металлом:
2Ti + 3H2SO4 = Ti2(SO4)3 + 3H2↑
8.
ПрименениеТитан и его сплавы отличает не только коррозионная
стойкость, но и лёгкость, прочность. В связи с этим он
активно используется при построении космических
ракет, самолётов, подлодок и морских судов. Титан не
взаимодействует с тканями организмов, из-за чего
используется в хирургии.
Сверло с покрытием из нитрида
титана
Часы из титанового сплава
9.
10.
Электронная конфигурацияХром находится в IV группе побочной
подгруппе и имеет следующее
электронное строение:
Так как для атома хрома энергетически более выгодно иметь
наполовину заполненную 3d-орбиталь, у него, как и у меди,
наблюдается проскок электрона, что позволяет ему находиться в
степенях окисления от +1 до +6, но наиболее устойчивыми являются
+2, +3, +6.
11.
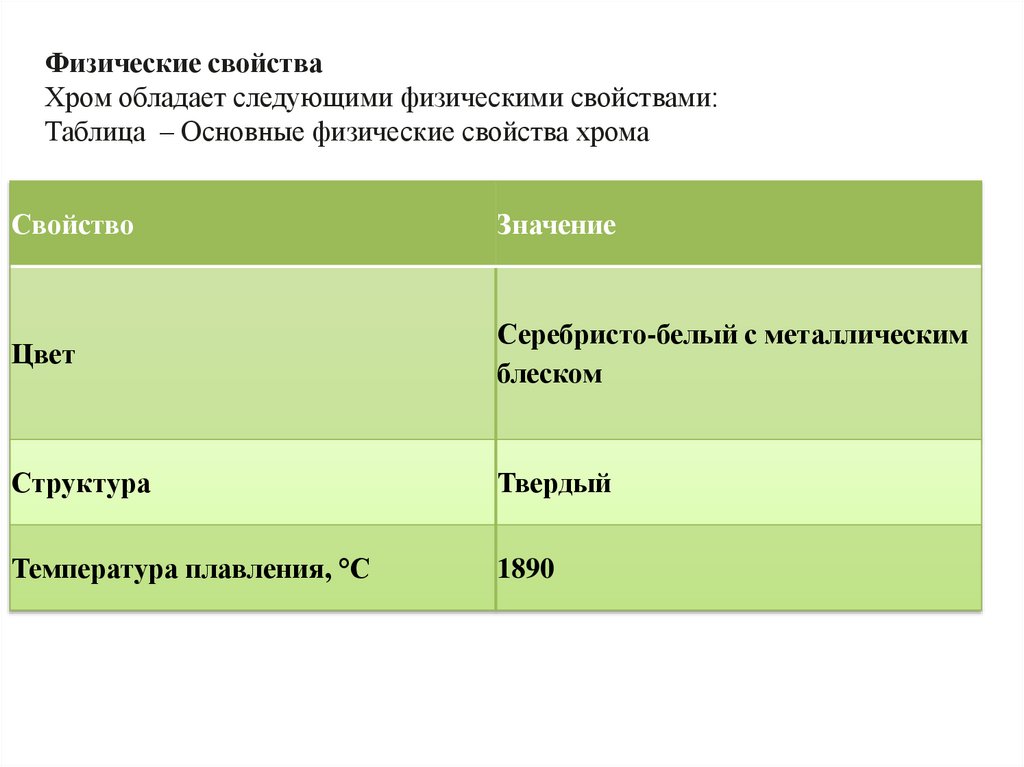
Физические свойстваХром обладает следующими физическими свойствами:
Таблица – Основные физические свойства хрома
Свойство
Значение
Цвет
Серебристо-белый с металлическим
блеском
Структура
Твердый
Температура плавления, °С
1890
12.
Нахождение в природеВ природе большая часть хрома заключена в составе хромистого
железняка Fe(CrO2)2. Иногда может встречаться в виде оксида хрома
(III) и других соединениях.
Способы получения хрома
Из хромистого железняка путем восстановлением углем при высоких
температурах получают смесь железа и хрома – феррохром:
FeO + Cr2O3 + 3C = Fe + 2Cr + 3CO↑
Для получения чистого хрома проводят восстановление оксида хрома
(III) алюминием:
Cr2O3 + 2Al = 2Cr + Al2O3
13.
Химические свойстваКак и титан , хром покрыт оксидной плёнкой, которую трудно растворить
даже сильными кислотами. Благодаря ней он обладает высокой стойкости
к коррозии, поэтому начинает реагировать с разбавленными растворами
кислот лишь спустя время. Концентрированные кислоты, такие как
HNO3 и H2SO4, пассивируют оксидную пленку (укрепляют ее).
14.
Химические свойства хромаI. Взаимодействие с простыми веществами.
1. При обычных условиях хром реагирует только со фтором. При высоких
температурах (выше 600 C) взаимодействует с кислородом, галогенами, азотом,
кремнием, бором, серой, фосфором.
4Cr + 3O2 2Cr2O3
2Cr + 3Cl2 2CrCl3
2Cr + N2 2CrN
2Cr + 3S Cr2S3
II. Взаимодействие со сложными веществами.
1. В раскалённом состоянии реагирует с парами воды:
2Cr + 3H2O Cr2O3 + 3H2
2. Хром растворяется в разбавленных сильных кислотах (HCl, H2SO4). В отсутствии
воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl → CrCl2 + H2
2Cr + 6HCl + O2 → 2CrCl3 + 2H2O + H2
3. Наличие защитной окисной плёнки на поверхности металла объясняет его
пассивность по отношению к холодным концентрированным кислотам – окислителям.
Однако при сильном нагревании эти кислоты растворяют хром:
2 Сr + 6 Н2SО4(конц) Сr2(SО4)3 + 3 SО2↑ + 6 Н2О
Сr + 6 НNО3(конц) Сr(NО3)3 + 3 NO2↑ + 3 Н2О
15.
ПрименениеБлагодаря своей коррозионной стойкости, хром используют в
качестве защитных покрытий (хромируют поверхности металлов и
сплавов). Также используется для создания легированных сталей. .















 chemistry
chemistry








