Similar presentations:
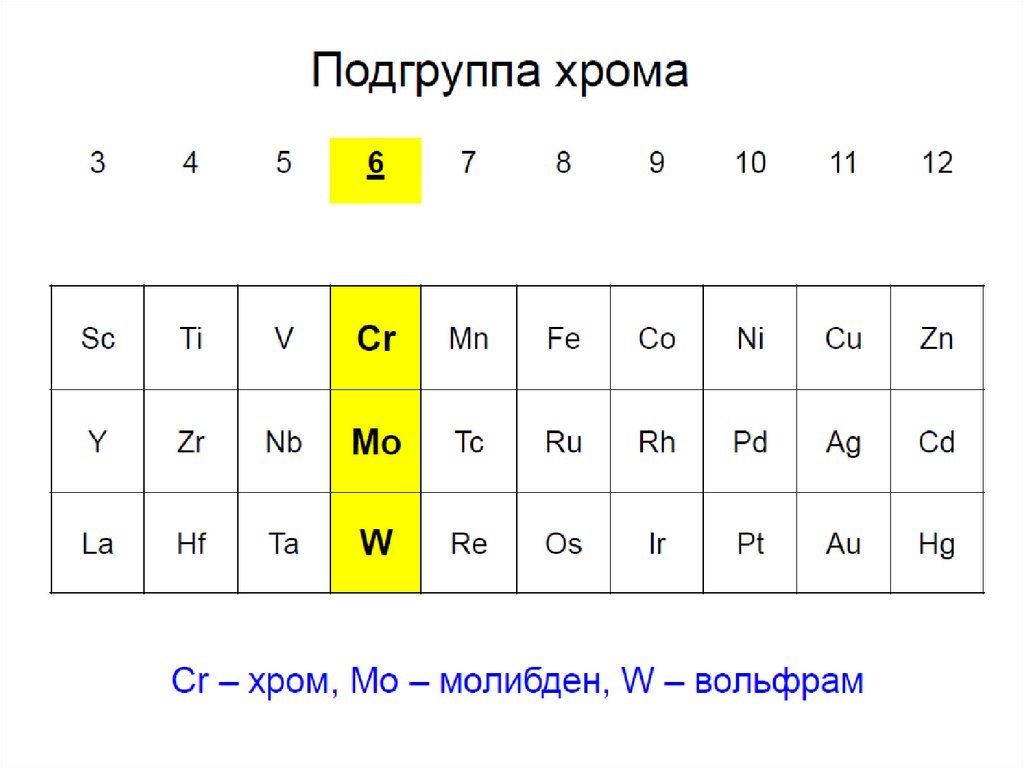
Хром. Подгруппа хрома
1.
2.
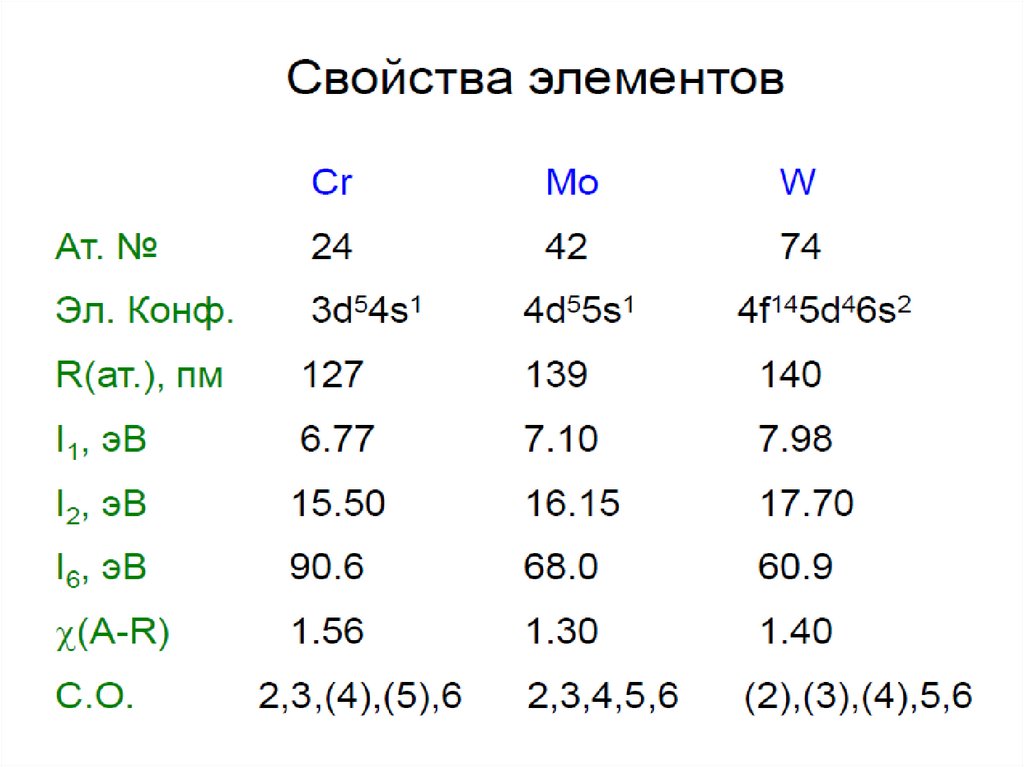
3.
4. ОБЩАЯ ХАРАКТЕРИСТИКА
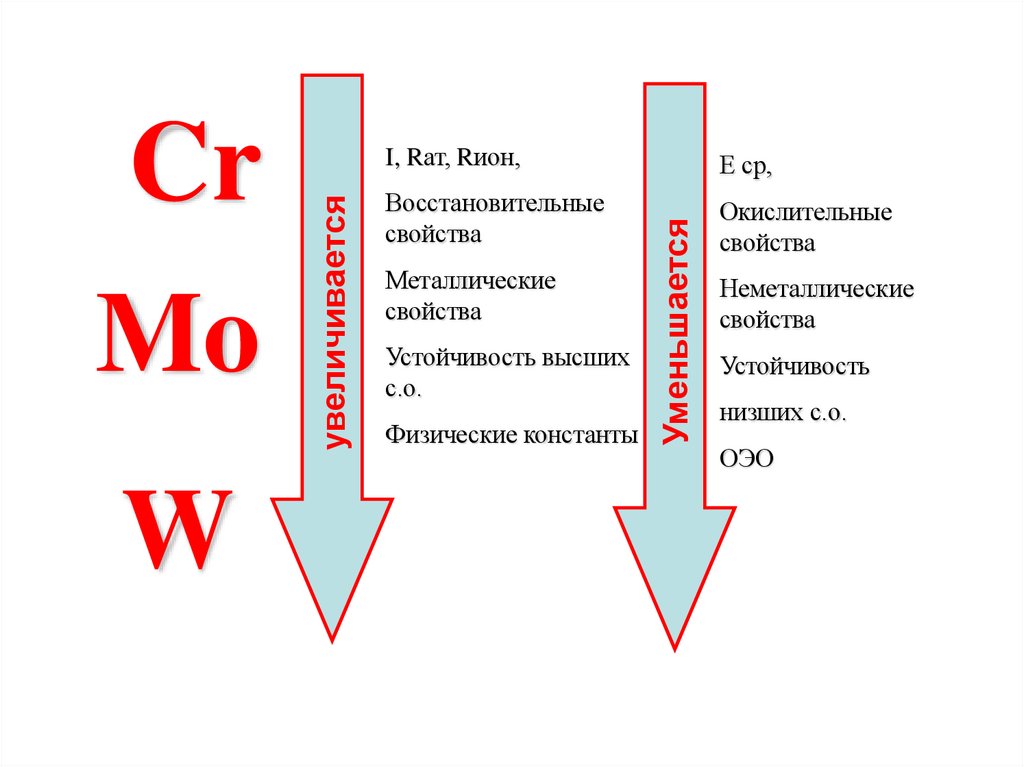
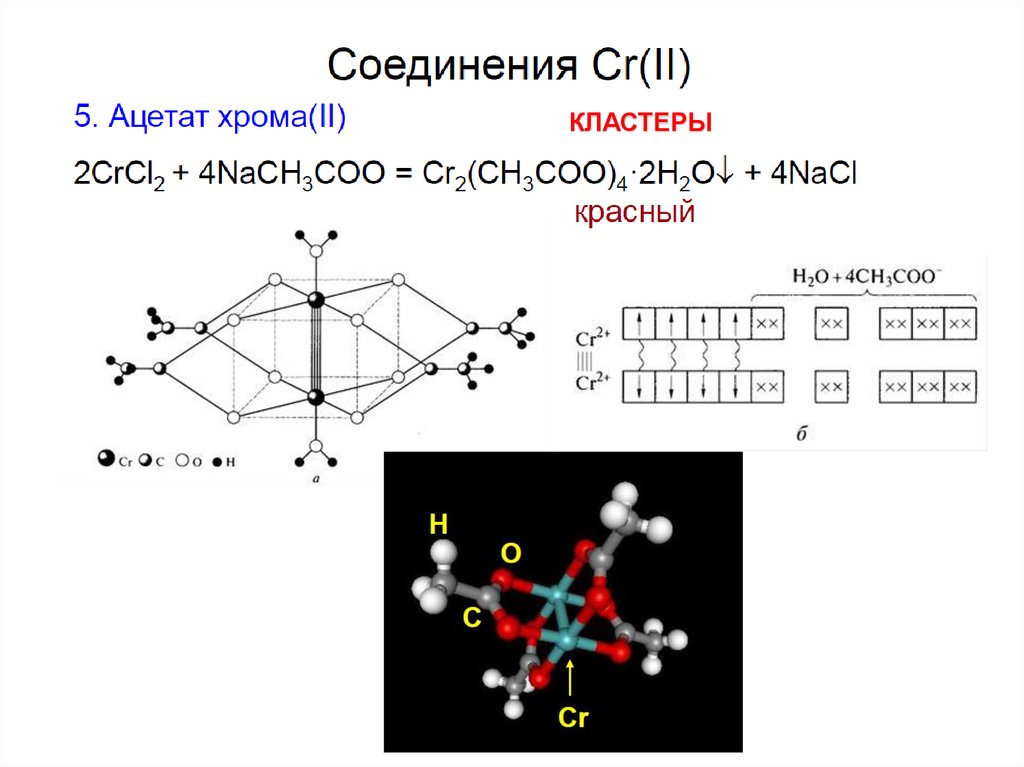
5.
WЕ ср,
Восстановительные
свойства
Окислительные
свойства
Металлические
свойства
Устойчивость высших
с.о.
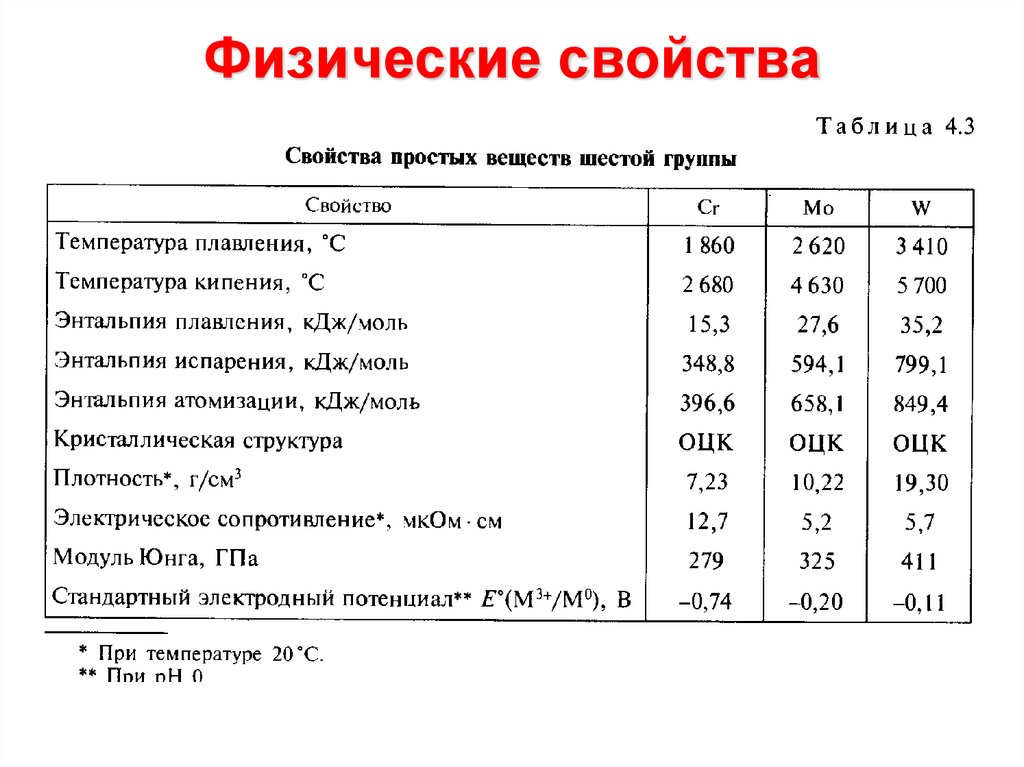
Физические константы
Уменьшается
увеличивается
Cr
Mo
I, Rат, Rион,
Неметаллические
свойства
Устойчивость
низших с.о.
ОЭО
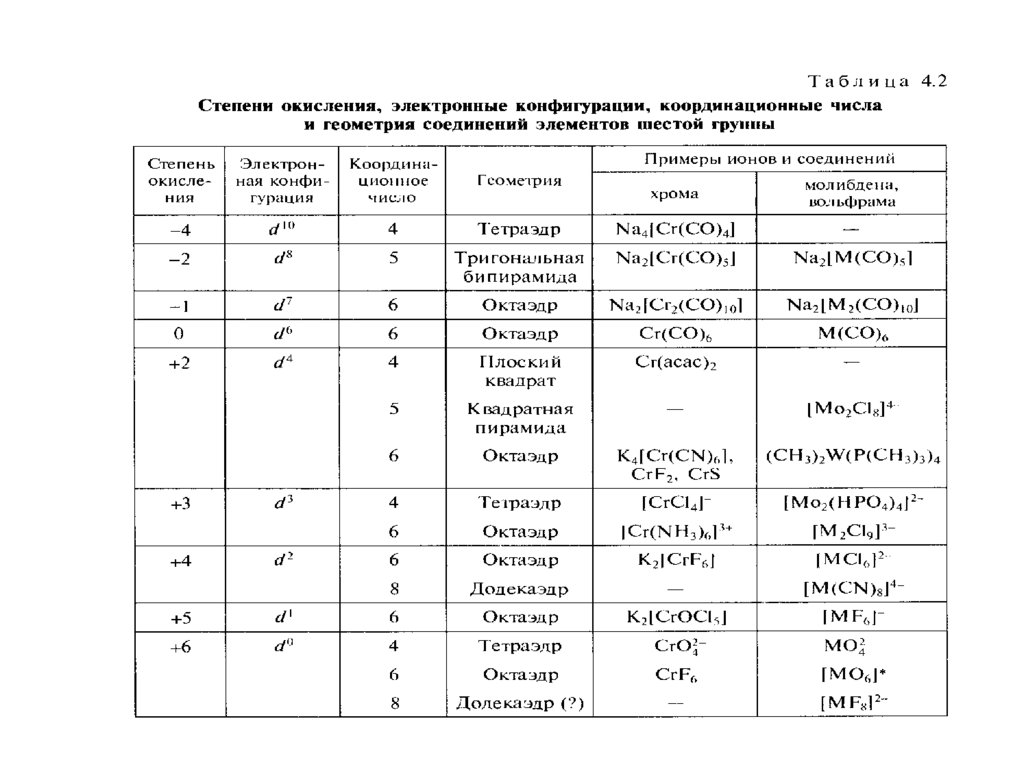
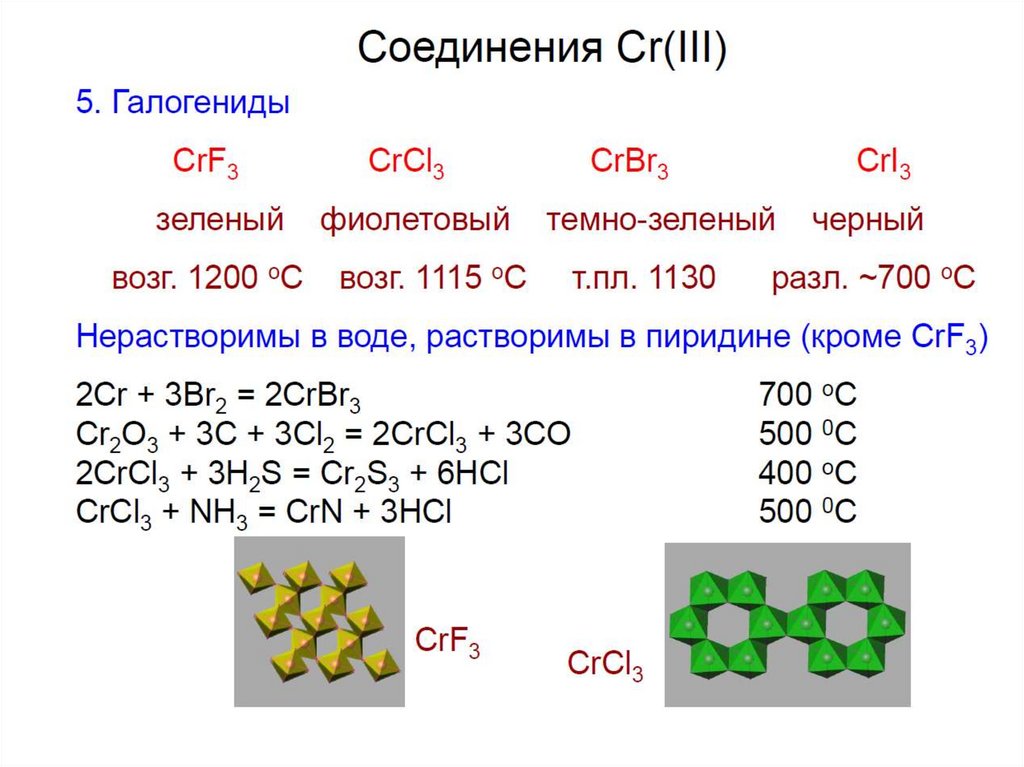
6.
7. Распространенность в природе
Fe(CrO2)2 — хромистыйжелезняк (хромит);
РЬСгО4 крокоит
Сг2О3 хромовая охра;
8. Распространенность в природе
MoS2 — молибденитCaWO4 — шеелит
(Fe, Mn)WO4 — вольфрамит
9. Получение Хрома:
1. Сплав-феррохром (производство нержавеющих сталей) получаетсяпри восстановлении хромистого железняка углем в электропечах:
2. Чистый хром - восстановление оксида Сг2О3 алюминием или
кремнием:
Получение оксида
1)Окислительное плавление хромистого железняка в щелочной среде:
2) Хромат Na2CrО4 обрабатывают серной кислотой:
3) Выкристаллизовавшийся бихромат натрия Na2Cr2О7• 2H2О
обезвоживают и восстанавливают серой или углем:
10.
Получение молибдена и вольфрама:1. Восстановлением оксидов водородом:
Предварительно руду, обогащенную методом флотации, обжигают:
Образующийся оксид при температуре реакции отгоняют и очищают
возгонкой или растворяют в водном растворе аммиака:
Щелочное вскрытие шеелита CaWО4 или вольфрамита FeWО4
Образовавшийся раствор подкисляют и осаждают кислоту:
Выделившийся осадок отфильтровывают и обезвоживают:
11.
12.
13.
ХромМолибден
Вольфрам
14.
15. Физические свойства
16. Химические свойства хрома
Хром при обычных условиях – инертный металл, при нагревании
становится довольно активным.
Взаимодействие с неметаллами
1) При нагревании выше 600°С хром сгорает в кислороде:
• 4Cr + 3O2 = 2Cr2O3.
2) С фтором реагирует при 350°С, с хлором – при 300°С, с бромом –
при температуре красного каления, образуя галогениды хрома (III):
• 2Cr + 3Cl2 = 2CrCl3.
3) С азотом реагирует при температуре выше 1000°С с образованием
нитридов:
• 2Cr + N2 = 2CrN
• или 4Cr + N2 = 2Cr2N.
4) С серой при температуре выше 300°С
- сульфиды от CrS до Cr5S8, например:
• 2Cr + 3S = Cr2S3.
5) С бором, углеродом и кремнием - бориды, карбиды и силициды:
Cr + 2B = CrB2 (возможно образование Cr2B, CrB, Cr3B4, CrB4),
2Cr + 3C = Cr2C3 (возможно образование Cr2C6),
Cr + 2Si = CrSi2 (возможно образование Cr3Si, Cr5Si3, CrSi).
6) С водородом непосредственно не взаимодействует.
17. Химические свойства хрома
2) Взаимодействие с водой (в тонкоизмельченном
раскаленном состоянии) :
2Cr + 3H2O = Cr2O3 + 3H2
3) Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов хром
находится до водорода, вытесняет водород из растворов
кислот-неокислителей:
Cr + 2HCl = CrCl2 + H2 (голубой раствор – без доступа
воздуха)
Cr + H2SO4 = CrSO4 + H2.
В присутствии кислорода воздуха образуются соли хрома (III):
4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O.(зеленый раствор)
4) Концентрированная азотная и серная кислоты пассивируют
хром. Растворяется только при сильном нагревании,
образуются соли хрома (III) и продукты восстановления
кислоты:
2Cr + 6H2SO4 = Cr2(SO4)3 + 3SO2 + 6H2O;
Cr + 6HNO3 = Cr(NO3)3 + 3NO2 + 3H2O.
18. Химические свойства хрома
• 5) Взаимодействие со щелочами• В водных растворах щелочей хром не растворяется,
медленно реагирует с расплавами щелочей с
образованием хромитов и выделением водорода:
• 2Cr + 6KOH = 2KCrO2 + 2K2O + 3H2.
• 6) Реагирует с щелочными расплавами
окислителей (хлоратом калия), при этом хром
переходит в хромат калия:
• Cr + KClO3 + 2KOH = K2CrO4 + KCl + H2O.
• 7)Восстановление металлов из оксидов и солей
• Хром – активный металл, способен вытеснять
металлы из растворов их солей:
• 2Cr + 3CuCl2 = 2CrCl3 + 3Cu.
19.
20.
21.
СИЛЬНЫЙ ОКИСЛИТЕЛЬ:ПОЛУЧЕНИЕ:
Cr2O3 + O3 = 2CrO3 при Р=12 атм, Т=460 °С , катализаторы - оксиды
серебра, цинка, кадмия и свинца
22.
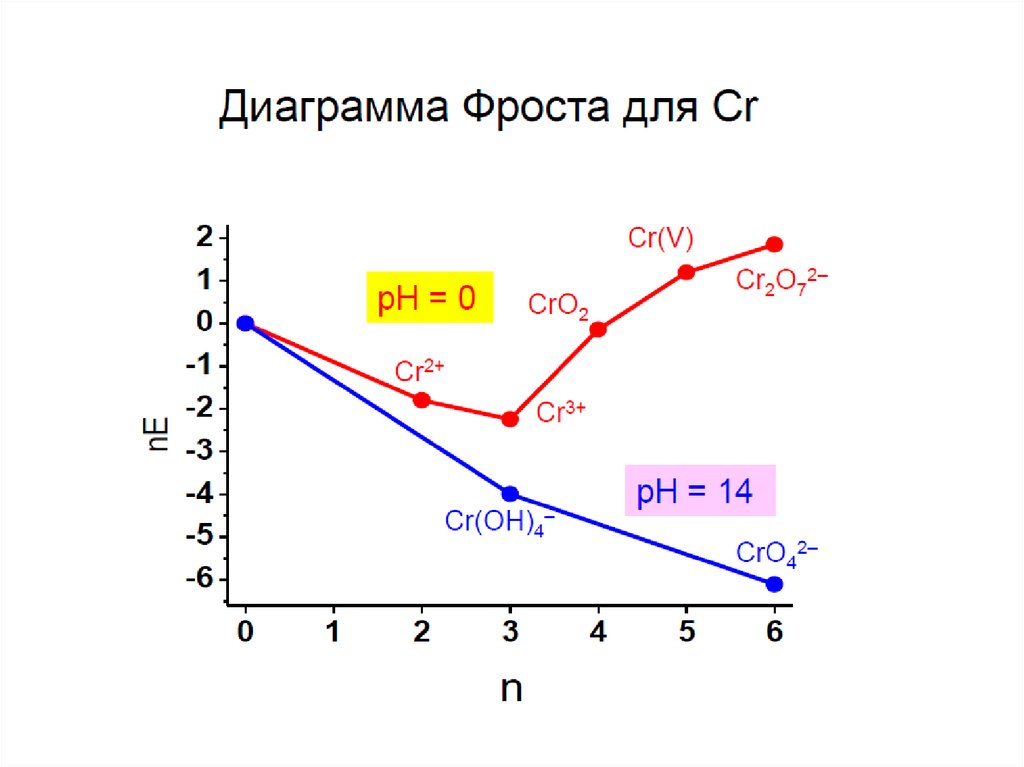
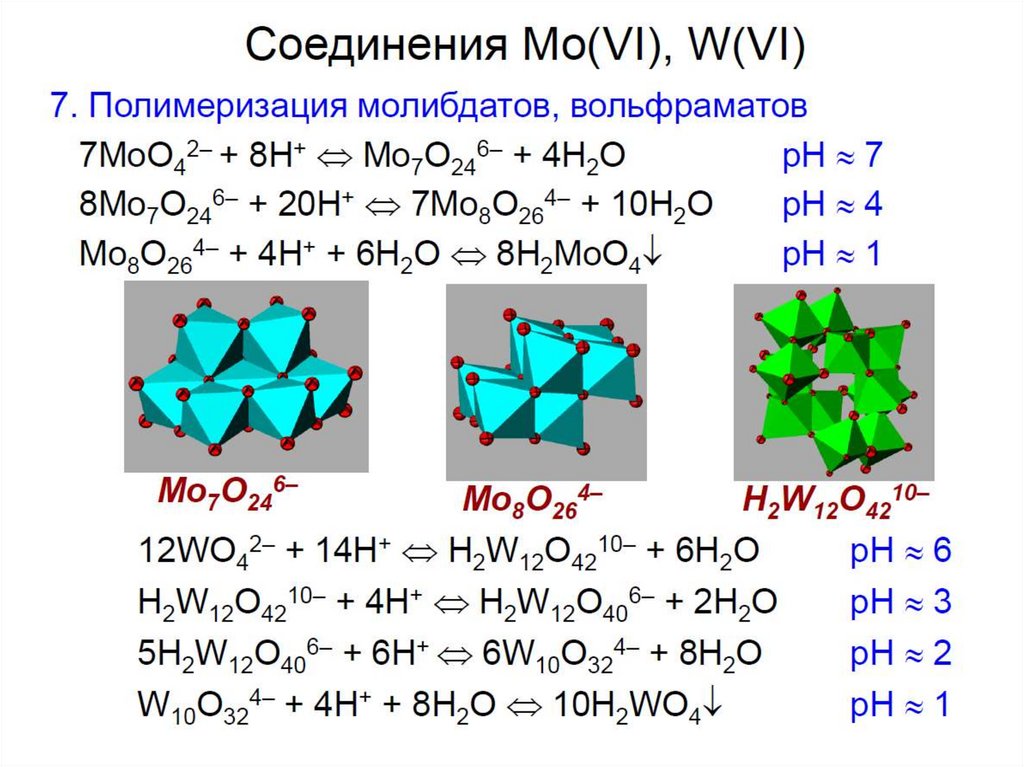
В растворе протекают процессы поликонденсации хромат-ионов:2
Переходы между хроматами и бихроматами регулируются изменением
кислотности среды:
желтый
оранжевый
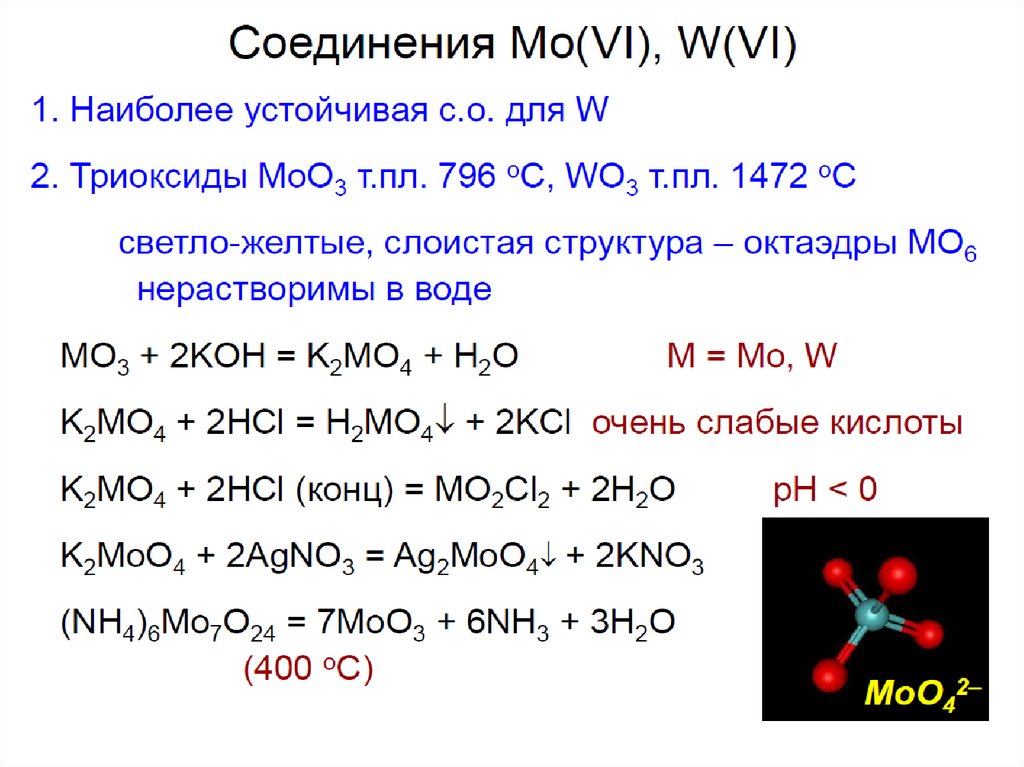
Растворимы в воде оксохроматы (VI), оксомолибдаты (VI) и
оксовольфраматы (VI) s-элементов I группы, а также Mg2+ и Са2+.
23.
Ум
е
н
ь
ш
е
н
и
е
р
Н
При действии на растворы полихроматов щелочью процесс идет в
обратном направлении до хромата. Взаимные переходы хромата и
дихромата можно выразить уравнением обратимой реакции:
24.
ПОЛУЧЕНИЕ:Сплавлением Сг2О3 или хромистого железняка с соответствующими
карбонатами при 1000—1300 °С на воздухе:
25.
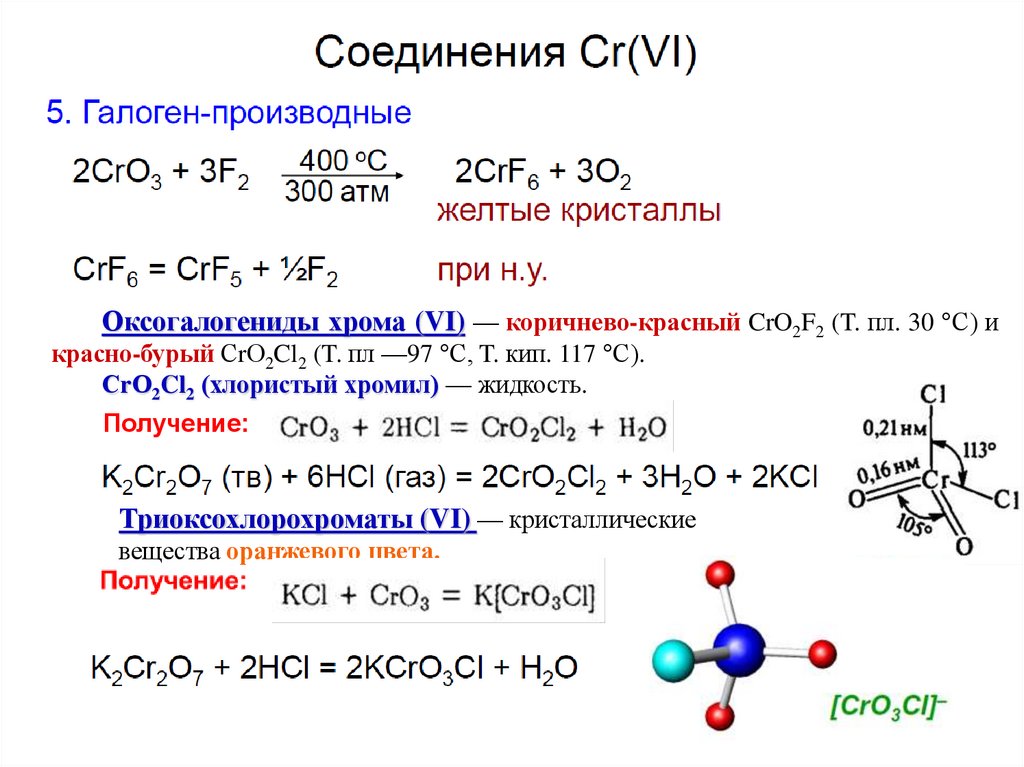
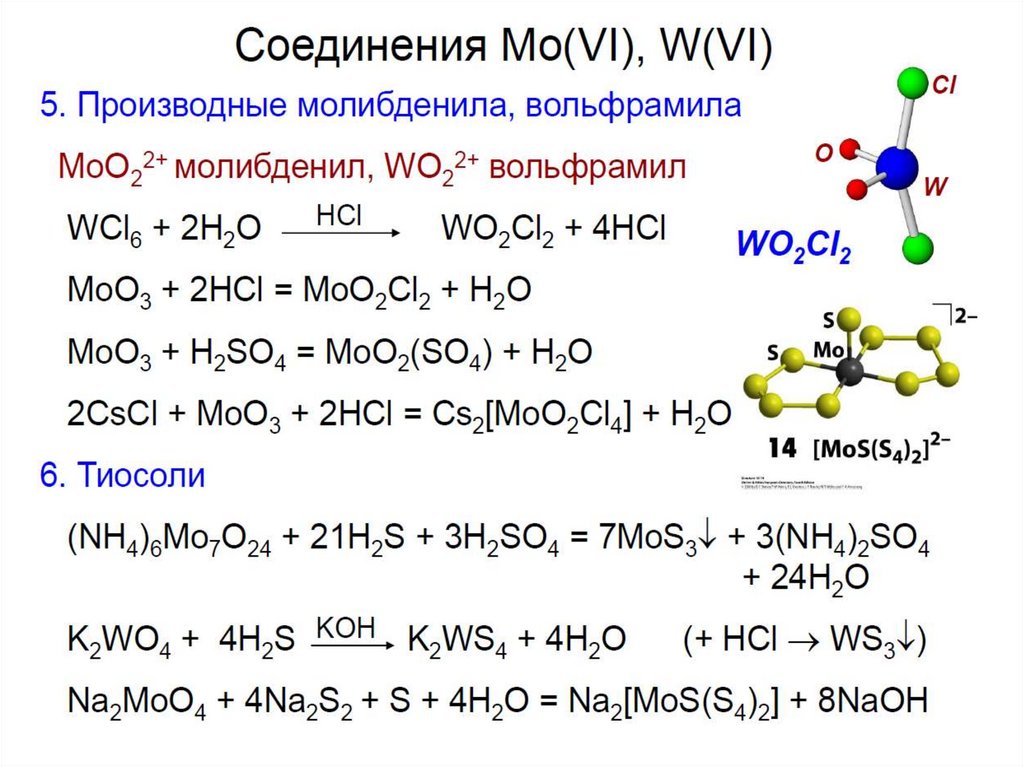
Оксогалогениды хрома (VI) — коричнево-красный CrO2F2 (T. пл. 30 °С) икрасно-бурый СrО2Cl2 (T. пл —97 °С, T. кип. 117 °С).
СrО2Cl2 (хлористый хромил) — жидкость.
Получение:
Триоксохлорохроматы (VI) — кристаллические
вещества оранжевого цвета.
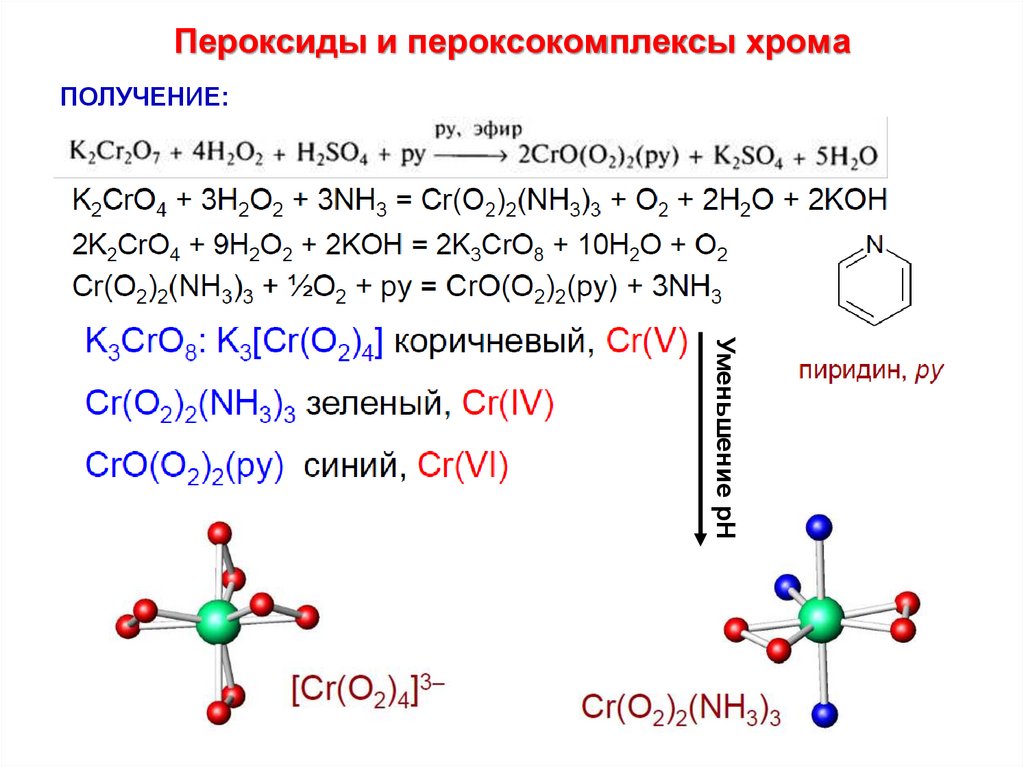
26. Пероксиды и пероксокомплексы хрома
ПОЛУЧЕНИЕ:Уменьшение рН
27.
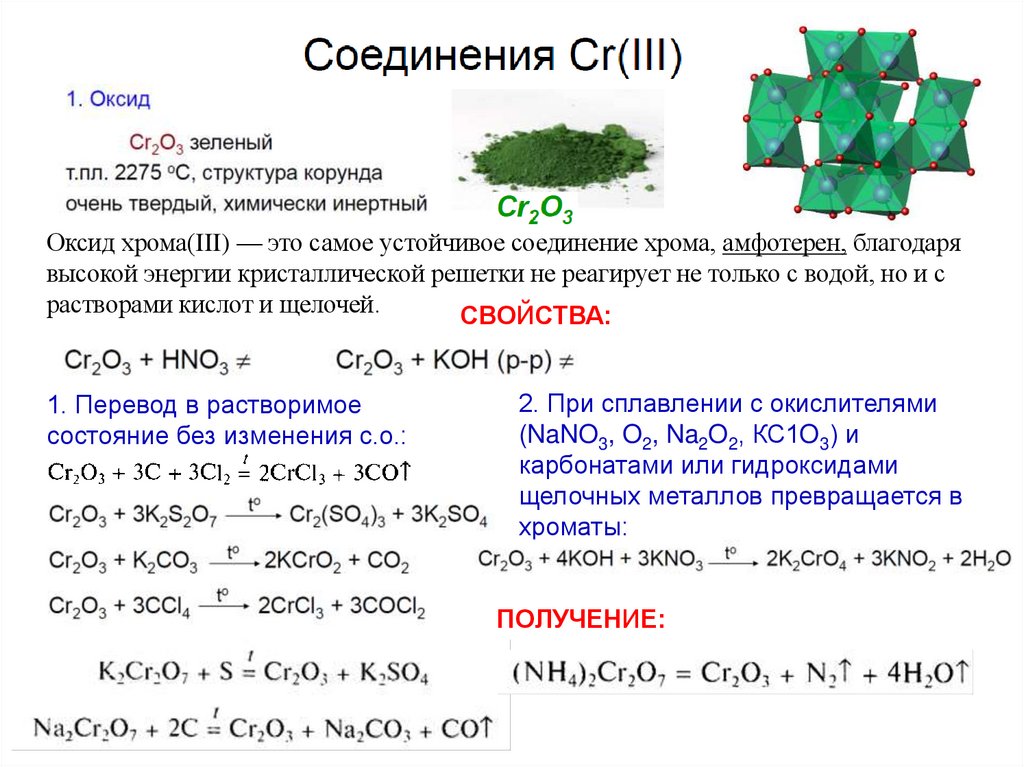
Оксид хрома(III) — это самое устойчивое соединение хрома, амфотерен, благодарявысокой энергии кристаллической решетки не реагирует не только с водой, но и с
растворами кислот и щелочей.
СВОЙСТВА:
1. Перевод в растворимое
состояние без изменения с.о.:
2. При сплавлении с окислителями
(NaNO3, O2, Na2O2, КС1O3) и
карбонатами или гидроксидами
щелочных металлов превращается в
хроматы:
ПОЛУЧЕНИЕ:
28.
амфотерностьСлоистый полимер
29.
Гидролиз сопровождает полимеризация:Cr2S3 или Сг2(СО3)3 в растворе получить нельзя из-за полного гидролиза:
30.
В щелочной среде : окислители - хлор, бром, гипохлорит натрия,пероксид водорода, оксид свинца(IV):
В нейтральной или слабокислой средах: окислитель - оксид марганца(IV):
В кислой среде: окислители - висмутат натрия, перманганат калия,
бертолетова соль, персульфаты в присутствии катионов серебра:
При сплавлении оксида хрома(III): окислители— пероксиды щелочных
металлов, нитраты, хлораты, кислород:
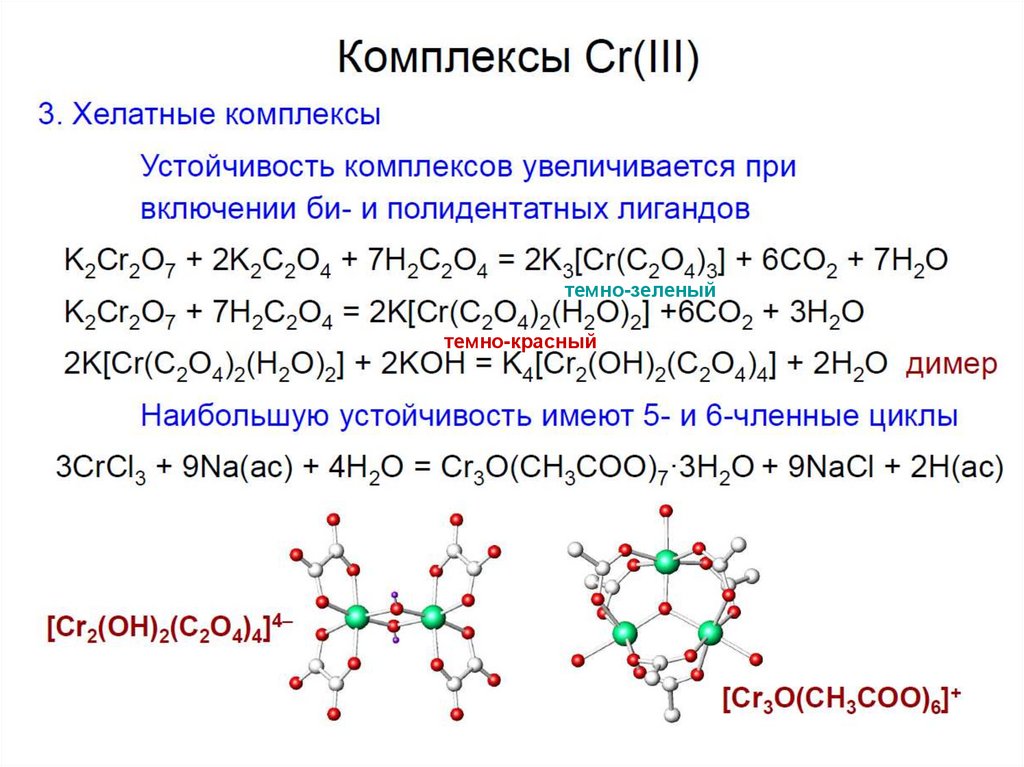
31.
32.
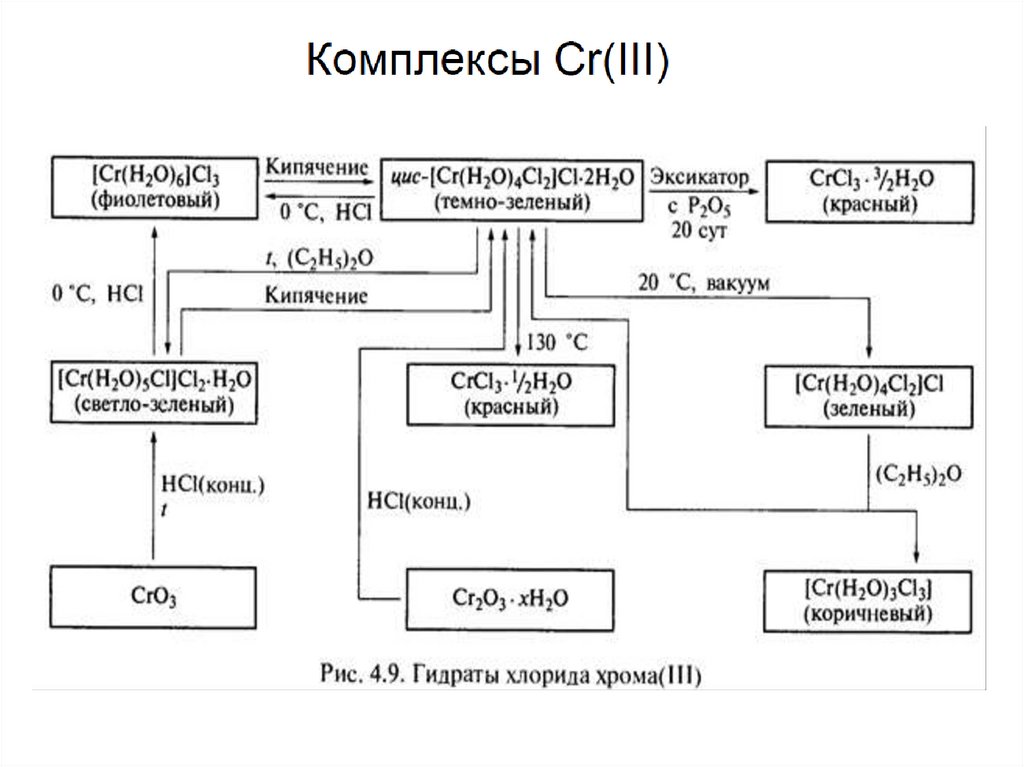
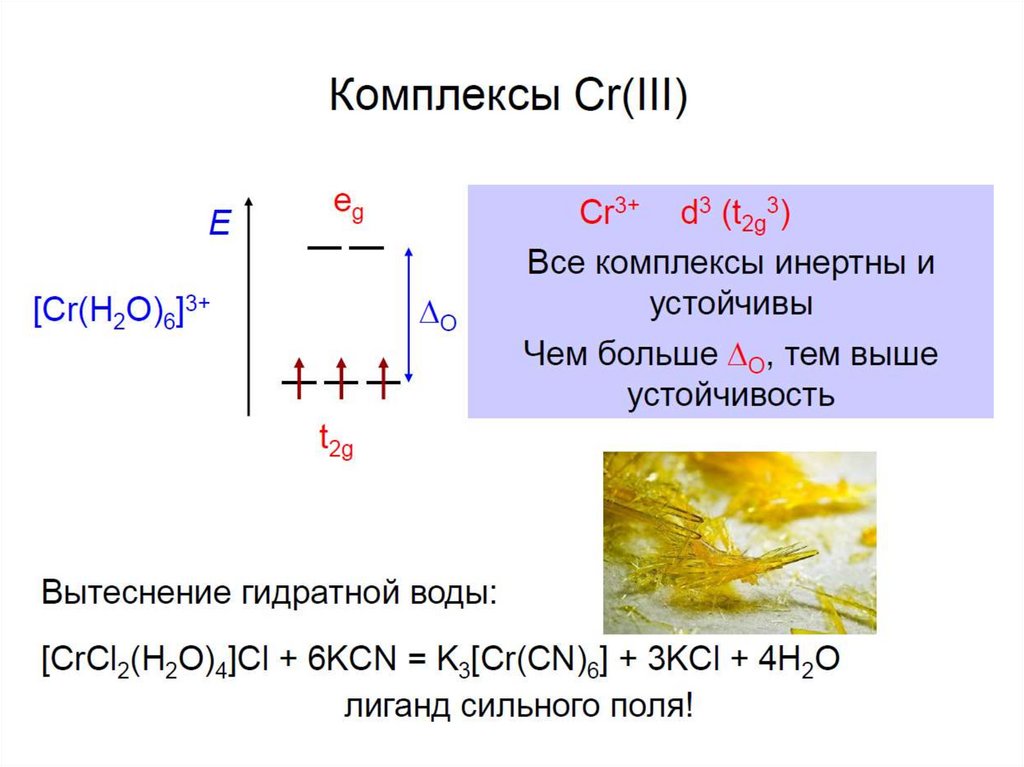
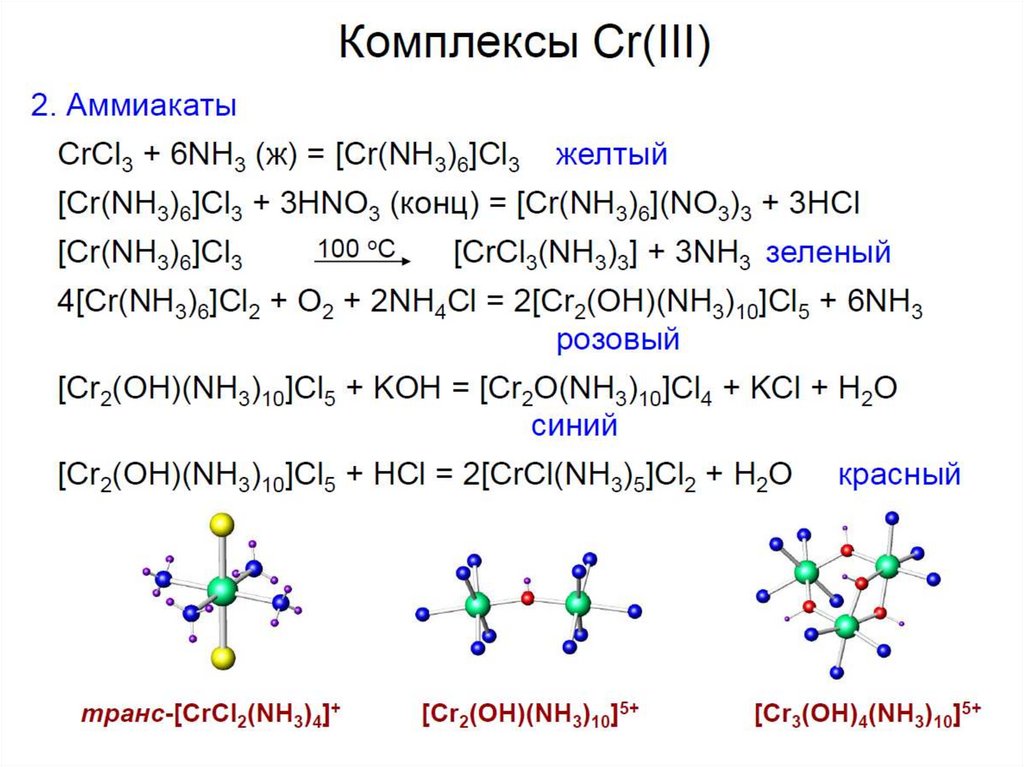
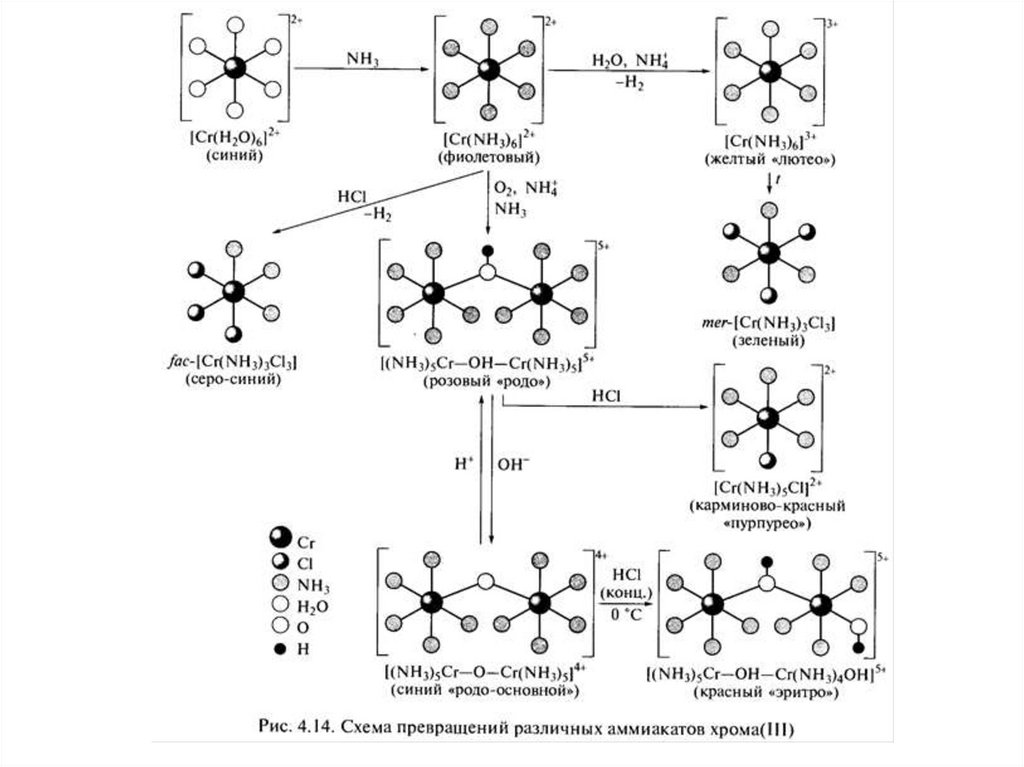
ГИДРАТНАЯ ИЗОМЕРИЯ33.
34.
35.
36.
37.
темно-зеленыйтемно-красный
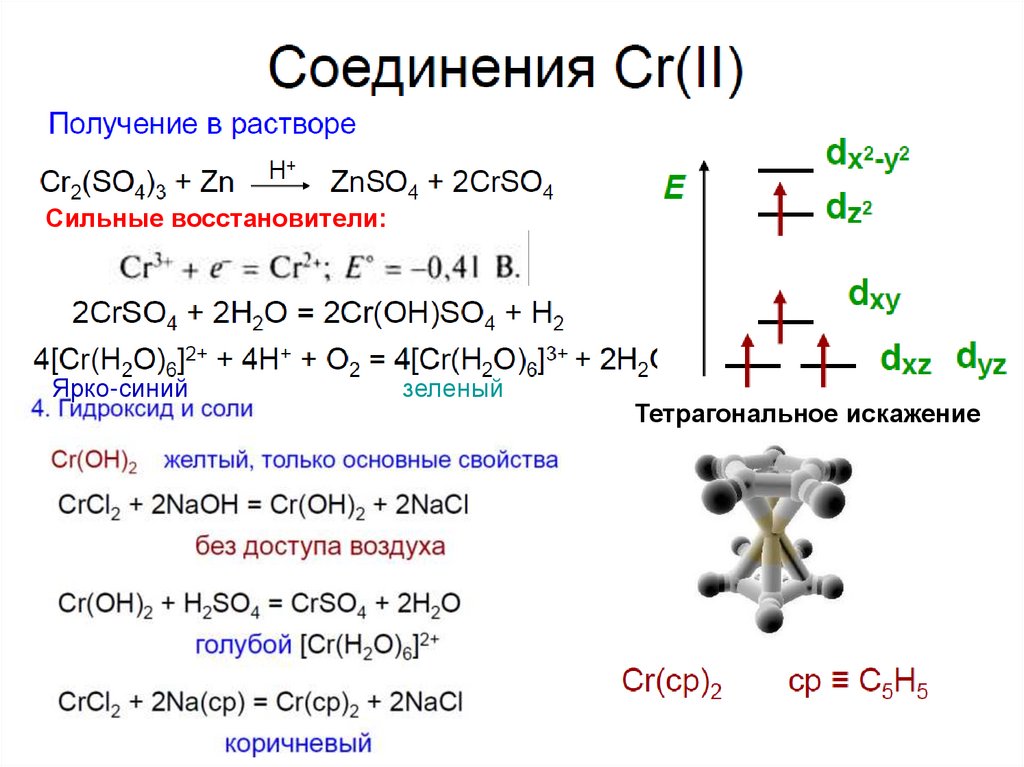
38. Оксид хрома(II)
Оксид хрома (II) CrO – тугоплавкий, черного цвета.
При обычной температуре устойчив на воздухе, выше 100°С окисляется:
4CrO + O2 = 2Cr2O3
Не растворим в воде, проявляет основные свойства и медленно переходит в раствор под
действием кислот:
С разбавленной серной и азотной кислотой и щелочами не взаимодействует.
Является сильным восстановителем. При температуре белого каления даже
способен отнимать кислород у углекислого газа:
Нагревание в инертной атмосфере или в вакууме приводит к
диспропорционированию:
Образуется при окислении амальгамы хрома кислородом воздуха:
• 2Cr/Hg + O2 = 2CrO + 2Hg
или при термическом разложении карбонила:
• Cr(CO)6 = CrO + 5CO + C.
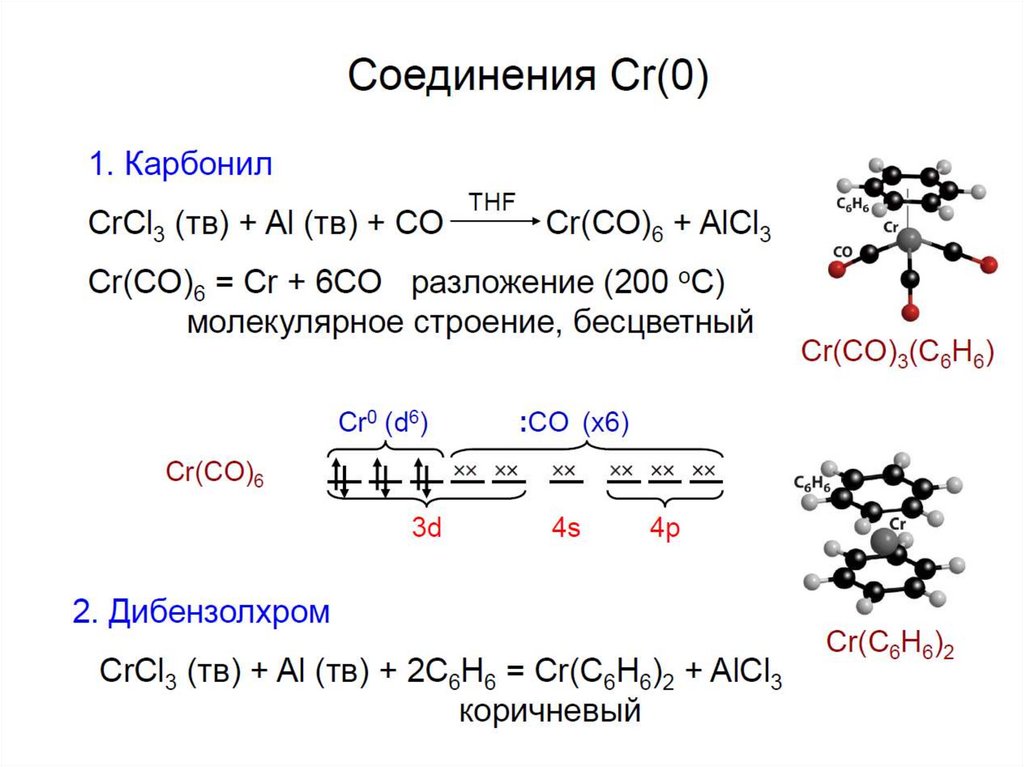
39.
Сильные восстановители:Ярко-синий
зеленый
Тетрагональное искажение

























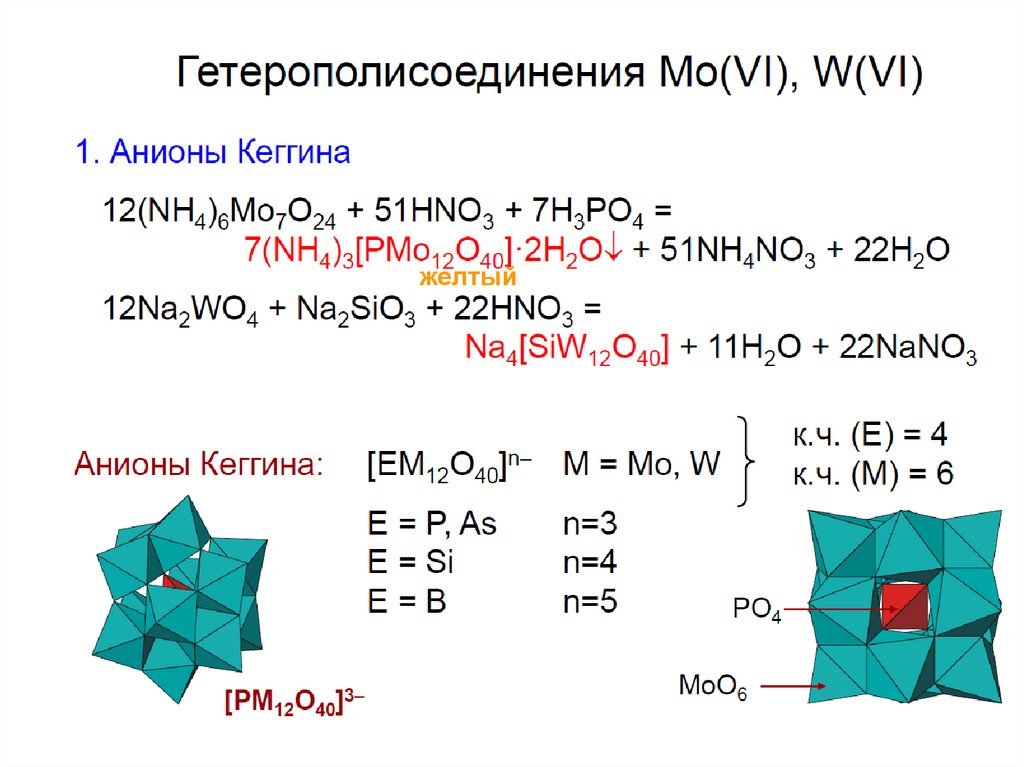
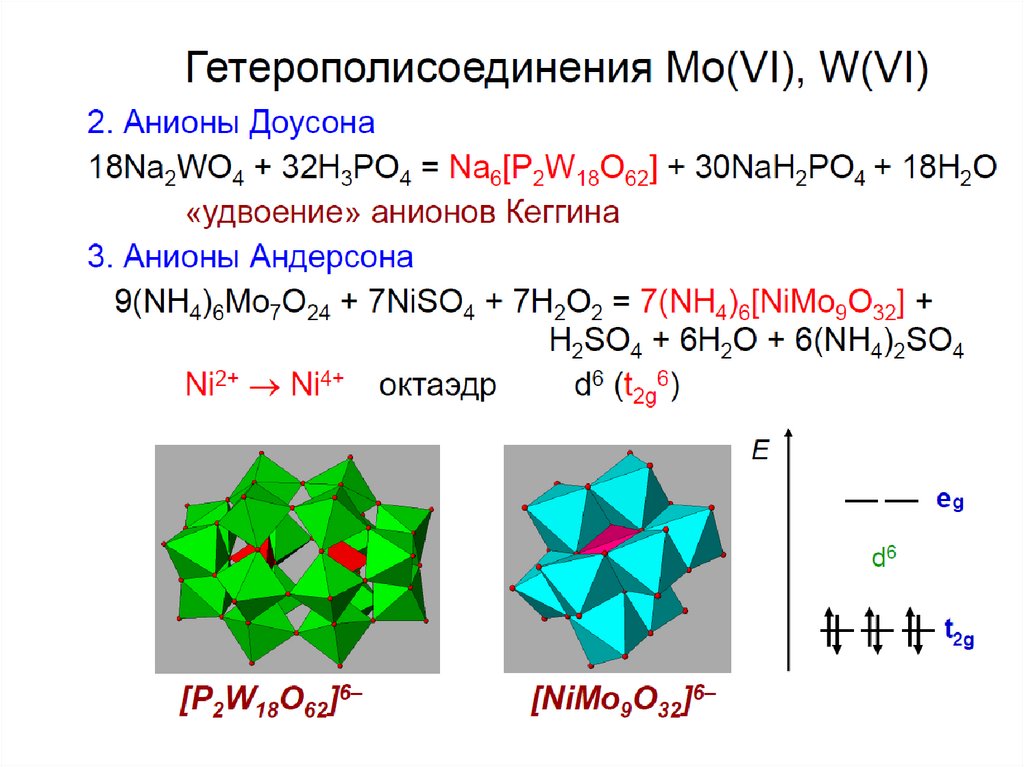
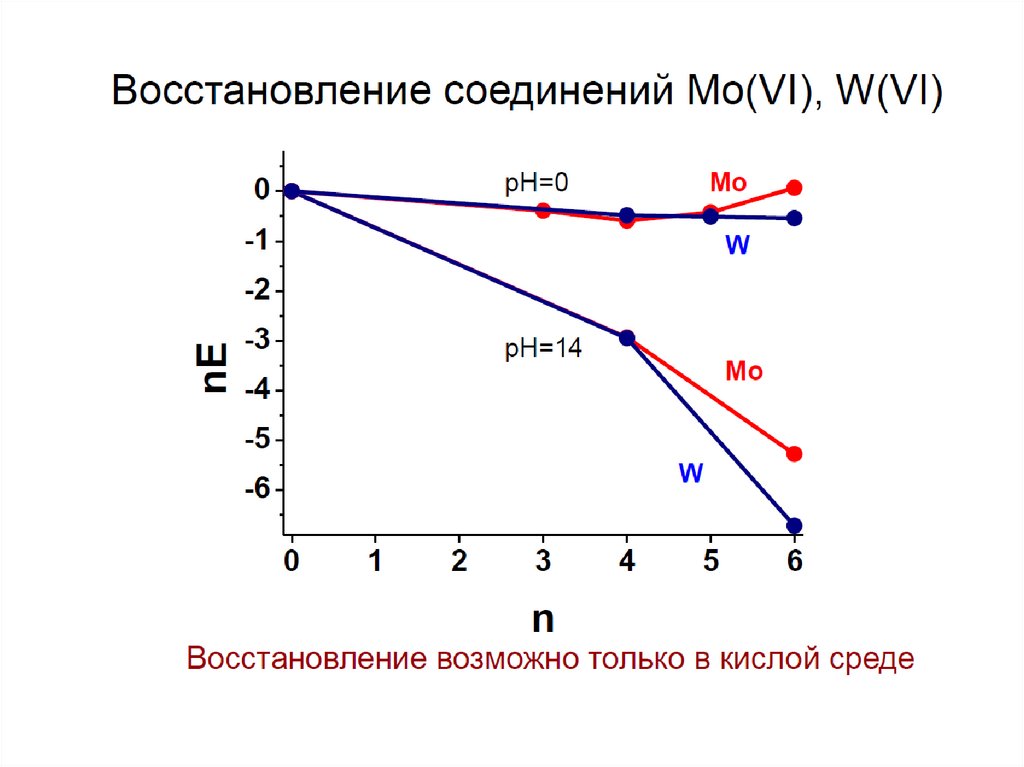


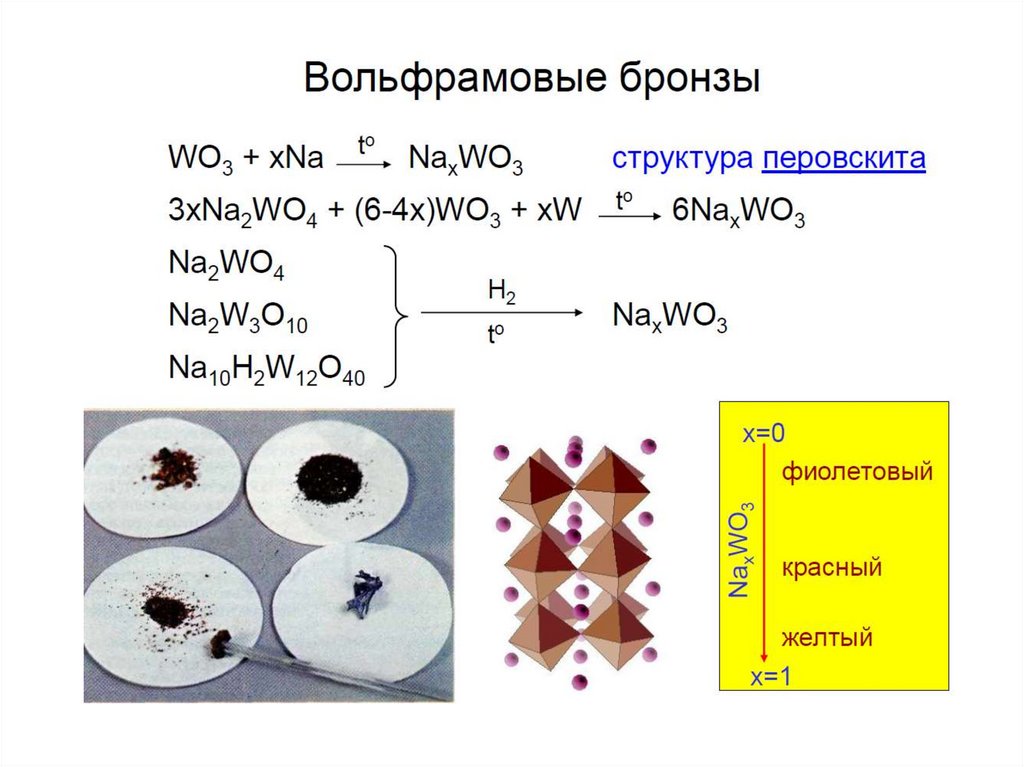
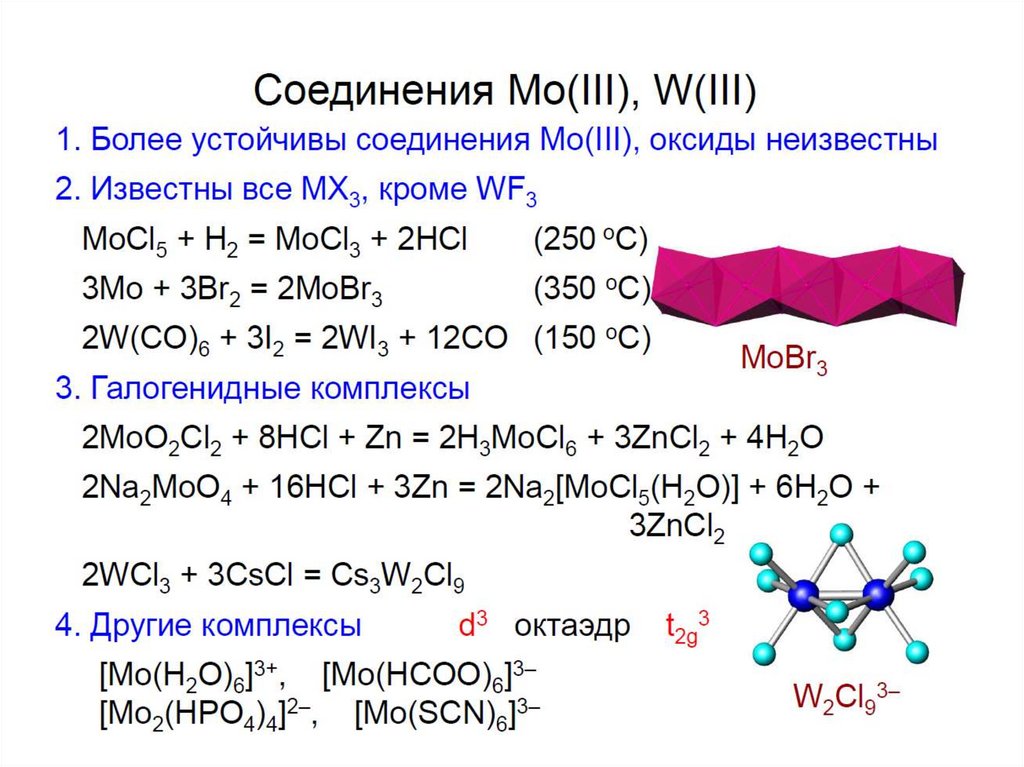
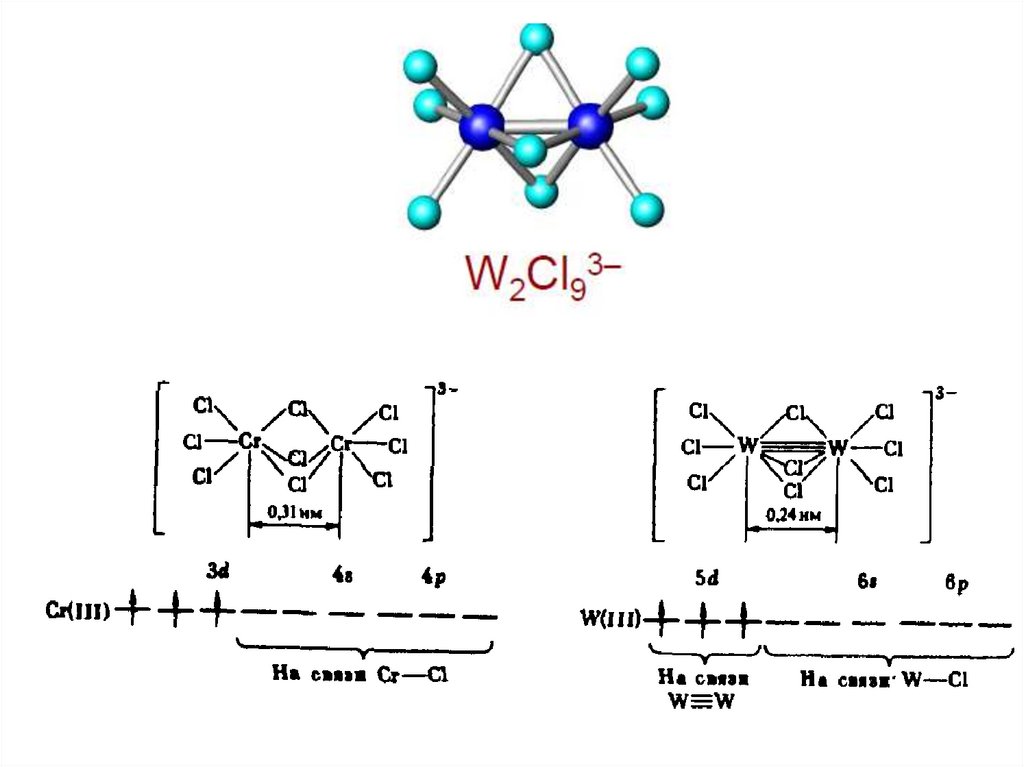
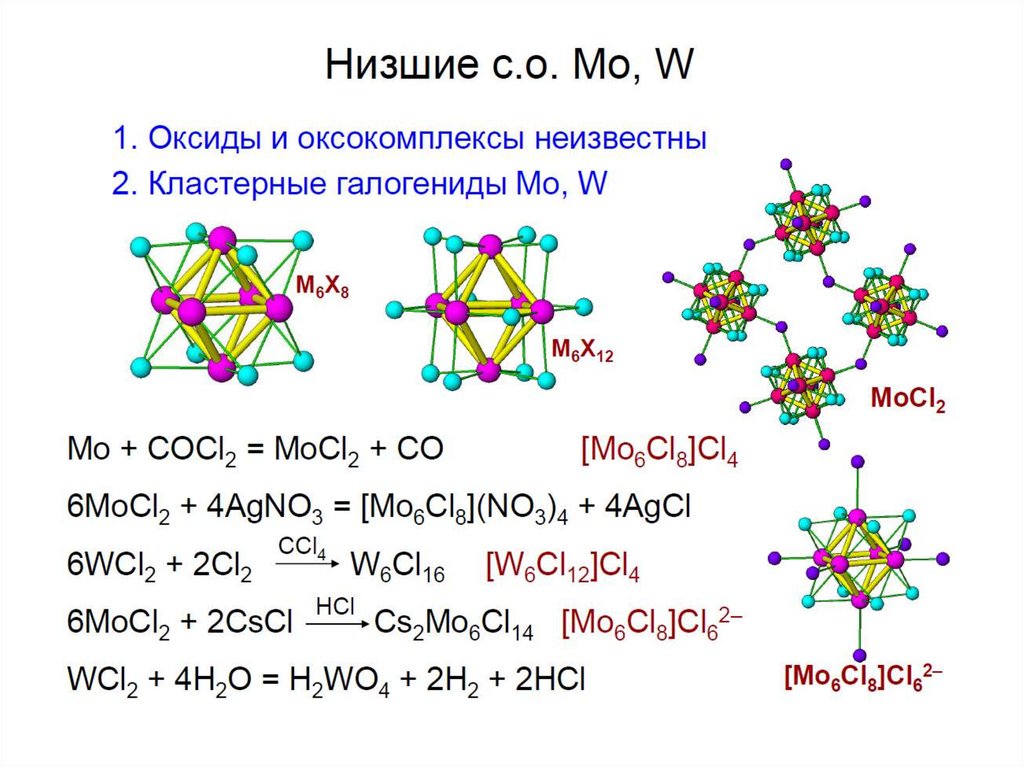
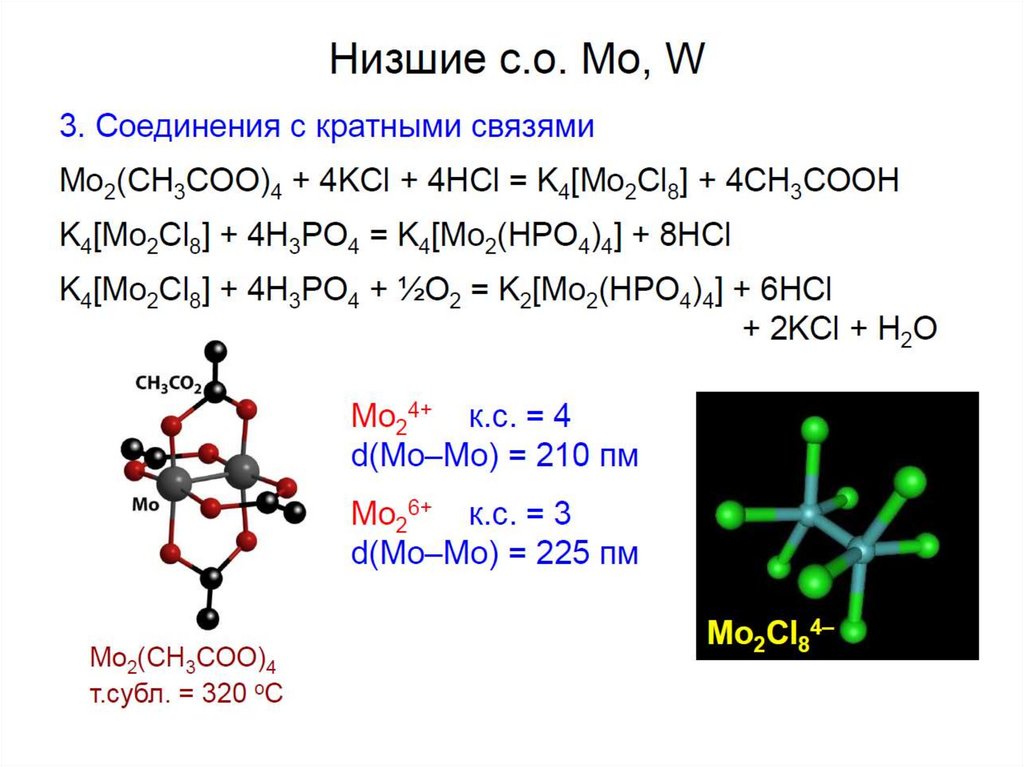


 chemistry
chemistry








